Оценка последствий дистанционной лучевой терапии у больных раком лёгкого путём анализа хромосомных аберраций в лимфоцитах крови
Автор: Хвостунов И.К., Курсова Л.В., Севанькаев А.В., Рагулин Ю.А., Шепель Н.Н., Коровчук О.Н., Пятенко В.С., Хвостунова Т.И.
Рубрика: Научные статьи
Статья в выпуске: 2 т.28, 2019 года.
Бесплатный доступ
В настоящей работе проведено исследование последствий лучевой терапии больных раком лёгкого. Оценка последствий выполнялась путём подсчёта аберраций хромосом в лимфоцитах крови пациентов. Всего было обследовано 25 больных раком лёгкого при различных стадиях развития заболевания. В указанной группе радикальная терапия осуществлялась путём облучения области опухоли пациентов на g-терапевтических установках марки «Луч» или «Рокус» в суммарной очаговой дозе (СОД) от 47,5 до 70 Гр. Забор крови для анализа производился по следующей схеме: до начала облучения (контроль), после первого дня облучения, после завершения полного курса радикальной терапии и регулярно в течение последующего периода времени до двух лет. Хромосомные аберрации анализировались стандартным методом в клетках первого митоза. В результате проведённого обследования было показано, что индивидуальная реакция пациентов существенно варьирует при схемах облучения, сопоставимых по суммарной дозе и фракционированию. По статистическим критериям были выделены три подгруппы: высокого, среднего и пониженного уровня индукции хромосомных аберраций. В работе была оценена доза общего облучения и СОД для каждой из подгрупп в сопоставлении с назначенными физическими дозами. Выявленные закономерности индукции хромосомных повреждений в лимфоцитах крови больных раком лёгкого доказывают необходимость внедрения персонализированного подхода к планированию и реализации схемы радикального курса терапии для повышения её эффективности и предотвращения побочных последствий.
Радиационное воздействие, хромосомные аберрации, лимфоциты крови, дистанционная лучевая терапия, доза общего облучения, рак лёгкого, радиотерапия, дицентрик, центрическое кольцо, ацентрик
Короткий адрес: https://sciup.org/170171490
IDR: 170171490 | УДК: 616.24-006.6-085.849.1]-07:616.155.32:575.224.23 | DOI: 10.21870/0131-3878-2019-28-2-87-101
Текст научной статьи Оценка последствий дистанционной лучевой терапии у больных раком лёгкого путём анализа хромосомных аберраций в лимфоцитах крови
Проблема совершенствования методов лечения онкологических заболеваний, особенно рака лёгкого, является актуальной и требует дополнительного клинико-дозиметрического анализа и обоснования [1]. Результаты фундаментальных исследований лучевого воздействия на тканевом и клеточном уровнях имеют существенное значение как для повышения эффективности существующих схем дистанционной лучевой терапии (ДЛТ), так и для разработки новых методов лучевой терапии онкологических пациентов [2]. В случае возникновения противоречий между данными о назначенной физической дозе и клинической картиной отдалённых последствий облучения часто требуется дополнительное подтверждение или опровержение ожидаемой степени тяжести радиационного воздействия. В таком случае метод анализа аберраций хромосом в лимфоцитах крови является одним из наиболее адекватных способов обоснования предполагаемого заключения [3]. Вместе с тем, область применения и оценка погрешности биологической дозы в случае локального фракционированного облучении in vivo всё ещё требуют до-
Хвостунов И.К.* – зав. лаб., д.б.н.; Курсова Л.В. – вед. научн. сотр., к.м.н.; Севанькаев А.В. – зав. лаб., д.б.н.; Рагулин Ю.А. – зав. отд., к.м.н.; Шепель Н.Н . – ст. научн. сотр., к.б.н.; Коровчук О.Н. – научн. сотр.; Хвостунова Т.И. – научн. сотр. МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России. Пятенко В.С. – вед. научн. сотр., к.б.н. МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России, ФГБУН Институт биохимической физики им. Н.М. Эмануэля РАН.
полнительных исследований и совершенствования [4, 5]. В качестве подхода к решению указанной проблемы предлагается анализ аберраций хромосом в клетках крови онкологических пациентов после ДЛТ с достоверным дозиметрическим обеспечением [6-8].
Цитогенетическое обследование онкологических пациентов после ДЛТ даёт возможность количественно оценить последствия радиационного воздействия и распределение числа аберраций по клеткам крови. Локальное облучение, фракционирование дозы, а также индивидуальные вариации осложняют анализ закономерностей индукции аберраций. В последнее время данная проблема исследовалась при помощи различных цитогенетических методов, а именно: стандартный метод [6, 7], метод флуоресцентной гибридизации in situ (FISH-метод) [5-7], метод преждевременной конденсации хромосом [9, 10], микроядерный тест [8] и подсчёт двойных разрывов ДНК по технологии γ-фокусов (γ-H2AX foci) [11].
В перечисленные исследования включались пациенты с различными локализациями опухоли: область головы и шеи, лёгкие, абдоминальная область, шейка матки, молочная железа и ряд других локализаций. Для лучевой терапии обследованных пациентов использовались, главным образом, γ-терапевтические или рентгеновские установки. Как правило, число обследованных составляло от 6 до 9 пациентов, но изредка это число достигало 32-35 человек [10, 12].
Для оценки поглощённой дозы методом биологической дозиметрии ключевой задачей является обоснованное использование параметров зависимости частоты аберраций от дозы [3]. Согласно принятым международным рекомендациям, следует использовать оригинальную лабораторную дозовую зависимость при облучении лимфоцитов in vitro . Особенностью ДЛТ является локальное фракционированное облучение. В таком случае в крови перемешиваются как облучённые, так и необлучённые клетки. Кроме того, значимую роль может играть восстановление клеток, а также модификация радиационной чувствительности клеток вследствие онкологического заболевания и/или применения химиопрепаратов. По данным литературы для учёта локального характера облучения были разработаны два следующих метода: Qdr (quotient of dicentrics and rings) [13] и метод Dolphin [14]. Следует отметить, что оба метода были верифицированы с использованием лишь модельных лабораторных экспериментов с облучением клеток in vitro [15]. Для оценки пригодности данных методов в случае облучения in vivo наиболее адекватным подходом является цитогенетическое обследование онкологических пациентов при проведении радикальной ДЛТ [5].
В выполненных нами ранее исследованиях были проанализированы образцы крови больных раком лёгкого, взятые непосредственно после завершения курса ДЛТ. Это позволило оценить поглощённые дозы при помощи эмпирической модели со свободным параметром [16, 17]. Дальнейшее развитие данного направления в рамках настоящей работы заключалось в анализе аберраций хромосом в лимфоцитах крови пациентов в зависимости от времени после окончания ДЛТ и проведении биологической дозиметрии с помощью современной радиобиологической модели неполной репарации [18, 19].
Цель настоящей работы состояла в количественной оценке последствий воздействия радикального курса ДЛТ на организм больных раком лёгкого при использовании аппаратов для лучевой терапии предыдущего поколения. Полученные результаты являются базовым ориентиром для совершенствования методики радикального курса ДЛТ на современных лучевых установках.
Материалы и методы
Для цитогенетического анализа использовали образцы периферической крови, взятые у обследованных пациентов из локтевой вены. Образцы крови у всех обследованных лиц брались в соответствии с действующим законодательством Российской Федерации и нормами медицинской этики после получения информированного согласия. Хромосомные аберрации изучали метафазным методом в клетках первого митоза. Методика состояла в приготовлении препаратов метафазных хромосом, их окрашивании и микроскопическом анализе. Культивирование клеток проводилось c использованием фитогемагглютинина (PHA M-form, Gibco, USA). Приготовление препаратов и фиксацию выполняли по стандартной методике в соответствии с международными рекомендациями МАГАТЭ [3]. Культивировали цельную кровь (0,8 мл) во флаконах Карреля в питательной среде следующего состава: 6,16 мл среды RPMI-1640; 1,6 мл инактивированной эмбриональной телячьей сыворотки; 0,08 мл L-глютамина; 0,08 мл раствора антибиотиков (пенициллин-стрептомицин); 0,15 мл PHA. Инкубацию культур клеток производили в термостате при 37 °C в течение 48 ч. За 2 ч до окончания инкубации во флаконы добавляли раствор демеколцина в финальной концентрации 0,2 мкг/мл среды. Гипотонизацию, фиксацию клеток и приготовление препаратов хромосом выполняли согласно протоколу [3]. Окраску препаратов осуществляли красителем Гимза.
В ходе анализа учитывали аберрации хромосомного типа: ацентрики (парные фрагменты и точки), центрические кольца и дицентрики. К дицентрику и центрическому кольцу относили по одному парному фрагменту или парной точке при отсутствии парных фрагментов. Все эти виды аберраций относятся к классу нестабильных хромосомных аберраций. Всего было проанализировано 22782 клетки стандартным метафазным методом - в пределах от 78 до 762 метафаз на одного человека.
Использованная для лечения обследованных пациентов схема ДЛТ представляла собой сумму дробно-фракционированных локальных облучений с высокой мощностью дозы. Для выполнения биологической дозиметрии по частоте аберраций была использована линейноквадратичная модель, когда при облучении в течение периода T частота аберраций Y как функция дозы D описывается следующим выражением [18]:
Y=c + a D + G (Т) Д D2 , (1)
где с , а , в - коэффициенты дозовой зависимости при остром облучении; G(T) - обобщённый временной фактор эффекта мощности дозы (Lea-Catcheside), который, с учётом эффекта мощности дозы и репарации разрывов хромосом, вычисляется по формуле [18]:
2 Тг
G(T)= —J R(t)dt J Ф (t-f)R(f)df,
D 0о где R(t) - мощность дозы в зависимости от времени за период облучения T; ф(t) - вероятность того, что двунитевые разрывы ДНК остаются нерепарированными до времени t; D - суммарная доза облучения.
Для построения калибровочной дозовой зависимости при остром облучении использовались результаты анализа аберраций в лимфоцитах крови четырёх здоровых доноров (двое мужчин и две женщины) в возрасте от 30 до 40 лет. Облучение in vitro образцов донорской крови производилось у-квантами 60Co на медицинской установке «Луч» (НИИТФА, Росатом, Рос- сия) в диапазоне доз от 0,035 до 4,27 Гр при мощности дозы 0,5 Гр/мин. Дозиметрическое обеспечение осуществлялось путём измерения мощности экспозиционной дозы ионизационной камерой VAK-253 с γ-дозиметром 27012 (Kip-guide, Germany), а также при помощи термолюминесцентных дозиметров-«свидетелей» ТЛД-100 (Harshow, USA).
При статистической обработке полученных данных стандартные ошибки частоты аберраций вычисляли в предположении распределения Пуассона для аберраций по клеткам. В качестве критерия значимости для проверки гипотезы о равенстве средних использовалась Z-статистика без дополнительных предположений о дисперсиях исследуемых распределений. Наблюдаемые распределения аберраций по клеткам сравнивали с теоретически ожидаемым распределением Пуассона с помощью параметрического критерия [20]. Для статистической оценки дозы был использован метод 95%-доверительных интервалов, традиционно применяемый при биодозиметрическом анализе [3].
Результаты исследования и обсуждение
В табл. 1 приведены клинико-диагностические характеристики обследованных пациентов и физические СОД в соответствии с проведёнными курсами ДЛТ. Типичная схема состояла в ежедневном облучении в СОД, равной 2,5 Гр, разделённой на две фракции в 1 и 1,5 Гр с интервалом 5,5 часов. В течение недели осуществлялось 5 сеансов по рабочим дням, за исключением выходных и праздничных дней. По этой причине число сеансов у каждого пациента было меньше общего числа дней облучения (табл. 1).
Для выполнения биологической дозиметрии была получена калибровочная дозовая зависимость частоты аберраций при остром облучении лимфоцитов крови четырёх доноров in vitro . В табл. 2 приведены результаты статистической оценки параметров регрессионной зависимости частоты различных видов хромосомных аберраций от дозы.
В табл. 3 приведены результаты анализа хромосомных аберраций в лимфоцитах крови обследованных пациентов до и после радикального курса ДЛТ. Для каждого из обследованных пациентов была рассчитана частота радиационных маркеров (дицентрики + центрические кольца) и выполнена статистическая оценка соответствия наблюдаемого распределения аберраций по клеткам распределению Пуассона. Такая оценка позволяет сделать обоснованное заключение об особенностях облучения, а именно: было ли радиационное воздействие равномерным по всему телу или оно было локальным и направлено на ограниченную область порядка размера опухоли. В последних двух колонках табл. 3 приведена относительная дисперсия (σ2/Y) и параметр U [20].
При | U | <1,96 наблюдаемое распределение соответствует распределению Пуассона, что свидетельствует о равномерном облучении всего тела (всех лимфоцитов крови). В последней колонке табл. 3 жирным курсивом отмечены распределения маркеров по клеткам с повышенной дисперсией, отличающиеся от распределения Пуассона. Превышение величины U по абсолютному значению 1,96 свидетельствует об отличии наблюдаемого распределения от Пуассоновского с превышением дисперсии при положительном значении U и снижением дисперсии при отрицательном U. Из табл. 3 следует, что у всех пациентов распределение суммы дицентриков и центрических колец по клеткам как после первых суток, так и после всего курса ДЛТ, как правило, имеет повышенную дисперсию и не соответствует распределению Пуассона. Аналогичная картина наблюдается и в отдалённом периоде (табл. 3).
Таблица 1
|
Код |
Возраст (лет) |
Диагноз по TNM |
Фракционирование дозы, Гр |
Длительность ДЛТ, сут |
СОД, Гр |
|
1 |
54 |
T 2 N 2 M 0 |
24x2,5 |
38 |
60 |
|
2 |
61 |
T 4 N 2 M 1 |
19x2,5 |
32 |
47,5 |
|
3 |
61 |
T 4 N 2 M 0 |
20x2,5 |
31 |
50 |
|
4 |
52 |
T 4 N 2 M 0 |
28x2,5 |
43 |
70 |
|
5 |
72 |
T 4 N 1 M 0 |
7x2,0; 10x3,0 |
26 |
44 |
|
6 |
61 |
T 4 N 3 M 0 |
25x2,0 |
33 |
50 |
|
7 |
70 |
T 2 N 0 M 0 |
30x2,0 |
43 |
60 |
|
8 |
61 |
T 4 N 2 M 0 |
25x2,5 |
39 |
62,5 |
|
9 |
67 |
T 2 N 1 M 0 |
24x2,5 |
32 |
60 |
|
10 |
55 |
T 3 N 2 M 0 |
28x2,5 |
38 |
70 |
|
11 |
58 |
T 3 N 2 M 0 |
24x2,5 |
37 |
60 |
|
12 |
53 |
T 3 N 1 M 0 |
24x2,5 |
35 |
60 |
|
13 |
68 |
T 3 N 2 M 0 |
24x2,5 |
34 |
60 |
|
14 |
63 |
T 3 N 1 M 0 |
23x2,5 |
31 |
57,5 |
|
15 |
61 |
T 3 N 2 M 1 |
20x2,5 |
31 |
50 |
|
16 |
47 |
T 2 N 2 M 0 |
3,0; 23x2,5 |
38 |
60,5 |
|
17 |
72 |
T 4 N 2 M 0 |
26x2,5 |
44 |
65 |
|
18 |
45 |
T 3 N 2 M 0 |
20x2,5 |
20 |
50 |
|
19 |
58 |
T 3 N 2 M 0 |
28x2,5 |
38 |
70 |
|
20 |
57 |
T 4 N x M 1 |
20x2,5 |
25 |
50 |
|
21 |
50 |
T 2 N 2 M 0 |
26x2,5 |
37 |
65 |
|
22 |
71 |
T 2 N 1 M 0 |
24x2,5 |
31 |
60 |
|
23 |
66 |
T 3 N 2 M x |
25x2,5 |
33 |
62,5 |
|
24 |
69 |
T 2 N 2 M 0 |
24x2,5 |
32 |
60 |
|
25 |
48 |
T 2 N 2 M 0 |
25x2,5 + 1,4 |
40 |
63,9 |
Клинико-диагностические характеристики обследованных пациентов и дозы радикальной ДЛТ*
Примечание: ДЛТ – дистанционная лучевая терапия; TNM – международная классификация диагнозов (TNM Classification of Malignant Tumors, 7-th edition); СОД – суммарная очаговая доза.
Таблица 2
Параметры зависимости частоты различных видов аберраций хромосом (Y/100 клеток) от дозы (D, Гр) при облучении образцов крови in vitro
Y=c+a D+p D 2
|
Вид аберраций |
Коэффициенты регрессионной зависимости (аберраций/100 клеток) |
||
|
c ±SE* |
a, Гр-1 ±SE* |
p, Гр-2 ±SE* |
|
|
Дицентрики |
0,011±0,012 |
1,40±0,38 |
7,28±0,24 |
|
Ацентрические фрагменты |
0,256±0,047 |
1,99±0,47 |
2,89±0,21 |
|
Дицентрики + центрические кольца |
0,012±0,013 |
1,42±0,42 |
9,59±0,27 |
|
Дицентрики + центрические кольца + ацентрические фрагменты |
0,255±0,050 |
4,05±0,68 |
12,3±0,40 |
Примечание: *SE – стандартная ошибка среднего.
Представленные в табл. 3 результаты показывают, что индивидуальная реакция пациентов на ДЛТ, сопоставимую по дозе и фракционированию, существенно варьирует. Путём последовательного статистического анализа индивидуальных временных зависимостей частоты радиационных маркеров после начала ДЛТ были выделены три подгруппы пациентов: подгруппа I – №№ 3, 6, 15, 17; подгруппа II – №№ 1, 4, 5, 7, 13, 14, 16, 18, 25 и подгруппа III – №№ 2, 8, 9, 10, 11, 12, 21, 23, 24.
Таблица 3
Хромосомные аберрации в лимфоцитах крови обследованных пациентов до и после радикального курса ДЛТ
|
Код пациента |
Время, дней |
Число клеток |
Число абер-рант. клеток |
Фрагменты |
Цен-трич. кольца (ЦК) |
Дицентрики (Диц) |
Частота (Диц+ЦК)/ /100 клеток |
Распределение (Диц+ЦК) по клеткам |
σ2/Y |
U* |
|
0 |
695 |
13 |
10 |
0 |
3 |
0,43±0,25 |
692/3 |
1,00 |
-0,07 |
|
|
1 |
1 |
213 |
20 |
12 |
0 |
13 |
6,10±1,69 |
201/11/1 |
1,10 |
1,05 |
|
38 (ДЛТ) |
284 |
152 |
94 |
37 |
257 |
103,5±6,0 |
152/52/32/27/13/5/2/0/1 |
2,01 |
12,0 |
|
|
0 |
499 |
14 |
13 |
0 |
2 |
0,40±0,28 |
497/2 |
1,00 |
-0,04 |
|
|
2 |
1 |
500 |
42 |
24 |
4 |
24 |
5,60±1,06 |
477/18/5 |
1,30 |
4,89 |
|
32 (ДЛТ) |
259 |
62 |
37 |
15 |
56 |
27,41±3,25 |
214/29/12/2/0/1/0/1 |
2,11 |
12,8 |
|
|
0 |
298 |
7 |
5 |
1 |
1 |
0,67±0,47 |
296/2 |
1,00 |
-0,06 |
|
|
3 |
1 |
300 |
28 |
16 |
3 |
11 |
4,67±1,25 |
286/14 |
0,96 |
-0,55 |
|
31 (ДЛТ) |
119 |
87 |
62 |
28 |
233 |
219,3±13,6 |
35/23/18/14/12/5/6/3/1/0/1/0/1 |
2,46 |
11,2 |
|
|
83 |
400 |
135 |
105 |
23 |
151 |
43,50±3,30 |
296/63/25/9/3/3/0/1 |
1,96 |
13,6 |
|
|
0 |
200 |
3 |
1 |
0 |
2 |
1,00±0,71 |
198/2 |
0,99 |
-0,07 |
|
|
4 |
1 |
260 |
14 |
9 |
2 |
8 |
3,85±1,22 |
252/6/2 |
1,37 |
4,40 |
|
43 (ДЛТ) |
249 |
109 |
37 |
33 |
142 |
70,28±5,31 |
156/56/17/9/3/4/2/2 |
2,29 |
14,5 |
|
|
0 |
200 |
5 |
4 |
0 |
3 |
1,50±0,87 |
198/1/1 |
1,66 |
8,06 |
|
|
5 |
1 |
400 |
29 |
21 |
2 |
10 |
3,0±0,87 |
388/12 |
0,97 |
-0,41 |
|
26 (ДЛТ) |
125 |
38 |
22 |
14 |
45 |
47,20±6,14 |
91/17/9/8 |
1,66 |
5,24 |
|
|
0 |
188 |
9 |
9 |
0 |
1 |
0,53±0,53 |
187/1 |
1,00 |
0,0 |
|
|
6 |
1 |
332 |
20 |
10 |
0 |
10 |
3,01±0,95 |
322/10 |
0,97 |
0,37 |
|
33 (ДЛТ) |
166 |
121 |
44 |
53 |
191 |
147,0±9,41 |
57/48/23/21/8/3/3/2/1 |
1,83 |
7,54 |
|
|
0 |
200 |
5 |
3 |
0 |
2 |
1,00±0,71 |
198/2 |
0,99 |
0,07 |
|
|
7 |
1 |
500 |
29 |
11 |
6 |
16 |
4,40±0,94 |
480/18/2 |
1,14 |
2,27 |
|
43 (ДЛТ) |
199 |
74 |
25 |
26 |
108 |
67,34±5,82 |
134/29/15/14/5/0/1/1 |
2,17 |
11,7 |
|
|
0 |
697 |
8 |
7 |
0 |
1 |
0,14±0,14 |
696/1 |
1,00 |
0,0 |
|
|
39(ДЛТ) |
157 |
31 |
9 |
3 |
33 |
22,93±3,82 |
132/17/5/3 |
1,56 |
5,00 |
|
|
8 |
142 |
200 |
48 |
13 |
5 |
45 |
25,0±3,54 |
160/32/6/2 |
1,24 |
2,38 |
|
246 |
200 |
48 |
29 |
25 |
54 |
39,50±4,44 |
158/23/9/7/1/0/1/1 |
2,44 |
14,5 |
|
|
337 |
500 |
87 |
42 |
22 |
93 |
23,0±2,14 |
433/38/18/6/2/3 |
2,13 |
17,9 |
|
|
0 |
500 |
24 |
21 |
3 |
1 |
0,80±0,40 |
496/4 |
0,99 |
-0,11 |
|
|
9 |
32 (ДЛТ) |
200 |
46 |
17 |
8 |
49 |
28,5±3,77 |
161/26/8/5 |
1,53 |
5,33 |
|
124 |
175 |
32 |
11 |
4 |
31 |
20,0±3,38 |
147/21/7 |
1,21 |
1,96 |
|
|
215 |
200 |
43 |
20 |
3 |
47 |
25,0±3,54 |
166/25/6/1/0/2 |
1,92 |
9,27 |
|
|
0 |
200 |
2 |
2 |
0 |
0 |
0 |
200/0 |
0,0 |
0,0 |
|
|
10 |
38 (ДЛТ) |
119 |
19 |
6 |
3 |
21 |
20,2±4,12 |
103/9/6/1 |
1,56 |
4,41 |
|
185 |
200 |
59 |
21 |
5 |
49 |
27,0±3,67 |
153/41/5/1 |
1,03 |
0,32 |
|
|
0 |
400 |
3 |
3 |
0 |
0 |
0 |
400/0 |
0,0 |
0,0 |
|
|
37 (ДЛТ) |
200 |
24 |
15 |
5 |
16 |
10,5±2,3 |
187/9/2/1/0/1 |
2,34 |
13,7 |
|
|
11 |
68 |
200 |
41 |
24 |
6 |
47 |
26,5±3,6 |
170/21/4/3/1/0/0/0/0/0/0/1 |
3,55 |
25,6 |
|
90 |
200 |
40 |
40 |
13 |
54 |
33,5±4,1 |
170/13/6/6/3/1/0/1 |
2,86 |
18,7 |
|
|
337 |
600 |
89 |
53 |
12 |
86 |
16,3±1,7 |
533/49/8/8/1/1 |
1,82 |
14,3 |
|
|
0 |
200 |
5 |
5 |
0 |
0 |
0 |
200/0 |
0,0 |
0,0 |
|
|
35(ДЛТ) |
200 |
35 |
10 |
4 |
40 |
22,0±3,32 |
170/19/8/3 |
1,56 |
5,66 |
|
|
12 |
251 |
200 |
43 |
33 |
21 |
84 |
52,5±5,12 |
161/14/11/4/4/2/1/2/0/0/0/1 |
3,90 |
29,1 |
|
349 |
200 |
46 |
31 |
26 |
65 |
45,5±4,77 |
161/16/8/8/3/1/3 |
2,87 |
18,7 |
|
|
460 |
500 |
126 |
64 |
29 |
121 |
30,0±2,5 |
391/73/33/1/2 |
1,34 |
5,43 |
|
|
0 |
500 |
10 |
9 |
1 |
0 |
0,20±0,20 |
499/1 |
1,00 |
0,0 |
|
|
13 |
34 (ДЛТ) |
154 |
70 |
30 |
26 |
75 |
65,58±6,53 |
96/35/14/3/2/3/1 |
1,94 |
8,27 |
|
119 |
100 |
53 |
25 |
15 |
95 |
110,0±10,5 |
54/19/13/5/4/3/0/1/0/0/0/0/1 |
3,00 |
14,2 |
|
|
294 |
697 |
62 |
32 |
15 |
60 |
10,76±1,24 |
650/29/11/5/1/1 |
2,02 |
19,1 |
|
|
0 |
497 |
13 |
12 |
0 |
3 |
0,60±0,35 |
494/3 |
1,00 |
-0,08 |
|
|
14 |
31 (ДЛТ) |
166 |
49 |
22 |
12 |
53 |
39,16±4,86 |
124/27/10/3/1/1 |
1,70 |
6,37 |
|
118 |
200 |
86 |
35 |
29 |
116 |
72,5±6,02 |
123/39/19/12/4/2/1 |
1,86 |
8,58 |
|
|
15 |
0 |
399 |
7 |
9 |
0 |
0 |
0 |
399/0 |
0,0 |
0,0 |
|
31 (ДЛТ) |
194 |
130 |
84 |
53 |
210 |
135,6±8,36 |
77/49/30/15/12/7/3/0/1 |
1,86 |
8,46 |
|
|
0 |
762 |
20 |
14 |
1 |
5 |
0,79±0,32 |
756/6 |
0,99 |
-0,14 |
|
|
16 |
38 (ДЛТ) |
200 |
84 |
50 |
12 |
187 |
99,5±7,05 |
124/29/13/16/10/3/1/1/1/1/0/1 |
3,10 |
21,0 |
|
148 |
199 |
68 |
70 |
14 |
141 |
77,9±6,26 |
139/21/15/8/6/5/4/1 |
2,89 |
18,9 |
|
|
223 |
513 |
85 |
55 |
19 |
83 |
19,9±1,97 |
452/39/9/11/0/1/0/1 |
2,24 |
19,9 |
|
|
17 |
0 |
200 |
5 |
4 |
0 |
1 |
0,50±0,50 |
199/1 |
1,00 |
0,0 |
|
44 (ДЛТ) |
78 |
64 |
61 |
39 |
175 |
274,4±18,8 |
18/9/16/15/2/6/5/1/3/1/2 |
2,39 |
8,64 |
|
|
0 |
298 |
4 |
4 |
0 |
0 |
0 |
298/0 |
0,0 |
0,0 |
|
|
18 |
74 |
166 |
69 |
51 |
9 |
85 |
56,63±5,84 |
112/30/14/6/2/2 |
1,81 |
7,36 |
|
139 |
200 |
54 |
29 |
7 |
53 |
30,0±3,87 |
159/27/11/2/0/1 |
1,61 |
6,12 |
|
Код пациента |
Время, дней |
Число клеток |
Число абер-рант. клеток |
Фрагменты |
Цен-трич. кольца (ЦК) |
Дицентрики (Диц) |
Частота (Диц+ЦК)/ /100 клеток |
Распределение (Диц+ЦК) по клеткам |
σ2/Y |
U* |
|
19 |
0 |
200 |
16 |
11 |
0 |
6 |
3,0±1,22 |
194/6 |
0,97 |
-0,27 |
|
20 |
0 |
200 |
4 |
4 |
0 |
0 |
0 |
200/0 |
0,0 |
0,0 |
|
0 |
500 |
10 |
5 |
0 |
5 |
1,0±0,45 |
495/5 |
0,99 |
-0,14 |
|
|
21 |
141 |
372 |
64 |
26 |
16 |
65 |
21,8±2,4 |
319/35/11/4/3 |
1,80 |
11,0 |
|
231 |
400 |
67 |
34 |
11 |
90 |
25,3±2,5 |
348/30/9/6/3/1/3 |
2,73 |
24,6 |
|
|
22 |
0 |
398 |
8 |
4 |
1 |
3 |
1,01±0,50 |
394/4 |
0,99 |
-0,12 |
|
1 |
257 |
11 |
4 |
1 |
4 |
1,94±0,87 |
250/7 |
0,98 |
-0,29 |
|
|
23 |
92 |
698 |
83 |
46 |
9 |
96 |
15,0±1,5 |
630/46/14/3/3/2 |
2,01 |
19,0 |
|
653 |
200 |
44 |
13 |
12 |
19 |
15,5±2,8 |
177/16//6/1 |
1,43 |
4,39 |
|
|
24 |
0 |
200 |
10 |
11 |
0 |
1 |
0,50±0,50 |
199/1 |
1,00 |
0,0 |
|
234 |
400 |
81 |
36 |
25 |
104 |
32,3±2,8 |
329/38/18/10/2/2/0/1 |
2,25 |
17,7 |
|
|
0 |
200 |
1 |
0 |
0 |
1 |
0,50±0,50 |
199/1 |
1,00 |
0,0 |
|
|
25 |
1 |
200 |
17 |
4 |
3 |
12 |
7,50±1,94 |
186/13/1 |
1,06 |
0,66 |
|
40 (ДЛТ) |
200 |
77 |
23 |
24 |
103 |
63,5±5,6 |
131/38/16/8/3/3/1 |
2,00 |
9,98 |
Примечание: жирным курсивом в последней колонке отмечены распределения маркеров по клеткам с повышенной дисперсией, статистически отличающиеся от распределения Пуассона.
На рис. 1 представлены сгруппированные результаты и соответствующие регрессионные зависимости. Так, для подгруппы III (наименее радиочувствительные пациенты) частота маркеров описывается следующей зависимостью Y=(0,347±0,020)⋅t⋅exp[-(0,0045±0,0002)⋅t], где Y – частота суммы дицентриков и центрических колец на 100 клеток, t – время от начала ДЛТ (сутки). Для подгруппы II (промежуточная радиочувствительность) зависимость имеет следующий вид: Y=(3,26±0,12)⋅t⋅exp[-(0,0158±0,0004)⋅t]. Для подгруппы I с наиболее радиочувствительными пациентами по тесту хромосомных аберраций аналогичную статистическую оценку выполнить не удалось вследствие недостаточной статистической мощности исходных данных.
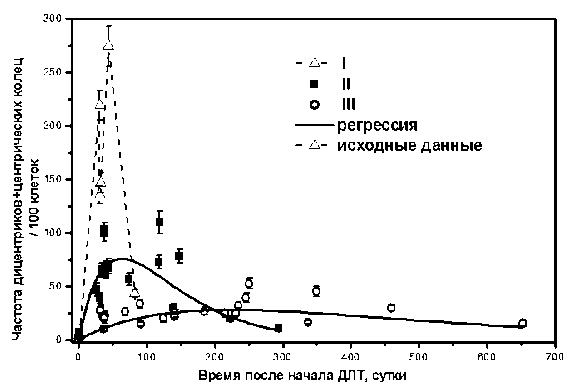
Рис. 1. Зависимость частоты радиационных маркеров от времени после радикального курса ДЛТ в подгруппах по индивидуальной радиационной чувствительности. Сплошными линиями показаны регрессионные зависимости. Пунктирная линия – исходные данные без оценки рег- рессии.
В табл. 4 приведены результаты анализа хромосомных аберрации в лимфоцитах крови обследованных пациентов до и после радикального курса ДЛТ в трёх выделенных подгруппах. Для каждой из подгрупп была рассчитана средняя частота радиационных маркеров (дицентрики + центрические кольца) и выполнена статистическая оценка соответствия распределению Пуассона – наблюдаемого средне-группового распределения маркеров по клеткам. В последней колонке табл. 4 жирным курсивом отмечены распределения маркеров по клеткам с повышенной дисперсией, которые отличаются от распределения Пуассона.
В табл. 5 приведены результаты биологической дозиметрии с использованием современной радиобиологической модели неполной репарации [19, 21] в форме оценки биологической дозы, которая была выполнена для модели облучения всего тела и СОД. По причине существенной индивидуальной вариации результатов цитогенетического анализа биологическая дозиметрия была выполнена для средних значений частоты аберраций в трёх подгруппах.
При оценке дозы в контроле были использованы регрессионные параметры калибровочной дозовой зависимости для суммы дицентриков и центрических колец в формуле (1) и фактор G(T)=1.
Таблица 4
Хромосомные аберрации в лимфоцитах крови обследованных пациентов и их средние величины в трёх подгруппах по степени индивидуальной реакции на облучение до и после курса радикального курса ДЛТ
|
Период наблюдения (среднее), сут |
Подгруппа |
Число пациентов |
Число клеток |
Число абер-рант. клеток |
Фрагменты |
Цен-трич. кольца (ЦК) |
Дицентрики (Диц) |
Частота (Диц+ЦК)/ /100 клеток |
Распределение (Диц+ЦК) по клеткам |
σ2/Y |
U* |
|
0 |
все |
24 |
8631 |
206 |
170 |
7 |
41 |
0,56±0,08 |
8584/46/1 |
1,04 |
2,40 |
|
I |
2 |
632 |
48 |
26 |
3 |
21 |
3,80±0,78 |
608/24 |
0,96 |
-0,66 |
|
|
II |
5 |
1573 |
109 |
57 |
13 |
59 |
4,58±0,54 |
1507/60/6 |
1,12 |
3,43 |
|
|
III |
1 |
500 |
42 |
24 |
4 |
24 |
5,60±1,06 |
477/18/5 |
1,30 |
4,87 |
|
|
I+II+III |
8 |
2705 |
199 |
107 |
20 |
104 |
4,58±0,41 |
2592/102/11 |
1,13 |
4,89 |
|
|
27-44 |
I |
4 |
557 |
402 |
251 |
173 |
809 |
176,3±5,63 |
187/129/87/65/34/21/17/6/6/1/3/0/1 |
2,26 |
21,0 |
|
(ДЛТ) |
II |
8 |
1577 |
653 |
303 |
184 |
970 |
73,2±2,15 |
1008/283/126/88/37/19/8/4/2/1/0/1 |
2,27 |
35,6 |
|
(36±1) |
III |
6 |
1135 |
217 |
94 |
38 |
215 |
22,3±1,40 |
967/109/41/15/0/2/0/1 |
1,78 |
18,7 |
|
I |
1 |
400 |
135 |
105 |
23 |
151 |
43,5±3,3 |
296/63/25/9/3/3/0/1 |
1,96 |
13,6 |
|
|
68-92 |
II |
1 |
166 |
69 |
51 |
9 |
85 |
56,6±5,84 |
112/30/14/6/2/2 |
1,81 |
7,36 |
|
(81±5) |
III |
3 |
1098 |
165 |
110 |
28 |
197 |
20,5±1,37 |
970/80/24/12/7/3/0/1/0/0/0/1 |
2,65 |
38,6 |
|
118-148 |
II |
4 |
699 |
261 |
159 |
65 |
405 |
67,2±3,10 |
475/106/58/27/14/11/5/2/0/0/0//0/1 |
2,53 |
28,6 |
|
(133±12 ) |
III |
3 |
747 |
144 |
50 |
25 |
141 |
22,2±1,72 |
626/88/24/6/3 |
1,50 |
9,74 |
|
185 |
III |
1 |
200 |
59 |
21 |
5 |
49 |
27,0±3,67 |
153/41/5/1 |
1,03 |
0,32 |
|
215-294 |
II |
2 |
713 |
112 |
70 |
29 |
110 |
19,5±1,65 |
631/49/16/14/1/1/0/1/ |
2,18 |
22,3 |
|
(242±10 ) |
III |
5 |
1400 |
282 |
152 |
85 |
379 |
33,1±1,54 |
1162/130/53/28/10/7/5/4/0/0/0/1 |
2,74 |
46,2 |
|
337-349 (341±4) |
III |
3 |
1300 |
222 |
126 |
60 |
244 |
23,4±1,34 |
1127/103/34/22/6/5/3 |
2,29 |
32,9 |
|
460 |
III |
1 |
500 |
126 |
64 |
29 |
121 |
30,0±2,5 |
391/73/33/1/2 |
1,34 |
5,43 |
|
653 |
III |
1 |
200 |
44 |
13 |
12 |
19 |
15,5±2,8 |
177/16//6/1 |
1,43 |
4,39 |
Примечание: жирным курсивом в последней колонке отмечены распределения маркеров по клеткам с повышенной дисперсией, отличающиеся от распределения Пуассона.
Средние дозы на всё тело и СОД в подгруппах рассчитывались в рамках сделанного нами обобщения теории неполной репарации [19, 21] на случай фракционированного острого облучения в различающихся дозах. Основные постулаты использованной биодозиметрической модели состояли в следующем:
-
(1) дозовая зависимость частоты аберраций следует линейно-квадратичной формуле (1) c фактором мощности дозы (2);
-
(2) длительность облучения каждой из дозовых фракций (1-3 мин) существенно меньше как характерного периода времени репарации повреждений хромосом (~2 ч) со скоростью μ ≈0,4 ч-1 [22], так и периода времени между фракциями дозы ( Δt =5,5 ч);
-
(3) фактор мощности дозы при облучении в течение суток в неравных дозах D 1 и D 2 , разделённых временем Δt , вычисляется по следующей формуле, обобщающей теорию [19]:
G(T) =
D 2 + D 2 + 2 D,D2exp( - M^ t) (D i + D 2 )2
-
(4) фактор мощности дозы при многократном ( n >>1) облучении короткими фракциями вычисляется в следующем приближении [18]:
G(T) = - . (4)
Средние дозы облучения в подгруппах на всё тело после первого дня облучения и в течение последующего периода были рассчитаны с использованием дозовой зависимости (1) для суммы дицентриков и центрических колец c фактором мощности дозы, приведённым в третьей колонке табл. 5. Рассчитанные величины отражают оценку побочной биологической дозы в результате ДЛТ, усреднённую как по циркулирующим в организме пациента лимфоцитам, так и по числу пациентов в подгруппе.
Средние величины СОД в подгруппах после первого дня облучения и в течение всего последующего периода были рассчитаны методом Dolphin [14] c фактором мощности дозы, приведённым в третьей колонке табл. 5. Средние величины доз на всё тело и СОД в подгруппах в период наблюдения после окончания ДЛТ рассчитывались путём применения той же методики, что и при оценке дозы непосредственно после ДЛТ. Поскольку физическая оценка дозы после ДЛТ отсутствует, то в табл. 5 на время 81 сутки и более стоит прочерк.
Таблица 5
Средние величины биологических доз в трёх подгруппах по степени индивидуальной реакции на облучение и физические величины СОД до и после радикального курса ДЛТ
|
Период наблюдения (M ± SE), сут |
Подгруппа |
G(T) |
Биологическая доза на всё тело M (CI), Гр |
<СОД> ± SE, Гр |
|
|
биологическая доза |
физическая доза |
||||
|
контроль |
все пациенты |
1 |
0,18 (0 – 0,29) |
0,59 ± 0,03 |
0 |
|
I |
0,563 |
0,72 (0,47 – 0,92) |
0,72 ± 0,12 |
2,5 |
|
|
1 |
II |
0,563 |
0,80 (0,62 – 0,96) |
1,68 ± 0,07 |
2,5 |
|
III |
0,563 |
0,89 (0,62 – 1,13) |
2,62 ± 0,10 |
2,5 |
|
|
I+II+III |
0,563 |
0,80 (0,65 – 0,94) |
1,74 ± 0,06 |
2,5 |
|
|
27-44 (ДЛТ) (36±1) |
I II |
0,02198 0,02051 |
25,8 (24,5 – 27,2) 16,0 (15,6 – 16,5) |
30,7 ± 0,7 25,4 ± 0,4 |
53,8±3,8 58,4±2,5 |
|
III |
0,02083 |
7,60 (7,30 – 7,86) |
17,8 ± 0,2 |
60,4±2,0 |
|
|
I |
0,0250 |
10,8 (10,0 – 11,7) |
19,0 ± 0,4 |
- |
|
|
68-92 (81±5) |
II |
0,0250 |
12,7 (11,2 – 14,1) |
19,9 ± 0,7 |
- |
|
III |
0,02055 |
7,21 (6,92 – 7,48) |
21,9 ± 0,2 |
- |
|
|
118-148 (133±12) |
II III |
0,0221 0,0200 |
14,8 (14,1 – 15,5) 7,68 (7,25 – 8,08) |
25,4 ± 0,5 15,3 ± 0,2 |
- - |
|
185 |
III |
0,01786 |
9,07 (7,81 – 10,2) |
9,39 ± 0,55 |
- |
|
215-294 (242±10) |
II III |
0,02105 0,02033 |
6,92 (6,47 – 7,33) 9,89 (9,64 – 10,2) |
20,8 ± 0,2 24,6 ± 0,3 |
- - |
|
337-349 (341±4) |
III |
0,02055 |
7,87 (7,63 – 8,10) |
21,9 ± 0,2 |
- |
|
460 |
III |
0,02083 |
9,20 (8,56 – 9,82) |
15,2 ± 0,2 |
- |
|
653 |
III |
0,0200 |
6,02 (4,77 – 7,03) |
14,8 ± 0,2 |
- |
Примечание: M – среднее значение; SE – ошибка среднего; CI – 95% доверительные интервалы.
Средняя частота радиационных маркеров (дицентрики и центрические кольца) в контроле у обследованной группы пациентов составила 0,56 аберраций/100 кл. с вариацией от 0 до 1,50. Данные величины в несколько раз выше принятого спонтанного уровня данных маркеров (~0,1 аберрация/100 кл. [3]). Эти результаты могут, в частности, свидетельствовать о наличии спонтанных мутаций в клетках у обследованных пациентов или о возможном влиянии предшествующих рентгенорадиологических исследований. Однако, в целом можно сделать вывод, что существенного радиационного воздействия на обследованных пациентов до начала ДЛТ не было (табл. 3). В среднем, доза на всё тело при указанной частоте составляет 0,18 Гр (табл. 5). При этом распределение маркеров по клеткам показало повышенную дисперсию, что может свидетельствовать о всё же имевшемся незначительном неравномерном облучении. Основной вклад в суммарное распределение маркеров по клеткам происходит от пациента № 5 (табл. 3), у которого в контроле было обнаружено два маркера в одной клетке. Расчёт средней дозы для всех пациентов в контроле методом Dolphin [14] приводит к величине 0,59 Гр (табл. 5).
Средняя частота радиационных маркеров после первых суток ДЛТ в обследованной группе составила 4,58 аберраций/100 кл. с индивидуальной вариацией от 3,0 до 6,1 (табл. 3, 4). Данная величина многократно выше принятого спонтанного уровня, что свидетельствует о существенном радиационном воздействия на обследованных пациентов после первого дня ДЛТ. В среднем доза на всё тело при указанной частоте маркеров составляет 0,80 Гр (табл. 5). Суммарное распределение маркеров по клеткам показывает повышенную дисперсию, что свидетельствует о неравномерном облучении пациентов (за исключением подгруппы I). Расчёт СОД для всех пациентов после первого дня ДЛТ методом Dolphin [14] с учётом фактора мощности дозы приводит к величине 1,74 Гр (табл. 5).
Средняя частота радиационных маркеров после окончания ДЛТ в подгруппах существенно варьирует от 22,3 до 176,3 аберраций/100 кл. (табл. 4). Указанные величины многократно выше принятого спонтанного уровня маркеров, что свидетельствует о значительном радиационном воздействии. В среднем доза на всё тело в подгруппах при указанной частоте маркеров также существенно варьирует от 7,6 до 25,8 Гр (табл. 5). Суммарное распределение маркеров по клеткам показывает повышенную дисперсию во всех подгруппах, что указывает на неравномерное облучение пациентов. Расчёт средней дозы после курса ДЛТ методом Dolphin [14] с учётом фактора мощности дозы приводит к СОД, которая варьирует в пределах от 17,8 до 30,7 Гр (табл. 5). Тот факт, что оценка СОД по хромосомным маркерам оказывается ниже, чем физические дозы в соответствующих подгруппах, может свидетельствовать о наличии противоречий между назначенными дозами и фактической реакцией на облучение пациентов при использовании Y-терапевтических установок предыдущего поколения.
Средние частоты радиационных маркеров в период после окончания ДЛТ варьируют в подгруппах от 15,5 до 67,2 аберраций/100 кл. (табл. 4). Указанные величины также многократно выше принятого спонтанного уровня маркеров, что свидетельствует о значительном радиационном воздействии. Результаты анализа распределения маркеров по клеткам указывают на неравномерное облучение обследованных пациентов. В среднем доза на всё тело в подгруппах при выявленной частоте маркеров варьирует от 6,02 до 14,8 Гр, в период до 653 суток после начала ДЛТ (табл. 5). Расчёт средней дозы в период после начала ДЛТ методом Dolphin [14] с учётом фактора мощности дозы приводит к СОД, которая варьирует в пределах от 14,8 до 25,4 Гр (табл. 5). Необходимо отметить, что повышенная частота радиационных маркеров в лимфоцитах крови пациентов сохраняется довольно длительное время. Так, даже по истечении почти двух лет, последствия ДЛТ могут быть достоверно выявлены при помощи использованного цитогенетического метода.
Анализ соотношения биодозиметрической и физической дозы, представленный в табл. 5, показывает следующее. Реакция лимфоцитов крови пациентов в форме частоты радиационных маркеров после первого дня ДЛТ отличается в 1,5 раза в подгруппах I-III (табл. 4), при этом биодозиметрические оценки дозы на всё тело различаются в 1,3 раза, а оценки СОД отличаются в 3,6 раза (табл. 5). В среднем биологическая оценка СОД составляет 70% от суточной фи- зической дозы в 2,5 Гр. Аналогичная, но более выраженная, тенденция сохраняется и для СОД, оцененной после всего курса ДЛТ. Так, в подгруппах биологическая оценка СОД составляет 57; 43,54; 29,5% (табл. 5).
Разумно предположить, что помимо сложного дробно-фракционированного метода реализации ДЛТ на частоту аберраций оказывает существенное влияние индивидуальные особенности пациента, в частности, способность к восстановлению первичных радиационных повреждений в лимфоцитах крови. Таким образом, наиболее вероятная причина расхождений биологической и физической оценок СОД может заключаться в существенной индивидуальной вариабельности радиационной чувствительности пациентов, которая не формализована в использованной модели расчёта биологической СОД. Дальнейшие исследования и привлечение надёжных дозиметрических данных должны помочь решить указанную проблему.
Кроме того, имеется явная специфика онкологических пациентов по сравнению с индукцией аберраций у здоровых людей. Речь идёт об аномально длительном периоде после окончания радиационного воздействия – до двух лет (табл. 4), когда сохраняется высокая частота радиационных маркеров и, соответственно, высокая биодозиметрическая оценка, как общей дозы, так и СОД (табл. 5).
Заключение
На основе цитогенетических показателей в виде аберраций хромосом, присутствующих в лимфоцитах крови, можно оценить характерные индивидуальные особенности воздействия локального облучения с учётом его фракционирования, а именно: общую и локальную дозу, а также подтверждение локального характера облучения.
В выполненной работе создана модель оценки локального облучения in vivo , позволяющая определить СОД по частоте аберраций хромосом на момент окончания курса радикальной лучевой терапии. Выявленные закономерности формирования аберраций хромосом представляют интерес, как для биологической дозиметрии, так и для оценки реакции на облучение различных соматических клеток пациента, а также для анализа индуцированной нестабильности всего генома.
По результатам цитогенетического обследования группы больных раком лёгкого после ДЛТ методом биологической дозиметрии были рассчитаны дозы общего облучения и СОД в сопоставлении с назначенными физическими дозами. Выявленные закономерности индукции хромосомных повреждений в лимфоцитах крови больных раком лёгкого доказывают необходимость использования персонализированного подхода к планированию и реализации схемы радикального курса ДЛТ. Полученные с использованием цитогенетического метода дозовые зависимости аберраций в лимфоцитах крови могут быть востребованы для подтверждения факта проведения адекватной ДЛТ и контроля полученной пациентом дозы. Указанный результат особенно важен для прогноза развития поздних лучевых повреждений и выработки схем лечебных мероприятий по устранению негативных последствий лучевой терапии в онкологии.
Данная работа проводилась в рамках выполнения тем государственного задания МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии» Минздрава России, итоги выполнения которых нашли отражение в промежуточной публикации [23].
Список литературы Оценка последствий дистанционной лучевой терапии у больных раком лёгкого путём анализа хромосомных аберраций в лимфоцитах крови
- Злокачественные новообразования в России в 2017 году (заболеваемость и смертность) /под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М.: МНИОИ им. П.А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2018. 250 с.
- Столбовой А.В., Залялов И.Ф. Радиобиологические модели и клиническая радиационная онкология //Онкология. Журнал им. П.А. Герцена. 2016. Т. 5, № 6. С. 88-96.
- Cytogenetic analysis for radiation dose assessment. A Manual. Technical Reports Series IAEA No 405. Vienna: IAEA, 2001. 127 p.
- Simon S.L., Bailiff I., Bouvill A., Fattibene P., Kleinerman R.A., Lloyd D.C., McKeever S.W.S., Romanyukha A., Sevan'kaev A.V., Tucker J.D., Wieser A. BiodosEPR-2006 consensus committee report on biodosimetric methods to evaluate radiation doses at long times after exposure //Radiat. Meas. 2007. V. 42, N 6-7. P. 948-971.
- Roch-lefévre S., Pouzoulet F., Giraudet A.L., Voisin P.A., Vaurijoux A., Gruel G., Grégoire E., Buard V., Delbos M., Voisin Ph., Bourhis J., Roy L. Cytogenetic assessment of heterogeneous radiation doses in cancer patients treated with fractionated radiotherapy //Br. J. Radiol. 2010. V. 83, N 993. P. 759-766.
- Matsuoka A., Yamada K., Hayashi M., Sofuni T. Chromosomal aberrations detected by chromosome painting in lymphocytes from cancer patients given high doses of therapeutic X-rays //J. Radiat. Res. 1996. V. 37, N 4. P. 257-265.
- Vorobtsova I., Darroudi F., Semyonov A., Kanayeva A., Timofeyeva N., Yakovleva T., Zharinov G., Natarajan A.T. Analysis of chromosome aberrations by FISH and Giemsa assays in lymphocytes of cancer patients undergoing whole-body irradiation: Comparison of in vivo and in vitro irradiation //Int. J. Radiat. Biol. 2001. V. 77, N 11. P. 1123-1131.
- Senthamizhchelvan S., Pant G.S., Rath G.K., Julka P.K., Nair O., Joshi R.C., Malhotra A., Pandey R.M. Biodosimetry using chromosome aberrations in human lymphocytes //Radiat. Prot. Dosim. 2007. V. 123, N 2. P. 241-245.
- Durante M., Yamada S., Ando K., Furusawa Y., Kawata T., Majima H., Nakano T., Tsujii H. Measurements of the equivalent whole-body dose during radiation therapy by cytogenetic methods //Phys. Med. Biol. 1999. V. 44, N 5. P. 1289-1298.
- Lee R., Yamada S., Yamamoto N., Miyamoto T., Ando K., Durante M., Tsujii H. Chromosomal aberrations in lymphocytes of lung cancer patients treated with carbon ions //J. Radiat. Res. 2004. V. 45, N 2. P. 195-199.
- Sak A., Grehl S., Erichsen P., Engelhard M., Grannass A., Levegrün S., Pottgen C., Groneberg M., Stuschke M. Gamma H2AX foci formation in peripheral blood lymphocytes of tumor patients after local radiotherapy to different sites of the body: dependence on the dose distribution, irradiated site and time from start of treatment //Int. J. Radiat. Biol. 2007. V. 83, N 10. P. 639-652.
- Matsubara S., Sasaki M.S., Adachi T. Dose response relationship of lymphocyte chromosome aberrations in locally irradiated persons //J. Radiat. Res. 1974. V. 15, N 4. P. 189-196.
- Sasaki M.S., Miyata H. Biological dosimetry in atomic bomb survivors //Nature. 1968. V. 220, N 5173. P. 1189-1193.
- Dolphin G.W. Biological dosimetry with particular reference to chromosomal aberration analyses. A review of methods (IAEA-SM-119/4) //Handling of radiation accidents. Proceedings of a Symposium on the Handling of Radiation Accidents. Vienna: IAEA, 1969. P. 215-224.
- Barquinero J.F., Barrios L., Caballin M.R., Miró R., Ribas M., Egozcue J. Biological dosimetry in simulated in vitro partial irradiations //Int. J. Radiat. Biol. 1997. V. 71, N 4. P. 435-440.
- Хвостунов И.К., Курсова Л.В., Шепель Н.Н., Рагулин Ю.А., Севанькаев А.В., Гулидов И.А., Гла-зырин Д.А., Иванова И.Н. Оценка целесообразности применения биологической дозиметрии на основе анализа хромосомных аберраций в лимфоцитах крови больных раком лёгкого при терапевтическом фракционированном у-облучении //Радиационная биология. Радиоэкология. 2012. Т. 52, № 5. С. 467-480.
- Хвостунов И.К., Шепель Н.Н., Севанькаев А.В., Нугис В.Ю., Коровчук О.Н., Курсова Л.В., Рагу-лин Ю.А. Совершенствование методов биологической дозиметрии путём анализа хромосомных аберраций в лимфоцитах крови человека при облучении in vitro и in vivo //Медико-биологические проблемы жизнедеятельности. 2013. Т. 9, № 1. С. 135-147.
- Brenner D.J., Hlatky L.R., Hahnfeldt P.J., Huang Y., Sachs R.K. The linear-quadratic model and most other common radiobiological models result in similar predictions of time-dose relationships //Radiat. Res. 1998. V. 150, N 1. P. 83-91.
- Nilsson P., Thames H.D., Joiner M.C. A generalized formulation of the "incomplete-repair" model for cell survival and tissue response to fractionated low dose-rate irradiation //Int. J. Radiat. Biol. 1990. V. 57, N 1. P. 127-142.
- Edwards A.A., Lloyd D.C., Purrott R.J. Radiation induced chromosome aberration and the Poisson distribution //Radiat. Environ. Biophys. 1979. V. 16, N 2. P. 89-100.
- Thames H.D. An "incomplete-repair" model for survival after fractionated and continuous irradiation //Int. J. Radiat. Biol. 1985. V. 47, N 3. P. 319-339.
- Bhat N.N., Rao B.S. Dose rate effect on micronuclei induction in cytokinesis blocked human peripheral blood lymphocytes //Radiat. Prot. Dosim. 2003. V. 106, N 1. P. 45-52.
- Каприн А.Д., Галкин В.Н., Жаворонков Л.П., Иванов В.К., Иванов С.А., Романко Ю.С. Синтез фундаментальных и прикладных исследований - основа обеспечения высокого уровня научных результатов и внедрения их в медицинскую практику //Радиация и риск. 2017. Т. 26, № 2. С. 26-40.


