Оценка потенциального повреждающего эффекта радиочастотного воздействия у детей в проспективном наблюдении (серия клинических случаев)
Автор: Джаффарова О.Ю., Свинцова Л.И., Плотникова И.В., Криволапов С.Н., Картофелева Е.О.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические случаи
Статья в выпуске: 3 т.35, 2020 года.
Бесплатный доступ
Цель: оценить электрическую активность миокарда и зоны радиочастотных (РЧ) аппликаций в результате радиочастотной аблации (РЧА), выполненных в раннем возрасте.Материал и методы. Представлена серия клинических случаев проспективного наблюдения за тремя пациентами, которым внутрисердечное электрофизиологическое исследование (ВСЭФИ) и эффективная РЧА тахикардии впервые выполнены в раннем возрасте. По причине рецидивирования и возникновения новых аритмий через 12 лет в первом случае и через 6 лет в двух других случаях потребовалось повторное вмешательство, в процессе которого выполнено электроанатомическое картирование для оценки потенциального повреждающего эффекта РЧ воздействия в зоне первой аблации.Результаты. ВСЭФИ и амплитудная биполярная CARTO-реконструкция зон первичной аблации, выполненные при проведении повторной РЧА, продемонстрировали отсутствие зон снижения амплитуды электрического сигнала миокарда, немых электрических зон, что свидетельствует об отсутствии рубцово-склеротических изменений миокарда у детей в отдаленном периоде после РЧ воздействия.Выводы. Показано, что при использовании щадящих энергетических и температурных параметров РЧА, ограниченного количества РЧ аппликаций отсутствовало увеличение зоны коагуляционного некроза в зоне первичной аблации с ростом ребенка. Необходимо продолжение исследований в этом направлении.
Дети, радиочастотная аблация, аритмии, радиочастотное повреждение миокарда, проспективное наблюдение
Короткий адрес: https://sciup.org/149126188
IDR: 149126188 | УДК: 615.84-06-053.2 | DOI: 10.29001/2073-8552-2020-35-3-116-124
Текст научной статьи Оценка потенциального повреждающего эффекта радиочастотного воздействия у детей в проспективном наблюдении (серия клинических случаев)
Радиочастотная аблация (РЧА) аритмий применяется в детской аритмологии с 1989 г. и имеет преимущества перед антиаритмической терапией (ААТ), так как является радикальным методом лечения аритмий у детей без структурного заболевания сердца и приводит к полному восстановлению здоровья. При неэффективности медикаментозной терапии тахиаритмий и развитии аритмоген-ной кардиомиопатии (АКМП) большинство авторов предлагают использовать РЧА у детей независимо от возраста [1–3]. В 2016 г. в журнале Heart Rhythm консенсус экспертов американских и европейских кардиологических и электрофизиологических сообществ опубликовал новые рекомендации, где РЧА медикаментозно рефрактерных аритмий, сопровождающихся гемодинамическими нарушениями у детей весом менее 15 кг, относят к I классу показаний [4], расширены показания к РЧА у этой категории пациентов с WPW паттерном, сопровождающимся диссинхронической кардиомиопатией [4, 5].
Однако возможности проведения РЧА у детей раннего возраста до настоящего времени дискутируются специалистами вследствие высокого риска осложнений процедуры и неизученных отдаленных результатов интервенционного лечения. Серьезным сдерживающим фактором для расширения показаний к РЧА у детей, и особенно детей раннего возраста, является нерешенный в течение многих лет вопрос об отдаленных последствиях радиочастотных (РЧ) воздействий на растущие детские сердца. Экспериментальные данные, опубликованные J.P. Saul и соавт. в 1994 г., показали, что у ягнят в зоне РЧ воздействия формируется локальная зона фиброза, которая в отличие от взрослых может иметь неровные края и увеличиваться в процентном отношении к нормальному миокарду в отдаленные сроки [6]. Несмотря на то, что данные экспериментальные находки не нашли своего продолжения в клинических исследованиях, они в значительной степени определяют ограничения в выборе РЧА в качестве метода лечения у детей раннего возраста. Однако не вызывает сомнений тот факт, что у данной категории детей с медикаментозно-рефрактерными тахикардиями, сопровождающимися гемодинамическим компромиссом, РЧА является единственно возможным методом лечения. На сегодняшний день нет клинических исследований, демонстрирующих с помощью существующих методов визуализации очаги РЧ повреждения в миокарде и динамику этих очагов по мере роста пациентов, которые в раннем возрасте подверглись РЧА. Существуют лишь единичные публикации клинических случаев, где предпринимаются попытки оценить зону РЧ воздействия с помощью магнитно-резонансной томографии (МРТ) либо эхокардиографии (ЭхоКГ) [7, 8]. Не вызывает сомнений актуальность продолжения проспективных исследований в этой области.
Цель исследования: в процессе долгосрочного проспективного наблюдения с использованием внутрисердечного электрофизиологического исследования (ВСЭФИ) и электроанатомического картирования, выполняемых по причине рецидивирования аритмий, оценить электрическую активность миокарда и зоны РЧ аппликаций в результате РЧА, выполненных в раннем возрасте.
Материал и методы
Трем пациентам, которым в возрасте 2 мес., 1 года и 5 лет соответственно выполнены РЧА аритмий, через 12 лет в первом клиническом случае и через 6 лет во вторых двух случаях выполнены повторные РЧА с использованием навигационной системы CARTO. Поводом для повторной РЧА в первом клиническом случае, когда первая аблация выполнялась по поводу предсердной тахикардии, явился манифестный синдром WPW с пароксизмами ортодромной тахикардии. Во вторых двух случаях повторная РЧА выполнена в связи с рецидивированием аритмий через несколько лет после первой успешной аблации.
Подготовка пациентов к ВСЭФИ и РЧА осуществлялась по общим правилам проведения катетерных вмешательств на крупных сосудах. Перед исследованием отменялись все антиаритмические препараты (ААП) не менее чем за пять периодов полувыведения. Процедура РЧА проводилась с использованием электрофизиологических комплексов Элкарт II (Электропульс, Томск, Россия) и BARD (LabSystem™ PRO EP Recording System, Bard Electrophysiology Division, United States). Всем детям вмешательство осуществлялось на фоне сбалансированной тотальной внутривенной анестезии, которая обеспечивалась постоянной инфузией 1% пропофола в дозе 7– 10 мг/кг/ч и 0,005% фентанила 5–7 мкг/кг/ч. Пациентке в возрасте 2 мес. жизни, у которой тахикардия сопровождалась выраженной недостаточностью кровообращения и риском развития дыхательной недостаточности, процедура РЧА осуществлялась в условиях искусственной вентиляции легких (ИВЛ). По методу Сельдингера пунктировали правую и левую бедренные вены, через которые проводили диагностические и аблационные электроды под флюороскопическим контролем. В зависимости от массы тела ребенка использовались следующие размеры электродов: 5 Fr – при массе тела до 10 кг, 6 Fr при массе тела 10–15 кг, 7 Fr – при массе тела более 15 кг. У детей исследуемой возрастной группы количество вводимых электродов ограничивалось двумя: одного диагностического, в качестве которого использовали четырехполюсный Bard 5 Fr, и одного аблационного – Medtronic 5 Fr SCXS Marinr™ с наконечником 4 мм. Электроанатомическое картирование проводилось посредством системы CARTO (Biosense Webster, США). В основе метода лежит детекция положения кончика электрода в электромагнитном поле с графическим его отображением в виде трехмерной фигуры, которая является реконструкцией анатомии исследуемой камеры сердца. В каждой точке фигуры возможна регистрация амплитуды электрограммы, времени активации относительно референтного сигнала. Таким образом, возможно построение анатомической, активационной и вольтажной карт исследуемой камеры сердца. При использовании системы CARTO применялись электроды NaviStar ThermoCool Biosense Webster 7Fr с интервалом 2–5–2 мм. Мы брали 12 точек в зоне интереса (первичной аблации). Для цветной шкалы определили границы 0,05–1 мВ. Сигналы выше 1 мВ представлены фиолетовым цветом, сигналы от 0,05 мВ до 1 мВ – в шкале цветности от красного до голубого. Зоны, близкие к красному цвету, считаются зоной повреждения – рубца. Далее проводили анатомический мэппинг предсердий, при этом отслеживали в режиме онлайн амплитуду интервала предсердий (зон интереса).
В связи с ограничениями, связанными с размерами электродов, мы не имели возможности применять высокоплотное картирование у детей, а использовали рутинное электроанатомическое картирование, которое не позволяет визуализировать точечный рубец от РЧ воздействия в отличие от послеоперационных рубцов.
Таблица. Клиническая характеристика пациентов и параметры первичной радиочастотной аблации Table. Clinical characteristics of patients and primary radiofrequency ablation parameters
|
Случай Пол Case Sex |
Возраст на момент Вид Кол-во РЧА Мощность, Повторное ВСЭФИ первой РЧА, лет Вес, кг тахикардии аппликаций Температура, °С Вт через … лет Age at the first RFA Weight, kg Tachycardia Number of RFA Temperature, ° С Power Years after repeated (year) type applications W intracardiac EPS |
|
1 ЖF |
0,17 4,6 Предсердная 7 50 30 12 (2 мес.) Atrial |
|
М 2M |
1 10,5 ПредAсtrеiрaдl ная 5 55 25 6 |
|
Ж 3F |
5 17,0 WВPПWВ 3 50 30 6 |
Тем не менее нормальная амплитуда активационной зоны первичной аблации исключает наличие роста поста-блационного рубца. Так как минимальный размер электрода, используемый в системе CARTO, составляет 7 Fr, у детей весом менее 15 кг электроанатомическое картирование выполнялось после предварительной ультразвуковой оценки диаметра бедренных вен.
Результаты – серия клинических случаев
Клиническая характеристика пациентов на момент первой процедуры РЧА и параметры РЧ воздействия представлены в таблице. Первая и повторная РЧА были выполнены в одном аритмологическом центре.
Первый клинический случай
Пациентка М., 12 лет. Из анамнеза известно, что пароксизмальная тахикардия у ребенка была диагностирована внутриутробно на 35-й нед. гестации. По причине угрозы жизни для плода на 37-й нед. беременности было проведено кесарево сечение. С рождения пациентка находилась в отделении реанимации, отмечалась непрерывно-рецидивирующая предсердная тахикардия, клинические признаки сердечной недостаточности (СН) – одышка до 60 в минуту, увеличение печени до 4 см из-под края реберной дуги. На электрокардиограмме (ЭКГ) пре- экзитация отсутствовала. По данным эхокардиографии (ЭхоКГ), выявлено увеличение полости левого желудочка (ЛЖ), регургитация на митральном и трикуспидальном клапанах I степени, снижение фракции выброса ЛЖ во время приступа до 30%. Проводился подбор ААП (ана-прилин, пропафенон, этацизин, новокаинамид, верапамил, кордарон) в возрастных дозах. Антиаритмическая монотерапия и комбинация кордарон + анаприлин были неэффективными, приступы тахикардии рецидивировали более 24 раз за сутки, купировались самостоятельно либо после внутривенного введения β-блокаторов с развитием брадикардии до 80 в минуту и сопорозных состояний. Учитывая ухудшение состояния пациентки, возникновение проаритмогенных эффектов препаратов, признаки аритмогенной кардиомиопатии и СН, ребенку на 64-й день жизни было выполнено ВСЭФИ, активационная реконструкция правого и левого предсердий (через функционирующее овальное окно), рисунок 1. При программированной стимуляции индуцированы устойчивые пароксизмы предсердной ре-ентри тахикардии. После картирования правого предсердия на средне-септальную его часть (область овальной ямки) на фоне тахикардии нанесена серия из семи РЧ аппликаций с температурой 50 ºС, мощностью 30 Вт, суммарная продолжительность эффективных аппликаций составила 120 с. Тахикардия была устранена.
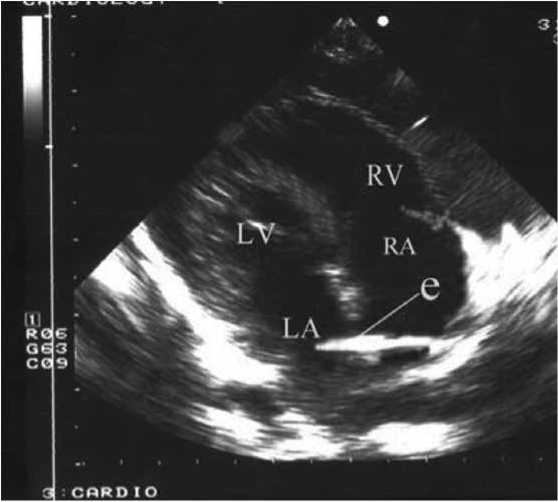
Рис. 1. Электрод (e) проведен через овальное отверстие из правого предсердия (RA) в левое (LA)
Fig. 1. The lead (e) passed through the foramen ovale from the right atrium (RA) to the left atrium (LA)
При проведении контрольной учащающей и программируемой электрокардиостимуляции тахикардия не индуцировалась. Послеоперационный период протекал без осложнений. Отмечалась положительная динамика в состоянии пациентки: исчезновение клинических проявлений СН в раннем послеоперационном периоде, нормализация объемов камер сердца и сократительной функции ЛЖ в течение месяца после выполненного вмешательства. Приступы тахикардии не рецидивировали
-
[9] . Ребенок наблюдался кардиологом по месту жительства.
В возрасте 7 лет впервые выявлена преэкзитация на ЭКГ. В возрасте 12 лет у пациентки появились жалобы на приступы учащенного сердцебиения. По результатам суточного мониторирования ЭКГ отмечались признаки постоянного функционирования дополнительного предсердно-желудочкового соединения (ДПЖС). По данным ЭхоКГ регистрировались нормальные размеры и объемы камер сердца, а также нормальная сократительная функция ЛЖ. Отсутствовали повреждения клапанных структур, зоны нарушения локальной сократимости и гипокинеза. При проведении МРТ сердца с контрастированием структурной патологии миокарда выявлено не было. Пациентке были выполнены ВСЭФИ и РЧА ДПЖС.
С целью оценки потенциального повреждающего воздействия РЧА, выполненной в 2-месячном возрасте, первым этапом операции было проведение амплитуд- ной биполярной реконструкции правого предсердия с использованием системы навигационного картирования CARTO, в результате которого снижения электрической активности миокарда, в том числе в зоне первой аблации (область овальной ямки) не выявлено. Данный факт свидетельствует о нормальной электрической активности ткани предсердий и отсутствии рубцово-некротических повреждений в отдаленном периоде после РЧ воздействия (рис. 2).
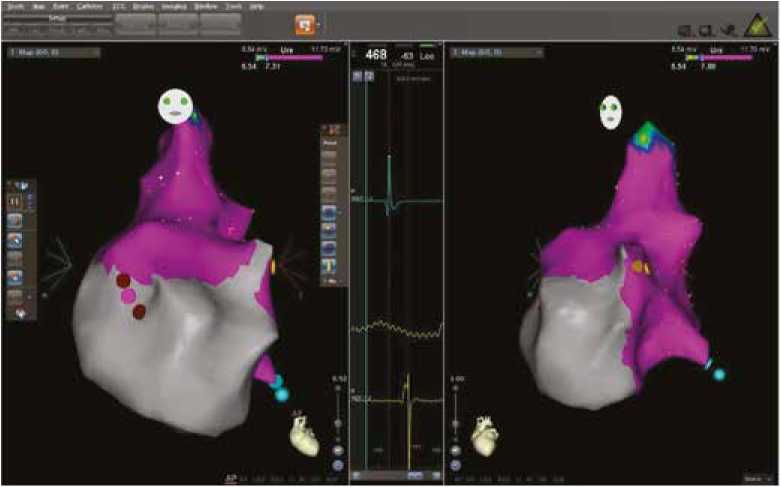
Рис. 2. Монополярная амплитудная реконструкция правого предсердия в прямой и левой косой проекциях. Желтыми точками отмечено место регистрации пучка Гиса, голубыми точками – область коронарного синуса. Сиреневая окраска реконструкции зоны первой РЧА соответствует монополярной амплитуде эндограммы 7,8–11,7 мВ что указывает на неизмененный миокард
Fig. 2. Monopolar amplitude reconstruction of the right atrium in direct and left oblique projections. The yellow dots mark the place of His bundle registration; the blue dots mark the area of coronary sinus. The purple color in the reconstruction of the first RFA zone corresponds to the monopolar endogram amplitude of 7.8–11.7 mV, which corresponds to the unchanged myocardium
Вторым этапом операции было проведение ВСЭ-ФИ, документирован манифестирующий синдром WPW, программированной стимуляцией индуцирована ор-тодромная тахикардия. После картирования правого атриовентрикулярного кольца на область наиболее ранней активации (передне-латеральная позиция) нанесена серия РЧ аппликаций 50 ºС, 30 Вт. Проведение по ДПЖС устранено. Послеоперационный период протекал без осложнений. Пациентка была выписана на 5-е сут после операции под наблюдение врача-кардиолога.
Второй клинический случай
Пациент И., 7 лет. Из анамнеза известно, что пациент в возрасте 11 мес. впервые поступил в отделение детской кардиологии с жалобами со стороны родителей на учащенное сердцебиение, потливость, вялость, утомляемость, снижение аппетита. Появление учащенного сердцебиения у ребенка мама отметила после вакцинации АКДС. После проведенного обследования, включающего ЭКГ, холтеровское мониторирование (ХМ) ЭКГ, ЭхоКГ поставлен диагноз: Непрерывно-рецидивирующая предсердная тахикардия. ФК III. Пациенту проводился подбор
ААТ, включающий карбамазепин, дигоксин, пропафе-нон, анаприлин, амиодарон и комбинацию пропафенон + анаприлин. Терапия была неэффективной. На фоне непрерывно-рецидивирующей тахикардии с высокой среднесуточной частотой сердечных сокращений (ЧСС), по данным ХМ ЭКГ, явлений аритмогенной кардиомиопатии, заключающихся в дилатации предсердных камер по данным ЭхоКГ, нарастании клинических признаков недостаточности кровообращения, в возрасте 1 года пациенту выполнена CARTO-аблация право-предсердного эктопического очага. К моменту РЧА масса тела пациента составляла 10,5 кг. Диаметр бедренных вен, который оценивался посредством ультразвукового исследования (УЗИ) перед выполнением процедуры, позволил выполнить катетерную манипуляцию у ребенка с использованием электрода размером 7 Fr, применяемым в системе CARTO.
В ходе операции выявлено место наиболее ранней активации по передней стенке правого предсердия рядом с кольцом трикуспидального клапана. Тахикардия была устранена, ребенок был выписан в удовлетворительном состоянии, по данным суточного мониторирования ЭКГ, регистрировался устойчивый синусовый ритм с нормальной среднесуточной ЧСС.
Через 5 лет после первичной аблации у ребенка появились эпизоды учащенного сердцебиения. По данным суточного мониторирования ЭКГ, была зарегистрирована непрерывно-рецидивирующая суправентрикулярная тахикардия (СВТ) с ЧСС до 230 в минуту, устойчивые и неустойчивые эпизоды. Пациенту вновь назначалась ААТ методом подбора: анаприлин, пропафенон, кордарон. Терапия была неэффективной, сохранялись симптомные затяжные эпизоды предсердной тахикардии.
По данным ЭхоКГ, структурной патологии не отмечалось. По данным МРТ, фиброзно-склеротических изменений в зоне первой аблации выявлено не было.
В возрасте 7 лет ребенку было проведено ВСЭФИ и РЧА очага тахикардии. Как и в первом клиническом случае, с целью оценки потенциального повреждающего РЧ воздействия на миокард, выполненном в возрасте 1 года, первым этапом операции была осуществлена амплитудная биполярная реконструкция правого предсердия с использованием системы электроанатомического картирования CARTO. При выполнении реконструкции предсердий зон снижения амплитуды электрического сигнала миокарда, в частности в области передней стенки правого предсердия – зоне первой РЧА, не выявлено, что свидетельствует о нормальной электрической активности ткани предсердий.
На следующем этапе учащающей стимуляцией индуцирован пароксизм правопредсердной тахикардии с циклом 310 мс. Выполнена CARTO-реконструкция правого предсердия. После картирования на область наиболее ранней активации – 8 ч на кольце трикуспидального клапана нанесена серия РЧ аппликаций 60 ºС, 30 Вт. Купирование тахикардии на воздействии.
Третий клинический случай
Пациентка С., 11 лет. Из анамнеза известно, что в возрасте 5 лет девочке была выполнена РЧА ДПЖС типа Кента. Показанием к РЧА был манифестирующий синдром WPW, сопровождающийся пароксизмами ортодром-ной тахикардии. В процессе ВСЭФИ был документирован манифестирующий синдром WPW, обусловленный функционированием в обоих направлениях правостороннего ДПЖС. Проведено картирование правого атриовентрикулярного кольца. На точку наибольшей преэкзитации в задне-боковой позиции нанесена серия РЧ аппликаций. При контрольном обследовании признаков функционирования ДПЖС не было. Девочка продолжала наблюдаться кардиологом. Через 5 лет после аблации на ЭКГ документирована преэкзитация.
В возрасте 11 лет пациентке была выполнена РЧА ДПЖС той же локализации. Как и в первых двух случаях, первым этапом операции была выполнена амплитудная биполярная CARTO-реконструкция первичной зоны РЧ воздействия. Зон снижения амплитуды электрического сигнала миокарда не зарегистрировано. На следующем этапе документирован манифестирующий феномен WPW, обусловленный функционированием в антеградном направлении правостороннего ДПЖС. Проведено картирование правого атриовентрикулярного кольца, на точки наибольшей преэкзитации (задняя позиция) нанесена серия РЧ аппликаций 60 ºС, 40 Вт. На фоне воздействия проведение по ДПЖС устранено. При контрольной стимуляции признаков функционирования ДПЖС нет.
Обсуждение
В течение многих лет не решен вопрос об отдаленных последствиях РЧ воздействий на растущие детские сердца, что является сдерживающим фактором для расширения показаний к РЧА у детей раннего возраста. На сегодняшний день нет клинических данных, демонстрирующих с помощью существующих методов визуализации очаги РЧ повреждения в миокарде и динамику этих очагов по мере роста пациентов, которые в раннем возрасте подверглись РЧА. D.R. Kolditz и соавт. описывают усиление эхо-сигнала в левом предсердии размером 2 x 3 мм, которое было выявлено непосредственно после РЧА у недоношенного новорожденного весом 2 кг, однако при проведении контрольной ЭхоКГ через 3 мес. после процедуры данная находка не подтвердилась [8]. Современные рутинные методы визуализации ЭхоКГ и МРТ ставят под сомнение наличие послеоперационных очагов от точечного воздействия аблационными катетерами. Однако доступными современными интервенционными электро-анатомическими способами возможно определить электрическую активность постаблационной зоны в динамике роста. Экспериментальные данные, проведенные на животных, показали проаритмическую роль РЧ воздействия с формированием локальной зоны фиброза, которая увеличивается с ростом животных. P. Khairy и соавт. в эксперименте выявили увеличение зоны поражения в предсердиях и желудочках независимо от вида применяемой энергии – радиочастотной или криотермальной [10]. В другом экспериментальном исследовании диагностировано уменьшение просвета коронарных артерий в зоне РЧ воздействия через 12 мес. после процедуры РЧА [11]. Возможно, доказанный в экспериментальных исследованиях рост зоны коагуляционного некроза у молодых животных связан с различием параметров РЧ воздействий в эксперименте и клинике. Для РЧ воздействий у молодых животных использовались катетеры размером 7 Fr, максимальная температура составляла 70 °С, продолжительность одной аппликации – 30–60 с [10–12], тогда как при выполнении РЧА детям раннего возраста данные параметры являются существенно более щадящими.
В литературе имеются сообщения, касающиеся оценки повреждения миокарда при проведении РЧА аритмий у взрослых [13]. Показано, что РЧА вызывает незначительное повреждение миокарда и сопровождается повышением концентрации тропонина I (TnI), которая положительно коррелирует с количеством наносимых аппликаций.
Существуют немногочисленные аналогичные исследования в педиатрической популяции. У детей независимо от возраста выявлено повышение уровня TnI на 3-и сут после процедуры, нормализация анализируемого показателя через неделю после аблации и отсутствие его повышения в проспективном наблюдении через 6 мес. [14].
Учитывая многолетний опыт РЧА, в литературе появляются публикации, свидетельствующие о том, что зона ранее выполненного РЧ воздействия может стать источником новых аритмий. J. Koch и соавт. описывают клинический случай пациента, которому в возрасте 9 лет была проведена РЧА ДПЖС [7]. При проведении ВСЭФИ был диагностирован скрытый синдром WPW с локализацией ДПЖС в латеральной области кольца митрального клапана. Проведена эффективная РЧА. Через 17 лет у пациента на ЭКГ диагностирована мономорфная желудочко- вая тахикардия. Электрофизиологическое картирование показало локализацию желудочкового эктопического очага в зоне первичной аблации. Авторы статьи предположили, что РЧА, выполненная пациенту в детском возрасте, могла привести к генерации субстрата для последующего возникновения других аритмий. Авторы подчеркивают, что РЧА у детей должна быть атравматичной, насколько это возможно, и может быть выполнена только опытными электрофизиологами. А опыт аритмологического центра является одним из факторов эффективности РЧА у детей раннего возраста, и число таких центров в мире ограничено. Для минимизации риска осложнений и повреждающего эффекта РЧ воздействия у детей раннего возраста применяются «щадящие» параметры РЧА – меньшая температура и мощность аппликаций, минимальные длительность и количество аппликаций, деликатные манипуляции катетером [15]. Однако «щадящие» параметры РЧА, наряду с такими факторами, как особенности анатомического расположения субстрата тахикардии, наличие множественных ДПЖС, неточность картирования аритмии, являются причинами рецидивирования аритмий у детей. В ряде проспективных исследований, где представлены результаты как многоцентровых исследований, так и отдельных клиник, было показано, что после первоначально успешной РЧА рецидивы возникали в 4,9–39% случаев [16–20].
В публикации J. Koch и соавт. повреждающий эффект РЧА оценивался с помощью МРТ, которая позволила авторам выявить измененную структуру ткани миокарда, потенциально связанную с РЧА [7]. В нашем исследовании в первом и втором клинических случаях выполнялась МРТ сердца с контрастированием гадолинием через 12
и 6 лет после первичной РЧА, однако фиброзно-склеротических изменений миокарда в зонах первичных РЧА выявлено не было. Наши клинические случаи являются первой попыткой анализа ситуации не в эксперименте, а в клинике. Мы оценивали электрическую активность в динамике с позиции электрофизиологии. Очевидно, что проведение ВСЭФИ и электроанатомического картирования без показаний в качестве оценки потенциального повреждающего эффекта РЧ воздействий у детей нецелесообразно. Однако в случаях повторных аблаций в связи с рецидивированием или возникновением новых аритмий использование ВСЭФИ и электроанатомического картирования может быть полезным для оценки отдаленных результатов первичного РЧ воздействия. Электроанато-мическое картирование зон первичной аблации, выполненное при проведении повторной РЧА, продемонстрировало отсутствие снижения амплитуды электрического сигнала миокарда, немых электрических зон, что может свидетельствовать об отсутствии рубцово-склеротических изменений миокарда у детей в отдаленном периоде после РЧ воздействия.
Заключение
Представлено уникальное многолетнее проспективное наблюдение за тремя детьми, которым ВСЭФИ и РЧА очага тахикардии впервые были выполнены в раннем возрасте. Показано, что при использовании щадящих энергетических и температурных параметров РЧА, ограниченного количества РЧ аппликаций отсутствовало увеличение зоны коагуляционного некроза в зоне аблации с ростом ребенка. Необходимо продолжить проспективные исследования в этом направлении.
Список литературы Оценка потенциального повреждающего эффекта радиочастотного воздействия у детей в проспективном наблюдении (серия клинических случаев)
- Kubus P., Vit P., Gebauer R.A., Zaoral L., Peichl P., Fiala M. et al. Long-term results of paediatric radiofrequency catheter ablation: A population-based study. Europace. 2014;16(12):1808-1813. DOI: 10.1093/ europace/euu087.
- Свинцова Л.И., Ковалёв И.А., Криволапов С.Н., Бразовская Н.Г., Усенков С.Ю. Клинические и гемодинамические закономерности течения аритмий у детей в возрасте от 0 до 7 лет. Российский кардиологический журнал. 2014;19(12):31-37. DOI: 10.15829/15604071-2014-12-31-37.
- Dechert B.E., Dick M., Bradley D.J., LaPage M.J. Variation in pediatric post-ablation care: A survey of the Pediatric and Congenital Elec-trophysiology Society (PACES). Pediatr. Cardiol. 2017;38:1257-1261. DOI: 10.1007/s00246-017-1654-1.
- Saul P.J., Kanter R.J., Writing Committee, Abrams D., Asirvatham S., Bar-Cohen Y. et al. PACES/HRS expert consensus statement on the use of catheter ablation in children and patients with congenital heart disease: developed in partnership with the pediatric and congenital electrophys-iology society (PACES) and the heart rhythm society (HRS). Endorsed by the governing bodies of PACES, HRS, the American Academy of Pediatrics (AAP), the American Heart Association (AHA), and the Association for European Paediatric and Congenital Cardiology (AEPC). Heart Rhythm. 2016;13(6):e251-289. DOI: 10.1016/j.hrthm.2016.02.009.
- Марцинкевич Г.И., Соколов А.А., Ковалев И.А., Мурзина О.Ю., Попов С.В. Электромеханическое сопряжение в норме и у детей с синдромом WPW. Вестник аритмологии. 2004;(35):38-44.
- Saul J.P., Hulse J.E., Papagiannis J., Van Praagh R., Walsh E.P. Late enlargement of radiofrequency lesions in infant lambs: implications for ablation procedures in small children. Circulation. 1994;90(1):492-499. DOI: 10.1161/01.CIR.90.1.492.
- Koch J., Lucke Ch., Gebauer R., Hindricks G., Arya A. Accessory pathway ablation in childhood forming the substrate for ventricular tachycardia in adulthood. Eur. Heart J. 2016;37(7):609. DOI: 10.1093/eurheartj/ ehv260.
- Kolditz D.R., Blom N.A., Bokencamp R., Scharlij M.J. Low-energy radiof requency catheter ablation as therapy for supraventricular tachycardia in a premature neonate. Eur. J. Pediatr. 2005;164:559-562.
- Свинцова Л.И., Попов С.В., Ковалев И.А., Антонченко И.В., Нико-лишин А.Н., Мурзина О.Ю. и др. Случай успешной радиочастотной аблации предсердной ре-ентри тахикардии у ребенка 2-х месяцев. Российский вестник перинатологии и педиатрии. 2005;(5):24-28.
- Khairy P., Guerra P.G., Rivard L., Tanguay J.-F., Landry E., Guertin M.-C. et al. Enlargement of catheter ablation lesions in infant hearts with cryo-thermal versus radiofrequency energy. An Animal Study. Circ. Arrhythm. Electrophysiol. 2011;4(2):211-217. DOI: 10.1161/CIRCEP.110.958082.
- Paul T., Bökenkamp R., Mahnert B., Trappe H.-J. Coronary artery involvement early and late after radiofrequency current application in young pigs. Am. Heart J. 1997;133(4):436-440. DOI: 10.1016/S0002-8703(97)70185-6.
- Okada M., de Araujo S., de Franco M.F., de Paola A., Fenelon G. Effects of the corticosteroids in the lesions by radiofrequency on rats' thigh in different age groups. Arq. Bras. Cardiol. 2010;95:207-214.
- Emkanjoo Z., Mottadayen M., Givtaj N., Alasti M., Arya A., Haghjoo M. et al. Evaluation of post-radiofrequency myocardial injury by measuring cardiac troponin I levels. Int. J. Cardiol. 2007;117(2):173-177. DOI: 10.1016/j.ijcard.2006.04.066.
- Мурзина О.Ю. Клинико-функциональные эффекты радиочастотной аблации тахикардий и аритмий у детей. Дис. ... канд. мед. наук. Томск; 2005.
- Brugada J., Blom N., Sarquella-Brugada G., Blomstrom-Lundqvist C., Deanfield J., Janousek J. et al. Pharmacological and non-pharmacological therapy for arrhythmias in the pediatric population: EHRA and AEPC-Arrhythmia Working Group joint consensus statement. Europace. 2013;15(9):1337-1382. DOI: 10.1093/europace/eut082.
- Chiu S.N., Lu C.W., Chang C.W., Chang C.-C., Lin M.-T., Lin J.-L. et al. Radiofrequency catheter ablation of supraventricular tachycardia in infants and toddlers. Circ. J. 2009;73(9):1717-1721. DOI: 10.1253/circj. CJ-09-0123.
- Akdeniz C., Ergul Y., Kiplapinar N., Tuzcu V. Catheter ablation of drug resistant supraventricular tachycardia in neonates and infants. Cardiol. J. 2013;20(3):241-246. DOI: 10.5603/CJ.2013.0068.
- Jiang H.E., Li X.M., Li Y.H., Zhang Y., Liu H-J. Efficacy and safety of ra-diofrequency catheter ablation of tachyarrhythmias in 123 children under 3 years of age. Pacing Clin. Electrophysiol. 2016;39(8):792-796. DOI: 10.1111/pace.12888.
- Ozaki N., Nakamura Y., Suzuki T., Yoshimoto J., Toyohara K., Fukuha-ra H. et al. Safety and efficacy of radiofrequency catheter ablation for tachyarrhythmia in children weighing less than 10 kg. Pediatr. Cardiol. 2018;39(2):384-389. DOI: 10.1007/s00246-017-1766-7.
- Telishevska M., Hebe J., Paul T., Nürnberg J.H., Krause U., Gebauer R. et al. Catheter ablation in asymptomatic pediatric patients with ventricular preexcitation: results from the multicenter "CASPED" study. Clin. Res. Cardiol. 2018;108:683-690. DOI: 10.1007/s00392-018-1397-x.


