Оценка прогрессирования фибрилляции предсердий после катетерной аблации и антиаритмической терапии у пациентов с пароксизмальной формой фибрилляции предсердий: рандомизированное контролируемое исследование
Автор: Симонян Алина Александровна, Колесников В.Н., Виленский Л.И., Кривошеев Ю.С., Башта Д.И., Гатило М.Ю., Мызникова Т.А., Мисходжева З.А.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Нарушения ритма сердца
Статья в выпуске: 3 т.20, 2016 года.
Бесплатный доступ
Цель Основной целью проспективного рандомизированного исследования являлась оценка прогрессирования фибрилляции предсердий после катетерной аблации и антиаритмической терапии у пациентов с пароксизмальной формой фибрилляции предсердий по данным аппаратов непрерывного мониторирования ритма сердца. Методы В исследование включены 92 пациента с пароксизмальной формой фибрилляции предсердий, которым было возможно проведение катетерной аблации фибрилляции предсердий и антиаритмической терапии. Пациенты были рандомизированы на две группы: антиаритмическая терапия в сочетании с имплантацией кардиомонитора (I группа; n = 46); катетерная аблация фибрилляции предсердий в сочетании с имплантацией кардиомонитора (II группа; n = 46). Первичная конечная точка - прогрессирование фибрилляции предсердий. Критерием прогрессирования являлся процент фибрилляции предсердий более 30 по данным имплантированного кардиомонитора. Вторичные конечные точки - осложнения оперативного вмешательства, побочные эффекты антиаритмической терапии. Период контрольного наблюдения составил 24 мес. Результаты К концу периода наблюдения в группе антиаритмической терапии прогрессирование фибрилляции предсердий выявлено у 27 (58,7%) пациентов по сравнению с 10 (21,7%) пациентами в группе катетерной аблации фибрилляции предсердий (р = 0,0003; отношение рисков (ОР) 0,37; 95% доверительный интервал (ДИ) 0,17-0,76; р = 0,007, регрессионный анализ Кокса). У 13 (28,3%) пациентов в группе антиаритмической терапии развилась персистирующая форма фибрилляции предсердий по сравнению с 2 (4,3%) пациентами в группе катетерной аблации (р = 0,002). Общий показатель осложнений в течение всего периода наблюдения составил 24% (11 пациентов) в группе антиаритмической терапии и 6,5% (3 пациента) в группе катетерной аблации (р = 0,02). Заключение Радиочастотная катетерная аблация значительно снижает прогрессирование фибрилляции предсердий по сравнению с антиаритмической терапией у пациентов с пароксизмальной формой фибрилляции предсердий по данным непрерывного мониторирования сердечного ритма.
Пароксизмальная фибрилляция предсердий, непрерывное мониторирование сердечного ритма, радиочастотная изоляция устьев легочных вен, антиаритмическая терапия
Короткий адрес: https://sciup.org/142140760
IDR: 142140760 | DOI: 10.21688-1681
Текст научной статьи Оценка прогрессирования фибрилляции предсердий после катетерной аблации и антиаритмической терапии у пациентов с пароксизмальной формой фибрилляции предсердий: рандомизированное контролируемое исследование
Фибрилляция предсердий (ФП) — форма устойчивой аритмии, распространенность которой увеличивается с возрастом пациентов [1, 2]. Пароксизмальная ФП обычно предшествует развитию персистирующей и хронической форм [3–7]. Эпидемиологические исследования показали, что пароксизмальная ФП естественным образом прогрессирует в персистирующую и хроническую, что происходит, по оценкам, в 15–30% случаев в течение 1–3 лет [3–7]. Катетерная аблация в лечении пациентов с пароксизмальной ФП продемонстрировала достаточно высокую эффективность [8–12]. Однако данные, касающиеся долгосрочного наблюдения после катетерной аблации, весьма ограничены [13–17]. Средняя эффективность операции по данным ряда авторов составляет от 45 до 75% [18]. В свою очередь эффективность антиаритмической терапии (ААТ) составляет не более 30–50% в течение первого года наблюдения.
Во многих исследованиях анализировали данные относительно эффективности антиаритмической терапии и аблации, однако прогрессирование пароксизмальной ФП после первичной катетерной аблации или ААТ не оценивали. Внедрение в клиническую практику имплантируемых устройств для непрерывного мониторирования сердечного ритма (ИКМ) позволяет объективно оценить процент возникновения ФП за длительный период наблюдения [19–24].
Цель исследования: оценка прогрессирования ФП после катетерной аблации и ААТ по данным имплантируемых кардиомониторов.
Методы
С апреля 2010 г. по декабрь 2014 г. обследованы 220 пациентов с различными формами ФП. У 116 пациентов выявлены персистирующая или длительно персистирующая ФП либо несоответствие критериям включе-ния/исключения. Двенадцать пациентов отказались от участия в исследовании. От всех пациентов, включенных в исследование, получено письменное информированное согласие.
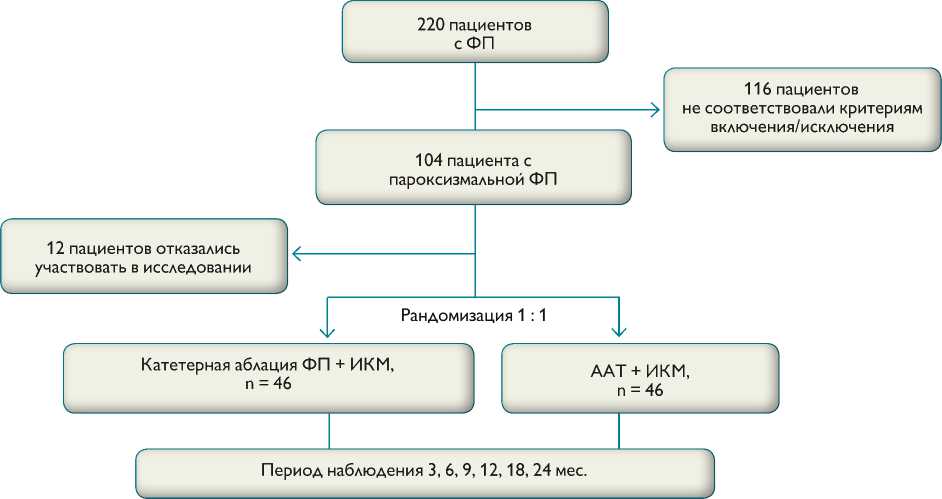
Рис. 1. Схема дизайна исследования
Fig. 1. Study design.
Примечание. ФП — фибрилляция предсердий; ИКМ — имплантируемый кардиомонитор; ААТ — антиаритмическая терапия
Критерии включения: пациенты с пароксизмальной формой ФП, которым возможно проведение катетерной аблации и антиаритмической терапии.
Критерии исключения: персистирующая или длительно персистирующая ФП; фракция выброса левого желудочка менее 35%; тромб в полости левого предсердия; невозможность приема антикоагулянтных препаратов; неэффективность одного антиаритмического препарата (ААП); предполагаемая продолжительность жизни менее 3 лет.
После проверки соответствия критериям включения/ исключения 92 пациента рандомизированы на две группы: антиаритмическая терапия в сочетании с имплантацией кардиомонитора (I группа; n = 46); катетерная аблация фибрилляции предсердий в сочетании с имплантацией кардиомонитора (II группа; n = 46). Период наблюдения составил 24 мес., контроль за пациентами осуществляли каждые 1–3, 6, 9, 12, 18, 24 мес. после включения в исследование путем анализа данных ИКМ. Схема дизайна исследования представлена на рис. 1.
Первичная конечная точка: прогрессирование ФП по данным устройства непрерывного мониторирования электрокардиографии (ЭКГ). Прогрессирование фибрилляции предсердий — процент ФП более 30 по данным ИКМ после «слепого» периода (AF burden progression). Вторичные конечные точки: осложнения оперативного вмешательства, побочные эффекты анти-аритмической терапии.
Катетерная аблация
(радиочастотная изоляция устьев легочных вен) Процедура радиочастотной изоляции легочных вен подробно описана ранее [13, 14, 17, 25]. Всем пациентам из II группы выполнена циркулярная изоляция легочных вен с использованием навигационной системы CARTO 3 (Biosense Webster, US) без создания дополнительных линейных воздействий. При сохранении ФП в конце оперативного лечения выполнялась медикаментозная или электрическая кардиоверсия. Блок входа и выхода подтвержден с помощью катетера Lasso. При документированном или выявленном во время операции типичном трепетании предсердий проведена аблация кавотрикуспидального перешейка.
Антиаритмическая терапия
В I группе медикаментозную терапию проводили согласно современным рекомендациям по лечению ФП [8]. К моменту включения в исследование один ААП был неэффективен. Пациентам назначали препараты I, II или III класса: пропанорм, соталол, бета-блокаторы, кор-дарон. Дозировка ААП не превышала среднетерапевтических значений. В ряде случаев пропанорм использо- вался как «таблетки в кармане» только для купирования приступов ФП в дозе 300–450 мг одномоментно. Пациентам из II группы антиаритмические препараты отменили через 3 мес. после оперативного вмешательства.
Устройство непрерывного мониторирования электрокардиографии
Процедура имплантации кардиомонитора (Reveal XT, Medtronic, US) для непрерывного мониторирования ЭКГ подробно описана ранее [19, 23–25].
Данные с ИКМ позволяют точно определить процент фибрилляции предсердий (AF burden) за весь период наблюдения пациента [19].
Аппарат Reveal XT (Medtronic Inc.) непрерывно анализирует сердечный ритм пациента, верифицирует и классифицирует аритмические события [19, 21] по степени вариабельности сердечных циклов на основе двухминутной записи ЭКГ. Устройство Reveal XT не только определяет количество эпизодов фибрилляции предсердий, но и характеризует аритмии: время возникновения ФП, количество часов ФП за один день, частота сердечных сокращений во время приступа и процент ФП в течение всего периода наблюдения (burden). Кроме того, данные подкожной ЭКГ сохраняются для визуального подтверждения эпизодов ФП. Сбор данных в течение нескольких периодов наблюдения отражается при помощи долговременного тренда.
Контрольное наблюдение
Данные, полученные от имплантируемых кардиомониторов, анализировали через 1–3, 6, 9, 12, 18, 24 мес. после включения пациентов в исследование. Данные с ИКМ интерпретировали два кардиолога. Во время контрольного обследования при необходимости проводили коррекцию антиаритмической терапии или решали вопрос о выполнении катетерной аблации.
Статистический анализ
Объем выборки составил 92 пациента (46 для каждой группы) с 5% потерей пациентов во время периода наблюдения при мощности 80% и альфа 0,05, вероятности рисков 0,36 и проценте отсутствия прогрессирования в группе медикаментозной терапии и катетерной аблации 45 и 75% соответственно (log-rank test, Freedman method).
Результаты представлены как среднее значение ± стандартное отклонение или как абсолютные значения и проценты. Количественные переменные сравнивали с помощью t-критерия Стьюдента. Критерий х2 для качественных переменных использован для сравнения характеристик
Сравнительная характеристика пациентов обеих групп
|
Показатель |
Все пациенты, n = 92 |
ААТ в сочетании с ИКМ, n = 46 |
РЧА ФП в сочетании с ИКМ, n = 46 |
р* |
|
Возраст, лет |
59±10 |
59±11 |
58±9 |
0,6 |
|
Пол (мужской/женский), n |
70/22 |
36/10 |
34/12 |
0,51 |
|
Артериальная гипертензия, n (%) |
40 (43) |
19 (41) |
21 (46) |
0,44 |
|
Сахарный диабет 2-го типа, n (%) |
9 (10) |
5 (11) |
4 (9) |
0,67 |
|
Острая недостаточность мозгового кровообращения в анамнезе, n (%) |
5 (5) |
3 (7) |
2 (4) |
0,3 |
|
Фракция выброса левого желудочка, % |
60±5 |
59±6 |
61±5 |
0,62 |
|
Левое предсердие, мм |
47±6 |
46±5 |
47±7 |
0,71 |
|
CHA2DS2-VASc, баллы |
0,9±0,7 |
0,9±0,7 |
0,8±0,6 |
0,76 |
|
HATCH, баллы Антиаритмические препараты, n (%) |
0,6±0,5 |
0,7±0,5 |
0,5±0,4 |
0,58 |
|
Пропанорм, n (%) |
64 (70) |
35 (76) |
29 (63) |
0,14 |
|
Бета-блокаторы, n (%) |
11 (12) |
5 (11) |
6 (13) |
0,55 |
|
Соталол, n (%) |
7 (8) |
2 (4) |
5 (11) |
0,32 |
|
Кордарон, n (%) |
10 (11) |
4 (9) |
6 (13) |
0,44 |
Примечание. ААТ — антиаритмическая терапия; ИКМ — имплантируемый кардиомонитор; РЧА — радиочастотная аблация; ФП — фибрилляция предсердий; * p — сравнение между группами. Для количественных признаков представлено среднее значение и стандартное отклонение
пациентов. Различия в прогрессировании ФП по данным ИКМ оценивали с помощью лог-ранк теста. Регрессионный анализ Кокса использовали для оценки вероятности риска прогрессирования фибрилляции предсердий.
Все представленные значения p основаны на двустороннем тесте, р<0,05 считалось достоверным. Все статистические расчеты проводили с помощью программы Stata (версия 13.0, Чикаго, США).
Результаты
Участники исследования
В исследование включены 92 пациента с пароксизмальной ФП. Все пациенты наблюдались в течение 24 мес. после оперативного вмешательства. В таблице представлены дооперационные характеристики пациентов обеих групп.
Интраоперационные данные
В группе катетерной аблации фибрилляции предсердий изоляция легочных вен с подтверждением блока входа и выхода достигнута у всех 46 (100%) пациентов. 18 (39%) пациентам с типичным трепетанием предсердий выполнялась аблация кавотрикуспидального перешейка. Средняя продолжительность процедуры соста- вила 142±46 мин со временем рентгеноскопии 25±19 мин. У одного (2,2%) пациента в конце аблации выявлен гемоперикард, который успешно разрешился с помощью пункции перикарда по Марфану.
После завершения аблации всем пациентам имплантированы кардиомониторы по методике, описанной ранее [17, 19, 23]. Осложнений, связанных с имплантацией кардиомонитора, не выявлено. В группе анти-аритмической терапии имплантация кардиомонитора проводилась в условиях стационара. Осложнений во время имплантации не было.
Прогрессирование фибрилляции предсердий по данным имплантируемого кардиомонитора (первичная конечная точка)
Через 24 мес. после оперативного лечения у 27 (58,7%) пациентов в группе антиаритмических препаратов выявлено прогрессирование фибрилляции предсердий по данным ИКМ по сравнению с 10 (21,7%) пациентами в группе катетерной аблации ФП (р = 0,0003; лог-ранк тест; отношение рисков 0,37; 95% доверительный интервал (ДИ) 0,17–0,76; р = 0,007; регрессионный анализ Кокса; рис. 2).
В группе антиаритмических препаратов средний процент ФП по данным ИКМ составил 22,7±17,4% по
р = 0,0003
58,7
21,7
Антиаритмическаятерапия
Катетерная аблация ФП
Рис. 2. Прогрессирование фибрилляции предсердий (ФП) по данным имплантируемого кардиомонитора (ИКМ) в течение периода наблюдения
Fig. 2. AF progression according to ICM data during follow-up.
сравнению с 5,9±5,2% в группе катетерной аблации (р = 0,001; рис. 3).
У 13 (28,3%) пациентов в группе антиаритмических препаратов развилась персистирующая ФП по сравнению с 2 (4,3%) пациентами в группе катетерной аблации (р = 0,002).
Вторичная конечная точка (осложнения)
В конце периода наблюдения в обеих группах серьезных осложнений, которые могли бы привести к гибели пациента или его инвалидизации, не зарегистрировано. В группе ААТ осложнения были связаны с побочным действием антиаритмических препаратов.
Так, прием кордарона пришлось прекратить у 4 (8,7%) пациентов в связи с развитием кордаронин-дуцированного гипотиреоза, у 2 (4,3%) — тиреотоксикоза и у 2 (4,3%) — выраженной брадикардии. В 3 (6,5%) случаях соталол отменен вследствие выраженной брадикардии. Двое (4,3%) пациентов при приеме пропанорма отмечали слабость и головокружение, и у 2 (4,3%) больных зарегистрированы гемодинамически значимые эпизоды брадикардии, требующие отмены препарата.
При повторных вмешательствах у 2 (4,3%) пациентов из группы катетерной аблации отмечались гематомы в местах пункции, которые были успешно разрешены.
Таким образом, общее количество осложнений в течение всего периода наблюдения составило 24% (11 па- циентов) в группе антиаритмической терапии и 6,5% (3 пациента) в группе катетерной аблации (р = 0,02).
Обсуждение
Катетерная аблация снижает вероятность риска прогрессирования фибрилляции предсердий на 63%, по сравнению с антиаритмической терапией, у пациентов с пароксизмальной формой фибрилляции предсердий. Процент прогрессирования пароксизмальной до персистирующей формы ФП значимо ниже после катетерной аблации, по сравнению с антиаритмической терапией, и составляет 4,3 и 28,3% соответственно. Общий процент осложнений после радиочастотной изоляции легочных вен был значимо ниже, по сравнению с процентом побочных эффектов антиаритмических препаратов, что составило 6,5 и 24% соответственно.
Данное исследование является первым в оценке антиаритмической медикаментозной терапии и катетерной аблации с точки зрения снижения прогрессирования ФП. Мы предположили, что катетерная аблация снижает прогрессирование ФП, по сравнению с анти-аритмической терапией, у пациентов с пароксизмальной формой фибрилляции предсердий.
По результатам исследования установлено, что катетерная аблация, в отличие от ААТ, значимо снижает прогрессирование ФП, что достигается у 78 и 41%
22,7
Z
z
9 о
10,4
11,2
12,5
18,5
14,7
C e
5оc
7,9
Антиа рапия
p<0,001
6,2
p = 0,18
5,1
5,4
5,5
5,9
Катетерная аблация ФП
Период наблюдения, мес.
Рис. 3. Процент фибрилляции предсердий (ФП) (AF burden) по данным имплантируемого кардиомонитора (ИКМ) у пациентов двух групп в течение периода наблюдения
Fig. 3. ICM data-based AF burden in patients of both groups during follow-up.
соответственно. Данные результаты получены с помощью ИКМ, что свидетельствует о высокой точности.
Таким образом, для объективной оценки прогрессирования ФП, а также данных об эффективности катетерной аблации или антиаритмической терапии целесообразно использование имплантируемых аппаратов для непрерывного мониторирования ритма сердца.
Кроме того, процент прогрессирования от пароксизмальной до персистирующей формы фибрилляции предсердий был значимо ниже после катетерной аблации по сравнению с антиаритмической терапией.
Полученные данные сопоставимы с результатами других авторов, которые продемонстрировали, что повторная катетерная аблация у пациентов с пароксизмальной ФП более эффективна в снижении процента ФП, а также перехода из пароксизмальной в персистирующую форму ФП по сравнению с антиаритмической терапией [25].
Pappone C. и соавт. впервые продемонстрировали влияние радиочастотной аблации на снижение прогрессирования ФП [13]. В исследовании, в которое включено 106 пациентов с впервые выявленной ФП, 56 пациентам назначена антиаритмическая терапия первой линии. В 11 случаях выполнена радиочастотная изоляция легочных вен. В данной группе рецидивов фибрилляции предсердий спустя 5 лет не обнаружено. Однако в группе антиаритмической терапии у 16 пациентов ФП стала носить постоянный характер, а у 8 пациентов ФП прогрессировала до персистирующей к периоду наблюдения 5 лет. В данном исследовании впервые высказано предположение, что радиочастотная аблация способна остановить прогрессирование ФП. Однако нарушения ритма оценивались с помощью краткосрочной записи ЭКГ, что являлось ограничением данного исследования. Набор пациентов был крайне узким, отсутствовали данные о прогрессировании ФП после первичной радиочастотной аблации или ААТ при длительном периоде наблюдения на основании непрерывного мониторинга сердечного ритма.
Для оценки прогрессирования фибрилляции предсердий мы использовали процент ФП более 30, определяемый устройством непрерывного мониторирования ЭКГ. Данная цифра выбрана в связи с тем, что 30% ФП за период наблюдения 6 мес. в сумме составляет около месяца фибрилляции предсердий, что в разы больше 7 дней [25]. Таким образом, прогрессирование фибрилляции предсердий от пароксизмальной до персистирующей формы следует рассматривать при проценте фибрилляции предсердий более 30, по данным имплантируемых кардиомониторов.
В исследовании мы также продемонстрировали, что катетерная аблация обладает меньшим процентом осложнений, чем побочные эффекты антиаритмической терапии.
Ограничения исследования
Период наблюдения пациентов в исследовании составил 24 мес. Для подтверждения эффективности радиочастотной аблации в предотвращении прогрессирования ФП требуется крупное рандомизированное исследование с более длительным сроком наблюдения. В настоящий момент проводится масштабное рандомизированное исследование CABANA (сравнение медикаментозного и интервенционного методов лечения), которое, возможно, окончательно ответит на вопрос, какая стратегия лечения ФП является более эффективной.
В исследовании не делалась поправка на изменение образа жизни и применение медикаментозной терапии по сопутствующей патологии (артериальной гипертензии, сахарному диабету), что, возможно, могло повлиять на эффективность того или иного метода лечения. Однако исследование носило рандомизированный характер, и пациенты в группах распределялись равномерно.
Заключение
Катетерная аблация снижает прогрессирование ФП, по сравнению с антиаритмической терапией, у пациентов с пароксизмальной формой ФП по данным непрерывного мониторирования сердечного ритма. Пациентам с пароксизмальной фибрилляцией предсердий целесообразно выполнять радиочастотную изоляцию легочных вен для снижения прогрессирования фибрилляции предсердий.
Финансирование
Исследование не имело финансовой поддержки.
Список литературы Оценка прогрессирования фибрилляции предсердий после катетерной аблации и антиаритмической терапии у пациентов с пароксизмальной формой фибрилляции предсердий: рандомизированное контролируемое исследование
- Feinberg W.M., Blackshear J.L., Laupacis A., Knomal R., Hart R.G. Prevalence, age distribution, and gender of patients with atrial fibrillation: analysis and implications//Arch. Intern. Med. 1995. Vol. 155. No. 5. P. 469-473.
- Go A.S., Hylek E.M., Phillips K.A., Chang Y., Henault L.E., Selby J.V., Singer D.E. Prevalence of diagnosed atrial fibrillation in adults: national implications for rhythm management and stroke prevention: the Anticoagulation and Risk Factors in Atrial Fibrillation (ATRIA) Study//JAMA. 2001. Vol. 285. No. 18. P. 2370-2375.
- de Vos C.B., Pisters R., Nieuwlaat R., Prins M.H., Tieleman R.G., Coelen R.J., van den Heijkant A.C., Allessie M.A., Crijns H.J. Progression from paroxysmal to persistent atrial fibrillation clinical correlates and prognosis//J. Am. Coll. Cardiol. 2010. Vol. 55. No. 8. P. 725-731 DOI: 10.1016/j.jacc.2009.11.040
- Abe Y., Fukunami M., Yamada T., Ohmori M., Shimonagata T., Kumagai K., Kim J., Sanada S., Hori M., Hoki L. Prediction of transition to chronic atrial fibrillation in patients with paroxysmal atrial fibrillation by signal averaged electrocardiography: a prospective study//Circulation. 1997. Vol. 96. No. 8. P. 2612-2616.
- Sakamoto H., Kurabayashi M., Nagai R., Fujii J. Prediction of transition to chronic atrial fibrillation in patients with paroxysmal atrial fibrillation//Circulation. 1998. Vol. 98. No. 10. P. 1045-1056 DOI: 10.1161/01.CIR.98.10.1045
- Scardi S., Mazzone C., Pandullo C., Goldstein D., Poletti A., Humar F. Lone atrial fibrillation: prognostic differences between paroxysmal and chronic forms after 10 years of follow-up//Am. Heart J. 1999. Vol. 137. No. 4 Pt. 1. P. 686-691.
- Kerr C.R., Humphries K.H., Talajic M., Klein G., Connolly S.J., Green M., Boone J., Sheldon R., Dorian P., Newman D. Progression to chronic atrial fibrillation after the initial diagnosis of paroxysmal atrial fibrillation: results from the Canadian registry of atrial fibrillation//Am. Heart J. 2005. Vol. 149. No. 3. P. 489-496.
- Calkins H., Kuck K.H., Cappato R., et al. 2012 HRS/EHRA/ECAS Expert Consensus Statement on Catheter and Surgical Ablation of Atrial Fibrillation: recommendations for patient selection, procedural techniques, patient management and follow-up, definitions, endpoints, and research trial design//Europace. 2012. Vol. 14. No. 4. P. 528-606. eus027 DOI: 10.1093/europace/
- Khaykin Y., Marrouche N.F., Saliba W., Schweikert R., Bash D., Chen M.S., Williams-Andrews M., Saad E., Burkhardt D.J., Bhargava M., Joseph G., Rossillo A., Erciyes D., Martin D., Natale A. Pulmonary vein antrum isolation for treatment of atrial fibrillation in patients with valvular heart disease or prior open heart surgery//Heart Rhythm. 2004. Vol. 1. No. 1. P. 33-39 DOI: 10.1016/j.hrthm.2004.02.007
- Ouyang F., Bänsch D., Ernst S., Schaumann A., Hachiya H., Chen M., Chun J., Falk P., Khanedani A., Antz M., Kuck K.H. Complete isolation of the left atrium surrounding the pulmonary veins: new insights from the double Lasso technique in paroxysmal atrial fibrillation//Circulation. 2004. Vol. 110. No. 15. P. 2960-2968. Patologiya krovoobrashcheniya i kardiokhirurgiya. 2016;20(3):72-81 DOI: 10.1161/01.CIR.0000144459.37455.EE
- Arentz T., Weber R., Bürkle G., Herrera C., Blum T., Stockinger J., Minners J., Neumann F.J., Kalusche D. Small or large isolation areas around the pulmonary veins for the treatment of atrial fibrillation?//Results from a prospective randomized study. Circulation. 2007. Vol. 115. No. 24. P. 3057-3063. DOI: 10.1161/CIRCULATIONAHA.107.690578.
- Verma A., Natale A., Padanilam B.J., Prystowsky E.N. Why atrial fibrillation ablation should be considered first-line therapy for some patients//Circulation. 2005. Vol. 112. No. 8. P. 1214-1222 DOI: 10.1161/CIRCULATIONAHA.104.478263
- Pappone C., Rosanio S., Augello G., Gallus G., Vicedomini G., Mazzone P., Gulletta S., Gugliotta F., Pappone A., Santinelli V., Tortoriello V., Sala S., Zangrillo A., Crescenzi G., Benussi S., Alfieri O. Mortality, morbidity, and quality of life after circumferential pulmonary vein ablation for atrial fibrillation: outcomes from a controlled nonrandomized long-term study//J. Am. Coll. Cardiol. 2003. Vol. 42. No. 2. P. 185-197.
- Cheema A., Vasamreddy C.R., Dalal D., Marine J.E., Dong J., Henrikson C.A., Spragg D., Cheng A., Nazarian S., Sinha S., Halperin H., Berger R., Calkins H. Long-term single procedure efficacy of catheter ablation of atrial fibrillation//J. Interv. Card. Electrophysiol. 2006. Vol. 15. No. 3. P. 145-155 DOI: 10.1007/s10840-006-9005-9
- Bertaglia E., Tondo C., De Simone A., Zoppo F., Mantica M., Turco P., Iuliano A., Forleo G., La Rocca V., Stabile G. Does catheter ablation cure atrial fibrillation? Single-procedure outcome of drug-refractory atrial fibrillation ablation: a 6-year multicenter experience//Europace. 2009. Vol. 12. No. 2. P. 181-187 DOI: 10.1093/europace/eup349
- Gaita F., Caponi D., Scaglione M., Scaglione M., Montefusco A., Corleto A., Di Monte F., Coin D., Di Donna P., Giustetto C. Long-term clinical results of 2 different ablation strategies in patients with paroxysmal and persistent atrial fibrillation//Circ. Arrhythm. Electrophysiol. 2008. Vol. 1. No. 4. P. 269-275. DOI: 10.1161/CIRCEP.108.774885.
- Артеменко С.Н., Романов А.Б., Шабанов В.В., Елесин Д.А., Стрельников А.Г., Камиев Р.Т., Лосик Д.В., Покушалов Е.А. Результаты радиочастотной изоляции устьев легочных вен в сочетании с аблацией ганглионарных сплетений у пациентов с пароксизмальной формой фибрилляции предсердий//Анналы аритмологии. 2011. Т. 8. № 4. С. 36-42.
- Calkins H., Reynolds M.R., Spector P., Sondhi M., Xu Y., Martin A., Williams C.J., Sledge I. Treatment of atrial fibrillation with antiarrhythmic drugs or radiofrequency ablation: two systematic literature reviews and meta-analyses//Circ. Arrhythm. Electrophysiol. 2009. Vol. 2. No. 4. P. 349-361 DOI: 10.1161/CIRCEP.108.824789
- Pokushalov E., Romanov A., Corbucci G., Artyomenko S., Turov A., Shirokova N., Karaskov A. Use of an implantable monitor to detect arrhythmia recurrences and select patients for early repeat catheter ablation for atrial fibrillation: a pilot study//Circ. Arrhythm. Electrophysiol. 2011. Vol. 4. No. 6. P. 823-831 DOI: 10.1161/CIRCEP.111.964809
- Pokushalov E., Romanov A., Katritsis D.G., Artyomenko S., Shirokova N., Karaskov A., Mittal S., Steinberg J.S. Ganglionated plexus ablation vs linear ablation in patients undergoing pulmonary vein isolation for persistent/long-standing persistent atrial fibrillation: a randomized comparison//Heart Rhythm. 2013. Vol. 10. No. 9. P. 1280-1286 DOI: 10.1016/j.hrthm.2013.04.016
- Pokushalov E., Romanov A., Corbucci G., Bairamova S., Losik D., Turov A., Shirokova N., Karaskov A., Mittal S., Steinberg J.S. Does atrial fibrillation burden measured by continuous monitoring during the blanking period predict the response to ablation at 12-month follow-up?//Heart Rhythm. 2012. Vol. 9. No. 9. P. 1375-1379 DOI: 10.1016/j.hrthm.2012.03.047
- Mittal S., Pokushalov E., Romanov A., Ferrara M., Arshad A., Musat D., Preminger M., Sichrovsky T., Steinberg J.S. Long-term ECG monitoring using an implantable loop recorder for the detection of atrial fibrillation after cavotricuspid isthmus ablation in patients with atrial flutter//Heart Rhythm. 2013. Vol. 10. No. 11. P. 1598-1604 DOI: 10.1016/j.hrthm.2013.07.044
- Байрамова С.А., Романов А.Б., Миттель С., Муссат Д., Стейнберг Д., Покушалов Е.А. Имплантируемый аппарат длительного мониторирования ЭКГ для выявления фибрилляции предсердий после аблации кавотрикуспидального перешейка у пациентов с трепетанием предсердий//Патология кровообращения и кардиохирургия. 2015. Т. 19. № 3. С. 100-109.
- Байрамова С.А., Романов А.Б., Артеменко С.Н., Шабанов В.В., Лосик Д.В., Караськов А.М., Покушалов Е.А. Превентивная изоляция легочных вен у пациентов с аблацией кавотрикуспидального перешейка: исследование PREVENT-AF Study I//Патология кровообращения и кардиохирургия. 2015. Т. 19. № 2. С. 93-101.
- Лосик Д.В., Романов А.Б., Шабанов В.В., Байрамова С.А., Якубов А.А., Стенин И.Г., Покушалов Е.А. Прогрессирование фибрилляции предсердий после неэффективной первичной процедуры радиочастотной изоляции легочных вен: рандомизированное сравнение повторной катетерной аблации и медикаментозного метода лечения//Патология кровообращения и кардиохирургия. 2015. Т. 19. № 2. С. 84-92.


