Оценка противоопухолевой и антикахексической активности экстракта аврана лекарственного (Gratiola officinalis L.) у крыс с перевитой саркомой
Автор: Наволокин Н.А., Мудрак Д.А., Полуконова Н.В., Тычина С.А., Корчаков Н.В., Бучарская А.Б., Маслякова Г.Н.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 (73), 2016 года.
Бесплатный доступ
Кахексия является тяжелым осложнением онкологических заболеваний, и пока не существует лекарственных препаратов, позволяющих эффективно бороться с истощением и интоксикацией организма при онкологических заболеваниях. Цель исследования - провести оценку противоопухолевой и антикахексической активности водного раствора экстракта аврана лекарственного (Gratiola officinalis L.) у крыс в эксперименте in vivo с перевитой саркомой 45. материал и методы. Экстракт аврана получен авторским способом и является слабо токсичным для животных. Исследование проводилось на 40 белых крысах-самцах линии Wistar, массой 150 ± 50 г. Животные были разделены на 4 группы (по 10 крыс): контрольная группа; группа сравнения животных с перевитой опухолью без воздействия; группа животных с перевитой опухолью и внутримышечным введением экстракта и группа животных с перевитой опухолью и пероральным введением экстракта. Использована одинаковая доза экстракта - 110 мг/кг. Экстракт вводили ежедневно внутримышечно и перорально через 72 ч после перевивки саркомы 45, также ежедневно оценивали объем опухоли и массу животных. результаты. Экстракт листьев и цветков аврана лекарственного, полученный авторским способом, обладает противоопухолевой активностью, снижая темпы роста опухоли и вызывая выраженные изменения в опухоли, а также оказывает стойкий антикахексический эффект. Индекс торможения опухоли по массе в среднем составил 70,6 %. Внутримышечное введение эффективнее перорального задерживает рост опухоли, но меньше способствует набору массы животных. При обоих способах введения экстракт аврана не оказывает токсического эффекта на периферическую кровь. Ранее нами было установлено, что данный экстракт обладает антиоксидантной активностью, следовательно, антикахексический эффект является патогенетическим, то есть происходит за счет снижения интоксикации. выводы. Экстракт аврана лекарственного обладает широким спектром биологической активности: противоопухолевым, антикахексическим, антиоксидантным действием, кроме того, не является токсичным, поэтому его целесообразно исследовать как перспективное средство для лечения опухолевой кахексии при онкологических заболеваниях, а также кахексии, вызванной другими хроническими заболеваниями.
Авран лекарственный, саркома, кахексия, кровь, противоопухолевая активность, флавоноид, растительный экстракт
Короткий адрес: https://sciup.org/14056638
IDR: 14056638 | УДК: 616-006.3.04-08-06-056.552]-092.9 | DOI: 10.21294/1814-4861-2016-15-1-37-43
Текст научной статьи Оценка противоопухолевой и антикахексической активности экстракта аврана лекарственного (Gratiola officinalis L.) у крыс с перевитой саркомой
Кахексия – одно из наиболее тяжелых проявлений и осложнений роста злокачественных новообразований, а также таких заболеваний, как туберкулез, диабет, болезни крови, заболеваниия эндокринной системы, инфекций и синдрома приобретенного иммунодефицита. Прогрессирование опухолевой кахексии может наблюдаться даже при эффективном лечении противоопухолевыми препаратами, что обусловлено побочными эффектами проводимой терапии, в том числе их миелотоксичностью. Кроме того, кахексия может явиться противопоказанием к назначению радио- и химиотерапии, а также влиять на эффективность их проведения [17, 18, 22].
Все известные в настоящее время средства для лечения кахексии обладают рядом серьезных недостатков, в том числе большим количеством побочных эффектов; они оказывают только симптоматическое лечение; при длительном применении усугубляют кахексию. Кроме того, ни один противоопухолевый препарат не обладает противокахексическим эффектом, а наоборот, только усугубляет истощение организма, в первую очередь из-за собственной токсичности. Долгое
время считалось, что биофлавоноиды не слишком перспективны в плане противоопухолевой активности. Однако открытие в 2011 г. способности растительного флавоноида Вагонина к активации апоптоза в опухолевых клетках [21] сделало актуальным поиск и других биофлавоноидов, обладающих противоопухолевой активностью. По мнению ряда авторов, флавоноиды служат одной из самых перспективных групп из веществ растительного происхождения для борьбы с онкологическими заболеваниями, так как обладают очень широким спектром биологической активности [2, 4, 10].
Авра́н лекарственный (Gratiola officinalis L.) – травянистое растение семейства Норичниковые, широко распространённое в Евразии и Северной Америке, – использовался ранее только в народной медицине и входил в состав сбора Здренко как симптоматическое средство при лечении папилломатоза мочевого пузыря. Само растение сильно ядовито, и все полученные ранее извлечения из сырья аврана обладали достаточно высокой токсичностью, поэтому при внутреннем применении использовались вместе со слизистыми отварами, с большой осторожностью и под обязательным врачебным контролем [24].
При различных способах извлечений из аврана можно получать биологически активные композиции с различным фармакологическим действием: слабительным, рвотным, спазмолитическим, диуретическим, дигиталисоподобным действием на сердце [24], антиоксидантным [6, 19, 23], противоопухолевым и иммуномодулирующим [5, 8, 12, 15], жаропонижающим, антимикробным, противотуберкулезным [7, 13]. Полученный авторским способом [12, 20] экстракт не является токсичным [1, 6] и, кроме того, способен благоприятно влиять и на состояние красного костного мозга [9]. Ранее антикахексический эффект экстракта аврана лекарственного не изучался.
Цель исследования – провести оценку противоопухолевой и антикахексической активности водного раствора экстракта аврана лекарственного (Gratiola officinalis L.) у крыс в эксперименте in vivo с перевитой саркомой 45.
Материал и методы
Материалом исследования послужил экстракт аврана лекарственного, полученного авторским запатентованным способом [11, 20]. В него входят следующие химические вещества: 4-винил-2-метоксифенол; 2,3-дигидро-3,5-дигидрокси-6-метил-4Н-пиран-4-он; 2,3-дигидробензофуран; 3-фуранкарбоновая кислота; 5-гидроксиметил-2-фуральдегид; этил-α-d-рибозид; 4-пропилфенол; пирокатехин; L-луксоза (пентоза); 6-деоксигексоза L-галактоза; бензоилуксусной кислоты этиловый эфир; гексадекановая кислота (пальмитиновая кислота); гомованилиновая кислота; глюкоза; 1,4-ангидро-d-маннитол;
бензойная кислота; кверцетин и ряд других флавоноидов.
В эксперименте, проводимом в соответствии с руководством по экспериментальному (доклиническому) изучению новых фармакологических веществ [14, 16], использовано 40 самцов белых лабораторных крыс, массой 150 ± 50 г, которым подкожно, в область лопатки, имплантировали по 0,5 мл 25 % опухолевой взвеси в растворе Хэнкса саркомы-45, полученной из банка опухолевых штаммов РОНЦ им. Н.Н. Блохина. Животные с перевиваемой саркомой методом случайной выборки были разделены на три группы по 10 крыс. Первую и вторую группы составили опытные крысы, получавшие водный раствор сухого экстракта аврана перорально и внутримышечно в одинаковой дозировке 110 мг/кг. В третью, группу сравнения, вошли животные с перевиваемой опухолью, но без воздействия. Четвертую группу составили интактные здоровые животные. В опытных группах через 78 ч после трансплантации опухоли крысам вводили раствор экстракта перорально и внутримышечно, ежедневно, в течение двух недель.
Динамику роста опухоли оценивали по изменению ее объема по формуле
V = А×В×С/1000 (мм 3), где А – ширина; В – толщина; С – высота опухоли в мм. Измерения проводили электронным штангенциркулем каждый день с начала эксперимента. Также каждый день животное взвешивали для оценки динамики массы тела. Для анализа результатов высчитывали истинную массу животного, вычитая теоретическую массу опухоли (умножая объем опухоли на ее плотность) из массы при взвешивании и изменение истинной массы (дельту): истинная животного р, где М – это масса при взвешивании;
V – объем опухоли; р – плотность прививаемой саркомы = 0,83 г/см3). Дельта массы тела животных определялась путем вычитания массы животного до начала эксперимента из истинной массы животного в день эксперимента.
По окончании опыта (через 2 нед) крыс выводили из эксперимента и для дальнейшего исследования производили забор образцов ткани органов, опухоли, крови. Гистологические препараты делали по стандартным методикам. Окраску мазков крови осуществляли по Романовскому – Гимзе, стандартными методами. Проводили количественную и качественную оценку мазков крови. В мазках крови производили подсчет не менее 100 клеток, а затем вычисляли процентное соотношение клеток и определяли лейкоцитарную формулу [3].
Работу с лабораторными животными осуществляли согласно протоколу исследований, не противоречащих Хельсинксой декларации. Тема и описания экспериментов одобрены этической комиссией ГБОУ ВПО «Саратовский ГМУ им. В.И. Разумовского» Минздрава РФ (протокол № 13 от 3 мая 2011 г.).
Для обработки полученных данных использовалось статистическое программное обеспечение SPSS v.20.0 с вычислением средней и ее стандартной ошибки, проведением дисперсионного анализа на нормальность распределения. При параметрическом распределении определяли различия при помощи t-критерия Стьюдента для независимых выборок, достоверными отличия считали при p<0,05.
Результаты и обсуждение
При внутримышечном введении экстракта ав-рана отмечали статистически значимое (p<0,005) замедление темпов роста перевиваемой саркомы по сравнению с группой животных с опухолью, но без воздействия во все дни измерений. На момент окончания эксперимента объем опухоли в группе с внутримышечным введением экстракта (5,30 ± 1,94 см3) был на 71,6 % меньше (p<0,005), чем в контроле (18,01 ± 3,39 см3). Индекс торможения опухоли по массе в среднем составил 70,6 % (рис. 1).
Опухоль в группе животных без воздействия экстракта была представлена вытянутыми клет- ками разных размеров и форм, с единичными маленькими некрозами до 400 мм2 и единичными митозами в поле зрения (рис. 2а). При обоих способах введения экстракта отмечали выраженный патоморфоз опухоли (III степени): обширные зоны некроза, выраженная степень дистрофии в живых клетках, участки фиброза и дезорганизации соединительной ткани (рис. 2б). При оценке динамики дельты истинной массы тела животных в группе сравнения животных с опухолью отмечали тенденцию к развитию опухолевой кахексии; в ходе эксперимента животные похудели на 18 %.
При введении экстракта аврана, как пероральном, так и внутримышечном, наблюдали стабильные показатели массы тела; по ходу всего эксперимента колебания динамики массы животных были незначительными. Получены следующие данные: истинная масса тела животных с опухолью в группе с пероральным путем введения экстракта аврана увеличилась на 5 % относительно массы на момент начала эксперимента (рис. 3); истинная масса тела животных с опухолью в группе с внутримышечным путем введения экстракта аврана
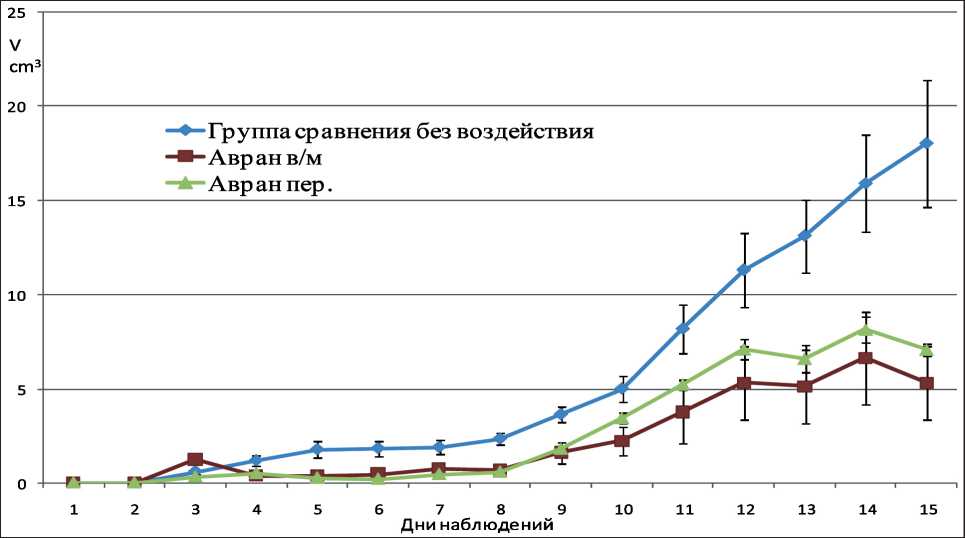
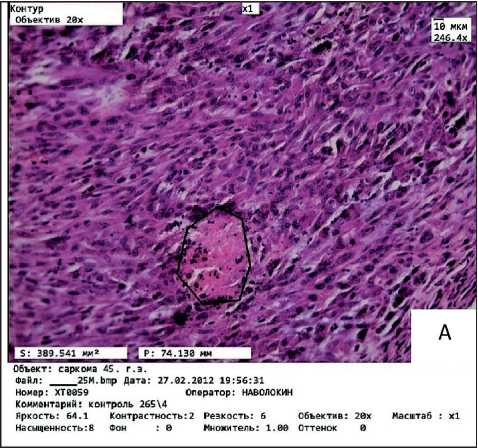
Рис. 2. Микрофото. Морфологическое строение саркомы 45:
А – группа сравнения; Б – при введении экстракта аврана. Окраска гематоксилином и эозином. ×246,4
Рис. 1. Динамика роста саркомы 45
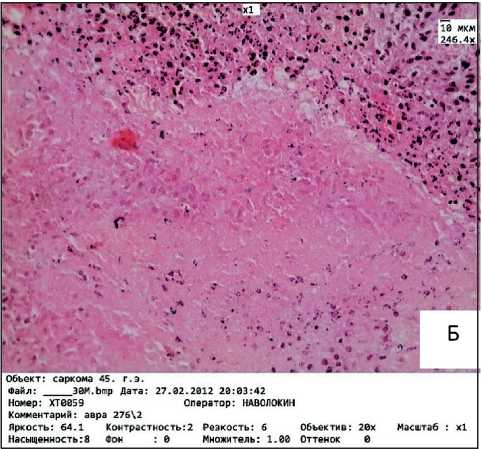
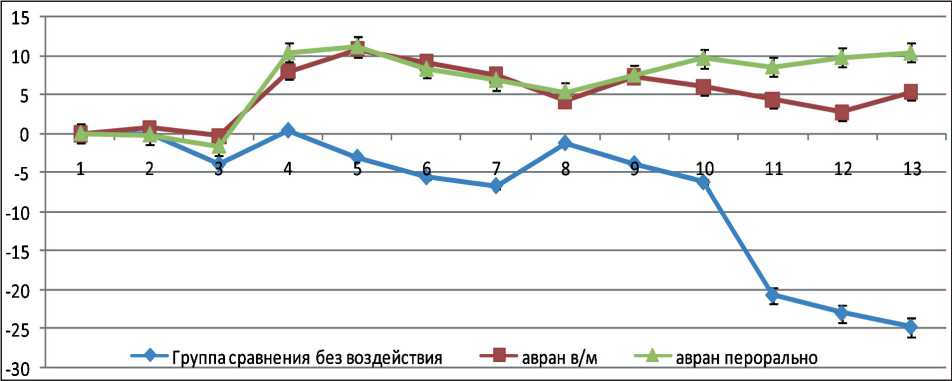
Рис. 3. Динамика дельты массы тела животных с перевитой саркомой 45: по оси ординат – дельта массы животных, а по оси абсцисс – дни измерений
таблица соотношение клеток в лейкоцитарной формуле
|
Группа |
ПЯ, % |
СЯ, % |
Эозинофилы, % |
Базофилы, % |
Моноциты, % |
Лимфоциты, % |
|
Норма у крыс |
1,5 ± 0,5 |
58,00 ± 1,0 |
2,0 ± 0,5 |
0,0 ± 0,0 |
9,5 ± 0,5 |
29,0 ± 1,0 |
|
Группа сравнения |
8,33 ± 0,33 а** |
11,33 ± 0,33 а** |
2,0 ± 0,57 |
1,33 ± 0,33 |
8,0 ± 1,54 |
69,0 ± 2,64 а** |
|
Внутримышечное введение экстракта |
9,66 ± 1,2 а* |
14,67 ± 1,67 а** |
1,67 ± 0,33 |
1,0 ± 0,33 |
8,67 ± 0,67 |
64,33 ± 3,17 а** |
|
Пероральное введение экстракта |
9,33 ± 0,66 а** |
15,67 ± 0,88 а**; б* |
1,33 ± 0,33 |
0,33 ± 0,33 |
5,67 ± 0,89 |
67,67 ± 2,72 а** |
Примечание: значимость отличий определяли между значениями в норме у здоровых животных с группой сравнения без воздействия и экспериментальными группами – (а); крыс с саркомой в группе сравнения и экспериментальными группами – (б); * – значимые отличия (p<0,05); ** – значимые отличия (p<0,01).
увеличилась на 8 % относительно массы на момент начала эксперимента (рис. 3).
Для оценки токсичности проводили оценку состояния периферической крови. При сравнении показателей в контрольной группе и группе сравнения (здоровых животных и животных с перевитой опухолью) статистически достоверно отмечали увеличение палочкоядерных нейтрофилов и лимфоцитов и уменьшение сегментоядерных нейтрофилов в группе животных с опухолью (табл. 1), что явилось следствием токсического действия продуктов распада опухоли на клетки костного мозга.
При пероральном введении экстракта аврана отмечали увеличение количества сегментоядерных лейкоцитов на 38 % по сравнению с группой животных с опухолью без воздействия (p<0,05), но данный показатель крови приближается к таковым у здоровых животных (табл.).
Заключение
Таким образом, экстракт листьев и цветов ав-рана лекарственного, полученный авторским способом, обладает противоопухолевой активностью, снижает темпы роста перевиваемых опухолей, вызывая выраженные изменения в опухоли, и, кроме того, оказывает стойкий антикахексический эффект. Индекс торможения опухоли по массе в среднем составил 70,6 %. Внутримышечное введение эффективнее перорального задерживает рост опухоли, но меньше способствует набору массы животных. При обоих способах введения экстракт аврана не оказывает токсического эффекта на периферическую кровь. Ранее нами было установлено, что экстракт обладает антиоксидантной активностью [6, 19, 23], следовательно, можно полагать, что антикахексический эффект экстракта является патогенетическим, т.е. идет за счет снижения интоксикации.
Выводы
Экстракт аврана лекарственного обладает широким спектром биологической активности, в частности противоопухолевым, антикахексиче-ским действием; является нетоксичным, поэтому его целесообразно исследовать как перспективное средство для лечения опухолевой кахексии и онкологических заболеваний, а также кахексии, вызванной другими хроническими заболеваниями.
Список литературы Оценка противоопухолевой и антикахексической активности экстракта аврана лекарственного (Gratiola officinalis L.) у крыс с перевитой саркомой
- Байтман Т.П., Наволокин Н.А. Влияние экстракта аврана лекарственного на лабораторных животных с перевитой саркомой S-45//Бюллетень медицинских интернет-конференций. 2013. Т. 3, № 2. С. 374.
- Гольдберг Е.Д., Разина Т.Г., Зуева Е.П., Амосова Е.Н., Крылова С.Г., Гольдберг В.Е. Растения в комплексной терапии опухолей. М., 2008. 232 c.
- Инвитро диагностика. Лабораторная диагностика/Под ред. Е.А. Кондрашевой, А.Ю. Островского. М., 2012. 840 с.
- Корсун В.Ф., Трескунов К.А., Корсун Е.В., Мицконас А. Лекарственные растения в онкологии. М., 2007. 445 с.
- Наволокин Н.А., Полуконова А.В., Бибикова О.А., Полуконова Н.В., Маслякова Г.Н., Бучарская А.Б. Цитоморфологические изменения клеток почки эмбриона свиньи в культуре (spev-2) при воздействии экстракта аврана лекарственного (Gratiola officinalis L.)//Фундаментальные исследования. 2014. № 10-7. С. 1369-1374.
- Наволокин Н.А., Полуконова Н.В., Маслякова Г.Н., Бучарская А.Б., Дурнова Н.А. Морфология внутренних органов и опухоли лабораторных крыс с перевитым раком печени РС-1 при пероральном введении флавоноидсодержащих экстрактов аврана лекарственного (Gratiola Officinalis L.) и кукурузы антоциановой (Zea Mays L.)//Саратовский научно-медицинский журнал. 2013. Т. 9, № 2. С. 213-220.
- Наволокин Н.А., Скворцова В.В., Полуконова Н.В., Манаенкова Е.В., Панкратова Л.Э., Курчатова М.Н., Маслякова Г.Н., Дурнова Н.А. Противотуберкулезная активность экстракта аврана лекарственного (gratiola officinalis L.) in vitro//Экспериментальная и клиническая фармакология. 2015. Т. 78, № 4. С. 10-13.
- Наволокин Н.А., Полуконова Н.В., Мудрак Д.А., Тычина С.А., Воронков М.О., Корчаков Н.В., Бучарская А.Б., Маслякова Г.Н. Сравнение противоопухолевой активности экстракта аврана лекарственного и входящего в его состав кверцетина при интротуморальном введении//Российский биотерапевтический журнал. 2015. Т. 14, № 1. С. 111.
- Наволокин Н.А., Мудрак Д.А., Тычина С.А., Корчаков Н.В. Изменения костного мозга и крови лабораторных крыс с перевитой саркомой 45 при пероральном введении экстракта аврана лекарственного (Gratiola Officinalis)//Вестник РГМУ. 2015. № 2. С. 317.
- Наволокин Н.А., Полуконова Н.В., Маслякова Г.Н., Скворцова В.В., Байтман Т.П., Бучарская А.Б., Дурнова Н.А. Противоопухолевая активность растительных экстрактов, содержащих биофлавоноиды//Российский биотерапевтический журнал. 2013. Т. 12, № 2. С. 59-59a.
- Полуконова Н.В., Дурнова Н.А., Курчатова М.Н., Наволокин Н.А., Голиков А.Г. Химический анализ и способ получения новой билогически активной композиции из травы аврана лекарственного (Gratiola Officinalis L.)//Химия растительного сырья. 2013. № 4. С. 165-173.
- Полуконова А.В., Наволокин Н.А., Бибикова О.А. Цитотоксическая активность in vitro экстракта аврана на культуре клеток почек эмбрионов свиньи, зараженных онковирусом//Бюллетень медицинских интернет-конференций. 2013. Т. 3, № 2. С. 375.
- Полуконова А. В., Наволокин Н. А., Райкова С. В., Маслякова Г.Н., Бучарская А.Б., Дурнова Н.А., Шуб Г.М. Противовоспалительная, жаропонижающая и антимикробная активность флавоноидсодержащего экстракта аврана лекарственного (Gratiola officinalis L.)//Экспериментальная и клиническая фармакология. 2015. Т. 78, № 1. С. 34-38.
- Руководство по проведению доклинических исследований лекарственных средств/Под ред. А.Н. Миронова. М., 2012. Ч. 1. 944 с.
- Скворцова В.В., Наволокин Н.А. Патоморфоз саркомы S45 при внутримышечном введении флавоноидсодержащего экстракта лабораторным крысам//Бюллетень медицинских интернет-конференций. 2013. Т. 3, № 2. С. 258.
- Хабриев Р.У. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. М., 2005. 832 с.
- Dewys W.D., Begg C., Lavin P.T., Band P.R., Bennett J.M., Bertino J.R., Cohen M.H., Douglass H.O.Jr., Engstrom P.F., Ezdinli E.Z., Horton J., Johnson G.J., Moertel C.G., Oken M.M., Perlia C., Rosenbaum C., Silverstein M.N., Skeel R.T., Sponzo R.W., Tormey D.C. Prognostic effect of weight loss prior to chemotherapy in cancer patients. Eastern Cooperative Oncology Group//Am. J. Med. 1980. Vol. 69 (64). P. 491-497.
- Morley J.E., Thomas D.R., Wilson M.M. Cachexia: pathophysiology and clinical relevance//Am. J. Clin. Nutr. 2006. Vol. 83 (4). P. 735-743.
- Navolokin N.A., Polukonova N.V., Maslyakova G.N., Bucharskaya A.B., Durnova N.A. Effect of extracts of Gratiola officinalis and Zea mays on the tumor and the morphology of the internal organs of rats with transplanted liver cancer//Russian Open Medical Journal. 2012. Vol. 1 (2). 0203.
- Polukonova N.V., Kurchatova M.N., Navolokin N.A., Bucharskaya A.B., Durnova N.A., Maslyakova G.N. A new extraction method of bioflavanoids from poisonous plant (Gratiola Officinalis L.)//Russian Open Medical Journal. 2014. Vol. 3 (3). 0304. doi: 10.15275/rusomj.2014.0304.
- Polier G., Ding J., Konkimalla B.V., Eick D., Ribeiro N., Köhler R., Giaisi M., Efferth T., Desaubry L., Krammer P.H., Li-Weber M. Wogonin and related natural flavones are inhibitors of CDK9 that induce apoptosis in cancer cells by transcriptional suppression of Mcl-1//Cell Death Dis. 2011. Vol. 2 (7):e182 DOI: 10.1038/cddis.2011.66
- Steinborn W., Anker S.D. Cardiac Cachexia: Pathophysiology and Clinical Implications//Basic Appl. Myol. 2003. Vol. 13 (4) P. 191-201.
- Tkachenko N., Pravdin A., Terentyuk G., Navolokin N., Kurchatova M., Polukonova N. Inhibiton of photodynamic haemolysis by Gratiola officinalis L. Extract//SPIE Proceedings. Saratov Fall Meeting 2014: Optical Technologies in Biophysics and Medicine XVI; Laser Physics and Photonics XVI; and Computational Biophysics. 2015. Vol. 9448. 94480 P DOI: 10.1117/12.2179862
- Авран лекарственный//AyZdorov.ru: сайт о народной и нетрадиционной медицине . URL: http://www.ayzdorov.ru/tvtravnik_avran.php (дата последнего обращения: 3.06.2015).


