Оценка радиационных рисков злокачественных новообразований среди населения регионов России, загрязнённых радионуклидами вследствие аварии на Чернобыльской АЭС
Автор: Иванов В.К., Кащеев В.В., Чекин С.Ю., Максютов М.А., Туманов К.А., Кочергина Е.В., Лашкова О.Е., Меняйло А.Н., Карпенко С.В., Ловачв С.С., Корело А.М., Власов О.К., Щукина Н.В., Иванов С.А., Каприн А.Д.
Рубрика: Научные статьи
Статья в выпуске: 1 т.30, 2021 года.
Бесплатный доступ
В результате аварии на Чернобыльской АЭС часть территории Российской Федерации подверглась загрязнению радионуклидами. Настоящая работа является продолжением и уточнением опубликованных ранее исследований Национального радиационно-эпидемиологического регистра (НРЭР) по оценке радиационных рисков онкологической заболеваемости населения 4-х наиболее загрязнённых областей РФ: Брянской, Калужской, Орловской и Тульской. Для заболеваемости раком щитовидной железы (РЩЖ) радиационные риски оцениваются с учётом влияния эффекта скрининга при диагностике этого заболевания. В когорту для исследования радиационного риска РЩЖ было включено более 327 тыс. жителей загрязнённых территорий, зарегистрированных и наблюдающихся в системе НРЭР. Средняя доза облучения щитовидной железы для детей и подростков в когорте составила 0,174 Гр и 0,035 Гр - для взрослых. За период наблюдения с 1991 по 2019 гг. в когорте было выявлено 1549 случаев РЩЖ: 423 случая диагностированы среди детей и подростков в возрасте 0-17 лет на момент аварии и 1126 - среди взрослых жителей. Исследование подтверждает значительный рост заболеваемости РЩЖ среди жителей загрязнённых территорий, подвергшихся внутреннему облучению от радиоизотопа 131I в молодом возрасте. Статистически значимый радиационный риск РЩЖ сохраняется более 30 лет после облучения, уменьшаясь с увеличением возраста при облучении и достигнутого возраста. Для возраста при облучении до года и достигнутого возраста 20 лет коэффициент избыточного относительного риска ERR/Гр=4,61. Среди членов когорты, бывших детьми и подростками на момент чернобыльской аварии, 20,6% случаев заболеваний РЩЖ являлись радиационно-обусловленными, а для детей до 4 лет к радиационно-обусловленным относились уже 58% случаев РЩЖ. Обнаружен ярко выраженный скрининговый эффект в процессе регистрации заболеваний РЩЖ: коэффициент скрининга (ES) равен 5,6 для детей и подростков и 2,1 для взрослых. Статистически значимые радиационные риски солидных злокачественных новообразований, включая радиационный риск рака молочной железы у женщин, для населения наиболее загрязнённых радионуклидами территорий пока не выявлены. Радиационный риск лейкозов среди населения также не выявлен, хотя для мужского населения среднее значение избыточного радиационного риска всё же превышало нулевой уровень. Дальнейшие наблюдения когорты лиц, проживающих или проживавших на загрязнённых радионуклидами территориях РФ, позволят увеличить статистическую мощность радиационно-эпидемиологических исследований и уточнить оценки радиационных рисков человека при пролонгированном облучении в малых дозах.
Чернобыльская аэс, радиационный риск, онкологическая заболеваемость, рак щитовидной железы, солидные злокачественные новообразования, рак молочной железы, лейкоз, население, избыточный относительный риск, избыточный абсолютный риск, эффект скрининга
Короткий адрес: https://sciup.org/170179202
IDR: 170179202 | УДК: 616-006.6-02:614.876(470.3) | DOI: 10.21870/0131-3878-2021-30-1-131-146
Текст научной статьи Оценка радиационных рисков злокачественных новообразований среди населения регионов России, загрязнённых радионуклидами вследствие аварии на Чернобыльской АЭС
В результате аварии на Чернобыльской АЭС часть территории Российской Федерации подверглась загрязнению радионуклидами [1, 2]. В первые месяцы после аварии за счёт радиоизотопов йода сформировались дозы внутреннего облучения щитовидной железы населения [3]. Дозы
облучения всего тела населения были накоплены в течение первых 10 лет после аварии и составляли, в основном, менее 0,2 Зв [4].
Оценка отдалённых стохастических радиологических эффектов для доз облучения менее 0,2 Зв является наиболее актуальной задачей радиационной эпидемиологии последних десятилетий. При обосновании предельных доз облучения в современной системе радиологической защиты ведущие международные организации, такие как Научный комитет ООН по действию атомной радиации (НКДАР ООН) [5], Международная комиссия по радиологической защите (МКРЗ) [6] и Международное агентство по атомной энергии (МАГАТЭ) [7] используют линейную беспорого-вую модель описания отдалённых стохастических радиологических эффектов (радиационных рисков). При этом существующие оценки радиационных рисков при дозах облучения менее 0,2 Зв получены, в основном, с использованием экстраполяции радиологических эффектов из области более высоких доз облучения и имеют значительную неопределённость [5, 6, 8]. Поэтому высокий научный приоритет имеют крупномасштабные радиационно-эпидемиологические исследования по оценке радиологических рисков среди облучённых лиц, зарегистрированных и наблюдающихся с 1986 г. в системе Национального радиационно-эпидемиологического регистра (НРЭР) [9].
Настоящая работа является продолжением и уточнением опубликованных ранее исследований НРЭР по оценке радиационного риска онкологической заболеваемости населения 4-х наиболее загрязнённых областей РФ: Брянской, Калужской, Орловской и Тульской [10-14]. Для заболеваемости раком щитовидной железы (РЩЖ) радиационные риски оцениваются с учётом влияния эффекта скрининга при диагностике этого заболевания.
Материалы и методы
Для исследования радиационных рисков РЩЖ на основе информации о возрасте и месте жительства в 1986 г. для 327 тыс. человек из населения загрязнённых территорий ранее были получены индивидуализированные оценки доз облучения щитовидной железы от инкорпорированных радионуклидов йода [3].
После выхода постановления Правительства РФ от 8 октября 2015 г. № 1074, утвердившего актуальный Перечень населённых пунктов, находящихся в границах зон радиоактивного загрязнения вследствие катастрофы на Чернобыльской АЭС, общее количество граждан, состоящих на учёте в НРЭР из числа проживающих на территориях зоны отселения и зоны с правом на отселение (свыше 185 кБк/м2), сократилось до 160 тыс. человек.
Для оценки радиационных рисков злокачественных новообразований (ЗНО) были сформированы когорты из жителей наиболее загрязнённых районов Брянской, Калужской, Орловской и Тульской областей. В Брянской области к наиболее загрязнённым относятся Гордеевский, Злын-ковский, Климовский, Клинцовский, Красногорский и Новозыбковский районы; в Калужской области – Жиздринский, Ульяновский и Хвастовичский районы; в Орловской области – Болховский район; в Тульской области – Арсеньевский, Белевский, Плавский, Узловский и Чернский районы. Численности когорт наблюдения для исследования радиационных рисков ЗНО различных локализаций среди взрослых на момент аварии старше 20 лет составили от 89 тыс. до 91 тыс. человек.
Оценка радиационного риска и эффекта скрининга рака щитовидной железы
Ранее неоднократно рассматривался вопрос оценки радиационных рисков и эффекта скрининга РЩЖ на примере детского и взрослого населения 4-х наиболее загрязнённых областей РФ [10-12]. В настоящей работе использована та же информация об индивидуальных дозах внутреннего облучения щитовидной железы населения, что и в предыдущих исследованиях, а период наблюдения расширен до 2019 г. включительно. Для учёта латентного периода в индукции солидных ЗНО использовался 5-летний временной лаг, т.е. период наблюдения был выбран с 1.01.1991 по 31.12.2019 гг.
Известно, что доза облучения щитовидной железы в группе детей и подростков до 18 лет снижается с возрастом при облучении. В то же время доза облучения щитовидной железы для взрослых старше 18 лет не зависит от возраста при облучении. Средняя доза облучения щитовидной железы для детей и подростков в когорте составляет 0,174 Гр и 0,035 Гр - для взрослых.
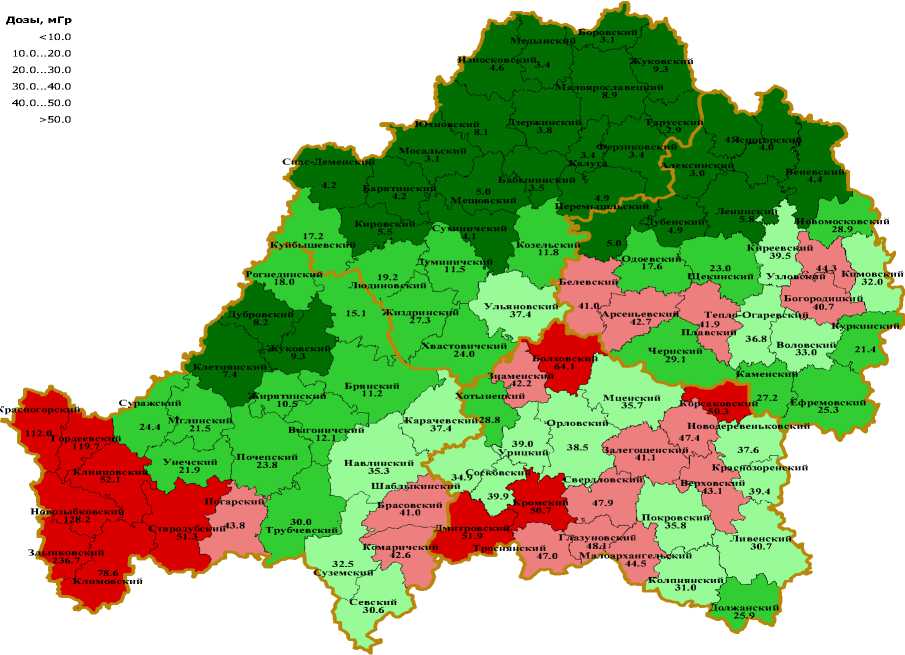
На рис. 1 приведена карта среднерайонных доз облучения щитовидной железы детей и подростков 4-х рассматриваемых областей. Как видно из рисунка, наибольшему облучению подверглись дети и подростки юго-западных районов Брянской области.
Дозы, мГр
<10.0
>50.0
Мосальский
Киро
28.9
Рогнединск
Дубро
37.4
36.8
24.0
35.7
39.0
38.5
37.6
Унечский
5ц2.
39.4
39.9
47.9
41.0
тародубс
48.1
47.0
44.5
32.5
78.6
31.0
евский 30.6
30.0...40.0
40.0...50.0
20.0...30.0
10.0...20.0
Чернский 29.1
Навлинский 35.3
Ливенский
30.7
30.0 Трубчевский
17.2 Куйбышев
Почепский
23.8
Должанский 25.9
23.0 екинс ачевский28.8 37.4
Рис. 1. Карта среднерайонных доз облучения щитовидной железы для детей и подростков (0-17 лет) на момент аварии, проживающих в Брянской, Орловской, Тульской и Калужской областях.
Согласно действующим стандартам, все жители наиболее загрязнённых территорий 4-х областей, зарегистрированные в НРЭР и включённые в исследование, проходят ежегодные медицинские осмотры. За период наблюдения с 1991 по 2019 гг. в рассматриваемых когортах были выявлены 1549 случаев РЩЖ, что на 25% выше, чем в предыдущем исследовании с периодом наблюдения 1991-2013 гг. (1241 случай) [11]. Из общего числа выявленных РЩЖ 423 случая диагностированы среди детей и подростков в возрасте 0-17 лет на момент аварии и 1126 – среди взрослых 18 лет и старше на момент аварии. Не более 7,9% диагнозов РЩЖ среди детей и подростков и 10,5% среди взрослых на момент аварии определены только клиническими методами. Все остальные случаи выявлены на основе радиоизотопных, ультразвуковых и других методов; диагнозы подтверждены морфологически у 90% детей и подростков и у 80% взрослых.
Известно, что при анализе заболеваемости РЩЖ в постчернобыльских когортах крайне важно учитывать, что не только фоновая заболеваемость зависит от возраста (достигнутого), но и доза внутреннего облучения от радиоизотопов йода, поглощённая в щитовидной железе, нелинейно связана с возрастом при облучении [8]. Поэтому оценка радиационного риска РЩЖ не может быть получена методом внутреннего сравнения только по данным наблюдения за исследуемой когортой. Для исключения смещения в оценках радиационного риска возможно использование смешанного метода внешнего и внутреннего сравнения (внешнего и внутреннего контроля) с использованием контрольных значений половозрастных показателей заболеваемости, например, полученных в системе здравоохранения [15].
Таким образом, в настоящей работе использована методика оценки радиационного риска и эффекта скрининга РЩЖ, предложенная авторами в предыдущей работе [11]. Выполнен расчёт по обновлённым радиационно-эпидемиологическим данным, накопленным за 35 лет после аварии на ЧАЭС.
Оценка зависимости заболеваемости РЩЖ от дозы инкорпорированного облучения щитовидной железы радионуклидами йода проводилась когортным методом с использованием Пуассоновской регрессии [16]. Время нахождения членов когорты под риском развития РЩЖ рассчитывалось как разница в датах Т1 и Т0 , где Т0 – дата внутреннего облучения 131I, а Т1 – дата выявления рака или дата последней диспансеризации или выбытия из когорты. Использовалась модель избыточного относительного риска (ERR, от англ. Excess Relative Risk) следующего вида:
Atft = lsp-[l + p(dtft)] , (1)
где λ sp – фоновая спонтанная заболеваемость РЩЖ в когорте, не зависящая от облучения; ρ (d th ) – функция, характеризующая зависимость интенсивности заболеваемости от дозы инкорпорированного облучения щитовидной железы.
Фоновая заболеваемость определялась с использованием внешней контрольной группы:
^• th (s , a, C) ES t ' ^-^us Cs, a, c) , (2)
где Arus(s,a,e) - годовые половозрастные показатели заболеваемости РЩЖ населения России [15]; s - пол; а - достигнутый возраст, в годах; с - календарный год; ESt - коэффициент скрининга за период времени t (коэффициент, учитывающий различие спонтанных заболеваемостей в изучаемой когорте и в российской популяции ) .
На рис. 2 графически отражена используемая методология оценки эффекта скрининга и линейной зависимости увеличения частоты заболеваний РЩЖ от дозы облучения [11]. Увеличение регистрируемого показателя заболеваемости за счёт эффекта скрининга учитывается коэффициентом ES.
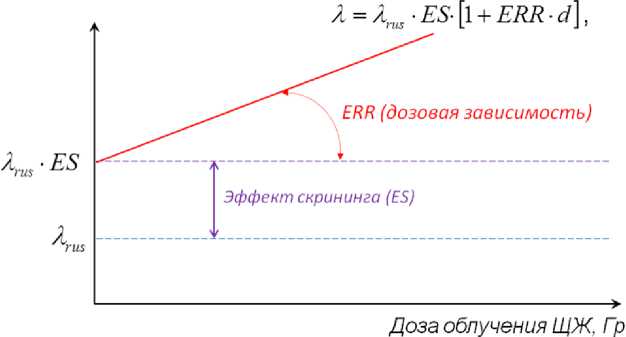
Рис. 2. Модель оценки эффекта скрининга и линейной зависимости увеличения частоты заболеваний РЩЖ от дозы облучения [11].
Как для детей и подростков на момент аварии, так и для взрослого населения, использовались линейные модели (консервативный подход) зависимости заболеваемости РЩЖ от дозы инкорпорированного облучения щитовидной железы:
для детей: p(e,a,dth) = ERR 1Гр ■ dth ■ ехр[и ■ е + to ■ ?n(a/20)] , (3)
для взрослых: p(e,a,dth) = ERR1rp ■ dth ■ ехр[и ■ (е - 45) + to ■ ?n(a/60)] , (4)
где ERR1Гр – неизвестный параметр, избыточный относительный риск на единицу дозы 1 Гр; dth – индивидуализированная доза облучения щитовидной железы от инкорпорированного радионуклида 131I, в Гр; e – возраст при облучении, в годах; a – достигнутый возраст, в годах; υ и ω – неизвестные параметры зависимости радиационного риска от возраста при облучении и достигнутого возраста.
Оценка неизвестных параметров ERR1Гр, β, ω и υ осуществлялась методом максимизации функции правдоподобия, а их статистическая значимость определялась на основе величины p статистики отношения правдоподобий [16]. Оценки неизвестных параметров, их 95% доверитель- ных интервалов (95% ДИ) и оценки величины p проводились с помощью программного пакета
Epicure [17].
После оценки неизвестных параметров в моделях (3) и (4), доля радиационно-обусловлен- ных случаев РЩЖ вычислялась по следующей формуле [16]:
AR th =
100% ■ - ■ 5™ i m ^^*--г
P(el,al,dl th ) 1+p(el,al,d ‘th ) ,
где AR th – доля радиационно-обусловленных случаев РЩЖ среди всех наблюдавшихся случаев РЩЖ, в %; m – число наблюдавшихся случаев РЩЖ; верхний индекс i обозначает конкретный случай РЩЖ; остальные обозначения соответствуют формулам (3) и (4).
Оценка радиационных рисков заболеваемости всеми солидными злокачественными новообразованиями и лейкозами
Для радиационно-эпидемиологических исследований, проводимых в НРЭР, используется информация о годовой динамике накопления эффективных доз облучения населения за протяжённый период времени. В настоящей статье не приводится описание технологии реконструкции средних по населённым пунктам годовых накопленных доз внешнего, внутреннего облучения и эффективных доз облучения населения 4-х областей РФ, загрязнённых после аварии на Чернобыльской АЭС. Использованная методика разработана соавторами и подробно изложена в недавней работе [18].
Для учёта латентного периода в индукции солидных ЗНО при оценке радиационных рисков использовался 5-летний временной лаг. Считалось, что для члена когорты, находящегося под риском заболевания в данном году, источником радиационного риска является доза, накопленная 5 лет назад. Период наблюдения за когортой был установлен с 1991 по 2019 гг. Известно, что для радиационно-обусловленной заболеваемости лейкозами характерен минимальный латентный период, не превышающий 2 года. Поэтому при оценке радиационного риска лейкозов источником радиационного риска являлась доза, накопленная на 2 года ранее, чем текущий год наблюдения. Период наблюдения за когортой в этом случае был установлен с 1987 по 2019 гг.
Оценка зависимости онкологической заболеваемости от накопленной эффективной дозы облучения проводилась когортным методом с использованием Пуассоновской регрессии [16]. Использовалась модель избыточного относительного риска следующего вида:
A oi = 2inc(s,r,a) ■ [1 + p(d cum )] , (6)
где Ainc(s,r,a) - фоновая онкологическая заболеваемость (заболеваемость людей, если бы они не подверглись облучению), зависящая от пола s , области проживания членов когорты r и их достигнутого возраста a ; p(dcum) - функция, характеризующая относительные изменения в онкологической заболеваемости, связанные с накопленной (с учётом латентного периода) эффективной дозой облучения d cum .
Рассматривалась линейная модель зависимости онкологической заболеваемости от накопленной эффективной дозы облучения всего тела:
p(d cum ) = ERR 13b ■ d cum , (7)
где ERR 13b - избыточный относительный риск на единицу эффективной дозы 1 Зв; d cum - накопленная (с учётом латентного периода) эффективная доза облучения всего тела, в Зв.
Оценка радиационного риска заболеваемости раком молочной железы
Многолетние радиационно-эпидемиологические исследования воздействия ионизирующего излучения на население городов Хиросима и Нагасаки (облучение в результате бомбардировки в 1945 г.) позволили выявить связь между частотой заболеваний раком молочной железы (РМЖ) и полученной населением дозой облучения [19]. Современные Рекомендации МКРЗ 2007 г. [6] содержат прогнозные модели радиационного риска РМЖ, идентифицированные на когортах, подвергшихся внешнему облучению. Согласно этим рекомендациям, зависимость «доза-эффект» для РМЖ устойчиво обнаруживается и имеет линейный вид в широком диапазоне доз. Модель риска имеет аддитивную зависимость от дозы облучения и выражается в виде избыточного абсолютного риска (EAR, от англ. Excess Absolute Risk):
^■breast ^•inc (r, a) + ^(^ cum) , (8)
где Atnc(r, a) - фоновая заболеваемость РМЖ (заболеваемость женщин, если бы они не подверглись облучению), зависящая от области r и достигнутого возраста а ; A(dcum) — функция, характеризующая избыточный абсолютный риск заболеваемости РМЖ, связанный с накопленной эффективной дозой облучения d cum .
Рассматривалась линейная модель зависимости онкологической заболеваемости от накопленной эффективной дозы облучения всего тела:
A(d cum ) = EARt зв ' d cum , (9)
где EARt Зв - избыточный абсолютный риск на единицу дозы 1 Зв; d cum - накопленная эффективная доза облучения всего тела, в Зв.
Результаты и обсуждение
Результаты оценки величин эффекта скрининга и радиационных рисков РЩЖ для рассматриваемых когорт представлены ниже. В табл. 1 отражены величины избыточных относительных рисков на единицу дозы облучения щитовидной железы (ERR/Гр) и коэффициентов скрининга (ES) для детей и подростков на момент аварии, а также для взрослых.
Статистически значимый радиационный риск индукции РЩЖ обнаружен только для детей и подростков (0-17 лет) на момент чернобыльской аварии. Для них радиационный риск РЩЖ так же статистически значимо уменьшался с увеличением достигнутого возраста: в модели (3) оценка параметра ю =- 2,36.
Высокое значение оцениваемой в модели величины ES за весь период наблюдения (5,6 для детей и подростков 0-17 лет на момент аварии и 2,1 для группы 18 лет и старше) подтверждает выраженный скрининговый эффект в процессе регистрации заболеваний РЩЖ. Как и следовало ожидать, выявленный коэффициент скрининга ES выше для молодых членов когорты, чем для взрослых.
Таблица 1
Оценки коэффициента избыточного относительного риска (ERR/Гр) и коэффициента (ES) для заболеваний РЩЖ в когорте лиц из Брянской, Орловской, Тульской и Калужской областей за период 1991-2019 гг.
|
Период наблюдения: 1991-2019 гг. |
Дети и подростки на момент аварии (0-17 лет) |
Взрослые на момент аварии (18 лет и старше) |
|
Всего человек Число случаев Средняя доза для когорты, Гр Средняя доза среди случаев, Гр Эффект скрининга ES (95% ДИ); величина p ES i : 1991-1995 гг. ES 2 : 1996-2000 гг. ES 3 : 2001-2005 гг. ES 4 : 2006-2013 гг. ES 5 : 2014-2019 гг. ES средний за период: 1991-2019 гг. ERR/Гр (95 % ДИ); величина p ω (95% ДИ); величина p и (95% ДИ); величина p |
108166 423 0,174 0,190 Модель(3) 11,9 (7,8; 16,9); p <0,001 6,5 (4,6; 8,7); p <0,001 5,8 (4,4; 7,4); p <0,001 6,7 (5,4; 8,1); p <0,001 4,7 (1,3; 5,7); p <0,001 5,6 (4,6; 6,5); p <0,001 4,61 (2,73; 7,01); p <0,001 -2,36 (-3,18; -1,56); p <0,001 -0,09 (-0,24; 0,02); p =0,14 |
219544 1126 0,035 0,036 Модель (4) 2,0 (1,7; 2,5); p <0,001 2,2 (1,8; 2,6); p <0,001 3,9 (3,4; 4,4); p <0,001 3,4 (3,0; 3,9); p <0,001 3,3 (2,8; 3,9); p <0,001 2,1 (2,8; 3,5); p <0,001 0,95 (-0,76; 3,01); p =0,30 Оценка не доступна Оценка не доступна |
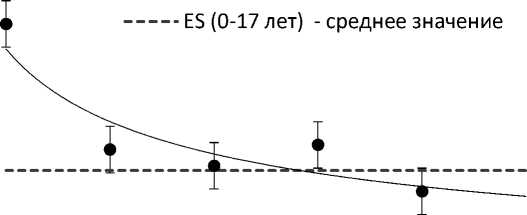
Оценка коэффициента скрининга ES по 5 периодам наблюдения позволила выявить значимое ( p <0,001) 2-кратное снижение эффекта скрининга, начиная с 1996 г., в сравнении с первым периодом (1991-1995 гг.). На рис. 3 приведено графическое представление зависимости коэффициента скрининга от календарного времени наблюдения за когортой детей и подростков на момент аварии. Сплошной линией показана тенденция к уменьшению эффекта скрининга РЩЖ со временем, прошедшим после чернобыльской аварии. Следует ещё раз подчеркнуть, что в первый период после начала наблюдения (1991-1995 гг.) для детей и подростков коэффициент скрининга был максимальным и составил 11,9.
• ES (0-17 лет) - по периодам наблюдения
1991-1995 1996-2000 2001-2005 2006-2013 2014-2019
Календарный период наблюдения
Рис. 3. Зависимость коэффициента скрининга (ES) от календарного времени наблюдения за когортой детского населения (0-17 лет) на момент чернобыльской аварии.
Оценки доли радиационно-обусловленных случаев РЩЖ, ARF th , по формуле (5), показали, что из выявленных среди детей и подростков 423 случаев заболеваний РЩЖ к радиационно-обусловленным можно отнести 20,6%, т.е. 87 случаев. В то же время, среди группы детей до 4-х лет на момент облучения из 103 выявленных случаев РЩЖ к радиационно-обусловленным можно отнести 58%, т.е. 60 случаев (табл. 2). Такая разница в доле радиационно-обусловленных случаев, в основном, определяется существенно большими дозами облучения щитовидной железы детей до 4-х лет, по сравнению со старшими возрастами.
Таблица 2 Доля радиационно-обусловленных раков щитовидной железы среди детей и подростков в зависимости от возраста в 1986 г.
|
Возраст в 1986 г., в годах |
0-4 |
5-9 |
10-17 |
|
Средняя доза, Гр |
0,326 |
0,149 |
0,088 |
|
Число выявленных случаев РЩЖ |
103 |
101 |
219 |
|
Число радиационно-обусловленных РЩЖ |
60 |
18 |
9 |
|
Доля радиационно-обусловленных РЩЖ, % |
58,3 |
17,8 |
4,1 |
Среди когорты взрослого (на момент чернобыльской аварии) населения, согласно полученной в данном исследовании статистически не значимой оценке величины избыточного относительного риска (p=0,30), радиационно-обусловленных случаев РЩЖ не выявлено. Однако следует обратить внимание на положительную величину ERR/Гр=0,95, которая свидетельствует о необходимости дальнейшего наблюдения за когортой.
Ниже приведены основные результаты оценки радиационных рисков заболеваемости ЗНО среди взрослого населения (старше 20 лет на момент аварии) наиболее загрязнённых районов Тульской, Брянской, Калужской и Орловской областей РФ.
С использованием моделей риска (6) и (7) за период наблюдения 1991-2019 гг. были получены оценки коэффициентов избыточного абсолютного риска (EAR/Зв) для заболеваемости всеми солидными ЗНО, а за период наблюдения 1987-2019 гг. - оценки коэффициентов EAR/Зв для заболеваемости лейкозами. Результаты оценок представлены в табл. 3 и 4 соответственно.
Таблица 3 Коэффициенты избыточного относительного риска (ERR/Зв) заболеваемости солидными ЗНО в когорте лиц из Брянской, Орловской, Тульской и Калужской областей за период с 1991 по 2019 гг.
|
Период наблюдения: 1991-2019 гг., модель (6) |
Все области |
Брянская область |
||
|
мужчины |
женщины |
мужчины |
женщины |
|
|
Всего человек |
38832 |
50603 |
30076 |
39784 |
|
Число случаев солидных ЗНО |
5515 |
5681 |
4201 |
4535 |
|
Средняя накопленная доза, Зв |
0,048 |
0,051 |
0,058 |
0,060 |
|
ERR/Зв (95 % ДИ); величина p |
-0,02 (-0,66; 0,70); p >0,5 |
0,14 (-0,55; 0,92); p >0,5 |
-0,06 (-0,69; 0,65); p >0,5 |
0,07 (-0,61; 0,84); p >0,5 |
Таблица 4
Коэффициенты избыточного относительного риска (ERR/Зв) заболеваемости лейкозами в когорте лиц из Брянской, Орловской, Тульской и Калужской областей за период с 1987 по 2019 гг.
|
Период наблюдения: 1987-2019 гг., модель (7) |
Все области |
Брянская область |
||
|
мужчины |
женщины |
мужчины |
женщины |
|
|
Всего человек Число случаев лейкозов Средняя накопленная доза, Зв ERR/Зв (95 % ДИ); величина p |
39587 126 0,051 2,04 (-н.н; 10,46); p >0,5 |
51705 137 0,053 0,00 (-2,27; 6,19); p >0,5 |
30630 100 0,061 1,94 (-н.н; 10,23); p >0,5 |
40591 110 0,063 -0,16 (-0,35; 5,79); p >0,5 |
За рассматриваемые периоды наблюдения в когортах Брянской области и всех загрязнённых областей было выявлено 8496 и 11459 случаев онкологических заболеваний соответственно. Как видно из таблиц, для населения наиболее загрязнённых районов накопленные эффективные дозы облучения всего тела в основном относятся к диапазону малых доз, со средними значениями порядка 0,05-0,06 Зв. Исследование не выявило статистически значимой зависимости онкологической заболеваемости населения от эффективной дозы облучения всего тела, накопленной за период проживания на загрязнённых территориях.
Известно, что РМЖ является ведущей онкологической патологией у женского населения России. РМЖ занимает первое место в структуре заболеваемости женщин ЗНО и превышает 20% от общего числа ежегодно выявляемых онкологических заболеваний [15]. Научные исследования, проводимые последние десятилетия, позволили выявить ряд факторов риска развития РМЖ: возраст старше 40 лет, поздняя менопауза, поздняя беременность, отсутствие родов, ожирение, злоупотребление алкогольными напитками и др. Дополнительным фактором риска развития РМЖ может являться воздействие на организм женщины ионизирующего излучения.
C использованием моделей риска (8) и (9), за период наблюдения 1991-2019 гг. были оценены величины коэффициентов избыточного абсолютного риска (EAR/Зв) РМЖ в когортах жителей наиболее загрязнённых районов Брянской, Орловской, Тульской и Калужской областей. В табл. 5 приведены число выявленных случаев, накопленные эффективные дозы облучения всего тела и оценки коэффициентов радиационного риска EAR/Зв для рассматриваемых когорт.
Таблица 5 Избыточный абсолютный риск (EAR) заболеваний РМЖ в когорте женщин из Брянской, Орловской, Тульской и Калужской областей за период с 1991 по 2019 гг.
|
Период наблюдения: 1991-2019 гг., модель (8, 9) |
Все области |
Брянская область |
|
Всего человек |
51020 |
40591 |
|
Число случаев РМЖ |
1123 |
894 |
|
Доля РМЖ от общего числа ЗНО, % |
19,8 |
19,1 |
|
Средняя накопленная доза, Зв |
0,051 |
0,061 |
|
EAR/Зв, |
-0,00028 |
-0,00033 |
|
(95 % ДИ); величина p |
(-0,0004; 0,0001); p >0,5 |
(-0,0005; 0,0001); p >0,5 |
За период наблюдения с 1991 по 2019 гг. в полной когорте лиц из населения, проживающего в 4-х загрязнённых областях, было выявлено 1123 случая РМЖ, а в когорте населения Брянской области – 894 случая. Сравнивая табл. 3 и 5, можно отметить, что доля РМЖ в структуре онкологической заболеваемости населения загрязнённых радионуклидами территорий РФ составляет около 20% и соответствует общенациональной российской статистике.
Как показывает табл. 5, оценки радиационных рисков РМЖ среди населения загрязнённых радионуклидами территорий являются статистически не значимыми ( p >0,5). Всё же дальнейшее наблюдение за когортой может изменить эти оценки, если латентный период развития радиационно-индуцированного РМЖ существенно больше 5 лет, – в этом случае для выявления радиационного риска необходимо более длительное время наблюдения.
Заключение
Полученные в настоящей работе результаты позволяют сделать следующие выводы.
После чернобыльской аварии диагностике и лечению РЩЖ населения загрязнённых радионуклидами территорий уделялось особое внимание. Среди жителей Брянской, Калужской, Орловской и Тульской областей это привело к так называемому эффекту скрининга: значительному увеличению наблюдаемых показателей заболеваемости РЩЖ для данного населения, по сравнению с показателями заболеваемости РЩЖ населения России в целом: до 11 раз – для детей и подростков (0-17 лет) на момент чернобыльской аварии.
Для этой же группы населения обнаружен статистически значимый радиационный риск РЩЖ, уменьшающийся с увеличением достигнутого возраста. Для возраста при облучении до года и достигнутого возраста 20 лет коэффициент избыточного относительного риска ERR/Гр=4,61. Среди всех членов когорты, бывших детьми и подростками на момент чернобыльской аварии, 20,6% случаев заболеваний РЩЖ являлись радиационно-обусловленными, а для детей до 4 лет к радиационно-обусловленным относились уже 58% случаев РЩЖ. Статистически значимый радиационный риск заболеваемости РЩЖ сохраняется более 30 лет после облучения.
Статистически значимые радиационные риски солидных ЗНО, включая радиационный риск РМЖ у женщин, для населения загрязнённых радионуклидами территорий пока не выявлены. Если придерживаться консервативных прогнозов по моделям риска МКРЗ, то избыточный радиационный риск заболеваемости солидными ЗНО среди населения следует ожидать на уровне 1% выше спонтанной заболеваемости. При таком небольшом ожидаемом риске для его выявления требуется более длительное время наблюдения за состоянием здоровья населения загрязнённых территорий.
Радиационный риск лейкозов среди населения загрязнённых радионуклидами территорий также не выявлен, хотя для мужского населения среднее значение избыточного радиационного риска всё же превышало нулевой уровень.
Дальнейшие наблюдения когорты лиц, проживающих или проживавших на загрязнённых радионуклидами территориях РФ, позволят увеличить статистическую мощность радиационноэпидемиологических исследований и уточнить оценки радиационных рисков человека при пролонгированном облучении в малых дозах.
Список литературы Оценка радиационных рисков злокачественных новообразований среди населения регионов России, загрязнённых радионуклидами вследствие аварии на Чернобыльской АЭС
- Ilyin L.A., Balonov M.I., Buldakov L.A., Bur'yak V.N., Gordeev K.I., Dement'ev S.I., Zhakov I.G., Zubovsky G.A., Kondrusev A.I., Konstantinov Y.O., Linge I.I., Likhtarev I.A., Lyaginskaya A.M., Matyuhin V.A., Pavlovsky O.A., Potapov A.I., Prysyazhnyuk A.E., Ramsaev P.V., Romanenko A.E., Savkin M.N., Starkova N.T., Tron'ko N.D., Tsyb A.F. Radiocontamination patterns and possible health consequences of the accident at the Chernobyl nuclear power station //J. Radiol. Prot. 1990. V. 10, N 1. P. 3-29.
- Питкевич В.А., Шершаков В.М., Дуба В.В., Чекин С.Ю., Иванов В.К., Вакуловский С.М., Махонько К.П., Волокитин А.А., Цатуров Ю.С., Цыб А.Ф. Реконструкция радионуклидного состава выпадений на территории России вследствие аварии на Чернобыльской АЭС //Радиация и риск. 1993. № 3. С. 62-93.
- Власов О.К., Щукина Н.В. Модификация действующих методик реконструкции доз внутреннего облучения щитовидной железы и всего тела жителей населённых пунктов Российской Федерации, подвергшихся радиоактивному загрязнению вследствие аварии на ЧАЭС в 1986 г. Часть 3. Реконструкция индивидуальных и стандартных доз внутреннего облучения щитовидной железы и всего тела населения по результатам их радиометрии в 1986 г. //Радиация и риск. 2010. Т. 19, № 2. С. 21-35.
- Брук Г.Я., Балонов М.И., Голиков В.Ю., Базюкин А.Б., Романович И.К., Шутов В.Н., Звонова И.А., Жеско Т.В., Константинов Ю.О., Пархоменко В.И., Кравцова О.С., Кадука М.В., Кайдановский Г.Н., Братилова А.А., Травникова И.Г., Яковлев В.А., Власов А.Ю., Власов О.К., Щукина Н.В., Перми-нова Г.С., Липатова О.В., Марченко Т.А. Средние накопленные за 1986-2005 годы эффективные дозы облучения жителей населённых пунктов Брянской, Калужской, Орловской и Тульской областей Российской Федерации, отнесённых к зонам радиоактивного загрязнения по постановлению правительства Российской Федерации № 1582 от 18 декабря 1997 г. «Об утверждении перечня населённых пунктов, находящихся в границах зон радиоактивного загрязнения вследствие катастрофы на Чернобыльской АЭС» //Радиация и риск. 2007. Т. 16, № 1. С. 3-73.
- United Nations Scientific Committee on the Effects of Atomic Radiation (UNSCEAR). Sources and effects of ionizing radiation. UNSCEAR 2008 Report to the General Assembly with Scientific Annexes, vol. II. New York: United Nations, 2011.
- ICRP, 2007. The 2007 Recommendations of the International Commission on Radiological Protection. ICRP Publication 103 //Ann. ICRP. 2007. V. 37, N 2-4. P. 1-332.
- Radiation protection and safety of radiation sources: International basic safety standards. IAEA Safety Standards, General Safety Requirements Part 3, No. GSR Part 3. Vienna: IAEA, 2014.
- Health risk assessment from the nuclear accident after the 2011 Great East Japan earthquake and tsunami based on a preliminary dose estimation. Geneva: WHO, 2013. 172 p.
- Медицинские радиологические последствия Чернобыля: прогноз и фактические данные спустя 30 лет /под общей ред. чл.-корр. РАН В.К. Иванова, чл.-корр. РАН А.Д. Каприна. М.: ГЕОС, 2015. 450 с.
- Ivanov V.K., Kashcheev V.V., Chekin S.Yu., Maksioutov M.A., Tumanov K.A., Vlasov O.K., Shchukina N.V., Tsyb A.F. Radiation-epidemiological studies of thyroid cancer incidence in Russia after the Chernobyl accident (estimation of radiation risks, 1991-2008 follow-up period) //Radiat. Prot. Dosim. 2012. V. 151, N 3. P. 489-499.
- Иванов В.К., Кащеев В.В., Чекин С.Ю., Максютов М.А., Туманов К.А., Меняйло А.Н., Власов О.К., Кочергина Е.В., Кащеева П.В., Щукина Н.В., Галкин В.Н., Каприн А.Д., Саенко В.А., Ямасита С. Рак щитовидной железы: уроки Чернобыля и их применение к ситуации в Фукусиме //Радиация и риск. 2016. Т. 25, № 2. С. 5-19.
- Кащеев В.В., Пряхин Е.А., Меняйло А.Н., Кочергина Е.В., Корело А.М., Туманов К.А., Иванов В.К. Скрининг рака щитовидной железы как фактор, повышающий показатель заболеваемости раком среди детей и подростков Брянской области и в префектуре Фукусима в Японии //Радиация и риск. 2019. Т. 28, № 4. C. 31-43.
- Чекин С.Ю., Максютов М.А., Кащеев В.В., Меняйло А.Н., Власов О.К., Щукина Н.В., Корело А.М., Туманов К.А. Методы и критерии формирования групп повышенного радиационного риска для оказания адресной специализированной медицинской помощи населению России и Республики Беларусь, подвергшемуся радиационному воздействию вследствие аварии на Чернобыльской АЭС //Радиация и риск. 2017. Т. 26, № 1. С. 8-22.
- Кащеев В.В., Чекин С.Ю., Максютов М.А., Туманов К.А., Корело А.М., Кочергина Е.В., Власов О.К., Щукина Н.В. Эффекты скрининга рака молочной железы среди населения Брянской и Орловской областей Российской Федерации //Радиация и риск. 2016. Т. 25, № 1. C. 25-33.
- Злокачественные новообразования в России в 2018 гг. (заболеваемость и смертность): справочник /под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М., 2019. 250 с.
- Breslow N., Day N. Statistical methods in cancer research. Volume II. The design and analysis of cohort studies. IARC Scientific Publication No. 82. Lyon: IARC, 1987. 406 p.
- Preston D.L., Lubin J.H., Pierce D.A., McConney M.E. EPICURE User's Guide. Seattle: Hirosoft International Corporation, 1993. 330 р.
- Власов О.К., Брук Г.Я., Щукина Н.В. Разработка и верификация технологии реконструкции эффективных доз облучения населения России после аварии на ЧАЭС //Радиация и риск. 2017. Т. 26, № 3. С. 28-45.
- Preston D.L., Ron E., Tokuoka S., Funamoto S., Nishi N., Soda M., Mabuchi K., Kodama K. Solid cancer incidence in atomic bomb survivors: 1958-1998 //Radiat. Res. 2007. V. 168, N 1. P. 1-64.


