Оценка разнообразия цианобактерий и водорослей эпилитона р. Сылвы (Пермский край) морфологическими и молекулярными методами
Автор: Саралов А.И., Беляева П.Г.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Экология
Статья в выпуске: 1, 2018 года.
Бесплатный доступ
Исследовано разнообразие альгоценозов эпилитона среднего течения р. Сылвы. Применен ком-плекс морфоцитологических методов альгологии и современной молекулярной экологии. Проведе-на полимеразная цепная реакция с использованием олигонуклеотидных праймеров для избира-тельной амплификации, клонирования и секвенирования фрагментов генов 16S рРНК цианобакте-рий и пластид. В конце аномально теплого лета 2016 г. в эпилитоне р. Сылвы выявлено 98 видов водорослей из трех отделов: Bacillariophyta (80% по биомассе - В; 40% по численности -N), Chlorophyta (15% В; 10% N) и Cyanophyta/Cyanobacteria (5% В; 50% N). По результатам филогене-тического анализа генов 16S рРНК 142 клонов, 80 отнесено к диатомовым и 2 к зеленым водорос-лям, 60 - к цианобактериям. В фрагментах пластидных геномов Bacillariophyta эпилитона выявле-но две филогенетически обособленных ветви клонов, родственные представителям с разным строением панциря и отношением к солености воды. Причем 89% видов диатомовых были детек-тированы в эпилитоне и морфологическими, и молекулярными методами. Результаты исследова-ния генов 16S рРНК хлоропластов Bacillariophyta эпилитона хорошо согласовались с их естествен-ной филогенетической системой, основанной на морфологии и детальной структуре кремневого панциря. Напротив, морфотаксономические признаки цианобактерий эпилитона слабо согласова-лись с данными молекулярного анализа на основе сравнения нуклеотидных последовательностей генов 16S рРНК.
Эпилитон, цианобактерии, 16s ррнк, диатомовые водоросли, зеленые водоросли, таксономия
Короткий адрес: https://sciup.org/147204873
IDR: 147204873 | УДК: 577.29:574.586 | DOI: 10.17072/1994-9952-2018-1-97-104.
Текст научной статьи Оценка разнообразия цианобактерий и водорослей эпилитона р. Сылвы (Пермский край) морфологическими и молекулярными методами
ной экологии [Nübel et al., 2000; O'Sullivan, Weightmann, Fry, 2002; Bricheux et al., 2013; Lindemann et al., 2013; Семейкина и др., 2015].
Фито- и бактериоперифитону водотоков Камского бассейна, в частности, в наиболее изученной нами предгорной р. Сылве Пермского края, принадлежит ведущее положение в самоочищении и биопродуктивности, азотфиксации и денитрификации [Беляева, 2004; Беляева и др., 2007; Саралов и др., 2010]. В настоящее время согласно морфоцитологическим данным в перифитоне р. Сылвы отмечена четкая тенденция увеличения численности и разнообразия Cyanophyta/Cyanobacteria за счет представителей родов Snowella, Merismopedia, Gloeotrichia, Oscillatoria и сокращение Bacillario-phyta родов Navicula, Synedra, Cymbella [Беляева, 2014]. В связи с этим возникает необходимость в оценке биоразнообразия и состава альго-бактериальных сообществ перифитона предгорной реки с использованием комплекса альгологических и молекулярных методов.
Цель работы – с применением молекулярнобиологических и общепринятых в альгологии морфоцитологических методов охарактеризовать разнообразие цианобактерий, диатомовых и зеленых водорослей в образцах эпилитона р. Сылвы.
Материалы и методы
Река Сылва – предгорная река Среднего Урала, впадает в Чусовской залив Камского водохранилища. Каменистые субстраты среднего течения р. Сылвы занимают около 70% площади, состоят из песка (<0.1 см), гравия, гальки и валунов (диаметром 0.1–1.5 м). Пробы эпилитона отбирали в середине августа 2016 г. выше г. Кунгура в районе учебно-научной базы «Предуралье» Пермского университета. Лето 2016 г. в Пермском крае по характеру погоды отличалось преобладанием очень теплой погоды и значительным дефицитом осадков. Средняя температура воздуха за лето 2016 г. превысила норму на 2.6°C. Самым жарким днем лета на большей части края стало 15 августа, до 35.6°С [Климатические…, 2016].
Для более полного анализа разнообразия водорослей и цианобактерий альгологические пробы отбирали в августе, при максимальном числе видов и биомассе альгоценозов [Беляева, 2014]. Пробы обрабатывали по общепринятым методам, описанным нами ранее [Беляева, 2004; Беляева и др.., 2007]. Таксономическую принадлежность водорослей устанавливали по отечественным и зарубежным определителям и справочникам пресноводных водорослей [Забелина и др., 1951; Голлер-бах, Косинская, Полянский, 1953; Паламарь-Мордвинцева, 1982; Куликовский и др., 2016; Komàrek, Fott, 1983; Krammer, Lange-Bertalot, 1986–1991; Komàrek, Anagnostidis, 1999]. Назва- ния таксонов приведены согласно классификации, принятой в серии «Определитель пресноводных водорослей СССР» [Забелина и др., 1951; Голлер-бах, Косинская, Полянский, 1953; Паламарь-Мордвинцева, 1982].
ДНК выделяли по методике, основанной на модифицированном методе щелочного выделения ДНК Бирнбойма-Доли и Wizard-технологии фирмы Promega (США) [Булыгина и др., 2002]. Очищенную ДНК хранили при -20 ° С.
Амплификацию фрагментов генов, кодирующих 16S рРНК, проводили с помощью системы праймеров CYA106F (5’ - CGG ACG GGT GAG TAA CGC GTG – 3’), CYA781R(a) (5’ - GAC TAC TGG GGT ATC TAA TCC CAT T – 3’) и CYA781R(b) (5’ - GAC TAC AGG GGT ATC TAA TCC CTT T – 3’) [Nübel, 1997]. Полученные ПЦР-продукты очищали от посторонних примесей и неспецифичных продуктов реакции при помощи электрофореза в легкоплавкой агарозе с применением набора Wizard PCR Preps (“Promega”, США). Очищенные ПЦР-продукты лигировали в вектор pGEM-T Easy System (“Promega”, США), согласно рекомендациям производителя, и клонировали в штамме E. coli DH10B.
Секвенирование ПЦР–продуктов и клонированных фрагментов проводили на секвенаторе ABI3730 DNA Analyzer (“Applied Biosystems”, США) с использованием набора реактивов Big Dye Terminator v 3.1 Cycle Sequencing Kit (“Applied Biosystems”, США), согласно инструкции производителя.
Длина анализируемых последовательностей 16S рРНК составляла 470 нуклеотидов. Первичный сравнительный анализ полученных последовательностей проводили с помощью сервиса NCBI BLAST . Последовательности были проверены на наличие химер с помощью сервиса Bellerophon [Huber et al., 2004]. Для построения филогенетических деревьев использовали программу MEGA 6.0 [Tamura et al., 2013].
Последовательности 16S рРНК были депонированы в GenBank под номерами KY274302– KY274361(цианобактериальные) и KY282959-KY283040 (пластидные).
Результаты и их обсуждение
В период с 2003 по 2016 гг. в р. Сылве в летнем эпилитоне наблюдалось значительное (в 10 раз) увеличение численности и биомассы цианобактерий родов Snowella, Merismopedia и Gloeotrichia echinulata P.G. Richter (таблица).
За этот же промежуток времени численность диатомовых сократилась в 2 раза (особенно Navicula cryptocephala Kütz. и Synedra ulna (Nitzsch) Ehrenb.). Однако они продолжают доми- нировать по биомассе, в частности, за счет получивших массовое распространение крупноклеточных Amphora ovalis (Kütz.) Kütz. и Cocconeis placentula Ehrenb.
Зеленые водоросли в многолетней динамике по данным за 2003–2016 гг. продолжают поддерживать и численность (10–15%), и биомассу (10– 15%) на сравнительно стабильном уровне, в частности, благодаря широко распространенным в планктоне и обрастаниях Cosmarium botrytis Meneg. ex Ralfs, Pediastrum boryanum (Turp.) Meneg. и Closterium spp. В конце аномально теплого лета 2016 г. в эпилитоне р. Сылвы выявлено 98 таксонов водорослей рангом ниже рода из трех основных отделов: Bacillariophyta (80% B; 40% N), Chlorophyta (15% B; 10% N) и Cyanophyta (5% B; 50% N).
Многолетняя динамика структуры эпилитона р. Сылвы (2003–2016 гг.)
|
Показатели |
2003–2005 гг. |
2012 г. |
2014 г. |
2016 г. |
|
Численность, млрд.кл/ м 2 |
8.9±3.6 |
10.8±4.1 |
5.0±1.2 |
4.6±0.4 |
|
Биомасса, г/м2 |
12.7±5.8 |
12.5±4.4 |
28.0±4.8 |
20.9±3.5 |
|
Количество видов |
127 |
122 |
102 |
98 |
|
з m g £ § О S S U p § § is" 5 S 8 I s c s 3 X |
Bacillariophyta : 80%N; 88%В Navicula cryptocephala 15%N; 25%B, Cocconeis placentula 20%B, Synedra ulna 15%B, Diatoma vulgaris 15%N; 5%B, Achnanthes spp. 15%N Chlorophyta : 15%N; 11.5%В Cosmarium botrytis 5%B, Pediastrum boryanum 2%N; 4%B, Closterium spp. 2%B Cyanophyta / Cyanobacteria : 5%N; 0.5%В Planctolyngbya lim-netica , Merismopedia spp. |
Bacillariophyta : 80% N; 85%В Cocconeis placentula 15%N; 50%B, Diatoma vulgaris 10%B, Epithemia sorex 8%B, Achnanthes spp. 10–25%N Chlorophyta : 15%N; 14.5%В Cosmarium spp. 8%B, Pediastrum boryanum 6%B, Crucigenia fenestrata 8%N Cyanophyta/ Cyanobacteria : 5%N; 0.5%В Snowella rosea , Merismopedia spp., Anabaena contorta , Gloeotrichia echinulata |
Bacillariophyta : 70%N; 85%В Cocconeis placentula 10%N; 20%B, Synedra ulna 15%B, Navicula cryptocephala 10%N; 15%B, Cymbella lanceolata 10%B, C. ventricosa 5%N, Achnanthes spp. 15%N Chlorophyta : 15%N; 10%В Pediastrum tetras 4%B, Pediastrum boryanum 2%N; 5%B Cyanophyta / Cyanobacteria : 15%N; 5%В Merismopedia spp. 10%N, Planctolyngbya limnetica , Snowella rosea , Anabaena spp. |
Bacillariophyta : 40%N; 80%В Amphora ovalis 40%B, Cocconeis placentula 10%N; 25%B, Diatoma vulgaris 6%B, Achnanthes spp. 20%N, Cymbella ventricosa , Melosira varians , Nitzschia amphibia Chlorophyta : 10%N; 15%В Scenedesmus spp. 6%N, Pediastrum boryanum 2%N; 5%B, Closterium spp. 5%B, Cosmarium botrytis 3%B Cyanophyta / Cyanobacteria : 50%N; 5%В Snowella rosea 20%N, Merismopedia spp. 13%N, Gloeotrichia echinulata 8%N, Oscillatoria spp. 5%N, Calothrix spp. |
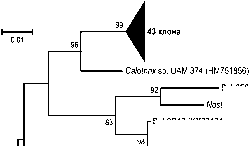
Филогенетический анализ разнообразия альго-бактериальных сообществ эпилитона р. Сылвы по результатам сравнения последовательностей генов 16S рРНК из библиотеки клонированных ПЦР-фрагментов, был проведен достаточно эффективно, идентифицировано 142 клона, 80 отнесено к диатомовым и 2 к зеленым водорослям, 60 – к цианобактериям (рис. 1, 2). На филогенетическом древе клоны с высокой степенью достоверности формировали обособленные кластеры. Основу аль-гофлоры эпилитона р. Сылвы составили широко распространенные пресноводные виды и космополиты (более 80% видового разнообразия), как правило, многочисленные в 16S рРНК-клонотеках пресноводных и морских экосистем [Nübel, Garcia-Pichel, Muyzer, 1997; Nübel et al., 2000; O´Sullivan, Weightmann, Fry, 2002; Bricheux et al., 2013; Lindemann et al., 2013; Komárek et al., 2014].
С использованием «специфичных» праймеров для 16S рРНК цианобактерий на дереве филогении были выявлены последовательности генов 16S рРНК фрагментов пластидных геномов пресноводных зеленых водорослей порядка Desmidiales рода Cosmarium ( C. botrytis ) (рис. 1). Для них характерно наличие примитивных архепластид, чрезвычайное разнообразие типов строения клеток и видов рода Cosmarium (более 200), широкое распространение в обрастаниях макрофитов и камней, в планктоне и бентосе [Паламарь-Мордвинцева, 1982; Keeling, 2013]. Последовательности генов 16S рРНК фрагментов хлоропластных геномов Chlorophyta, однако, филогенетически удалены (как и ядерные геномы) от неродственных Bacillariophyta, у которых пластиды были образованы в высоко развитых формах с кремневым панцирем лишь при третичном эндосимбиозе [Bhattacharya, Medlin, 1995; Keeling, 2013].
В фрагментах генов 16S рРНК, локализованных в хлоропластных геномах Bacillariophyta в эпилитоне р. Сылвы, выявлено две филогенетически обособленные ветви клонов представителей диатомей с разным строением панциря и отношением к солености воды (рис. 1). Единичные представители гетерогенной ветви из 5 родов принадлежат к древнему классу Centricae с панцирем радиального строения (20 клонов: 18 родственны минорным солоноватоводным-морским, эвригалинным Melosira varians и Aulacoseira (Melosira) granulata).
—lAmp/ior^o^/s^ крона)
0.02
I Syl-3A05 (KY282978)
Syl-3B06 (KY282987) 7Л- Cvmatooleura solea (E
721- C^^urasofea (EU580477)
j-Syl-3D06 (KY283002)
pSyl-2E07 (KY282969)
5i|jSyl-3B05 (KY282986)
1 * Pseudo-nitzschia seriata (FJ002178)
— Cymbella subturqidul9 №0519^
Syl-3B01 (KY282983)
Syl-2D01 (KY282967)
" |—Syl-3G12 (KY283033)
. Syl-3B04 (KY282985)
Syl-3F06 (KY283020)
- Didymosphenia geminate (KC509523)
Lsyl-3E12 (KY283016)
-Syl-3E01 (KY283008)
■ Gyrosigma fasciola (AF514847)
1-Syl-2A04 (KY282960)
J Nitzschia frustulum (AY221721) l-Sy|-1E07(KY282959)
-Syl-3F05 (KY283019)
— Nitzschia amphibia (FJ002224)
— Pseudo-nitzschia seriata (FJ002177)
-
—◄ 5 клонов
-
- Synedra acus (JQ088178)
____rSyl-2F10 (KY282972)
о
Л й c
c
Q
!98*— Synedra hyperborea (FJ002235)
I------- Fragilaria zeilleri (EU580508)
53jLsyl-3G08 (KY283030)
^|Lsyl-3F03 (KY283018)
I— Fra*niic№fe (FJ002188)
I----- Achnanthes brevipes (FJ002237)
И—Syl-2A10 (KY282961)
1i-------- Asterionellopsis glacialis (AJ536455)
|rSyl-2H08 (KY282974)
8ol-Syl-3GO1 (KY283025)
— Stephanopyxis nipponica (AJ536465) Syl-3H02 (KY283034)
■ Man(2£l№ (AY221720)
j Syl-3H06 (KY283037)
■ Cyclotella cryplica (FJ002189)
■ Aulacoseira (Melosira} aranulata (FJ002181)
И 4 клона
Closterium baillyanum (KU646494)
I— Cosmarium botrvtis (KU646492) hSyl-3B08(KY282988) ■ Syl-3C02 (KY282993)
0 й CO
и й
c и 0
Я
a 0
"л
E
V
Q
Рис. 1 . Дендрограмма сравнения последовательностей генов 16S рРНК пластид диатомовых и стрептофитовых водорослей эпилитона р. Сылвы
Дендрограмма построена путем сравнения последовательностей длиной 470 нуклеотидов на основании анализа 1000 альтернативных деревьев, алгоритм построения Neighbour-Joining. Цифры указывают достоверность ветвления на основании bootstrap – анализа. Масштабная линейка – 2 нуклеотидные замены на каждые 100 нуклеотидов. Подчеркнуты виды, выявленные и молекулярными, и морфологическими методами
Большинство нуклеотидных последовательностей 16S рРНК на дереве филогении отнесено к классу Pennatae (панцирь моносимметричного строения с перистой структурой). Из 60 фрагментов пластидных геномов диатомей у 34 выявлено сходство с доминантными пресноводными крупноклеточной Amphora ovalis , 6 – субдоминантными пресноводными Cymbella subturgidula / Didymos-phenia geminata , 8 – минорными эвригалинными Nitzschia amphibia / N. frustulum . Около 80% видов диатомовых были детектированы в эпилитоне и морфологическими, и молекулярными методами.
Cyanophyta/Cyanobacteria эпилитона р. Сылвы характеризуются морфологическим многообразием пресноводных видов. Морфологические признаки цианобактерий эпилитона слабо согласовались с их филогенией на основе сравнения нуклеотидных последовательностей генов 16S рРНК. У этих наиболее древних оксигенных фототрофов таксономически значимый ключевой фермент фотоассимиляции углекислоты (RubisCO) несовершенен, обладает очень низким сродством к CO 2 , локализуется в специфичных включениях цитоплазмы – кар-боксисомах α- и β-типа, соответственно у α- и β-цианобактерий [Badger, Hanson, Price, 2002; Espie, Kimber, 2011; Rae et al., 2013].
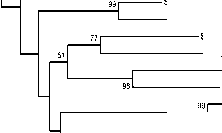
Согласно филогенетическому анализу последовательностей генов 16S рРНК, клоны цианобактерий вошли в две гетерогенные ветви, состоящие из нескольких довольно обособленных кластеров (рис. 2). Большинство клонов первой ветви (75%) проявили высокий уровень сходства с β-цианобактериями (с карбоксисомами β-типа) класса Hormogoneae порядка Nostocales с варьирующими значениями бутстреп-поддержки (92–99%). Только представителям Hormogoneae присущи плазмодесмы – тончайшие протоплазматические тяжи, соединяющие соседние клетки в единое целое в форме многоклеточного нитчатого трихома [Голлербах, Косинская, Полянски й , 1953; Вассер и др., 1989; Komárek et al., 2014].
Основной кластер (45 клонов) примыкает к азотфиксирующим минорным видам эпилитона порядка Nostocales ( Calothrix , Nostoc, Tolypothrix ), формирующих асимметричные трихомы с гетероцистами. Представители этих родов широко распространены на водорослях и макрофитах, камнях и скалах [Вассер и др., 1989].
К основному кластеру порядка Nostocales примыкает обособленный кластер из 5 клонов, родственных доминантным в эпилитоне р. Сылвы видам Snowella класса Chroococcaceae порядка Chroococ-cales . У видов рода Snowella ( S. rosea, S. litoralis ), хотя плазмодесмы отсутствуют, но шаровидные клетки диаметром 3–4 мкм в слизистых колониях располагаются на тонких радиальных разветвлениях–ножках [Голлербах, Косинская, Полянский,
1953]. На периферии первой группы клонов выявлен клон, родственный недостаточно описанному штамму Oscillatoria sp. KNUA009 порядка Oscilla-toriales , объединяющего безгетероцистных представителей класса Hormogoneae [Komárek et al., 2014].
Syl-2F06 (KY274354)
toe insulare SAG 54.79 (KM019927)
Syl-2B12 (KY274342)
j— Calothrix marchica AUS-JR/MT/NT-093 (KX670258)
7^- Tolypothrix sp. PCC 7504 (FJ661002)
---- Snowella rosea 1LM40S01 (AJ781042)
____________________ j—Syl-2D03 (KY274347)
99 П Syl-2A06 (KY274337)
88 —Syl-1D01 (KY274314) — Syl-1D02 (KY274315) Syl-1A07 (KY274304)
Snowella litoralis 1ES42S2 (DQ264220)
।--------------Syl-2C05 (KY274344)
Я---------------- Oscillatoria sp. KNUA009 (HQ201392)
991— Chamaesiphon minutus РОС 6605T (NR_102459)
I—Syl-2B02 (KY274338)
-
99, Cyanobium sp. 0ES35S4 (DQ264240)
99 1 L Syl-2D07 (KY274349)
П_____, Syl-2E02 (KY274351)
I9sL Cyanobium gracile PCC 6307T (NR_102447)
Syl-2F09 (KY274355)
----Pleurocapsa concharum VP3-02 (FR798927)
Syl-2H07 (KY274359)
— Nodosilinea sp. NTRI45 (KP030748)
■ Syl-2D09 (KY274350)
I
z
Hormogoneae
Oscillatoriales
Chamaesiphoneae Pleurocapsales
Pseudanabaena limnetica PUPCCC (KM376980) 8 ■ Limnococcus limneticus Svet06 (GQ375048) J — Syl-1H12 (KY274336)
-----Oscillatoria prolifera UTEX В 1270 (AB075993)£
___1— Syl-2B06 (KY274340)|
"93I— Syl-3A12 (KY274361)“
Рис. 2 . Дендрограмма сравнения последовательностей генов 16S рРНК цианобактерий эпилитона р. Сылвы
Дендрограмма построена путем сравнения последовательностей длиной 470 нуклеотидов на основании анализа 1000 альтернативных деревьев, алгоритм построения Neighbour-Joining. Цифры указывают достоверность ветвления на основании bootstrap – анализа. Масштабная линейка – 2 нуклеотидные замены на каждые 100 нуклеотидов. Подчеркнуты виды, выявленные и молекулярными, и морфологическими методами
Другие клоны эпилитона, близкие α-циано-бактериям (с карбоксисомами α-типа) рода Oscilla-toria, включая холодноводную O. prolifera, вошли во вторую малочисленную группу. Тем не менее, в нее включены морфологически, метаболически и таксономически разнообразные представители классов Hormogoneae, Chroococcaceae, Chamaesi-phoneae, порядков Oscillatoriales, Synechococcales, Pleurocapsales и 5 родов (Oscillatoria, Limnococcus (Chroococcus), Pleurocapsa, Cyanobium, Chamaesi-phon (Sphaerogonium) с высоким значением бутст-реп-поддержки – 99%). Молекулярные исследования последних лет, секвенирование генов большо- го числа видов, полное секвенирование геномов позволило внести существенные коррективы в предшествующие филогенетические системы цианобактерий, в расстановку большого числа видов внутри других родов, семейств, порядков и даже классов [Komárek et al., 2014].
Заключение
Впервые в эпилитоне предгорной р. Сылвы осуществлена параллельная оценка биоразнообразия альго-бактериальных сообществ с использованием современных методов молекулярной экологии и общепринятых в альгологии морфоцитологических методов.
Согласно филогенетическому анализу последовательностей генов 16S рРНК, большинство клонов Cyanobacteria (75%) проявили высокий уровень сходства с представителями порядка Nostocales класса Hormogoneae, с азотфиксирую-щими видами эпилитона, относящихся к β-цианобактериям (с карбоксисомами β-типа). Морфо-таксономические признаки Cyanobacteria слабо согласовались с их филогенией на основе сравнения последовательностей генов 16S рРНК.
Среди Bacillariophyta в эпилитоне р. Сылвы явно преобладает пресноводная крупноклеточная Amphora ovalis (класс Pennatae – с панцирями мо-носимметричного строения). Представители второй гетерогенной ветви принадлежат к древнему классу Centricae с панцирем радиального строения, родственных минорным солоноватоводным-морским, эвригалинным Melosira varians и Aulacoseira ( Melosira ) granulata . Установлено, что диатомовые водоросли сравнительно полно детектируются и современными молекулярными in situ методами и традиционными морфологическими методами водной альгологии. Результаты исследования фрагментов генов 16S рРНК, локализованных в хлоропластных геномах Bacillariophyta, хорошо согласовались с их естественной филогенетической системой, основанной на морфологии и детальной структуре кремневого панциря.
Секвенирование ПЦР–продуктов и клонированных фрагментов выполнено на оборудовании ФГБУН Центр «Биоинженерия» РАН, Москва.
Список литературы Оценка разнообразия цианобактерий и водорослей эпилитона р. Сылвы (Пермский край) морфологическими и молекулярными методами
- Беляева П.Г. Фитоперифитон предгорной реки Сылва (бассейн Камы)//Ботанический журнал. 2004. Т. 89, № 3. С. 435-449
- Беляева П.Г. Состав и структура фитоперифитона реки Сылва (Пермский край)//Ботанический журнал. 2014. Т. 99, № 8. С. 903-916
- Беляева П.Г. и др. Функциональная роль перифитона предгорной реки Сылва (бассейн р. Камы) 102 А. И. Саралов, П. Г. Беляева//Биология внутренних вод. 2007. № 3. С. 32-40
- Булыгина Е.С. и др. Изучение нуклеотидных последовательностей nifH генов у представителей метанотрофных бактерий//Микробиология. 2002. Т. 71, № 4. С. 425-432
- Вассер С.П. и др. Водоросли. Киев, 1989. 608 с
- Голлербах М.М., Косинская Е.К., Полянский В.И. Определитель пресноводных водорослей СССР. Синезеленые водоросли. М., 1953. Вып. 2. 652 с
- Забелина М.М. и др. Определитель пресноводных водорослей СССР. Диатомовые водоросли. М., 1951. 619 с
- Климатические особенности лета 2016 г. в Пермском крае URL: http://accident.perm.ru/index.php/novosti/854summer-2016. (дата обращения: 31.08.2016)
- Куликовский М.С.и др. Определитель диатомовых водорослей России. Ярославль: Филигрань, 2016. 804 с
- Паламарь-Мордвинцева Г.М. Определитель пресноводных водорослей СССР. Зеленые водоросли. Класс Конъюгаты. Порядок Десмидиевые. М., 1982. Вып. 11, ч. 2. 620 с
- Саралов А.И. и др. Азотфиксация и денитрификация в планктоне и перифитоне водотоков Камского бассейна//Биология внутренних вод. 2010. № 2. С. 13-19
- Семейкина П.И. и др. Состав альгобактериального сообщества эпилитона предгорной реки Сылва//Российский иммунологический журнал. 2015. Т. 9 (18), вып. 2(1). С. 606-608
- Badger M.R., Hanson D., Price G.D. Evolution and diversity of CO 2 concentrating mechanisms in cyanobacteria//Functional Plant Biology Journal. 2002. Vol. 29(2-3). P. 161-173
- Bhattacharya D., Medlin L. The phylogeny of plastids: a review based on comparisons of smallsubunit ribosomal RNA coding regions//Journal of Phycology. 1995. Vol. 31. P. 489-498
- Bricheux G. et al. Pyrosequencing assessment of prokaryotic and eukaryotic diversity in biofilm communities from a French river//Microbiology Open. 2013. Vol. 2 (3). P. 402-414
- Espie G.S., Kimber M.S. Carboxysomes: cyanobacterial RubisCO comes in small packages//Photosynthesis Research. 2011. Vol. 109(1-3). P. 7-20
- Huber T., Faulkner G., Hugenholtz P. Bellerophon: a program to detect chimeric sequences in multiple sequence alignments//Bioinformatics. 2004. Vol. 20(14). P. 2317-2319
- Keeling P.J. The number, speed, and impact of plastid endosimbioses in eukaryotic evolution//Annual Review of Plant Biology. 2013. Vol. 64. P. 583-607
- Komàrek J., Anagnostidis K. Cyanoprokaryota. Chroococcales. Süsswasserflora von Mitteleuropa. Jena: FicherVerland, 1999. Bd. 19. T. 1. 548 p
- Komàrek J., Fott B. Chlorophyceae (Gruunalgen), Ordnung: Chlorococcales.Stuttgard: E. Schweizerbart’scheVerlagsbuchhandlung , 1983. Bd. 16. T. 7. H. 1. 1044 S
- Krammer K., Lange-Bertalot H. Bacillariophyceae//Süßwasserflora von Mitteleuropa. Eds. by H. Ettl, J. Gerloff, H. Heying, D. Mollenhauer. Stuttgart-Jena: G. Fisher Verlag, 1986. Bd 2/1. 876 S.; 1988. Bd 2/2. 596 S.; 1991. Bd 2/3. 576 S.; 1991. Bd 2/4. 473 S
- Komárek J. et al. Taxonomic classification of Cyanoprokaryotes (Cyanobacterial genera), using a polyphasic approach//Preslia. 2014. Vol. 86. P. 295-335
- Lindemann S.R. et al. The epsomitic phototrophic microbial mat of Hot Lake, Washington: community structural responses to seasonal cycling//Frontiers in Microbiology. 2013. Vol. 4. P. 1-17
- NCBI BLAST: The National Center for Biotechnology Information. 2016. URL: http://www.ncbi. nlm.nih.gov/blast. (дата обращения: 31.08.2016)
- Nübel U. et al. Matching molecular diversity and ecophysiology of benthic cyanobacteria and diatoms in communities along a salinity gradient//Environmental Microbiology. 2000. Vol. 2. P. 217-226
- Nübel U., Garcia-Pichel F., Muyzer G. PCR primers to amplify 16S rRNA genes from Cyanobacteria//Applied and Environmental Microbiology. 1997. Vol. 63(8). P. 3327-3332
- O'Sullivan L.A., Weightmann A.J., Fry J.C. New degenerate Cytophaga-Flexibacter-Bacteroidesspecific 16S ribosomal DNA-targeted oligonucleotide probes reveal high bacterial diversity in river taff epilithon//Applied and Environmental Microbiology. 2002. Vol. 68. P. 201-210
- Rae B.D. et al. Functions, compositions, and evolution of the two types of carboxysomes: polyhedral microcompaartments that facilitate CO 2 fixation in Cyanobacteria and some Proteobacteria//Microbiology and Molecular Biology Reviews. 2013. Vol. 77(3). P. 357-379
- Tamura K. et al. MEGA6: molecular evolutionary genetics analysis version 6.0//Molecular biology and evolution. 2013. Vol. 30(12). P. 2725-2729


