Оценка риска метастазирования при проведении "прогностической" тонкоигольной аспирационной биопсии увеальной меланомы
Автор: Левашов Илья А., Яровой Андрей А., Яровая Вера А., Булгакова Евгения С.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 2 т.12, 2022 года.
Бесплатный доступ
Несмотря на широкое использование тонкоигольной аспирационной биопсии (ТИАБ) увеальной меланомы (УМ) с прогностической целью, до сих пор высказываются сомнения в безопасности этой процедуры. При этом в отечественной литературе анализ таких данных не проводился, а среди зарубежных авторов по этой теме встречаются лишь единичные работы. Цель: проведение анализа риска метастазирования у пациентов с УМ при проведении ТИАБ. Были сформированы 2 группы пациентов: основная, где при проведении брахитерапии (БТ) одномоментно выполняли ТИАБ (БТ+ТИАБ) (n=70), и контрольная, где проводилась только БТ (n=144). Согласно полученным данным, вероятность возникновения метастазов в период 3-летнего наблюдения в обеих группах не имеет статистически значимой разницы (р=0,22 по точному критерию Фишера и p=0,11 по логарифмическому ранговому критерию при оценке выживаемости методом Каплана-Майера), относительный риск (RR) составил 1,43 (95 % доверительный интервал от 0,79 до 2,24). Кроме того, не отмечалось статистически значимой разницы при оценке основных клинических исходов локального лечения, ассоциированных с ухудшением прогноза: степень регрессии опухоли (р=0,46), экстрасклеральный рост, необходимость проведения дополнительной брахитерапии (р=0,32) или вторичной энуклеации (р=0,99). Отсутствие статистически значимой разницы в выживаемости пациентов в группах БТ и БТ+ТИАБ открывает перспективы для более масштабного применения ТИАБ у пациентов с УМ с прогностической целью.
Офтальмоонкология, увеальная меланома, тонкоигольная аспирационная биопсия, прогнозирование, метастазы
Короткий адрес: https://sciup.org/140296518
IDR: 140296518 | DOI: 10.18027/2224-5057-2022-12-2-29-35
Текст научной статьи Оценка риска метастазирования при проведении "прогностической" тонкоигольной аспирационной биопсии увеальной меланомы
Увеальная меланома (УМ) является одним из исключительных случаев в онкологической практике, когда диагноз устанавливается врачом-офтальмологом на основании клинических и инструментальных данных и, как правило, не требует цитологической или гистологической верификации, а проведение биопсии новообразования необходимо только в редких случаях с целью дифференциальной диагностики [1]. Такой подход обусловлен доступностью прямой визуализации опухоли с характерной офтальмоскопической картиной и специфическими данными дополнительных методов диагностики, а также вероятным риском возникновения осложнений, связанных главным образом с системной диссеминацией опухоли при проведении инвазивной диагностики.
Указанные факторы на протяжении длительного времени ограничивали применение биопсии УМ. Эта опухоль характеризуется крайне плохим прогнозом, обусловленным высокой частотой метастазирования и отсутствием эффективных методов лечения метастатической болезни. Пятилетняя выживаемость при УМ составляет около 80%, 10-летняя — 50–70% [2,3]. Несмотря на прогресс в разработке методов лечения первичной опухоли, высокий уровень локального контроля и множество предложенных методов лечения метастазов, показатели выживаемости не изменились за последние 50 лет [4,5].
Понимание особенностей метастазирования УМ принципиально изменилось с началом изучения ее молекулярно-генетических характеристик. Идентификация генетических факторов УМ позволяет не только формировать более точный прогноз для пациента, но и способствовать раннему выявлению метастазов и разработке эффективной адъювантной терапии метастатической болезни [6]. С учетом органосохраняющей направленности в лечении УМ, получение материала для проведения молекулярно-генетического исследования возможно не только при хирургическом удалении опухоли, но и при лучевых методах лечения — в частности, при проведении брахитерапии (БТ) [4]. Среди многообразия методов получения материала опухоли основным является тонкоигольная аспирационная биопсия (ТИАБ).
Несмотря на широкое использование ТИАБ в общемировой офтальмологической практике, до сих пор высказываются сомнения в безопасности этой процедуры. При этом в отечественной литературе анализ таких данных не проводился, а среди зарубежных авторов по этой теме встречаются лишь единичные работы.
МАТЕРИАЛЫ И МЕТОДЫ
Данное ретроспективное исследование проводилось по материалам из медицинского архива «МНТК „Микрохирургия глаза“ им. Федорова» пациентов, пролеченных в период 2013–2019 гг. За указанный срок пациентам с УМ было проведено 636 курсов БТ и 157 ТИАБ с прогностической целью.
Критериями включения в исследование являлись клинически установленный диагноз УМ и проведенная БТ в качестве первичного метода лечения, наличие на момент исследования актуальной информации о пациентах в архиве учреждения (по данным диспансерного наблюдения или, при отсутствии актуальной информации, по заключениям офтальмологов, терапевтов, онкологов или патологоанатомов, полученных через органы здравоохранения по месту жительства). Критериями исключения являлись установленная метастатическая болезнь до проведения локального лечения, УМ высотой менее 3 мм по данным В-сканирования, срок наблюдения менее 6 мес., эндовит-реальные вмешательства в течение всего срока наблюдения, наличие более одного опухолевого очага и билатеральная УМ.
Анализ риска метастазирования проводился по типу «случай-контроль» и по методу Каплана–Майера. Для анализа выживаемости были сформированы 2 группы пациентов: основная, где при проведении брахитерапии (БТ) одномоментно выполняли ТИАБ (БТ+ТИАБ) (n=70), и контрольная, где проводилась только БТ (n=144). За установленный срок наблюдения было выявлено 20 случаев метастазирования.
Офтальмологическая диагностика проводилась по данным остроты зрения (ОЗ), внутриглазного давления (ВГД), биомикроскопии, офтальмоскопии и инструментальных методов диагностики (ультразвукового исследования с определением локализации и размеров очага, а также вторичной отслойки сетчатки, и оптической когерентной томографии (ОКТ). Для выявления возможных метастазов использовались магнитно-резонансная томография (МРТ)
органов брюшной полости и компьютерная томография (КТ) органов грудной клетки.
БТ проводилась по стандартной хирургической технике офтальмоаппликаторами с рутением-106. ТИАБ выполнялась с использованием модифицированных игл диаметром 25–30 G трансвитреальным (92%) или транссклеральным (8%) доступами по описанной ранее технологии [7].
На материале ТИАБ во всех случаях проводились цитологическое исследование с определением клеточного типа опухоли и молекулярно-генетическое исследование методами высокочувствительной мутационно-специфической ПЦР-РВ и флуоресцентной гибридизации in situ (FISH). В зависимости от полученных результатов формировались различные прогностические классы, что более подробно описано в предыдущих работах на эту тему [8–10].
В рамках диспансерного наблюдения проводились общий офтальмологический осмотр (биомикроскопия, офтальмоскопия, измерение ОЗ и ВГД), ультразвуковое исследование, контроль общеклинических обследований по заключению онколога, данным МРТ или УЗИ органов брюшной полости и КТ органов грудной клетки.
Статистическая обработка данных проводилась c использованием программного обеспечения Google Sheets (Google LLC), Microsoft Office Excel 2019 (Microsoft), MedCalc 19.2.6 (MedCalc Software Ltd) и GraphPad Prism 9.2.0 (GraphPad Software, LLC). Для оценки достоверности различий между количественными значениями двух выборок использовался непараметрический U-критерий Манна–Уитни; для сравнения качественных признаков — критерий χ² и критерий Фишера. Безрецидивную выживаемость (выживаемость до выявления метастазов) оценивали методом Каплана–Майера с проверкой значимости различий по логарифмическому ранговому критерию. Статистически достоверная разница между группами отсутствует, если p >0,05.
РЕЗУЛЬТАТЫ
Анализ статистической однородности по основным клиническим параметрам, которые влияют на развитие метастазов (возраст пациентов, высота и протяженность опухоли, юкстапапиллярная локализация, вовлечение цилиарного тела, экстрабульбарный рост), в группах БТ и БТ+ТИАБ указывает на отсутствие статистически значимых различий по всем указанным характеристикам (табл. 1).
Медиана срока наблюдения для группы БТ+ТИАБ составила 32 мес. (среднее — 32 мес., минимум — 10 мес., максимум — 51 мес.), медиана для группы БТ cоставила 65 мес. (среднее — 63, минимум — 8 мес., максимум — 99 мес.). Учитывая различия в сроках наблюдения, обусловленные тем, что лечение группы пациентов БТ+ТИАБ проводилось в период 2016–2019 гг, а пациентов из группы БТ в период 2013–2016 гг, анализ выживаемости проводили только в сроки 1, 2 и 3 лет.
Клинические данные по динамическому наблюдению за опухолью и необходимости дополнительного лечения
Таблица 1. Исходные клинические характеристики
|
Показатель (среднее, σ, значения min и max) |
БТ+ТИАБ (n=70) |
БТ (n=144) |
p |
|
|
Возраст (минимальный и максимальный), лет |
54±14 (10–81) |
57±13 (26–83) |
0,09 * |
|
|
Пол, % мужчин и женщин |
27/73 |
39/61 |
0,08 ** |
|
|
Вовлечение цилиарного тела |
6 (9%) |
8 (6%) |
0,39 * |
|
|
Юкстапапиллярная локализация |
14 (20%) |
21 (15%) |
0,38 ** |
|
|
Экстрасклеральный рост |
1 |
1 |
1,0 *** |
|
|
Высота опухоли, мм |
5,3±1,7 (3,0–9,3) |
5,3±1,8 (3,0–9,7) |
0,89 * |
|
|
Размер основания по наибольшему значению, мм |
12,0±2,3 (7,5–16,0) |
12,0±2,9 (7,3–18,5) |
0,66 * |
|
|
Средняя поглощенная доза, Гр |
на вершину |
138±16 |
150±17 |
1,0 * |
|
на основание |
1139±485 |
1143±541 |
0,78 * |
|
* — уровень значимости оценивался по критерию Манна – Уитни;
** — по критерию χ2;
*** — по точному двустороннему критерию Фишера.
у пациентов, которым проводилась БТ или БТ+ТИАБ, представлены в табл. 2. В данный анализ были включены особенности локального лечения, влияющие на вероятность метастазирования УМ: экстрасклеральный рост, необходимость дополнительного лечения, вторичная энуклеация [11]. Анализ локальных осложнений, не влияющих на прогноз выживаемости, в данной работе не проводился.
За указанный срок наблюдения было выявлено 20 случаев метастазирования (в печени — в 17 случаях, в легких — в 2 случаях, множественные метастазы — в 1 случае), что составило группу «случаи»; группа «контроль» была представлена пациентами без метастазов (n=194). В группе пациентов, которым проводилась БТ+ТИАБ (n=70), число таких случаев насчитывало 9, в группе БТ (n=144) — 11. Таким образом, относительный риск (relative risk, RR) соста-
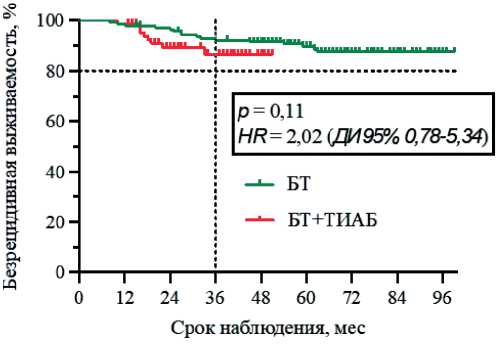
Рисунок 1. Безрецидивная выживаемость пациентов с УМ в группах БТ и БТ+ТИАБ по методу Каплана–Майера (анализ выживаемости проводился в срок 36 мес.).
Таблица 2. Итоговые клинические характеристики
|
Показатель (среднее, σ, значения min и max) |
БТ+ТИАБ (n=70) |
БТ (n=144) |
p |
|
Высота опухоли после лечения, мм |
2,4±1,2 |
2,3±1,3 |
0,65 * |
|
Степень регрессии, % |
54±19 |
56±18 |
0,46 * |
|
Экстрасклеральный рост |
0 |
0 |
– |
|
Дополнительное лечение (БТ), % |
4 (6%) |
16 (11%) |
0,32 *** |
|
Вторичная энуклеация, % |
3 (4%) |
8 (6%) |
0,99 *** |
* — уровень значимости оценивался по критерию Манна – Уитни;
** — по критерию χ2;
*** — по точному двустороннему критерию Фишера.
вил 1,43 (95% доверительный интервал от 0,79 до 2,24), p = 0,22 (точный критерий Фишера).
Безрецидивную выживаемость оценивали по методу Каплана–Майера (рис. 1). Однолетняя безрецидивная выживаемость составила 97% в обеих группах, 2-летняя — 96% и 88% в группах БТ и БТ+ТИАБ, соответственно, 3-летняя — 92% и 85%, соответственно. Статистически значимая разница в выживаемости между группами отсутствовала в период 3-летнего наблюдения (p=0,11; HR 2,02 (ДИ95% 0,78–5,34)).
ОБСУЖДЕНИЕ
Механическое повреждение опухолевых сосудов при проведении биопсии связано с теоретическим увеличением риска метастазирования первичного очага [12]. В общей онкологической практике ТИАБ используется для диагностики новообразований практически любой локализации, при этом риск диссеминации опухоли в результате этой процедуры считается минимальным [1]. В то же время биопсия меланомы, как кожи, так и сосудистой оболочки глаза, на протяжении длительного времени рассматривалась как потенциально опасная процедура ввиду высокого метастатического потенциала этих опухолей. В случае кожной меланомы смена парадигмы произошла благодаря результатам крупных исследований, в которых было показано отсутствие различий в выживаемости при различных типах биопсии (эксцизионной или инцизионной, [13,14]).
Первые упоминания о ТИАБ злокачественных внутриглазных новообразований относятся к 1950 м годам, однако в то время подобные процедуры имели исключительно диагностический характер [15]. В реальной клинической практике для подтверждения диагноза УМ биопсия требуется крайне редко [16]. По данным Collaborative Ocular Melanoma Study, более 99% энуклеированных по поводу УМ глаз впоследствии получали подтверждение диагноза по данным гистологического исследования, что указывает на высокую чувствительность и специфичность неинвазивной диагностики [17]. Прогнозирование риска метастазирования УМ длительное время осуществлялось только на материале энуклеа-
Собственные исследования ции, однако в связи с выраженной органосохраняющей тенденцией в лечении этого заболевания, потребовалась разработка соответствующих технологий биопсии УМ, позволяющих получить материал опухоли при сохранении глаза [18].
Одним из первых крупных исследований, в которых ТИАБ проводилась с прогностической целью, стала работа Char D. H. et al., где аспирационный материал служил основой для определения клеточного типа УМ [15]. Что более важно, в этой работе авторы впервые провели анализ выживаемости пациентов, которым проводилась БТ с ТИАБ (в 90% случаев транссклераль-но), в сравнении с пациентами, которым проводилась только БТ при среднем сроке наблюдения 4 года. После стандартизации по возрасту, размерам и локализации опухоли относительный риск (RR, relative risk) составил 0,988±0,255, что свидетельствовало об отсутствии влияния ТИАБ на возникновение метастазов УМ. В более поздней работе McCannel et al. сравнили выживаемость пациентов с УМ «средних» размеров (высота 3–8 мм), которым была проведена БТ и транссклеральная ТИАБ на базе их учреждения (Калифорнийский университет), с 5-летней выживаемостью пациентов с опухолями аналогичных размеров по результатам исследования
COMS при среднем сроке наблюдения в 31,7±15,0 мес в изучаемой когорте — выживаемость составила 14% и 13%, соответственно [19,20]. К недостаткам данной работы стоит отнести сравнение двух когорт пациентов из разных исследований. Наиболее актуальное исследование системной безопасности было проведено авторами из Дании с самой крупной выборкой в 1637 пациентов [12]. Согласно полученным данным, не было обнаружено статистически значимого увеличения отношения рисков (hazard ratio, HR) при анализе общей смертности (HR 1,07, ДИ 95% 0,89–1,26, p=0,47) и специфической смертности (HR 1,11, ДИ 95% 0,89–1,39, p=0,35).
По данным нашего исследования, вероятность возникновения метастазов в обеих группах не имеет статистически значимой разницы при оценке по точному критерию Фишера (p=0,22), показатель RR составил 1,43 (95 % доверительный интервал от 0,79 до 2,24) при максимальном сроке наблюдения в 36 мес. Анализ выживаемости по Каплану–Майеру в период 3 лет также продемонстрировал отсутствие статистически значимой разницы в выживаемости двух групп пациентов (p=0,11; HR = 2,02 (ДИ 95%, 0,78–5,34)). Полученные результаты согласуются с данными зарубежной литературы (рис. 2). Трехлетний срок наблюдения является критически важ-
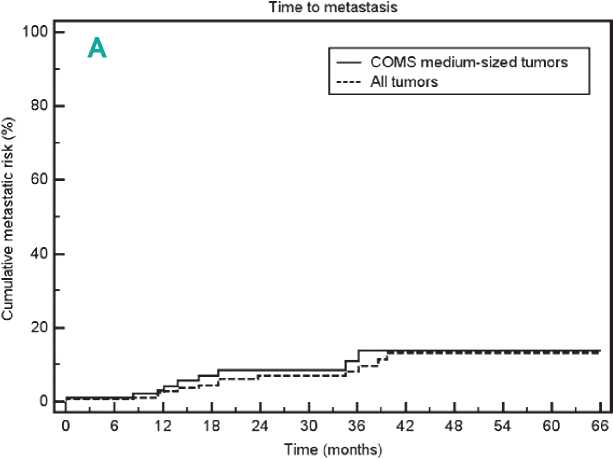
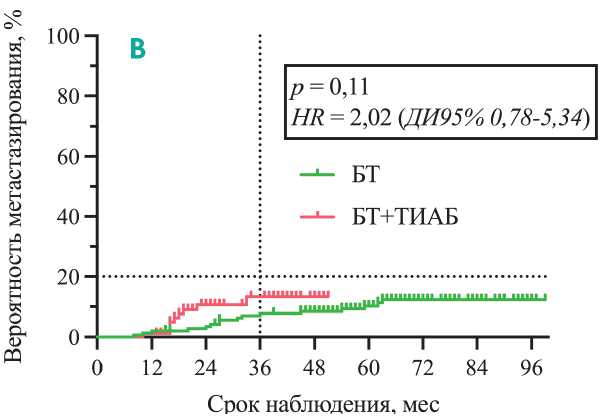
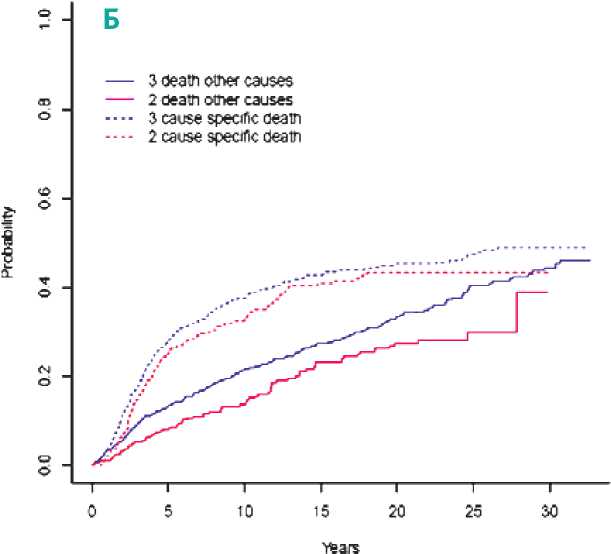
Рисунок 2. Метастазирование УМ по данным различных исследований: (А) сравнение метастазирования УМ по данным McCannel et al. и COMS №14; (Б) Bagger et al. (оранжевая пунктирная линия — специфическая смертность пациентов с биопсией УМ, синяя пунктирная — без биопсии); (В) собственные данные.
ным для оценки риска метастазирования, пик которого приходится именно на этот период [2,4].
Стоит отметить, что в группе БТ+ТИАБ по результатам молекулярно-генетического исследования пациентам с плохим прогнозом был рекомендован более частый режим мониторинга метастатической болезни посредством контрольных МРТ органов брюшной полости и КТ органов грудной клетки, что могло повлиять на более ранние сроки выявления метастазов в этой группе в сравнении с группой БТ. В то же время на протяжении первого года наблюдения в обеих группах отмечались лишь единичные случаи метастазирования, частоту которых, однако, можно было бы ожидать на более высоком уровне в том случае, если бы ТИАБ увеличивала риски диссеминации опухоли. Кроме того, пациенты, получившие дополнительную консультацию по прогнозу заболевания, вероятно, могут иметь более настороженное отношение к своему здоровью и чаще быть склонными следовать корректному протоколу мониторинга, что также могло повлиять на более частое выявление метастазов у этой группы пациентов.
Понимание процессов роста первичной опухоли и метастазов позволяет оптимизировать лечение и последующий мониторинг онкологических заболеваний. В качестве одного из базовых показателей для оценки этих процессов используется время удвоения опухоли. При изучении времени удвоения УМ у пациентов с метастатической болезнью, авторы пришли к выводу, что большинство микрометастазов возникают в течение 5 лет еще до обнаружения первичного очага и проведения соответствующего лечения [21]. Это объясняет случаи выявления метастазов в ближайшие сроки (до 6 мес.) вне зависимости от проведенного первичного локального лечения — в комбинации с ТИАБ или без.
Продолженный рост опухоли и экстрасклеральный рост являются важными факторами, влияющими на вероятность метастазирования УМ [11]. Анализ частоты этих осложнений и итоговой степени регрессии опухоли являются важными составляющими в оценке риска метастазирования. По нашим данным, статистически значимая разница в динамике регрессии опухоли между группами с биопсией и без нее отсутствовала (p=0,46). Аналогичные данные в мировой литературе не представлены. Также отсутствовала статистически значимая разница в необходимости вторичной энуклеации между двумя группами (4–6%, p=0,99), что соотносится с данными крупнейшего исследования из Дании, где вторичная энуклеация потребовалась в 7% [12]. Ни в одной группе не были зафиксированы случаи экстрасклерального роста опухоли, что также согласуется с данными крупнейших исследований ТИАБ УМ [12,19].
Ограничениями данного исследования являются его ретроспективный и нерандомизированный характер, различные сроки наблюдения в группах сравнения, обусловленные тем, что лечение этих пациентов проводилось в разные временные периоды, а также затруднительной оценкой статистической мощности проведенного исследования. Большинство ограничений связаны со сравнительно небольшим объемом выборки, обусловленным редкостью патологии (встречается примерно в 6–8 случаях на миллион среди европеоидной расы) и невозможностью в настоящее время проведения молекулярно-генетического тестирования, которое является непосредственной целью ТИАБ, в счет бюджетных средств, а также тем фактом, что не каждый пациент имеет потребность в таком исследовании. Представленные данные являются первой оценкой выживаемости пациентов, которым проводилась ТИАБ в отечественной практике.
ЗАКЛЮЧЕНИЕ
Проведение «прогностической» тонкоигольной аспирационной биопсии при брахитерапии не связано со статистически значимым увеличением риска метастазирования увеальной меланомы (p=0,22 по критерию Фишера и p=0,11 по логарифмическому ранговому критерию при оценке выживаемости методом Каплана–Майера) и влиянием на основные клинические исходы локального лечения, ассоциированные с ухудшением прогноза: степень регрессии опухоли (p=0,46), экстрасклеральный рост, необходимость проведения дополнительной брахитерапии (p=0,32) или вторичной энуклеации (p=0,99).
Отсутствие статистически значимой разницы в выживаемости пациентов в группах БТ и БТ+ТИАБ открывает перспективы для более масштабного применения ТИАБ у пациентов с УМ с прогностической целью.
Список литературы Оценка риска метастазирования при проведении "прогностической" тонкоигольной аспирационной биопсии увеальной меланомы
- Midena E., Parrozzani R. Biopsies in Uveal Melanoma // Current Concepts in Uveal Melanoma. 2011. P. 81-95.
- Kaliki S., Shields C., Shields J. Uveal melanoma: Estimating prognosis // Indian Journal of Ophthalmology. 2015. Vol. 63, № 2. P. 93.
- Radivoyevitch T., Zabor E. C., Singh A. D. Uveal melanoma: Long-term survival // PLOS ONE. 2021. Vol. 16, № 5. P. e0250939.
- Singh A. D., Turell M. E., Topham A. K. Uveal Melanoma: Trends in Incidence, Treatment, and Survival // Ophthalmology. 2011. Vol. 118, № 9. P. 1881-1885.
- Саакян С. В., Ширина Т. В. Анализ метастазирования и выживаемости больных увеальной меланомой // Опухоли головы и шеи. 2012. № 2.
- Яровая В. А. и др. Прогностическое значение клеточного типа увеальной меланомы // Архив патологии. 2021. Вып. 83, № 4. С. 14.
- Яровой А. А. и др. Тонкостенная игла для биопсии внутриглазных новообразований и способ выбора угла среза рабочего конца иглы: Патент №2020109301. 2020.
- Яровая В. А. и др. Молекулярное тестирование увеальной меланомы. Находки // Современные технологии в офтальмологии. 2018. № 4. С. 297-299.
- Van den Bosch T. et al. Higher Percentage of FISH-Determined Monosomy 3 and 8q Amplification in Uveal Melanoma Cells relate to Poor Patient Prognosis // Investigative Opthalmology & Visual Science. 2012. Vol. 53, № 6. P. 2668.
- Martin M, Maßhöfer L, Temming P et al. Exome sequencing identifies recurrent somatic mutations in EIF1AX and SF3B1 in uveal melanoma with disomy 3. // Nat Genet. 2013. Vol. 45, № 8. P. 933-936.
- Gallie B. L. et al. Local Recurrence Significantly Increases the Risk of Metastatic Uveal Melanoma // Ophthalmology. 2016. Vol. 123, № 1. P. 86-91.
- Bagger M. M. Intraocular biopsy of uveal melanoma Risk assessment and identification of genetic prognostic markers // Acta Ophthalmologica. 2018. Vol. 96. P. 1-28.
- Martin R. C. G. et al. Is incisional biopsy of melanoma harmful? // The American Journal of Surgery. 2005. Vol. 190, № 6. P. 927-932.
- Molenkamp B. G. et al. Non-Radical Diagnostic Biopsies Do Not Negatively Influence Melanoma Patient Survival // Annals of Surgical Oncology. 2007. Vol. 14, № 4. P. 1424-1430.
- Char D. H. et al. Irradiated Uveal Melanomas: Cytopathologic Correlation With Prognosis // American Journal of Ophthalmology. 1996. Vol. 122, № 4. P. 509-513.
- Chattopadhyay C. et al. Uveal melanoma: From diagnosis to treatment and the science in between // Cancer. 2016. Vol. 122, № 15. P. 2299-2312.
- Accuracy of Diagnosis of Choroidal Melanomas in the Collaborative Ocular Melanoma Study // Archives of Ophthalmology. 1990. Vol. 108, № 9. P. 1268.
- Frizziero L. et al. Uveal Melanoma Biopsy: A Review // Cancers. 2019. Vol. 11, № 8. P. 1075.
- McCannel T. A., Chang M. Y., Burgess B. L. Multi-Year Follow-up of Fine-Needle Aspiration Biopsy in Choroidal Melanoma // Ophthalmology. 2012. Vol. 119, № 3. P. 606-610.
- Development of Metastatic Disease After Enrollment in the COMS Trials for Treatment of Choroidal Melanoma // Archives of Ophthalmology. 2005. Vol. 123, № 12. P. 1639.
- Eskelin S. Tumor doubling times in metastatic malignant melanoma of the uvea Tumor progression before and after treatment // Ophthalmology. 2000. Vol. 107, № 8. P. 1443-1449.


