Оценка риска развития остеоартроза коленного сустава при протезировании голени (пилотное экспериментально-морфологическое исследование)
Автор: Ступина Татьяна Анатольевна, Еманов Андрей Александрович, Кузнецов Виктор Павлович, Овчинников Евгений Николаевич
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 6 т.27, 2021 года.
Бесплатный доступ
Цель. Получение предварительных данных о риске развития остеоартроза коленного сустава при протезировании голени собак в постоперационном периоде после одноэтапной остеоинтеграции в условиях внешней фиксации и компрессионного нагружения. Материалы и методы. Исследование выполнено на 5 интактных (контрольная группа) и 3 экспериментальных (опытная группа) животных в возрасте 1,8 ± 0,5 года с массой тела 19 ± 1,2 кг. Производили остеотомию большеберцовой кости на границе верхней и средней трети и забивали имплантат типа PressFit. Фиксация кости и компрессионная нагрузка на кость осуществлялась специальным устройством и составляла FН = 20 Н. Гистоморфометрическое исследование выполнено по парафиновым срезам суставного хряща с подлежащей субхондральной костью. Результаты. У всех опытных животных сохранено зональное строение суставного хряща и цитоархитектоника, деструктивные изменения не значительны и проявлялись нарушением гомогенности межклеточного вещества верхней трети поверхностной зоны. Зарегистрировано снижение толщины кальцифицированного хряща в 2 раза и толщины субхондральной костной пластинки в 1,9 раза. Объемная плотность трабекул в субхондральной зоне снижалась до 22,31 ± 5,41% (в контроле - 46,94 ± 1,94%). В одном наблюдении отмечены участки, в которых полностью отсутствовали зона кальцифицированного хряща и субхондральная костная пластинка, сосуды и костномозговой паннус инвазировали некальцифицированный хрящ. Заключение. При экспериментальном протезировании голени у собак выявленные в коленном суставе структурные изменения зоны контакта суставного хряща и субхондральной кости свидетельствуют о риске развития остеоартроза.
Эксперимент, протезирование голени, коленный сустав, суставной хрящ, субхондральная кость, гистоморфометрия
Короткий адрес: https://sciup.org/142231577
IDR: 142231577 | УДК: 616.718.5/.6-089.844-77:616.72-018.3-076]-092.9 | DOI: 10.18019/1028-4427-2021-27-6-795-799
Текст научной статьи Оценка риска развития остеоартроза коленного сустава при протезировании голени (пилотное экспериментально-морфологическое исследование)
Изменение механической нагрузки является индуцирующим фактором в развитии патологических процессов в суставном хряще и субхондральной кости. Это может быть проблемой после односторонней травматической ампутации нижней конечности, когда поврежденная конечность испытывает пониженные, а неповрежденная конечность, наоборот, повышенные нагрузки [1, 2, 3].
По данным работ ряда авторов, распространенность остеоартроза контралатерального коленного сустава выше в группе с ампутацией нижней конечности по сравнению с контрольной группой [4, 5].
У пациентов с ампутацией конечности ниже колена отмечают высокий риск сгибательных контрактур коленного сустава. Пролонгированное ограничение движений в суставе влечет уменьшение массы хрящей [6, 7, 8].
Остеоартроз прогрессирует до стадии, когда операция по замене сустава может быть единственным вариантом для облегчения боли и улучшения функции и качества жизни. Однако эндопротезирование сустава может быть невозможным вариантом для пациентов с ампутацией нижней конечности.
Субхондральная кость играет решающую роль в патогенезе остеоартроза [9, 10, 11]. Известно, что механическое напряжение влияет на контуры и форму субхондральной кости [12, 13, 14]. Среди анатомофункциональных особенностей постампутационных культей нижней конечности у взрослых пациентов отмечают контрактуры и формирование деформирующего артроза в вышерасположенных суставах [15].
Однако в одной из работ [16] установлено, что при использовании протезов у молодых людей с транстиби-альной ампутацией практически нет биомеханических факторов риска развития остеоартроза коленного сустава.
Фундаментальные исследования компонентов сустава в условиях восстановления функций ампутированных конечностей имеют важное значение для разработки методов функциональной реабилитации пациентов.
В настоящее время наблюдается значительный рост операций по восстановлению функций ампутированных нижних конечностей с применением технологий остеоинтеграции [17, 18, 19, 20].
Следует отметить, что до настоящего времени не было исследований влияния остеоинтеграции имплантата при восстановлении функции ампутированной нижней конечности на состояние коленного сустава.
Цель данного пилотного исследования – получение предварительных данных о риске развития остеоартроза коленного сустава при протезировании голени собак в постоперационном периоде после одноэтапной остеоинтеграции в условиях внешней фиксации и компрессионного нагружения.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование выполнено на восьми беспородных собаках – 5-ти интактных (контрольная группа) и 3-х экспериментальных (опытная группа) в возрасте 1,8 ± 0,5 года с массой тела 19 ± 1,2 кг. Оперативное вмешательство собакам осуществляли под общим наркозом. Производили остеотомию большеберцовой кости на границе верхней и средней трети, также удаляли малоберцовую кость на этом же уровне. После чего рассверливали канал до диаметра 7 мм и забивали с помощью молотка короткими ударами имплантат типа PressFit (Патент РФ № 194912) [21] диаметром 7,5 мм, изготовленный методом селективного лазерного сплавления из порошка сплава Ti6Al4V на установке EOSINT M280. Затем производили иссечение мягких тканей на уровне скакательного сустава. В сформированном кожном лоскуте делали отверстие для выхода наружной части имплантата и моделировали культю. Мягкие ткани послойно ушили.
Фиксация имплантата и компрессионная нагрузка на кость осуществлялась специальным устройством (Патент РФ № 185647) [21], которое реализовано на базе конструктивных элементов аппарата Илизарова (рис. 1, а). Компрессионная нагрузка Fн = 20 Н задавалась на основе ранее проведенных исследований остеоинтеграции имплантата в бедренной кости кроликов [22] с перерасчетом на основе подобия масс в течение первых 42 дней после операции, после чего на срок 4 месяца устанавливался протез.
Имплантат типа PressFit (рис. 1, б) имеет заходную ступенчатую часть А с режущими зубьями Б, диаметр которых увеличивается к кольцу головки В. Режущая часть зуба обеспечивает требуемый размер отверстия в кости для калибрующей части и первичную осевую фиксацию имплантата.
К имплантату прикрепляли протез и проводили перекресты спиц, которые фиксировали в устройстве фиксации и компрессионного нагружения. Демонтаж устройства осуществляли через 6 недель. Животных выводили из опыта через 6 месяцев эксперимента.
Исследование на животных проведено согласно Европейской Конвенции по защите позвоночных животных, Директиве 2010/63/EU Европейского парламента и Совета Европейского союза по охране животных, используемых в научных целях, и СП 2.2.1.3218-14; ГОСТу 33217-2014; ГОСТу 33215-2014, одобрено внутриучрежденческим этическим комитетом (протокол № 2 (57) от 17.05.18 г.).
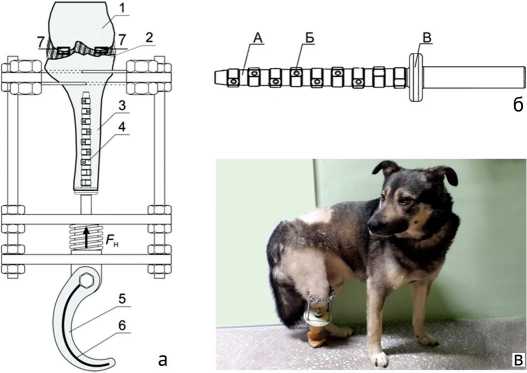
Рис. 1. Устройство для остеоинтеграции имплантата в культю большеберцовой кости (а): 1 – бедренная кость; 2 – субхондральная кость; 3 – большеберцовая кость; 4 – имплантат типа PressFit; 4 – устройство фиксации и компрессионного нагружения; 5 – силиконовый протез; 6 – пружина жесткости, 7 – исследованные участки суставного хряща с подлежащей субхондральной костью; конструкция имплантата (б) и внешний вид экспериментального животного (в)
Для патоморфологического исследования вскрывали коленный сустав, скальпелем с мыщелков бедра срезали суставной хрящ вместе с подлежащей субхондральной костью. Костно-хрящевые блоки фиксировали в формалине, декальцинировали в смеси муравьиной и соляной кислот, обезвоживали в спиртах, заливали в парафин и изготавливали парафиновые срезы (методы окраски: гематоксилин и эозин; трехцветный метод по Массону). Светооптическое исследование, оцифровку и морфометрию производили с помощью микроскопа «AxioScope.A1» с цифровой камерой «AxioCam» и программным обеспечением «Zenblue» (Carl Zeiss MicroImagingGmbH, Германия). Измеряли толщину (мкм, M ± m) некалицифицирован-ного (huncal.cr), кальцифицированного (hcal.cr) хряща, субхондральной костной пластики (hsubch.b.pl). Рассчитывали объемную плотность костных трабекул в субхондральной зоне (%, M ± m). Анализ данных проводили с помощью описательной статистики. Использовали непараметрический критерий Вилкоксона, достоверными считали различия при р < 0,05 (программа AtteStat, версия 9.3.1).
РЕЗУЛЬТАТЫ
В послеоперационном периоде в устройстве фиксации и компрессионного нагружения животные приступали на конечность. После снятия устройства и установки протеза функция оперированной конечности постепенно восстанавливалась. К четвертому месяцу эксперимента отмечалась хромота опирающейся конечности.
У всех опытных животных сохранено зональное строение суставного хряща и цитоархитектоника (рис. 2, а). В верхних слоях поверхностной зоны визуализировались коллагеновые волокна (рис. 2, б), что указывало на снижение в матриксе гликозаминогликанов, обеспечивающих гомогенность межклеточного вещества. Хондроциты с признаками деструкции немногочисленны и наблюдались во всех зонах хряща. Изогенные группы единичны, чаще отмечены в глубокой зоне. В большей части наблюдений базофильная линия, разделяющая некальцифицированный и кальцифицированный хрящ, хорошо визуализировалась, непрерывна на всем протяжении. Зона кальцифициро- ванного хряща неравномерной толщины, истончена. Выявлены участки, в которых отсутствовала зона кальцифицированного хряща, базофильная линия граничила с субхондральной костной пластинкой (рис. 2, в). Субхондральная костная пластинка неравномерна на всем протяжении, истончена, в отдельных участках полностью отсутствовала. В таких участках зона кальцифицированного хряща контактировала с костным мозгом. В субхондральной губчатой кости наблюдали разреженное расположение костных трабекул, ориентация нарушена, отсутствовало параллельное расположение трабекул, в межтрабекуллярных пространствах преобладал жировой костный мозг (рис. 2, а).
В одном наблюдении из трех отмечены участки, в которых полностью отсутствовали зона кальцифицированного хряща и субхондральная костная пластинка. В некальцифицированный хрящ со стороны субхондральной кости проникали сосуды и костномозговой паннус (рис. 2, г). Признаков воспаления и воспалительного инфильтрата не выявлено.

Рис. 2. Суставной хрящ мыщелка бедра. Срок эксперимента 180 суток: а – общий вид; б – демаскировка коллагеновых волокон в поверхностной зоне хряща; в – зона контакта некальцифицированного суставного хряща (НКХ) и субхондральной кости, в центре участок, где отсутствует зона кальцифицированного хряща (КХ), субхондральная костная пластинка (СбКП) истончена, нарушена архитектоника субхондральной губчатой кости (СбГК); г – базофильная линия не визуализируется, пенетрация сосудов в глубокую зону некальцифицированного хряща. Окраска трехцветным методом по Массону (а, в), гематоксилином и эозином (б, г). Увеличение 100× (а), 400× (б, в, г)
Зарегистрировано достоверное снижение всех параметров (табл. 1). Наиболее снижены параметры – толщина кальцифицированного хряща (в 2 раза) и толщина субхондральной костной пластинки (в 1,9 раза). Объемная плотность трабекул в субхондральной зоне снижалась (р = 0,0026) до 22,31 ± 5,41% относительно контроля – 46,94 ± 1,94%.
Таблица 1
Толщина хряща и субхондральной кости в опыте и контроле (мкм, M ± m)
|
Параметры |
Опытная группа |
Контрольная группа |
|
h uncal.cr |
382,46 ± 13,65 (р = 0,00657) |
475,53 ± 4,27 |
|
h cal.cr |
40,72 ± 3,84 (р = 0,00499) |
87,89 ± 3,37 |
|
h subch.b.pl |
52,68 ± 10,04 (р = 0,00507) |
102,42 ± 2,81 |
ОБСУЖДЕНИЕ
Светооптическое исследование гистологических препаратов показало сохранность зонального строения и цитоархитектоники хряща, суставная поверхность не разволокнена. Гистоморфометрический анализ позволил выявить структурные изменения в зоне контакта суставного хряща с субхондральной костью.
Суставной хрящ и субхондральная кость – это динамические структуры, несущие нагрузку и дополняющие друг друга при функционировании сустава. Изменения структуры каждой из зон будут влиять на свойства и функции костно-хрящевого соединения [11, 23]. Субхондральная кость выполняет важные амортизирующие, поддерживающие функции и питание суставного хряща. Понятие «субхондральная кость» включает два отдельных объекта: субхондральную костную пластинку и субхондральную губчатую кость [12, 24].
В проведенном эксперименте наблюдали выраженное истончение зоны кальцифицированного хряща, субхондральной костной пластинки, нарушение архитектоники и редкое расположение трабекул в субхондральной губчатой кости, снижение объемной плотности трабекул в 2,1 раза. В одном наблюдении отмечено проникновение сосудов и костномозгового паннуса в некальцифицированный хрящ.
Изменения структуры субходральной кости отражаются на ее механической прочности, в цикле костно- го ремоделирования доминируют процессы резорбции, впоследствии это ведет к нарушению непрерывности базофильной линии, проникновению сосудов в некаль-цифицированный хрящ со стороны субхондральной кости [10, 11]. Проникновение сосудистых элементов в кальцинированный хрящ в местах образования микротрещин и трещин костно-хрящевого соединения инициируют процессы деструкции и кальцификации не-кальцифицированного хряща [25].
Среди анатомо-функциональных особенностей постампутационных культей нижней конечности у взрослых пациентов отмечают контрактуры и формирование деформирующего артроза в вышерасположенных суставах [26].
Полученные в данном исследовании результаты указывают на то, что выявленные изменения структуры субхондральной костной пластинки и субхондральной губчатой кости, возможно, являются инициирующими факторами дальнейшей деструкции суставного хряща.
Исследование носило пилотный характер. Ограничение выполненного исследования – относительно малая выборка (три опытных собаки), однако выявленная нами тенденция к истончению зоны кальцифицированного хряща и субхондральной костной пластинки согласуется с данными о роли субхондральной кости в патогенезе деструкции суставного хряща [27, 28, 29, 30].
ЗАКЛЮЧЕНИЕ
В данном пилотном исследовании при экспериментальном протезировании голени у собак выявленные в коленном суставе структурные изменения зоны контакта суставного хряща и субхондральной кости свидетельствуют о риске развития остеоартроза.
Полученные предварительные данные о структурных изменениях зоны контакта суставного хряща и субхондральной кости важны для планирования дальнейших этапов исследования на большей выборке животных.
Список литературы Оценка риска развития остеоартроза коленного сустава при протезировании голени (пилотное экспериментально-морфологическое исследование)
- А Narrative Review of the Prevalence and Risk Factors Associated With Development of Knee Osteoarthritis After Traumatic Unilateral Lower Limb Amputation / S. Farrokhi, B. Mazzone, A. Yoder, K. Grant, M.A. Wyatt // Mil. Med. 2016. Vol. 181, No S4. Р. 38-44. DOI: 10.7205/ MILMED-D-15-00510.
- Смирнова Л.М. Биомеханические показатели перегрузки сохранной конечности у пациентов с ампутацией голени, бедра или вычленением в тазобедренном суставе // Гений ортопедии. 2018. Т 24, № 1. С. 50-56. DOI: 10.18019/1028-4427-2018-24-1-50-56
- Knee joint biomechanics in transtibial amputees in gait, cycling, and elliptical training / G. Orekhov, A.M. Robinson, S.J. Hazelwood, S.M. Klisch // PLoS One. 2019. Vol. 14, No 12. P. e0226060. DOI: 10.1371/journal.pone.0226060.
- Melzer I., Yekutiel M., Sukenik S. Comparative study of osteoarthritis of the contralateral knee joint of male amputees who do and do not play volleyball // I. Rheumatol. 2001. Vol. 28, No 1. P. 169-172.
- Pröbsting E., Blumentritt S., Kannenberg A. Veränderungen am Bewegungsapparat als Folge von Amputationen an der unteren Extremität // Z. Orthop. Unfall. 2017. Vol. 155, No 1. P. 77-91. DOI: 10.1055/s-0042-112821.
- Neogi T. The epidemiology and impact of pain in osteoarthritis // Osteoarthritis Cartilage. 2013. Vol. 21, No 9. P. 1145-1153. DOI:10.1016/j. joca.2013.03.018.
- Relief of knee flexion contracture and gait improvement following adaptive training for an assist device in a transtibial amputee: A case study / S.B. Kim, C.Y. Ko, J. Son, S. Kang, J. Ryu, M. Mun // J. Back Musculoskelet. Rehabil. 2017. Vol. 30, No 2. P. 371-381. DOI: 10.3233/BMR-160736.
- Awareness, potential factors, and post-amputation care of stump flexion contractures among transtibial amputees / M.F. Ghazali, N.A. Abd Razak, N.A. Abu Osman, H. Gholizadeh // Turk. J. Phys. Med. Rehabil. 2018. Vol. 64, No 3. P. 268-276. DOI: 10.5606/tftrd.2018.1668.
- Макушин В.Д., Ступина Т.А. К вопросу об активизации процессов, регулирующих восстановление структуры суставного хряща (обзор литературы и собственные данные) // Гений ортопедии. 2014. № 1. С. 82-88.
- Stupina T.A., Stepanov M.A., Teplen'kii M.P. Role of subchondral bone in the restoration of articular cartilage // Bull. Exp. Biol. Med. 2015. Vol. 158, No 6. P. 820-823. DOI: 10.1007/s10517-015-2870-4.
- Subchondral bone in osteoarthritis: insight into risk factors and microstructural changes / G. Li, J. Yin, J. Gao, T.S. Cheng, NJ. Pavlos, C. Zhang, M.H. Zheng // Arthritis Res. Ther. 2013. Vol. 15, No 6. P. 223. DOI: 10.1186/ar4405.
- Goldring S.R. Alterations in periarticular bone and cross talk between subchondral bone and articular cartilage in osteoarthritis // Ther. Adv. Musculoskelet. Dis. 2012. Vol. 4, No 4. P. 249-258. DOI: 10.1177/1759720X12437353.
- Elevated cross-talk between subchondral bone and cartilage in osteoarthritic joints / J. Pan, B. Wang, W. Li, X. Zhou, T. Scherr, Y. Yang, C. Price, L. Wang // Bone. 2012. Vol. 51, No 2. P. 212-217. DOI: 10.1016/j.bone.2011.11.030.
- Subchondral bone changes and the impacts on joint pain and articular cartilage degeneration in osteoarthritis / D. Yu, J. Xu, F. Liu, X. Wang, Y. Mao, Z. Zhu // Clin. Exp. Rheumatol. 2016. Vol. 34, No 5. P. 929-934.
- Ранняя протезно-ортопедическая помощь как основа медицинской реабилитации детей с врождёнными и ампутационными дефектами нижних конечностей / В.Г. Сусляев, К.К. Щербина, Л.М. Смирнова, Ю.И. Замилацкий, А.А. Кольцов, А.В. Сокуров, Т.В. Ермоленко // Гений ортопедии. 2020. Т. 26, № 2. С. 198-205. DOI: 10.18019/1028-4427-2020-26-2-198-205.
- Russel Esposito E., Wilken J.M. Biomechanical risk factors for knee osteoarthritis when using passive and powered ankle-foot prostheses // Clin. Biomech. (Bristol, Avon). 2014. Vol. 29, No 10. P. 1186-1192. DOI: 10.1016/j.clinbiomech.2014.09.005.
- Osseointegrated reconstruction and rehabilitation of transtibial amputees: the Osseointegration Group of Australia surgical technique and protocol for a prospective cohort study / R. Haque, S. Al Jawazneh, J. Hoellwarth, M.A. Akhtar, K. Doshi, Y.C. Tan, W.Y. Lu, C. Roberts, М. Al Muderis // BMJ Open. 2020. Vol. 10, No 10. P. e038346. DOI: 10.1136/bmjopen-2020-038346.
- Estimated forces and moments experienced by osseointegrated endoprostheses for lower extremity amputees / C.E. Taylor, Y. Zhang, Y. Qiu, H.B. Henninger, K.B. Foreman, K.N. Bachus // Gait Posture. 2020. Vol. 80. P. 49-55. DOI: 10.1016/j.gaitpost.2020.05.018.
- Li Y., Bránemark R. Osseointegrated prostheses for rehabilitation following amputation: The pioneering Swedish model // Unfallchirurg. 2017. Vol. 120, No 4. P. 285-292. DOI: 10.1007/s00113-017-0331-4.
- Orthopaedic osseointegration: Implantology and future directions / A.L. Overmann, C. Aparicio, J.T. Richards, I. Mutreja, N.G. Fischer, S.M. Wade, B.K. Potter, T.A. Davis, J.E. Bechtold, J.A. Forsberg, D. Dey // J. Orthop. Res. 2020. Vol. 38, No 7. P. 1445-1454. DOI: 10.1002/jor.24576.
- Пат. 185647 Российская Федерация, МПК A61F 2/78, A61F 2/28. Устройство для остеоинтеграции имплантата в кость культи нижней конечности / Кузнецов В.П., Губин А.В., Горгоц В.Г., Аникеев А.В., Борзунов Д.Ю., Еманов А.А. ; заявитель и патентообладатель: ООО «Предприятие «Сенсор», ФГБУ «РНЦ «ВТО» им. акад. Г.А. Илизарова. № ; заявл. 26.06.2018 ; опубл. 13.12.2018, Бюл. № 35.
- Выживаемость чрескожных имплантатов в условиях различной механической нагрузки на кость / А.А. Еманов, Е.Н. Горбач, М.В. Стогов, В.П. Кузнецов, А.Н. Дьячков // Гений ортопедии. 2018. Т. 24, № 4. С. 500-506. doi: 10.18019/1028-4427-2018-24-4-500-506.
- Goldring S., Goldring M. Changes in the osteochondral unit during osteoarthritis: structure, function and cartilage-bone crosstalk // Nat. Rev. Rheumatol. 2016. Vol. 12, No 11. P. 632-644. DOI: 10.1038/nrrheum.2016.148.
- Subchondral bone as a key target for osteoarthritis treatment / S. Castañeda, J.A. Roman-Blas, R. Largo, G. Herrero-Beaumont // Biochem. Pharmacol. 2012. Vol. 83, No 3. P. 315-323. DOI: 10.1016/j.bcp.2011.09.018.
- Subchondral bone and cartilage disease: a rediscovered functional unit / H. Imhof, I. Sulzbacher, S. Grampp, C. Czerny, S. Youssefzadeh, F. Kainberger // Invest. Radiol. 2000. Vol. 35, No 10. P. 581-588. DOI: 10.1097/00004424-200010000-00004.
- Медицинская технология раннего восстановления способности к самостоятельному передвижению после ампутации нижней конечности / В.Г. Сусляев, К.К. Щербина, Л.М. Смирнова, А.В. Сокуров, Т.В. Ермоленко // Вестник Российской военно-медицинской академии. 2019. Т. 66, № 2. С. 101-109.
- Сустав: морфология, клиника, диагностика, лечение / В.Н. Павлова, Г.Г. Павлов, Н.А. Шостак, Л.И. Слуцкий. М., 2011. 552 с.
- Алексеева Л.И., Зайцева Е.М. Роль субхондральной кости при остеоартрозе // Научно-практическая ревматология. 2009. Т. 47, № 4. С. 4148. URL: https://doi.org/10.14412/1995-4484-2009-1149
- Goldring M.B., Goldring S.R. Articular cartilage and subchondral bone in the pathogenesis of osteoarthritis // Ann. NY Acad. Sci. 2010. Vol. 1192. Р. 230-237. DOI: 10.1111/j.1749-6632.2009.05240.x.
- Findlay D.M., Atkins G.J. Osteoblast-chondrocyte interactions in osteoarthritis // Curr. Osteoporos. Rep. 2014. Vol. 12, No 1. P. 127-134. DOI: 10.1007/s11914-014-0192-5.


