Оценка состояния генофондов популяций Pinus sylvestris L. на востоке и северо-востоке Восточно-Европейской равнины
Автор: Сбоева Я.В.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Генетика
Статья в выпуске: 4, 2023 года.
Бесплатный доступ
Проведен молекулярно-генетический анализ хорологически смежных популяций Pinus sylvestris L. на востоке и северо-востоке Восточно-Европейской равнины с использованием межмикросателлитного анализа полиморфизма ДНК. Получены данные о генетическом разнообразии популяций и дана оценка состояния их генофондов. У изученных популяций сосны обыкновенной установлено высокое генетическое разнообразие (P95 = 0.938, He = 0.170, ne = 1.540). Из 144 фрагментов ДНК только 3 (0.021%) являются редкими. Анализ доли редких аллелей показал, что генетическая структура менее сбалансирована в Верхневетлужской (h = 0.254) и Ветлужско-Вятской (h = 0.273) популяциях. Наиболее сбалансированная генетическая структура отмечена в Моломской популяции (h =0.112) и в Северо-Вятско-Увальской популяции (h = 0.127). При оценке состояния генофондов установлено, что наибольшие значения коэффициента генетической оригинальности (КГО) выявлены у популяций Сысоло-Вычегодской (1.164) и Волжско-Ветлужской (1.140), что свидетельствует о их высокой специфичности. Наименьшие значения КГО определены у популяций Ветлужско-Вятская (0.857) и Волжско-Суринская (0.875). Анализ всех трех групп показателей состояния генофондов популяций показал, что с учетом генетической структуры и генетической оригинальности у 6 популяций P. sylvestris состояние генофондов удовлетворительное, а двух популяций (Верхневетлужская и Ветлужско-Вятская) отмечено обеднение генофондов. При отборе деревьев для сохранения и лесовосстановления необходимо выбирать популяции как с типичными, так с специфическими генофондами.
Полиморфизм днк, генетическое разнообразие, генофонд популяций, восточно-европейская равнина
Короткий адрес: https://sciup.org/147242771
IDR: 147242771 | УДК: 575.22 | DOI: 10.17072/1994-9952-2023-4-375-384
Текст научной статьи Оценка состояния генофондов популяций Pinus sylvestris L. на востоке и северо-востоке Восточно-Европейской равнины
Сохранение генетических ресурсов лесообразующих видов растений предполагает изучение существующей структуры аборигенных популяций, т.е. уровней внутрипопуляционного генетического разнообразия и пространственного распределения характерной для вида генетической изменчивости [Алтухов, 2003; Макеева и др., 2018; Тараканов и др., 2019]. Важную роль при этом играет оценка состояния генофондов этих видов на популяционном уровне [Состояние …, 2020; Тараканов и др., 2021]. Генофонды популяций оцениваются с использованием показателей их генетического разнообразия и с учетом внутривидовой дифференциации в регионе исследований [Degen et al., 2021; Янбаев и др., 2022]. Кроме этого, при оценке состояния генофондов необходимо учитывать генетическую структуру изучаемых популяций, а также специфику генофондов [Бо-ронникова, 2013; Vasilyeva et al., 2021]. Именно на данных о генетической структуре и состоянии генофондов популяций обосновывается комплекс мероприятий, направленных на максимальное сохранение генетического разнообразия вида в процессе долгосрочного неистощительного природопользования и воспроизводства лесов [Динамика …, 2004; Крутовский, 2014; Рябухина и др., 2019]. Известно, что при сокращении эффективной численности древесных растений в популяциях из-за сплошных рубок, потери древостоев в результате пожаров, болезней, ветровала, загрязнения окружающей среды, происходит неуклонное снижение генетического разнообразия [Видякин, 2004а; Konig, Geburek, Turok, 2005; Захарова, Сейц, 2017; Yanbaev et al., 2020; Шейкина, Гладков, 2020]. Вырубка лесов, особенно несанкционированная, уничтожает некоторые генотипы и неизбежно приводит к генетическому обеднению популяций и уменьшению генетического разнообразия [Ветчинникова и др., 2013; Шилкина и др., 2019].
Сосна обыкновенная ( Pinus sylvestris L. Pinaceae ) имеет один из наиболее обширных ареалов среди всех хвойных древесных видов мира, растет в широком диапазоне экологических условий [Состояние …, 2020; Vasilyeva et al., 2021]. Популяционно-хорологическая структура сосны обыкновенной характеризуется специфическими и относительно стабильными частотами генотипически детерминированных морфологических признаков-маркеров разного ранга [Видякин, 2010]. Исследования А.И. Видякина [2004а, б] показали, что маркерными характеристиками популяций сосны обыкновенной являются различные показатели шишек, отражающие форму органов или пропорции их частей. Согласно результатам его исследований, среди количественных характеристик генеративных органов популяционными маркерами могут считаться только показатели шишек, семян и семенных крылышек [Видякин, 2004а, б]. Выделение 8 хорологически смежных популяций P. sylvestris на востоке и северо-востоке Восточно-Европейской равнины на основании морфофенотипических данных шишек [Видякин, 2004] подтверждено с использованием молекулярно-генетических методов [Видякин и др., 2015].
В настоящее время применяются разные подходы к оценке состояния генофондов [Сидор и др., 2014; Ильинов, Раевский, 2015; Гермак, Калько, 2019; Сбоева, Боронникова, 2019; Ильинов, Раевский, Чирва, 2020], в том числе для видов хвойных растений [Нечаева, 2015]. Вместе с тем, пространственное распределение генетической изменчивости [Гладков, Шейкина, Швецова, 2016; Шейкина, Гладков, Демаков, 2017] и оценка состояния генофондов популяций P. sylvestris не исследованы в полной мере на востоке и северо-востоке Восточно-Европейской равнины.
Материал и методы исследования
Объектами исследования явились 8 хорологически смежных популяций P. sylvestris на востоке восточно-Европейской равнины: I – Сысоло-Вычегодская, II – Северодвинская, III – Верхневетлужская, IV – Ветлужско-Вятская, V – Волжско-Ветлужская, VI – Волжско-Суринская, VII – Велико-Моломская, VIII – Летско-Холуницкая. Эти популяции были выделены ранее на основании морфофенотипических данных шишек [Видякин, 2004а, б]: в каждой популяции изучены по 2 выборки, поэтому были обследованы 16 выборок (рисунок). Весной 2012–2015 гг. были собраны свежие вегетативные почки латеральных побегов индивидуально с 46 деревьев каждой выборки, расположенных на расстоянии не менее 100 м друг от друга. Общая выборка составила 736 деревьев. Материалом для молекулярно-генетических исследований служила хвоя из распустившихся почек.
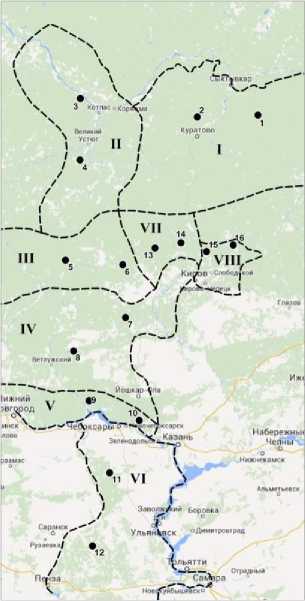
Карта-схема расположения популяций P. sylvestris и мест отбора популяционных выборок для молекулярно-генетического анализа.
Популяции: I – Сысоло-Вычегодская, II – Северодвинская, III – Верхневетлужская, IV – Ветлужско-Вятская, V – Волжско-Ветлужская, VI – Волжско-Суринская, VII – Моломская, VIII – Северо-Вятско-Увальская;
----- границы популяций; • 5 – место отбора и номер популяционной выборки
[Schematic map of the location of P. sylvestris populations and places of selection of population samples for molecular genetic analysis.
Populations: I – Sysolo-Vychegda, II – Severodvinsk, III – Verkhnevetluzhskaya, IV – Vetluzhsko-Vyatluzhskaya, V – Volzhsko-Vetluzhskaya, VI – Volzhsko-Surinskaya, VII – Molomskaya, VIII – North-Vyatsko-Uvalskaya;
-----population boundary; • 5 – sampling location and population sample number]
Анализ полиморфизма ДНК проведен у 736 проб ДНК P. sylvestris . Проанализирован полиморфизм 144 фрагментов ДНК, т.е. матрица содержала 105 984 позиций. Для молекулярно-генетического анализа применялся ISSR (Inter Simple Sequence Repeats)-метод анализа полиморфизма ДНК [Zietkiewicz, Rafalski, Labuda, 1994]. Эффективные праймеры для P. sylvestris были определены ранее [Нечаева и др., 2014]. Для полимеразной цепной реакции (ПЦР) объемом 25 мкл использовалась реакционная смесь, содержащая: 2 единицы Taq-полимеразы, 2.5 мкл стандартного 10х буфера для ПЦР, 25 пМ праймера; 2.5 мМ MgCl, 0.25 мM dNTP, 5 мкл тотальной ДНК. Амплификацию проводили в амплификаторе GeneAmp PCR System 9700 («Applied Biosystems», USA) по следующей программе: предварительная денатурация 94°C, 2 мин.; первые пять циклов: 94°С, 20 сек.; t° отжига праймера, 10 сек.; 72°С, 10 сек.; в последующих тридцати пяти циклах 94°С, 5 сек.; tº отж., 5 сек.; 72°С, 5 сек. Последний цикл элонгации длился 2 мин. при tº 72ºС. Температура отжига в зависимости от G/С-состава праймеров варьировала от 46 до 64°С. Для проверки достоверности, полученных ДНК-спектров, ПЦР и электрофорез повторяли не менее трех раз. В качестве отрицательного (К-) контроля в реакционную смесь для проверки чистоты реактивов добавляли вместо ДНК добавляли 5 мкл деионизированной воды. Продукты амплификации разделяли путем электрофореза в 1.7%-ном агарозном геле в 1×ТВЕбуфере, окрашивали бромистым этидием и фотографировали в проходящем ультрафиолетовом свете в системе Gel Doc XR (Bio Rad, USA). Для определения длины фрагментов ДНК использовали маркер молекулярной массы (100 bp + 1.5 + 3 Кb DNA Ladder, ООО СибЭнзимМ, Москва). Определение длин фрагментов проводилось с использованием программы Quantity One в системе гельдокументации Gel-Doc XR (Bio–Rad, USA). В изученных популяциях P. sylvestris проанализирован полиморфизм 114 ДНК-фрагментов.
Компьютерный анализ данных проведен по стандартным для молекулярно-генетического анализа программам [Yeh, Yang, Boyle, 1999; Peakall, Smouse, 2006]. Уровень внутрипопуляционного разнообразия оценивался с помощью показателей: среднее число морф (μ) и доля редких морф (h) [Животовский, 1980]. Выявление специфических особенностей генофондов проводилось с использованием метода рас- чета коэффициента генетической оригинальности (КГО) [Потокина, Александрова, 2008], модифицированной для дикорастущих древесных видов растений [Боронникова, 2013]. Оценка состояния генофондов популяций сосны обыкновенной проведена в соответствии с методикой С.В. Боронниковой [2013].
Сравнение долей полиморфных локусов и показателей ожидаемой гетерозиготности проведены по критерию Фишера с преобразованием φ [Урбах, 1963]. Определение параметров генетического разнообразия популяций проводилось с использованием программы STATISTICA 12.0.
Результаты и их обсуждение
Изучение генофондов лесообразующих видов растений с использованием молекулярных маркеров основано на оценках количественных характеристик генетического разнообразия популяций. Одной из них является доля полиморфных локусов ( P 95 ), которая выше в популяции VII ( P 95 =0.862), а ниже – в IV ( P 95 =0.512). Средняя ожидаемая гетерозиготность ( H E ) на общую популяцию P. sylvestris составила 0.170. Этот показатель наибольший в популяции VII ( H E = 0.238), а наименьший – в популяции IV ( H E =0.085) (табл. 1). Абсолютное число аллелей на локус ( n a ), а в данном случае на фрагмент ДНК на общую популяцию, составило 1.972. Этот параметр наивысший в популяции VIII, в популяции IV он наименьший (табл. 1). Эффективное число аллелей на локус ( n e ) на общую выборку равно 1.540. Наибольшее значение этого показателя в популяции VII ( n e =1.405), а наименьшее– в популяции III ( n e =1.132). Информационный Индекс Шеннона выше в популяции VIII ( I = 0.358), ниже – в популяции IV (табл. 1).
Таблица 1
Генетическое разнообразие изученных восьми популяций P. sylvestris [Genetic diversity of the eight P. sylvestris populations studied]
|
Популяции |
Р 95 |
НЕ |
na |
ne |
I |
R |
|
I |
0.742 |
0.167 (0.016) |
1.507 (0.075) |
1.279 (0.029) |
0.254 (0.023) |
0 |
|
II |
0.760 |
0.164 (0.015) |
1.528 (0.076) |
1.268 (0.028) |
0.252 (0.022) |
0 |
|
III |
0.561 |
0.106 (0.014) |
1.333 (0.073) |
1.178 (0.026) |
0.160 (0.021) |
0 |
|
IV |
0.512 |
0.085 (0.012) |
1.313 (0.071) |
1.132 (0.021) |
0.134 (0.018) |
1 (0.007) |
|
V |
0.741 |
0.175 (0.017) |
1.472 (0.078) |
1.300 (0.031) |
0.260 (0.024) |
0 |
|
VI |
0.765 |
0.187 (0.016) |
1.569 (0.076) |
1.318 (0.031) |
0.282 (0.023) |
2 (0.014) |
|
VII |
0.862 |
0.238 (0,016) |
1.660 (0.071) |
1.405 (0.031) |
0.356 (0.023) |
0 |
|
VIII |
0.839 |
0.237 (0.016) |
1.708 (0.070) |
1.400 (0.030) |
0.358 (0.023) |
0 |
|
На общую выборку |
0.938 |
0.170 (0.006) |
1.972 (0.027) |
1.540 (0.010) |
0.257 (0.008) |
3 (0.021) |
Примечание: H E – ожидаемая гетерозиготность; n a – абсолютное число аллелей на локус; n e – эффективное число аллелей на локус; I – информационный индекс Шеннона; у всех вышеуказанных параметров в скобках даны стандартные отклонения; R – число редких фрагментов, в скобках указана их доля от общего числа фрагментов.
У популяций, произрастающих на правом берегу р. Волги в северной и центральной части Приволжской возвышенности, с использованием ISSR-метода выявления полиморфизма ДНК установлено [Шей-кина, 2022], что ожидаемая гетерозиготность ( H E ) варьирует от 0.217 до 0.241, а эффективное число аллелей ( n e ) – от 1.34 до 1.39; у левобережных популяций диапазон варьирования показателей уже ( n e = 1.27–1.35; H E = 0.174–0.218).
Из 144 ДНК-фрагментов 3 (0.02%) являются редкими ( R ), т.е. встречающиеся с частотой менее 5%, а 141 ДНК-фрагментов (99.98%) являются общими для всех изученных популяций. С помощью ISSR-метода выявления полиморфизма ДНК в VI выявлено 2 уникальных фрагмента, т.е. характерных только для этой популяции. В популяции IV выявлен 1 уникальный фрагмент, а в остальных шести популяциях уникальных фрагментов не обнаружено (табл. 1).
Таким образом, установлено, что общая выборка из восьми популяций P. sylvestris на ВосточноЕвропейской равнине характеризуются высоким уровнем генетического разнообразия ( P 95 =0.938; H E =0.170; n e = 1.540), при этом наибольшие значения изученных параметров отмечены в Моломской (VII) популяции ( P 95 =0.862; H E =0.238; n e = 1.405), а наименьшие – в Ветлужско-Вятской (IV) ( P 95 =0.512; H E =0.085; n e = 1.132). Разница между показателями доли полиморфных локусов (F =7.535) и ожидаемой гетрозиготности (F =4.101) между популяциями VII и IV значима (F опыт > 1.96). Тем не менее, ожидаемая гетерозиготность и эффективное число аллелей, в изученных популяциях P. sylvestris незначительно ниже, чем в популяциях этого вида в северной и центральной частях Приволжской возвышенности.
Для оценки состояния генофондов популяций сосны обыкновенной параметры генетического разнообразия разделены на три группы (табл. 2). К первой группе «Основные показатели генетического разнообразия» относятся доля полиморфных локусов (P95) и ожидаемая гетерозиготность (HE). Вторая группа «Генетическая структура и дифференциация популяций» включает показатели внутрипопуляционного разнообразия (μ), и долю редких фрагментов ДНК (h), информационный индекс Шеннона (I). Третья группа «Специфика генофондов» содержит показатели: число редких аллелей (R) и КГО.
Таблица 2
Расчет коэффициента генетической оригинальности (КГО) 8 популяций P. sylvestris
[Calculation of the coefficient of genetic originality (GCO) of 8 populations of P. sylvestris ]
|
Исходная матрица присут-ствия/отсутствия ISSR-фрагментов в 8 выборках |
«Взвешанные» на основе частоты встречаемости в выборке значения присут-ствия/отсутствия ISSR-фрагментов |
∑ |
КГО= ∑/N |
||||||||
|
Поп. |
IS1_1350 |
IS1_1130 |
IS1_930 |
n ... |
Поп. |
IS1_1350 |
IS1_1130 |
IS1_930 |
n ... |
||
|
I |
0 |
1 |
0 |
... |
I |
0.33 |
3 |
0.17 |
... |
142.35 |
1.164 |
|
II |
0 |
0 |
0 |
... |
II |
0.33 |
0.33 |
0.17 |
... |
118.85 |
0.981 |
|
III |
0 |
0 |
0 |
... |
III |
0.33 |
0.33 |
0.17 |
... |
148.03 |
0.932 |
|
IV |
0 |
0 |
0 |
... |
IV |
0.33 |
0.33 |
0.17 |
... |
132.84 |
0.857 |
|
V |
0 |
0 |
0 |
... |
V |
0.33 |
0.33 |
0.17 |
... |
138.62 |
1.140 |
|
VI |
0 |
0 |
0 |
... |
VI |
0.33 |
0.33 |
0.17 |
... |
119.47 |
0.875 |
|
VII |
1 |
0 |
1 |
... |
VII |
3 |
0.33 |
6 |
... |
130.16 |
1.033 |
|
VIII |
1 |
1 |
0 |
... |
VIII |
3 |
3 |
0.17 |
... |
159.27 |
1.019 |
|
Кол-во «1» |
2 |
2 |
1 |
... |
Кол-во «1» |
2 |
2 |
1 |
... |
||
|
Кол-во «0» |
6 |
6 |
6 |
... |
Кол-во «0» |
6 |
6 |
6 |
... |
||
|
«Вес» «1» |
3 |
3 |
6 |
... |
«Вес» «1» |
3 |
3 |
6 |
... |
||
|
«Вес» «0» |
0.33 |
0.33 |
0.17 |
... |
«Вес» «0» |
0.33 |
0.33 |
0.17 |
... |
||
Примечание: ∑ – сумма «весов» всех ISSR-фрагментов для каждой популяции, КГО=∑/N – коэффициент генетической оригинальности популяции как частное полученной суммы и количества проанализированных ISSR-фрагментов каждой популяции (n = 125).
Полученные показатели оценки состояния приведены в табл. 3. При анализе внутрипопуляционного разнообразия P. sylvestris с применением показателя μ , предложенного Л.А. Животовским [1980], установлено, что у изученных популяций более равномерно распределены частоты аллелей в популяциях VII ( μ =1.776) и VIII ( μ =1.747), а менее ( μ =1.454) – у популяции IV (табл. 3). Показатель h позволяет характеризовать структуру разнообразия каждой популяции. По мнению Л.А. Животовского [1980], при значениях h ˃ 0.3 в генетической структуре популяций увеличена доля рецессивных гомозигот. Таким образом, чем меньше значения h порогового 0.3, тем более сбалансированной структурой разнообразия характеризуются изученные популяции. Все изученные популяции P. sylvestris на Восточно-Европейской равнине в той или иной степени сбалансированы. Наиболее сбалансирована генетическая структура в популяциях VII ( h =0.112) и VIII ( h =0.127), менее сбалансированными являются популяции III ( h =0.254) и IV ( h =0.273).
Таблица 3 Оценка состояния популяционных генофондов P. sylvestris
[Assessment of the state of P. sylvestris population gene pools]
|
Популяция |
I. Основные показатели генетического разнообразия |
II. Генетическая структура и дифференциация популяций |
III. Специфика генофондов |
Оценка состояния генофондов |
|||||
|
Р 95 |
Н Е |
μ |
h |
I |
R |
КГО |
тип |
состояние |
|
|
I |
0.742 |
0.167 |
1,653 |
0.173 |
0.254 |
0 |
1.164 |
С |
I |
|
II |
0.760 |
0.164 |
1.680 |
0.160 |
0.252 |
0 |
0.981 |
I |
|
|
III |
0.561 |
0.106 |
1.492 |
0.254 |
0.160 |
0 |
0.932 |
Т |
II |
|
IV |
0.512 |
0.085 |
1.454 |
0.273 |
0.134 |
1 |
0,857 |
Т |
II |
|
V |
0.741 |
0.175 |
1.659 |
0.171 |
0.260 |
0 |
1.140 |
С |
I |
|
VI |
0.765 |
0.187 |
1.663 |
0.168 |
0.282 |
2 |
0.875 |
Т |
I |
|
VII |
0.862 |
0.238 |
1.776 |
0.112 |
0.356 |
0 |
1.033 |
I |
|
|
VIII |
0.829 |
0.237 |
1.747 |
0.127 |
0.358 |
0 |
1.019 |
I |
|
Примечание: P 95 – доля полиморфных локусов; H E – ожидаемая гетерозиготность; μ – среднее число морф; h – доля редких морф; I – информационный индекс Шеннона; R – число уникальных фрагментов; КГО – коэффициент генетической оригинальности; типы генофондов: Т – типичный генофонд, С – специфичный генофонд; I – состояние удовлетворительное, II – состояние обеднение генофонда.
Наибольшее значение индекса Шенона ( I ) выявленно в популяции VIII (0.358), а наименьшее, равное 0.134, у популяции IV.
Наибольшее значение КГО установлено у Сысоло-Вычегодской (I) (КГО =1.164) и у Волжско-Ветлужской (V) популяций (КГО =1.140), что позволяет судить о высокой специфичности генофондов этих популяций для региона исследований. Наименьшее значение КГО наблюдается в IV (КГО =0.857) и VI (КГО =0.875) популяциях. Они характеризуются типичным генофондом (табл. 3), т.е. содержат типичные для региона исследований аллели. Наибольшие показатели генетического разнообразия в первой и во второй группах параметров установлены в популяции VII, а наименьшие – в популяции IV (табл. 3). С целью сохранения генофондов ресурсных видов растений и объективной оценки генетических взаимосвязей между генофондами рекомендуется отбор как популяций с типовыми генофондами, так и популяций со специфическими особенностями генофондов [Боронникова, 2013], являющихся резервом генетической изменчивости. Анализ всех трех групп показателей состояния генофондов популяций показал, что с учетом генетической структуры и генетической оригинальности у 6 популяций P. sylvestris состояние удовлетворительное, а у двух популяций (III и IV) отмечено обеднение генофондов.
С целью сохранения генофонда ценного ресурсного вида растений P. sylvestris рекомендуется отбирать как популяции с типичными генофондами, так и популяции, обладающие специфическими особенностями генофондов, являющиеся резервом генетической изменчивости. Для лесовосстановления нужно не только сохранять генофонды популяций, но и генетическую структуру популяций с учетом внутри- и межпопуляционной дифференциации, что будет способствовать сохранению генетического разнообразия лесообразующих видов растений.
Заключение
В ходе молекулярно-генетического анализа с использованием ISSR-метода анализа полиморфизма ДНК установлено, что изученные на Восточно-Европейской равнине восемь популяций P. sylvestris характеризуется высокими показателями генетического разнообразия ( P 95 = 0.938; H E = 0.170; n e = 1.540). Среди 8 изученных популяций наибольшее генетическое разнообразие характерно для Велико-Моломской (VII) популяции ( P 95 = 0.862; H E = 0.238; n e = 1.405), а наименьшее– для Ветлужско-Вятской (IV) популяции ( P 95 = 0.512; H E = 0.085; n e = 1.132). У всех изученных популяций показатель h (доля редких аллелей для оценки состояния генетической структуры популяций) имеет значения, меньшие 0.3. Вместе с тем, генетическая структура менее сбалансирована в Верхневетлужской (III) ( h = 0.254) и Вет-лужско-Вятской (IV) популяциях ( h = 0.273), а наиболее сбалансирована – в Велико-Моломской (VII) ( h = 0.112) и Северо-Вятско-Увальской (VIII) популяиях ( h = 0.127). При оценке состояния генофондов было установлено, что наибольшее значение КГО определено в популяциях Велико-Моломской (1.164) и Волжско-Ветлужской (1.140), что позволяет судить о высокой специфичности генофондов данных популяций. Наименьшее значение КГО наблюдается у популяций Ветлужско-Вятской (0.857) и Волжско-Суринской (0.875). Эти популяции характеризуются типичными генофондами, т.е. содержат аллели, характерные для исследуемого региона. Было установлено, что генофонды шести популяций находятся в удовлетворительном состоянии (I, II, V, VI, VII и VIII), а у популяций III и IV наблюдается обеднение генофонда. Для сохранения генофондов на популяционном уровне рекомендуются популяции Ветлуж-ско-Вятская (IV) и Волжско-Суринская (VI) с типичным генофондом, а также популяции Северодвинская (II) и Волжско-Ветлужская (V) – со специфическими генофондами.
Список литературы Оценка состояния генофондов популяций Pinus sylvestris L. на востоке и северо-востоке Восточно-Европейской равнины
- Алтухов Ю.П. Генетические процессы в популяциях / отв. ред. Л.А. Животовский. М.: Академкнига, 2003. 431 с.
- Боронникова С.В. Молекулярно-генетический анализ и оценка состояния генофондов ресурсных видов растений Пермского края. Пермь, 2013. 223 с.
- Ветчинникова Л.В., Титов А.Ф., Кузнецова Т.Ю. Карельская береза: биологические особенности, динамика ресурсов и воспроизводство. Петрозаводск, 2013. 312 с.
- Видякин А.И. Изменчивость количества семядолей у семян сосны обыкновенной производственной и опытной заготовки на Северо-Востоке Русской равнины // Теоретическая и прикладная экология. 2010. № 3. С. 90–95.
- Видякин А.И. Популяционная структура сосны обыкновенной на востоке европейской части России: автореф. дис. … д-ра биол. наук. Екатеринбург, 2004а. 48 с.
- Видякин А.И. Изучение популяционной структуры сосны обыкновенной на основе индексной оценки признаков генеративных органов // Методы популяционной биологии: сб. материалов. VII Всерос. популяц. семинара. Сыктывкар, 2004б. Ч. 1. С. 35–37.
- Видякин А.И. и др. Генетическая изменчивость, структура и дифференциация популяций сосны обыкновенной (Pinus sylvestris L.) на северо-востоке Русской равнины по данным молекулярно-генетического анализа // Генетика. 2015. Т. 51, № 12. С. 1401–1409.
- Гермак М.В., Калько Г.В. Микросателлитный анализ для оценки дифференциации популяций ели европейской на Северо-западе России // Труды Санкт-Петербургского научно-исследовательского института лесного хозяйства. 2019. № 1. С. 4–14.
- Гладков Ю.Ф., Шейкина О.В., Швецова Е.Н. Сравнение частот встречаемости ISSR-ДНК-маркеров в смежных болотной и суходольной ценопопуляциях сосны обыкновенной в республике Марий Эл // Современные проблемы медицины и естественных наук: сб. статей Междунар. науч. конф. Йошкар-Ола, 2016. Вып. 5. С. 139–143.
- Динамика популяционных генофондов при антропогенных воздействиях / под ред. Ю.П. Алтухо-ва. М.: Наука, 2004. 619 с.
- Животовский Л.А. Показатель внутрипопуляционного разнообразия // Журнал общей биологии. 1980. Т. 41, № 6. С. 828–836.
- Захарова К.В., Сейц К.С Роль экологических факторов в формировании генетической структуры популяций P. abies (L.) Karst. // Экологическая генетика. 2017. Т. 15, № 2. С.11–20.
- Ильинов А.А., Раевский Б.В. Сравнительная оценка генетического разнообразия естественных популяций и клоновых плантаций сосны обыкновенной и ели финской в Карелии // Экологическая генети-ка. 2015. Т. 13, № 4. С. 55–67.
- Ильинов А.А., Раевский Б.В., Чирва О.В. Состояние генофондов основных лесообразующих видов водосбора Белого моря (на примере Picea fennica (Regel) Kom. и Pinus sylvestris L.) // Экологическая генетика. 2020. Т. 18, № 2. С. 185–202.
- Крутовский К.В. Перспективы использования геномных исследований в лесном хозяйстве // Сибирский лесной журнал. 2014. № 4. C. 11–15.
- Лесной план Кировской области на 2008-2020 годы [Электронный ресурс]. URL: www.kirovreg.ru/publ/akoup.nsf/ (дата обращения: 29.10.2023).
- Макеева В.М. и др. Оценка состояния генофонда и жизнеспособности лесопосадок ели европейской (Picea abies (L.) Karst.) из парков города Москвы и Подмосковья // Леса России: политика, промышленность, наука, образование: материалы третьей междунар. науч.-техн. конф. СПб., 2018. С. 187–190.
- Нечаева Ю.С. Молекулярно-генетический анализ природных популяций западной расы Larix sibirica Ledeb. (Larix sukaczewii Dyl.) на Среднем и Северном Урале: автореф. дис. … канд. биол. наук. Уфа, 2015. 25 с.
- Нечаева Ю.С. и др. Молекулярно-генетический анализ популяций хвойных видов растений на Урале и востоке европейской части России для сохранения и возобновления лесных ресурсов // Известия Самарского научного центра РАН. 2014. Т. 16, № 1(3). С. 878–882.
- Потокина Е.К., Александрова Т.Г. Методы классификации внутривидового разнообразия по результатам молекулярного маркирования // Фундаментальные и прикладные проблемы ботаники в нача-ле XXI века: материалы Всерос. конф. Петрозаводск, 2008. Ч. 3. С. 62–65.
- Рябухина М.В. и др. Генетическое разнообразие популяций сосны обыкновенной Pinus sylvestris L. // Теоретическая и прикладная экология. 2019. № 3. С. 66–71.
- Сбоева Я.В., Боронникова С.В. Генетическая структура и межпопуляционная дифференциация восьми популяций Pinus sylvestris L. на Восточно-Европейской равнине // Бюллетень науки и практики. 2019. Т. 5, № 12. С. 89–97. https://doi.org/10.33619/2414-2948/49/10.
- Сидор A.И. и др. Селекционная и генетическая оценка лесосеменных плантаций дуба черешчатого ГЛХУ «Кличевский лесхоз» // Труды БГТУ. 2014. № 1. С. 181–184.
- Состояние лесных генетических ресурсов Российской Федерации: 2-й Национальный доклад Российской Федерации / под общ. ред. М.М. Паленовой. М.: ВНИИЛМ, 2020. 213 с.
- Тараканов В.В. и др. Состояние и перспективы развития генетико-селекционного комплекса хвойных пород в Сибири (на примере Новосибирской области) // Вестник Поволжского государственного технологического университета. Сер. Лес. Экология. Природопользование. 2019. № 3 (43). С. 5–24.
- Тараканов В.В. и др. Лесная селекция в России: достижения, проблемы, приоритеты (обзор) // Лесохозяйственная информация. 2021. № 1. С. 100–143.
- Урбах В.Ю. Математическая статистика для биологов и медиков. М.: Изд-во АН СССР, 1963. Т. 1. 323 с.
- Шейкина О.В. Генетическая структура и дифференциация популяций сосны обыкновенной (Pinus sylvestris L.) в Среднем и Верхнем Поволжье // Экологическая генетика. 2022. Т. 20, № 4. С. 261–270.
- Шейкина О.В., Гладков Ю.Ф. Генетическое разнообразие и дифференциация ценопопуляций сос-ны обыкновенной (Pinus sylvestris L.), сформированных в болотных и суходольных экотопах //. Биология. 2020. № 50. С. 101–118.
- Шейкина О.В., Гладков Ю.Ф., Демаков Ю.П. Генетическая структура суходольных и болотных ценопопуляций сосны обыкновенной в республике Марий Эл // Проблемы популяционной биологии: Материалы XII Всерос. популяционного семинара. Йошкар-Ола, 2017. С. 262–265.
- Шилкина Е.А. и др. Использование методов ДНК-анализа в экспертизе незаконного оборота древесины // Сибирский лесной журнал. 2019. № 3. С. 64–70.
- Янбаев Р.Ю. и др. Анализ взаимосвязи климатических факторов и генетического разнообразия популяций дуба черешчатого в разных частях Республики Башкортостан // Вестник Пермского университета. Сер. Биология. 2022. Вып. 4. С. 327‒334.
- Degen B. et al. Applying targeted genotyping by sequencing with a new set of nuclear and plastid SNP and indel loci for Quercus robur and Quercus petraea // Conservation Genetics Resources. 2021. Vol. 13 (4). P. 345–347.
- Konig А.O., Geburek Th., Turok J. Conservation and Management of Forest Genetic Resourses in Europe // Arbora Publishers. 2005. P. 281–284.
- Peakall R., Smouse P.E. GenAlEx6: Genetic analysis in Excel. Population genetic software for teaching and research // Mol. Ecol. Not. 2006. Vol. 6. P. 288–295.
- Vasilyeva Yu. et al. Genetic Structure, Differentiation and Originality of Pinus sylvestris L. Populations in the East of the East European Plain // Forests. 2021. Vol. 12. P. 999.
- Yanbaev Yu. et al. Gene pool of scots pine (Pinus sylvestris L.) under reforestation in extreme environ-ment // Wood Res. 2020. № 65. P. 459–470.
- Yeh F.C., Yang R.C., Boyle T. POPGENE, the Microsoft Windows-based user-friendly software for popu-lation genetic analysis of co-dominant and dominant markers and quantitative traits / Department of Renewa-ble Resources, Univ. of Alberta, Edmonton. Alta, 1999. 238 p.
- Zietkiewicz E., Rafalski A., Labuda D. Genome fingerprinting by simple sequence repeat (SSR)-anchored polymerase chain reaction amplification // Genomics. 1994. Vol. 20, № 2. P. 176–183.


