Оценка состояния красной крови при желчном перитоните
Автор: Купреева М.С., Петросян Э.А., Сухинин А.А., Терещенко О.А.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Экспериментальные исследования
Статья в выпуске: 2 (18), 2008 года.
Бесплатный доступ
Нарушения метаболизма при желчном перитоните приводят к повреждению эритроцитов. Причиной деструктивных процессов является сорбция на мембране клеток токсинов и активизация перекисного окисления липидов. Изменения мембран носит разнонаправленный характер. Цитолитические процессы характерны для «старых» клеток, их разрушение регулирующе действует на перекисное окисление, тормозя его на уровне менее токсичных форм и приводит к появлению в крови молодых эритроцитов. Для более молодых форм характерно повышение жесткости эритроцитарной мембраны, препятствующее полноценному функционированию.
Желчный перитонит, эритроциты, интоксикация, перекисное окисление липидов
Короткий адрес: https://sciup.org/142148726
IDR: 142148726 | УДК: 616.381-002-092.9-074
Текст научной статьи Оценка состояния красной крови при желчном перитоните
Нарушения метаболизма, сопровождающие развитие желчного перитонита (ЖП), приводят к развитию эндогенной интоксикации. Одним из последствий ее развития является клеточная дезорганизация [3]. Молекулярные нарушения клеточной мембраны приводят к дезорганизации клеточного метаболизма, потере функциональной компетентности, изменению жизнедеятельности кле- ток и их гибели [10—13]. Повреждение клеточных мембран определяет все основные патофизиологические и клинические проявления эндотоксикоза [7, 9].
Основу структурной организации мембран составляет бимолекулярный липидный слой с встроенными мембранными белками. Поэтому дисбаланс переокисления липидов и антиоксидантной защи-

ты в настоящее время рассматривают как одну из составляющих эндотоксикоза и механизма дестабилизации клеточных мембран [2].
Общность строения и функционирования плазматических мембран различных органов и тканей позволяет предположить однонаправленность изменений свойств клеточных мембран всех органов и тканей. Чувствительность эритроцитов к действию токсинов, простота их выделения и доказанная корреляция между изменениями свойств мембран эритроцитов и клеточных мембран внутренних органов при интоксикации [5] дают возможность использовать красные клетки крови в качестве модели для изучения состояния цитоплазматических мембран [1, 11].
ЦЕЛЬ РАБОТЫ
Изучить процессы повреждения эритроидного звена системы крови при интоксикации и найти методы их коррекции.
МЕТОДИКА ИССЛЕДОВАНИЯ
Работа была проведена на белых крысах-самцах весом 160—220 г (n=39). Животные были разделены на 2 группы: 1-я группа — интактные животные (n=24); 2-я группа — животные, у которых исследования проводили через 24 часа после создания модели ЖП (n=15). Для создания ЖП была использована модель, разработанная в Российском центре функциональной хирургической гастроэнтерологии [8].
Для оценки эритроцитарного звена крови определяли эритроциты, концентрацию гемоглобина. Для оценки уровня перикисного окисления липидов проводили определение в эритроцитах содержания малонового диальдегида (МДА) и диеновых коньюгат (ДК). Для оценки уровня интоксикации в эритроцитах определяли вещества низкой и средней молекулярной массы по методике М. Я. Малаховой [5]. Состояние мембран эритроцитов оценивали методом определения осмотической резистентности по Л. И. Идельсону [4].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
И ИХ ОБСУЖДЕНИЕ
При развитии ЖП наблюдается снижение концентрации эритроцитов на 20 %, обусловленное токсическим воздействием на мембраны эритроцитов, приводящим к цитолитическим процессам. При этом отмечается пропорциональное снижение общей концентрации гемоглобина (см. табл.).
Нарастающая с развитием желчного перитонита интоксикация приводит к развитию процессов, связанных с образованием избыточного количества активных форм кислорода (АФК) и развитием перекисных процессов окисления клеточных мембран. Под влиянием АФК происходит отрыв атомов водорода от молекул полиненасыщенных жирных кислот, что приводит к перемещению двойной связи с образованием диеновых конъюгат. При дальнейшем усилении окислительной дегенерации клеточных структур возникает образование более токсичных конечных продуктов перекисного окисления липидов МДА.
Таблица
Показатели эритроцитарного звена крови интактных животных и животных с желчным перитонитом
|
Обследуемые животные |
Эр, х 1012/л |
Нв, г/л |
ДК |
МДА |
|
Интактные |
2,84±0,24 |
137±16 |
1,19±0,06 |
2,36±0,28 |
|
С желчным перитонитом |
2,31±0,37* |
111±9* |
5,18±0,17* |
5,54±0,41* |
* р<0,05 по сравнению с группой интактных животных.
При развитии ЖП отмечается рост всех продуктов перекисного окисления липидов. При этом рост промежуточных продуктов ПОЛ ДК более выражен по сравнению с ростом конечных продуктов МДА: в 4,35 и 2,34 раза соответственно, что свидетельствует в пользу продолжающегося эффективного функционирования процессов антирадикальной защиты на этой стадии развития ЖП.
Развитие синдрома эндогенной интоксикации при ЖП подтверждается ростом ВНСММЭР с 15,6±2,27 до 32,6±2,54 (р<0,05). При этом спектральная кривая поглощения ВНСММЭР имеет сдвиг пика в сторону больших длин волн (рис.1).
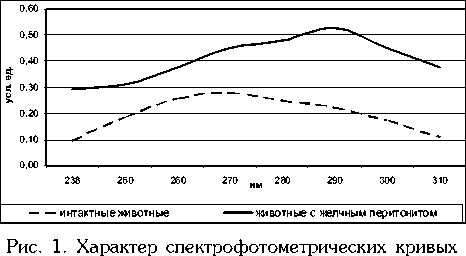
ВНСММЭР у интактных животных и животных с ЖП
Увеличение высоты, сдвиг максимума кривой и рост концентрации ВНСММЭР при ЖП характерны для фазы обратимой декомпенсации эндогенной интоксикации, при которой функция детоксицирующей системы организма в целом сохранена [5].
И у интактных животных, и при ЖП в крови животных при определении осмотической устойчивости эритроцитов выделяются три фракции: низкостойкая — гемолиз которой происходит в пределах 0,60—0,45 %; среднестойкая — с гемолизом в пределах 0,45—0,30 %; высокостойкая в пределах 0,30—0,10 % (рис. 2). Различие в осмотической устойчивости объясняется разнообразием возрастных форм эритроцитов, которое обес- печивает разнонаправленность действия токсических продуктов метаболизма на эритроцитарную мембрану.
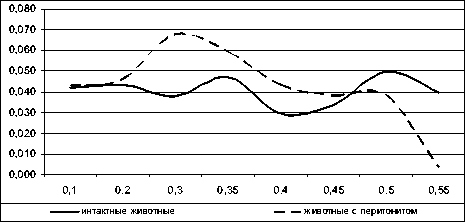
Рис. 2. Дифференциальные кривые осмотического гемолиза эритроцитов интактных животных и животных с ЖП
Так, при развитии ЖП отмечается резкое снижение количества низкостойкой («старой») популяции и рост более молодых среднестойкой и высокостойкой популяций. Максимумы гемолиза каждой фракции при перитоните также сдвигаются в сторону уменьшения концентраций гемолитического агента.
Вероятно, действие мембраноповреждающих агентов приводит к повышению чувствительности и снижению устойчивости мембран преимущественно «старых» клеточных фракций к действию АФК и продуктов их реакций с компонентами биомембран. Следствием этого становится образование дополнительных каналов проницаемости, изменение клеточного гомеостаза и разрушение «старых» эритроцитов.
С другой стороны, токсическое действие аномальных продуктов метаболизма при развитии ЖП на мембраны молодых форм эритроцитов не приводит к критическому повреждению белково-фосфолипидного бислоя мембран, однако способно формировать «жесткую» мембрану, что приводит к резкому снижению трансмембранного транспорта эритроцита.
Положительным следствием разрушения эритроцитов «старой» фракции является компенсаторный запуск эритропоэза и выход в кровь более эффективных молодых форм клеток, что, в конечном счете, направлено на усиление доставки к клеткам кислорода и снижение гипоксических проявлений. Кроме этого, разрушение клеток приводит к выходу в плазму большого количества цитозольных белков, обладающих ан-тиокислительными свойствами, что подтверждается данными о менее интенсивном росте цитотоксичных конечных продуктов перекисного окисления липидов МДА по сравнению с промежуточными ДК.
ЗАКЛЮЧЕНИЕ
Таким образом, развитие желчного перитонита приводит к сорбции на эритроцитарной мембра- не большого количества токсичных веществ низкой и средней молекулярной массы и активизации перекисного окисления липидов мембран эритроцитов.
Продукты патологического метаболизма взаимодействуют с эритроцитарными клетками, что приводит к разнонаправленным изменениям состояния мембран клеток в зависимости от их возраста.
Цитолитические процессы наиболее характерны для «старых» клеток. Разрушение наименее прочных «старых» эритроцитов регулирующе действует на процессы перекисного окисления, тормозя его на уровне менее токсичных форм, и приводит к компенсаторному появлению в крови молодых эритроцитов.
На фоне развития интоксикации при желчном перитоните характерно повышение жесткости эритроцитарной мембраны, препятствующее полноценному функционированию эритроцитов.


