Оценка спектра мочевых и сывороточных биомаркеров при определении стадии рака мочевого пузыря
Автор: Попков В.М., Понукалин А.Н., Захарова Н.Б.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Урология
Статья в выпуске: 4 т.9, 2013 года.
Бесплатный доступ
Цель: установить эффективность спектра мочевых и сывороточных биомаркеров рака мочевого пузыря для диагностики и прогноза риска развития рецидива заболевания. Материал и методы. Проведено исследование уровня ТРА и TPS, VEGF в сыворотке крови, UBC в моче у 176 человек, среди которых 135 больных раком мочевого пузыря (РМП). Группу сравнения составили 16 пациентов (больные циститами). Контрольную группу составили 25 практически здоровых мужчин. У 75 пациентов был немышечно-инвазивный РМП (Ta-1N0M0), а у 60 мышечно-инвазивный РМП (T2-4N0-1M0-1). Пациентам с НМИРМП (п=75) выполнена ТУР стенки мочевого пузыря с опухолью, а больным с МИРМП (п+60): 57 выполнена цистэктомия, трем паллиативные операции. Результаты. Установлен статистически достоверный рост содержания ТРА, TPS в сыворотке крови и UBC в моче у больных немышечно-инвазивным РМП по сравнению с больными в группах контроля и сравнения. Отмечен подъем содержания UBC в моче больных данной группы с рецидивом опухолевого роста в течение года после ТУР В сравнении с цитологическим исследованием осадка мочи молекулярные маркеры РМП (мочевой — UBC и сывороточные ТРА, TPS) обладают большей диагностической чувствительностью, позволяют подтвердить наличие заболевания, провести диагностику стадий внутриорганной и экстраорганной инвазии. Дополнительным прогностическим сывороточным маркером при РМП можно считать увеличение уровня VEGF в сыворотке крови. Заключение. Включенное в диагностический процесс в нашей клинике исследование он-комаркеров у всех больных РМП показало, что выявление НМИРМП повысилось с 18,1 % в 2006 г. до 55,6% в 2011 г. Выбранный адекватный стадии объем комплексного лечения позволил снизить рецидивы и летальность у больных РМП в первые два года с 32 до 15,5%.
Мышечно-инвазивный рак мочевого пузыря, онкомаркеры, фактор роста эндотелия сосудов, цитокератины
Короткий адрес: https://sciup.org/14917832
IDR: 14917832
Текст научной статьи Оценка спектра мочевых и сывороточных биомаркеров при определении стадии рака мочевого пузыря
-
1 Введение. Рак мочевого пузыря (РМП) относится к наиболее часто встречающимся злокачественным новообразованиям мочевыводящих путей. Характер ной особенностью РМП является частое рецидиви-
- Ответственный автор — Захарова Наталия Борисовна
Адрес: 410053, г. Саратов, ул. Рабочая, 40/60, кв. 159.
Тел.: +79093360261.
рование и склонность к метастазированию при мы-шечно- инвазивных (МИРМП) стадиях заболевания [1, 2]. Показано, что в результате радикальной терапии поверхностного рака, в отличие от мышечно-инвазивного, часто удается сохранить мочевой пузырь, обеспечив больным более высокое качество жизни. Выживаемость пациентов с РМП напрямую зависит от стадии его выявления [3]. Поэтому своевременная ранняя диагностика опухолей мочевого пузыря, правильная оценка их распространенности и злокачественности имеют решающее значение как для выбора адекватного метода лечения, так и для прогноза развития данного заболевания. Однако клинические проявления ранних стадий РМП неспецифичны и часто совпадают с симптомами воспалительных заболеваний мочеполовой системы. Онкопатология мочевого пузыря в 80-90% случаев сопровождается макро- и микрогематурией, однако степень гематурии не коррелирует со стадией болезни, поэтому позволяет выявить РМП только на поздних стадиях развития [4, 5].
Ультразвуковое исследование и ряд других инструментальных методов, применяемых для выявления и мониторинга опухолей мочевого пузыря дают пока еще довольно высокий процент диагностических ошибок. Одним из основных методов диагностики РМП остается цистоскопия и цитологическое исследование осадка мочи, при котором опухолевые клетки обнаруживаются лишь у 54% обследуемых больных. Диагностическая чувствительность цитологических и гистологических исследований мазков и биоптатов опухолей мочевого пузыря не превышает 60% [6, 7].
Таким образом, разработка новых методов неинвазивной диагностики РМП, позволяющих выявлять его ранние стадии, осуществлять оценку злокачественности опухолей, проводить их мониторинг и прогнозировать дальнейшее развитие, является актуальной проблемой. Важным аспектом является также их применение в качестве дополнительных показателей при выборе тактики адекватной терапии и оценки ее эффективности.
В качестве биохимических маркеров злокачественных опухолей мочевого пузыря к настоящему времени исследованы онкоантигены, маркеры пролиферации и ангиогенеза, регуляторы клеточного цикла, рецепторы клеточной адгезии, протеазы внеклеточного матрикса и базальной мембраны, пептидные факторы роста и другие биомолекулы [3, 8, 9].
Показано, что в качестве маркера, свидетельствующего об активном развитии РМП, может быть успешно использован фактор роста эндотелия сосудов (vascular end othelial growth factor — VEGF). Содержание VEGF в сыворотке крови больных коррелирует с плотностью микрососудов в опухолевой ткани и с клинико-морфологическими признаками данного заболевания [10]. При немышечно-инвазивной форме рака повышение концентрации VEGF связано с активацией процесса опухолевого роста. При инвазивном РМП высокий уровень этого фактора у больных в дооперационный период являлся предиктором рецидива заболевания после цистэктомии [11]. Однако интенсивная продукция VEGF, сопровождающая активный ангиогенез, характерна не только для развития РМП, но и других солидных опухолей, а также при ишемии сосудов, характерной для многих других заболеваний [11, 12].
В ряде исследований показано, что для диагностики ранних стадий опухолей мочевого пузыря могут быть использованы онкоассоциированные цито-кератины (ЦК) — структурные белки промежуточных филаментов цитоскелета эпителиальных клеток [13]. Группа ЦК включает 20 различных белков, которые при разрушении клеток и в результате протеолиза в виде растворимых полипептидных фрагментов поступают в кровяное русло, а также в просвет моче- вого пузыря [5]. Показано, что состав цитокератинов в уротелии уникален: так, ЦК 7, 8 и 13 обнаруживаются только базальном слое, ЦК 20 в поверхностных зонтичных клетках, а ЦК 18 и 19 содержатся во всех клеточных слоях [14]. Увеличение количества злокачественных опухолевых клеток мочевого пузыря и их внедрение в более глубокие слои уротелия приводят к изменению спектра растворимых фрагментов цито-кератинов у больного [7]. Это послужило основанием для использования данных полипептидов в качестве биомаркеров для ранней диагностики РМП [14].
В настоящее время выпускается ряд зарубежных коммерческих тестов для количественного анализа онкомаркеров данного типа в крови и моче. Тканевый полипептидный антиген (tissue polypeptide antigen — TPA), содержащий растворимые фрагменты цитокерратинов 8 и 18, а также тканевый полипептид-специфический антиген (tissue polypeptide-specif-icantigen — TPS), представленный ЦК 18, определяют в сыворотке крови обследуемых лиц. Для исследования антигена опухоли мочевого пузыря (– UBC) смесь ЦК 8 и 18, а также фрагмента 21–1 ци-токерратина 19 (cytokeratinfragmen — CYFRA 21–1) используют мочу больных. Несомненным достоинством диагностики РМП с помощью количественного определения этих онкомаркеров является более высокая чувствительность, чем при цитологическом исследовании мочевого осадка. Кроме того, анализ онкомаркера у одного и того же больного может быть проведен многократно для мониторинга развития опухоли, выявления ее прогрессии или рецидива с целью принятия адекватных клинических решений.
Основным недостатком использования цитокер-ратинов для диагностики РМП пузыря является их недостаточная специфичность. Показано, например, что уровни ТРА и TPS повышаются при раке молочной железы, опухолях желудочно-кишечного тракта, головы, шеи, а также воспалительных заболеваниях легких, печени и урогенитального тракта [4, 14]. Поэтому положительные результаты определения данных онкомаркеров у пациентов с подозрением на РМП требуют назначения уточняющих цистоскопических и гистологических исследований, что существенно ограничивает их применимость в клинике. Опубликованы данные, что UBC и CYFRA 21–1 обладают большей специфичностью [13], однако в целом на сегодняшний день биохимического маркера, позволяющего надежно выявлять опухоли мочевого пузыря на ранних стадиях и проводить мониторинг их развития, пока не найдено.
Одним их перспективных подходов к повышению эффективности диагностики рака может быть исследование комплекса различных онкомаркеров [1, 4, 10].
Цель : установить эффективность спектра мочевых и сывороточных биомаркеров рака мочевого пузыря для диагностики и прогноза риска развития рецидива заболевания.
Материал и методы. Материалом настоящей работы являются результаты исследований, проведенных в период с 2007 по 2011 г. в центральной научноисследовательской лаборатории (ЦНИЛ) ГБОУ ВПО «Саратовский ГМУ им. В. И. Разумовского» Минздрава России.
В исследование было включено 176 человек, находившихся на обследовании и лечении в Саратовском НИИ фундаментальной и клинической уронефрологии ГБОУ ВПО «Саратовский ГМУ им. В. И. Разумовского» Минздрава России. Возраст пациентов колебался от 44 до 79 лет (средний возраст 63 года). В числе обследованных пациентов 46 женщины и 130 мужчин. В аналитическую группу вошло 135 больных РМП. Группу сравнения составили 16 пациентов (больные циститами). Контрольную группу составили 25 практически здоровых мужчин. Данная группа состояла из лиц, проходивших медицинское обследование, в ходе которого не выявлено заболеваний мочеполовой системы и значимых хронических заболеваний.
При проведении клинико-инструментального обследования (УЗИ, ЯМРТ, КТ, ЭУ, цито- и гистологическое исследования биопсийного и операционного материала) у 135 больных установлен РМП. В 75 (55,6%) наблюдениях диагностирован немышеч-но-инвазивный РМП (НМИРМП) (Та-Т1N0M0), у 60 (44,4%) установлен мышечно-инвазивный (МИ РМП). В пределах органа (Т2аN0M0 — Т2bN0M0) он был у 31 пациента, а у 29 больных опухоль прорастала паравезикальную клетчатку и окружающие органы (T 3а-б N 0 M 0 –22; Т 3б N 1 M 0 –2; Т 4 N 1 M 0 –4; Т 4 N 1 M 1 –1). При гистологическом исследовании у всех 135 больных верифицирован переходноклеточный рак. Опухоли имели следующие градации: G1–51; G2–45; G3–39.
Пациентам с НМИРМП (n=75) выполнена ТУР стенки мочевого пузыря с опухолью, а больным с МИРМП (n+60): 57 выполнена цистэктомия, троим паллиативные операции. При динамическом наблюдении за больными после органосохраняющего лечения выполнялся УЗИ мониторинг, цистоскопический контроль и исследование молекулярных онкомаркеров (мочевой UBC и сывороточные TPA, TPS, VEGF). После цистэктомии УЗИ контроль и сывороточные TPA, TPS, VEGF. При повышенных уровнях онкомаркеров выполнялась МРТ.
Отбор больных с РМП проведен в соответствии с клиническими критериями включения и исключения. Критерии включения:
-
— пациенты с первичным и рецидивным переходно-клеточным (уротелиальным) РМП: стадии Та-4NxMx;
— отсутствие макрогематурии, острой задержки мочеиспускания, требующей установки уретральных катетеров, на момент забора биоматериала на исследование.
Критерии исключения:
-
— при гистологическом исследовании верифицирован тип опухоли — аденокарцинома, саркома, лейомиома и другие (не переходно-клеточный рак);
-
— наличие опухолей других локализаций (в т.ч. рак лоханки и мочеточника, рак простаты);
-
— неотложные состояния (острый инфаркт миокарда, острое нарушение мозгового кровообращения, тромбоэмболия легочной артерии);
-
— почечная и печеночная недостаточность;
-
— заболевания сердечно-сосудистой системы атеросклеротического генеза и артериальная гипертония 3–4 стадии.
Для получения сыворотки забиралась венозная кровь в утренние часы до приема пищи. После забора в течение часа кровь доставлялась в лабораторию для последующей обработки. При определении уровня ТРА и TPS в исследуемой сыворотке крови использованы наборы реактивов «TPAcyk ELISA» и «TPS ELISA» фирмы IDL Biotech AB (Швеция) по прилагающимся к наборам методикам, содержание VEGF — наборы реактивов ЗАО «Вектор Бест», Новосибирск.
На преаналитическом этапе при сборе образцов мочи в мочевые стаканчики по 100 мл в каждый наносили на дно 20 мкл реактива «ProClin 300». При заполнении стакана происходило быстрое растворение стабилизатора в моче. Образцы мочи, содержащие 0,02% «ProClin 300» доставлялись в лабораторию в течение двух часов, где центрифугировались 10 минут при 1500 g. Супернатант отбирался и замораживался в полипропиленовых пробирках «Эппен-дорф» при температуре –25оС и хранился до момента исследования. Перед проведением исследования образцы размораживались при комнатной температуре, перемешивались и центрифугировались 5 минут при 3000 g. Определение уровня UBC в моче производилось методом твердофазного ИФА наборами реактивов «UBC II ELISA» фирмы IDL Biotech AB (Швеция) по прилагающейся к набору методике.
Для математического и статистического анализа полученных результатов использовались пакеты компьютерных программ Statistica v6.0 (StatSoft Inc.), SPSS 13.0 for Windows (SPSS Inc.), Microsoft Office Excel 2007. Для определения вида распределения данных в выборке использовались критерии Колмогорова — Смирнова и Шапиро — Уилка. В исследовании имело место распределение значений в выборках, которое отличалось от нормального. Поэтому в процессе статистической обработки использовались методы непараметрического анализа, который включал вычисление медианы, квартилей вариационного ряда, максимальных и минимальных значений. В качестве критерия достоверности отличия между двумя независимыми группами использовался непараметрический критерий (U) Манна — Уитни.
Чувствительность и специфичность представленных методик диагностики определялась с помощью построения характеристической кривой (ROC-анализ) при разных точках разделения значений лабораторных показателей. ROC-кривые приведены для следующих показателей: TPA, TPS, ФРЭС, UBC. Для выявленных методом ROC-анализа эффективных диагностических показателей построены кривые зависимости чувствительности и специфичности от уровня точки отсечения. Также предложены точки отсечения (дискриминационный уровень, cut off), соответствующие максимально возможной чувствительности и специфичности применения эффективных диагностических показателей.
Результаты. Полученные результаты представлены в табл. 1, 2 и на рис. 1–3.
Как видно, при прорастании опухоли в мышечный слой отмечается значительный подъем уровня цито-кератина в моче (табл. 1). В более поздних стадиях уровень онкомаркера не позволяет отличить инвазивный рак от рака с экстраорганной локализацией. Можно считать, на стадии инвазии при РМП в мочу попадают лишь цитокератины с поверхности слизистой оболочки мочевого пузыря. То есть UBC, как онкомаркер, имеет диагностическую ценность для раннего обнаружения рецидивов РМП и для уточнения вопроса перехода РМП в Т2 стадию. Также высокие значения уровня UBC отмечаются у РМП с высоким риском инвазивного роста и плохим прогнозом — низкодифференцированный РМП.
Анализ уровней онкомаркеров-цитокератинов показал статистически достоверный (p<0,05) рост содержания TPA, TPS в сыворотке крови больных НМИРМП по сравнению с больными в группах контроля и сравнения (табл. 1). Также отмечался достоверный рост содержания UBC в моче больных
Таблица 1
Содержание цитокератинов и VEGF в сыворотке крови у больных РМП
|
Группа обследованных |
UBC, мкг/мл |
TPA, нг/мл |
TPS, ед/л |
VEGF, пг/мл |
|
Контрольная группа |
16,9;10,9;34,5 |
0,12;0;1,21 |
14,1;12,1;35,7 |
53,0; 13,7; 266,5 |
|
Группа сравнения: больные циститами |
24,3;6,7;49,6* |
0,97;0,6;3,2* |
16,1;11,2;30,5 |
97,5;56,7;400,8* |
|
Немышечноинвазивный РМП без рецидива |
33,8; 26,8;108,5* |
1,25;1;15,1 |
61,5;45,6;86,2* |
123,9;28,7;195,0* |
|
Немышечноинвазивный РМП с рецидивом |
45,3;31,7;0;233,1* |
2,48;0,27;5,5* |
98,4;40,2;198,* |
266,1;144,6;629,0* |
|
Инвазивный РМП в пределах органа |
86,5;46,6;408,5* |
1,75;1,4;2,45* |
146,9;101,1;188,8* |
326,6;48,4;1208,0* |
|
Инвазивный РМП с экстра-органной инвазией |
143,5;16,6;375,5* |
2,6;1,8;2,9* |
194,3;181,1;248,8* |
568,8;197.2;3215,0* |
|
П р и м еч а н и е : *Р≥0,05 (по критерию Манна — Уитни). |
||||
Таблица 2
Диагностическая чувствительность и специфичность онкомаркеров и VEGF при определении стадии инвазии рака мочевого пузыря
|
Стадия инвазии |
UBC мочи |
TPA сыворотки крови |
TPS сыворотки крови |
VEGF сыворотки крови |
|
Переход мышечно-неинвазивного рака (Та-Т1) в мышечно-инвазивный без экстарорганной инвазии (Т2-Т3а) |
64,1 мкг/мл Чувств. 60% Специф. 83% |
1,89 нг/мл Чувств.66,7% Специф. 50% |
106,93 Ед/л Чувств. 80% Специф. 70,8% |
192,2 нг/мл Чувств. 75% Специф. 82,8% |
|
Переход мышечно-инвазивного рака (Т2-Т3а) в мышечно-инвазивный с экстраорганной инвазией (Т3б-Т4) |
89,1 мкг/мл Чувств. 83,3% Специф. 73% |
2,38 нг/мл Чувств. 66,7% Специф. 60% |
181,29 Ед/л Чувств. 80% Специф. 70,8% |
266,05 нг/мл Чувств. 73% Специф. 75,8% |
НМИРМП с рецидивом опухолевого роста в течение года после ТУР. Уровни ТРА и TPS в сыворотке крови пациентов групп сравнения значительно меньше, чем у пациентов с онкологическим процессом. Их содержание зависит от стадии онкологического процесса и в меньшей степени зависит от степени дифференцировки опухоли. Такие характеристики TPS и TPA позволяют рассматривать его как специфичный и чувствительный онкомаркер, уровень которого отражает стадию роста РМП. По-видимому, подъем экспрессии цитокератинов опухолью, распад клеток вследствие некроза и апоптоза приводят к их появлению в кровотоке.
Одновременно на фоне повышения уровня ци-токератинов отмечалось статистически достоверное повышение уровня VEGF относительно группы сравнения и контрольной группы (табл. 1). Наиболее высокие значения VEGF отмечены у больных экс-траорганным и низкодифференцированным РМП. То есть при РМП дополнительным прогностическим сывороточным маркером при РМП можно считать содержание VEGF. Высокие значения VEGF в группе с НМИРМП дают основание считать, что патогенетический механизм формирования поверхностным раком сети новообразованных сосудов запускается на ранней стадии РМП и прогрессирует по мере дальнейшего роста опухоли.
Таким образом, нарастание уровня UBC в моче характеризует начальные стадии РМП. Одновременный подъем содержания UBC в моче и TPA, TPS в сыворотке крови связан с прогрессией опухолевого роста и характеризует начальный этап инвазии РМП в мышечный слой. Уровни содержания факторов ангиогенеза, прежде всего VEGF, могут быть использованы для уточнения стадии РМП и степени диффе- ренцировки опухоли. Высокий уровень VEGF связан с высокой активностью опухолевого роста и низкой степенью ее дифференцировки.
Данные ROC-анализа позволяют сделать предположение, что при комбинировании маркеров UBC и TPS можно повысить чувствительность и специфичность для дифференциальной диагностики между стадией внутриорганной инвазии и экстраорган-ной инвазией РМП (табл. 2). На рис. 1, 2 приведены ROC-кривые комбинированного использования онкомаркеров UBC, ТРА и TPS, на рис. 3 — UBC и VEGF. ROC-анализ диагностической ценности цито-кератинов показал, что все три онкомаркера могут быть признаны эффективными в качестве маркеров мышечно-инвазивного РМП. Построение характеристической кривой позволило выбрать диагностический порог (точку отсечения, cut off), который соответствует максимально возможной чувствительности и специфичности. Если за критерий разделения стадий внутриорганной и экстраорганной инвазии взять сочетания уровня UBC более 89,1 мкг/мл, и уровня TPS более 181,29 Ед/л, то чувствительность составит 93% при специфичности 83% (табл. 2).
В клинической практике основные характеристики опухолевого роста, имеющие значение в выборе тактики лечения, становятся известными: либо во время выполнения непосредственно цистоскопии и ТУР (количество и максимальный размер опухолевых фокусов), либо после получения результата гистологического исследования (стадия заболевания; степень дифференцировки уротелиального рака G), на которое необходимо от пяти до десяти суток. В ходе проводимой работы установлено, что еще до начала оперативного лечения и получения результата гистологического исследования удален-
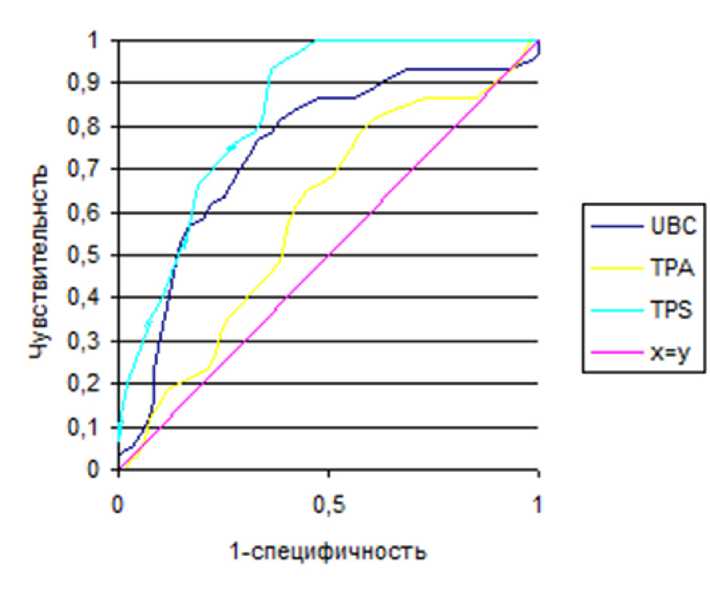
Рис. 1. ROC-анализ значимости онкомаркеров при диагностике между неинвазивно-мышечным и инвазивным РМП в пределах органа.
ной опухолевой ткани (то есть на этапе уточняющей диагностики) с высокой диагностической эффективностью можно узнать об основных характеристиках опухолевого роста с помощью определения уровня следующих биомаркеров: в моче — UBC, в сыворотке крови — TPS и и VEGF.
Обсуждение. В сравнении с цитологическим исследованием осадка мочи молекулярные маркеры РМП (мочевой — UBC и сывороточные TPA, TPS) обладают большей диагностической чувствительностью. Кроме того, являясь количественным методом, определение уровня молекулярных маркеров РМП позволяет оценить вероятность наличия заболевания, а также провести диагностику стадий внутриор-ганной и экстраорганной инвазии.
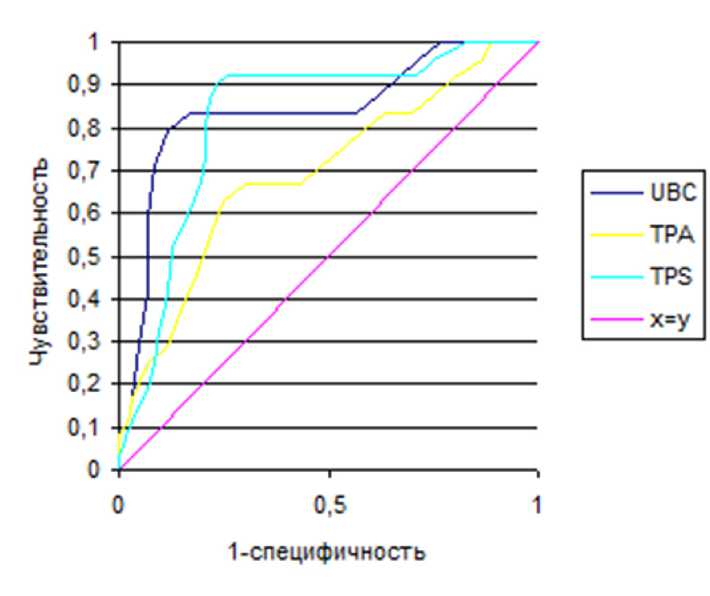
Рис. 2. ROC-анализ значимости онкомаркеров при диагностике между инвазивным РМП в пределах органа и экстра-органной инвазией
На основании проведенного исследования можно предложить следующую последовательность диагностики поверхностного РМП с использованием молекулярных маркеров. У пациента с подозрением на РМП производится забор биоматериала для исследования уровня онкомаркеров TPA и TPS, VEGF в сыворотке, UBC в моче, цитологического исследования мочи. В случае, если уровень онкомаркеров не превышает следующих величин: TPS — 61,5 Ед/л; TPA — 1,05 нг/мл; UBC — 22,55 мкг/мл, VEGF — 198,2 нг/мл, с достаточной долей вероятности можно считать, что имеется доброкачественное заболевание мочевого пузыря. В случае, если результаты исследования содержания онкомаркеров в сыворотке и моче приходятся на так называемую «серую зону», требуется дополнительное обследование и динамическое исследование онкомаркеров. В случае превышения уровней онкомаркеров: TPS — 82,6 Ед/л; TPA — 1,52 нг/мл; UBC — 50,1 мкг/мл, VEGF — 266,05 нг/мл и/или обнаружения атипичных клеток в моче, с высокой долей вероятности констатируется диагноз РМП на стадии внутриорганной и экстраорганной инвазии, проводится установление стадии с помощью инструментальных методов, морфологически подтверждается и онкоконсилиумом принимается решение об характере и объеме лечения.
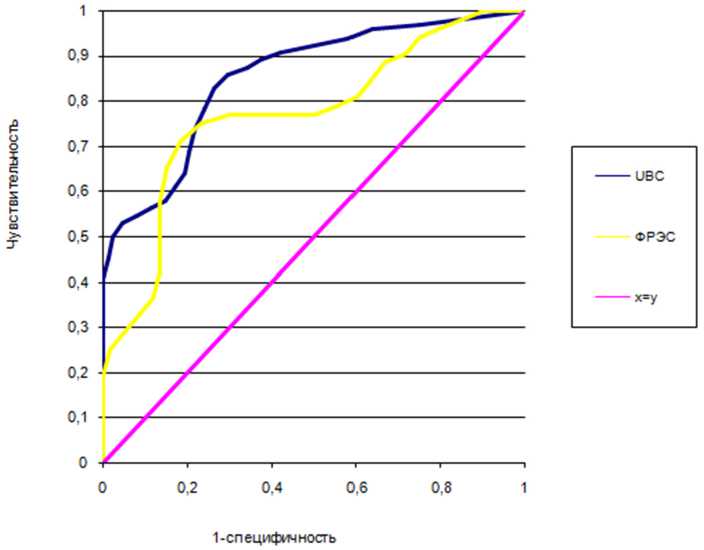
Рис. 3. ROC-анализ значимости содержания UBC мочи и VEGF сыворотки крови при диагностике между инвазивным РМП в пределах органа и экстраорганной инвазией
При динамическом наблюдении в течение 3,5±0,5 года за пациентами НМИРМП после ТУР мочевого пузыря с опухолью из 75 больных у 27 (36%) в первый год диагностирован рецидив заболевания. Из них у 11 (14,6%) человек диагностирована прогрессия заболевания: у 4 (5,3%) пациентов — переход из стадии Та в стадию Т1, а у 3 (4%) — переход из НМИРМП в мышечно-инвазивный РМП.
Пациентам с МИРМП (n+60) у 57 выполнена цистэктомия, у трех паллиативные операции. Из всех 135 больных в течение двух лет умер 21 (15,5%) больной от прогрессии онкологического заболевания, 114 (84,5%) пациентов находятся под нашим наблюдением в течение 3,5±0,5 года.
Заключение. Таким образом, проведенное исследование молекулярных маркеров позволяет осуществить персонализированную диагностику и лечение у больных РМП. Наши данные показывают, что наибольшую чуствительность и специфичность в стадировании РМП имеют три маркера — UBC, TPS и VEGF. Нарастание уровня UBC в моче характеризует начальные стадии РМП и возможный неинвазивный рецидив опухоли при органосохраняющем лечении. У больных с НМИРМП повышенный уровень VEGF может служить дополнительным критерием не только рецидива заболевания, но и его прогрессии. Одновременный подъем содержания UBC в моче и TPS, VEGF в сыворотке крови связан с прогрессией опухо- левого роста и характеризует начальный этап инвазии РМП в мышечный слой. Высокий уровень VEGF характерен для выхода опухоли за пределы органа, а также с высокой активностью опухолевого роста и низкой степенью ее дифференцировки, что является плохим прогностическим фактором. Сывороточные опухолевые маркеры TPS и VEGF также могут быть использованы в диагностике рецидива онкологического заболевания после радикальной цистэктомии, так как мочевые маркеры в таких случаях неприменимы. Включение в диагностический процесс в нашей клинике исследования онкомаркеров у всех больных РМП, показало, что выявление НМИРМП повысилось с 18,1% в 2006 г до 55,6% в 2011 г. Выбранный адекватный стадии объем комплексного лечения позволил снизить рецидивы и летальность у больных РМП в первые 2 года с 32 до 15,5%.
Список литературы Оценка спектра мочевых и сывороточных биомаркеров при определении стадии рака мочевого пузыря
- Bladder tumor markers: a review of the literature/A. Volpe [et al.]//The International Journal of Biological Markers. 2008. Vol. 23 (4). P. 249-261
- Goebell P. J., Knowles M.A. Bladder cancer or bladder cancers? Genetically distinct malignant conditions on the urothelium//Urol. Oncol. 2010. № 28 (4). P. 409-428
- Прогностические молекулярно-генетические маркеры рака мочевого пузыря (обзор литературы)/С. А. Аль-Шукри, В. Н. Ткачук, Н. М. Волков, М. В. Дубина/Онкология. 2009. № 2. С. 78-84
- Кушлинский Н.Е., Герштейн Е.С. Биологические маркеры опухолей в клинике: достижения, проблемы, перспективы//Молекулярная медицина. 2008. № 3. С. 48-55
- Shirodkar S. P., Lokeshwar V. В. Bladder tumor markers: from hematuria to molecular diagnostics where do we stand?//Expert review of Anticancer Therapy. 2008. Vol. 8 (7). P. 1111-1123
- Jacobs L. В., Lee TO, Montie J.E. Bladder cancer in 2010: how far have we come?//CA Cancer J. Clin. 2010. № 60. P. 244-272
- Update of the Clinical Guidelines of the European Association of Urology on muscle-invasive and metastatic bladder carcinoma/A. Stenzl, N. О Cowan, M. De Santis [et al.]/Actas Urol. Esp. 2010, Jan. Vol. 34(1). P. 51-62
- Значение маркеров опухолевого роста и ангиогенеза в диагностике рака мочевого пузыря/П. В. Глыбочко, А. Н. По-нукалин, Н.Б. Захарова, Н.К. Шахапазян//Онкоурология. 2009. № 2. С. 56-60
- Клиническое применение FISH-метода в ранней диагностике поверхностного рака мочевого пузыря/А. В. Се-ванькаев, Е. Ф. Пушников, О. Б. Карякин [и др]/Онкоурология. 2008. №4.0 61-65
- Молекулярно-генетические маркеры как факторы прогноза течения поверхностного рака мочевого пузыря/А. Ю. Бабаян, С. В. Башкатов, О. Б. Карякин [и др.]/Онкоурология. 2009. № 3. С. 19-24
- Harper J., Moses M.A. Molecular regulation of tumor angiogenesis: mechanism and therapeutic implication//EXS. 2006. Vol. 96. P. 223-268
- Konety B.R., Lotan Y. Urothelial bladder cancer: biomarkers for detection and screening//BJU International. 2008. Vol. 102 (9 PtB). P. 1234-1241
- 13. Erythrocyte and platelet phospholipid fatty acids as markers of advanced non-small cell lung cancer: comparison with serum levels of sialic acid, TPS and CYFRA 21-1 // J. de Castro [et al.] // Cancer Invest. 2008. Vol. 26 (4). P. 407-418
- The value of combined use of surviving, cytokeratin 20 and mucin 7 mRNA for bladder cancer detection in voided urine/X.Y. Pu[etal.]//J. Cancer Res. Clin. Oncol. 2008. Vol. 134(6). P. 659-665.


