Оценка степени распространенности рака шейки матки при использовании МРТ
Автор: Трухачва Наталья Геннадьевна, Фролова Ирина Георгиевна, Коломиец Лариса Александровна, Усова Анна Владимировна, Григорьев Евгений Геннадьевич, Величко Светлана Андреевна, Чернышова Алена Леонидовна, Чуруксаева Ольга Николаевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 2 (68), 2015 года.
Бесплатный доступ
Для оценки возможностей высокопольной МРТ в определении степени распространенности рака шейки матки проанализированы данные магнитно-резонансной томографии (МРТ), выполненной 66 пациенткам. МР-томография выполнялась на МР-сканере MAGNETOM ESSENZA (SIEMENS, Германия) с напряженностью магнитного поля 1,5 Т. Применялось внутривенное болюсное введение парамагнетика, с получением динамической серии срезов и отсроченных сканов в стандартной Т1-взвешенной последовательности. Проведен анализ диагностической ценности МРТ в определении стадирования опухолевого процесса, выявлены критерии, характеризующие распространение опухоли за пределы шейки матки.
Стадирование рака шейки матки, магнитно-резонансная томография, химиолучевая терапия
Короткий адрес: https://sciup.org/14056530
IDR: 14056530 | УДК: 618.146-006.6-073.756.8
Текст научной статьи Оценка степени распространенности рака шейки матки при использовании МРТ
В мире рак шейки матки (РШМ) является второй по распространенности онкологической патологией у женщин после рака молочной железы, при этом показатели смертности занимают третье место после рака молочной железы и рака легкого [2, 3, 14]. В России в последние годы заболеваемость РШМ составляет 10,8 на 100 тыс. женского населения [8].
Определение стадии опухолевого процесса при РШМ имеет особую важность для выбора оптимальной тактики лечения, оценки возможности проведения оперативного вмешательства или химиолучевой терапии. При этом в первую очередь учитываются размер опухоли, состояние лимфатических узлов и вовлечение параметрия [5–7]. В мире наибольшее распространение получила система стадирования РШМ, предложенная Международной ассоциацией акушеров-гинекологов (FIGO), параллельно с которой используется Международная классификация по системе ТNM.
Клиническое стадирование основывается в первую очередь на данных комплексного гинекологического обследования, одним из ключевых моментов которого является оценка параметраль-ного распространения опухоли [2, 8]. В то же время рядом исследователей доказано, что клиническая оценка параметральной инвазии недостаточно точна [11, 13]. Также серьезным недостатком клинического стадирования по классификации FIGO является отсутствие информации о состоянии лим- фоузлов. Между тем наличие регионарных лимфогенных метастазов – крайне неблагоприятный прогностический фактор, который существенно снижает выживаемость при РШМ. Несмотря на большую информативность ультразвукового исследования, при определении стадии рака шейки матки сохраняется высокий процент диагностических ошибок.
В последние десятилетия при РШМ все чаще применяются томографические методы диагностики, что обусловлено их способностью, особенно МРТ, улучшить качество оценки анатомических структур таза, вовлекаемых в опухолевый процесс [1]. В диагностике рака шейки матки КТ способна дать информацию о распространенности злокачественного процесса в случае уже установленного диагноза, но при первичной и дифференциальной диагностике возможности ее ограничены [14].
Применение МРТ дает возможность исключить распространение опухоли на тазовые органы, выявить уровень и причину обструкции мочеточников. Это обстоятельство привело к уменьшению диагностической потребности в рентгеновских (внутривенная урография и ирригоскопия) и эндоскопических (цистоскопия и ректоскопия) процедурах. Необходимость в цистоскопии и/или ректоскопии возникает лишь в случаях, когда требуется подтверждение и морфологическая верификация данных МРТ о прорастании опухолью стенки полого органа [4, 9].
Большинство авторов придерживается мнения, что необходимость применения МРТ возрастает пропорционально стадии и объему опухоли, а также при наличии соответствующей патологии внутренних органов [1, 4]. Анализ литературных данных свидетельствует о значительной вариабельности результатов МРТ, сложности интерпретации визуальной картины в выявлении опухоли и определении стадии процесса с целью дальнейшего выбора оптимального оперативного и химиолучевого лечения.
Целью исследования явилась оценка возможностей высокопольной МРТ в определении степени распространенности рака шейки матки.
Материал и методы
В исследование включены 66 больных РШМ, получивших лечение в Томском НИИ онкологии в 2010–2013 гг. Возраст пациенток варьировал от 25 до 63 лет (средний возраст 44,7 ± 1,2 года). Морфологически у 49 (74,3 %) женщин диагностирован плоскоклеточный рак, у 17 (25,7 %) — аденокарцинома разной степени дифференцировки. Оперативное лечение было проведено 23 (34,8 %) пациенткам, 43 (65,1 %) больных получили хи-миолучевое лечение. Пациенткам, получавшим химиолучевое лечение, было выполнено контрольное МР-исследование органов малого таза через 3, 6, 9 и 12 мес после лечения.
МР-томография выполнялась на МР-сканере MAGNETOM ESSENZA (SIEMENS, Германия) с напряженностью магнитного поля 1.5 Т. Выполнялось стандартное МРТ исследование органов малого таза в Т2-ВИ, Т1-ВИ в аксиальной, коронарной, сагиттальной плоскостях. Основными в протоколе исследования являлись Т2-взвешенные изображения (ВИ), полученные с помощью импульсных последовательностей турбо или быстрого спинэхо (TSE, FSE), обеспечивающие хороший контраст между опухолью и окружающими тканями. На сагиттальных срезах оценивали распространение опухоли вдоль длинной оси матки, ее переход на тело и взаимоотношения между опухолью, задней стенкой мочевого пузыря и передней стенкой прямой кишки. Аксиальные и коронарные срезы использовались для оценки перехода опухоли на стенки таза и визуализации лимфоузлов. Наилучшая визуализация параметральной инвазии достигалась с помощью косых аксиальных срезов, ориентированных перпендикулярно длинной оси шейки матки. Обструкция мочеточников хорошо определялась с помощью методики МР-урографии (получение толстого среза в коронарной плоскости с сильной взвешенностью по Т2). Данная методика позволила в течение нескольких секунд, не прибегая к контрастированию, получить изображение мочевого пузыря и расширенных мочеточников. Хороший контраст между лимфоузлами и окружающей жировой клетчаткой обеспечивал режим Т1.
При использовании Т2ВИ лучше дифференцировались лимфоузлы от скелетных мышц, яичников и сосудов. Преимуществом фронтальной плоскости являлась возможность исследовать забрюшинное пространство от лонного сочленения до уровня почечных сосудов. Для визуализации увеличенных парааортальных лимфоузлов были полезными сагиттальные изображения. Аксиальные срезы для адекватной оценки структуры лимфоузлов охватывали область от лонного сочленения до почечных сосудов.
При выполнении магнитно-резонансной томографии для уменьшения артефактов от перистальтики кишечника пациенткам было рекомендовано воздерживаться от приема пищи в течение 5–6 ч до исследования с применением антиперистальтиче-ских препаратов. За 1–2 ч до исследования пациентки принимали 1–2 таблетки но-шпы. Артефакты от дыхательных движений передней брюшной стенки устранялись программными средствами (с помощью полосы сатурации) или механической компрессией живота эластичным поясом.
Для уточнения распространения опухоли, определения границ опухоли, уточнения ее структуры применялось внутривенное болюсное введение парамагнетика (Омнискан) в дозе 2 мл/10 кг массы тела, с получением динамической серии срезов с интервалом 12–14 сек, и отсроченных сканов в стандартной Т1-взвешенной последовательности. С целью оценки распространения опухоли за пределы шейки матки дополнительно проводилось исследование с программой «подавления» сигнала от жировой ткани (Т2-FatSat или TIRM).
Статистический анализ данных проводился с использованием Microsoft Excel и пакета прикладных программ SPSS 13.0.
Результаты исследования и обсуждение
Значение при визуализации рака шейки матки имели: форма роста, размеры и глубина стромальной инвазии. Как уже было указано, оптимальными для визуализации опухолей шейки матки являются Т2-ВИ. При этом опухоль имеет сигнал средней или повышенной интенсивности на фоне стромы, имеющей низкоинтенсивный сигнал. Структура опухоли зависит от ее размеров. При размерах от 20 до 30 мм структура опухоли была однородной в 63,9 % случаев. Новообразования с размерами от 35 до 60 мм имели неоднородную структуру за счет наличия кистозного компонента или распада, что характеризовалось наличием участков с высокой интенсивностью Т2 сигнала.
Для определения стадии по кодификатору Т анализировались размеры новообразования, локализация, глубина инвазии в строму, состояние цервикального канала, парацервикальной клетчатки, тела матки, влагалища, мочевого пузыря, прямой кишки, стенок таза. В 61 (92,4 %) случае имелось циркулярное поражение шейки с признаками ин-
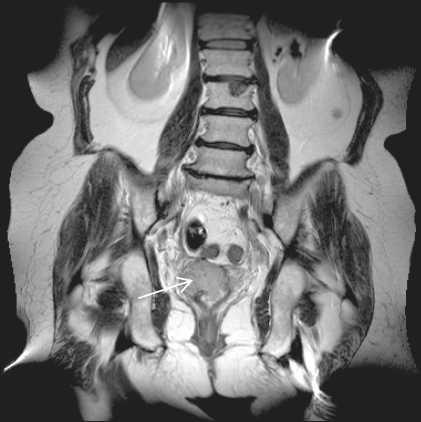
Рис. 1. В области шейки матки визуализируется циркулярно расположенное мягкотканное опухолевое образование, инфильтрирующее все слои шейки, цервикальный канал и парацервикальную клетчатку. Эндоцервикс замещен опухолевой тканью, цервикальный канал не визуализируется, с признаками опухолевой инфильтрации на всем протяжении опухоли. Визуализируются нечеткость и прерывистость наружного слоя шейки матки в области боковых стенок, интенсивность парацервикальной клетчатки на этом уровне в Т2-режиме снижена
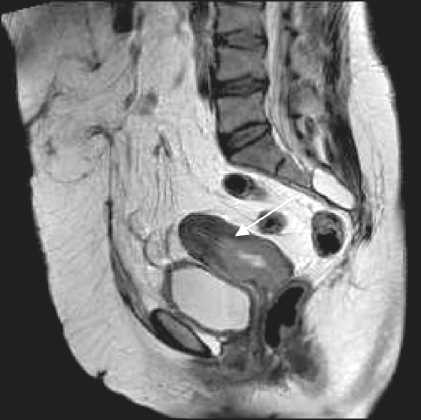
Рис. 2. В шейке матки визуализируется циркулярное Т1-гипо, Т2-гиперинтенсивное опухолевое образование, с нечеткими, бугристыми контурами. Верхний полюс опухоли распространяется на нижний сегмент тела матки циркулярно на протяжении 15 мм, с признаками инфильтрации полости матки, эндометрия и миометрия
фильтрации стромы, в остальных случаях опухоль локализовалась в области одной из стенок шейки; эндоцервикс был инфильтрирован в 45 (68,1 %) случаях, распространение опухоли на цервикальный канал выявлено в 37 (56,1 %) случаях (рис. 1). Переход опухоли шейки на тело матки определялся у 19 (28,8 %) больных, при этом на томограммах визуализировалось распространение опухолевых масс через внутренний зев в полость матки с нарушением ее нормальной зональной анатомии и изменением интенсивности МР-сигнала на Т2-ВИ (рис. 2). Распространение опухоли на парацервикальную клетчатку отмечено в 26 (39,4 %) случаях, что характеризовалось прерыванием целостности гипоинтенсивной полоски стромы шейки матки в сочетании с неровностью и размытостью контуров опухоли в этом месте. У 7 (10,6 %) пациенток было выявлено распространение опухолевой инфильтрации на верхнюю треть влагалища, которое проявлялось непрерывным или дискретным утолщением стенки влагалища и нарушением её целостности (рис. 3). Распространение опухолевой инфильтрации на заднюю стенку мочевого пузыря зарегистрировано в 3 (4,5 %) случаях, реже выявлялась инфильтрация устья одного из мочеточников – 1 (1,5 %). Инфильтрация стенки прямой кишки была установлена в 4 (6,1 %) случаях. В 5 (7,6 %) случаях по данным МРТ поражение шейки матки не было выявлено по причине небольших размеров опухоли (5 мм и меньше) и отсутствия вовлечения смежных структур.
Оценка состояния лимфоузлов является одной из важнейших задач МР-исследования при РШМ.
При метастатическом поражении лимфоузлов меняется прогноз заболевания и вносятся значительные изменения в план лечения. К сожалению, точность традиционной МРТ в диагностике лимфогенных метастазов оценивается как невысокая. Использование контрастного усиления препаратами гадолиния не дает дополнительной информации для оценки состояния лимфоузлов (ЛУ), а органоспецифичные лимфотропные контрастные препараты на основе ультрамелких суперпарамагнитных частиц оксида железа пока остаются недоступными для клинического применения. Регионарными для шейки матки являются парацервикальные, параметральные, внутренние подвздошные, обтураторные, наружные и общие подвздошные, пресакральные и латеральные сакральные лимфоузлы. Поражение других лимфатических структур, например парааортальных ЛУ, классифицируется как отдаленные метастазы и относится к IVВ стадии заболевания. Основным критерием оценки лимфоузлов с помощью любого томографического метода является их размер, причем предпочтение отдается поперечному размеру. В качестве точки разделения используют значения в интервале от 6 до 15 мм, но наиболее часто верхней границей нормы для тазового лимфоузла считают 10 мм. Минимальный диаметр, превышающий 10 мм, рассматривается в качестве наиболее достоверного критерия метастатического поражения, хотя некоторые авторы считают подозрительными тазовые ЛУ с максимальным размером, превышающим 10 мм [1, 14]. Кроме того, имеются данные о том, что при метастатическом поражении лимфоузла
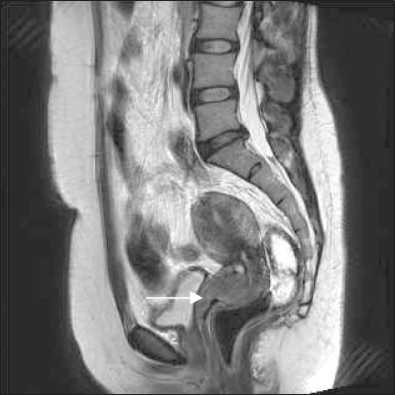
Рис. 3. В шейке матки визуализируется Т2-гиперинтенсивное мягкотканное опухолевое образование, расположенное преимущественно по передней губе шейки, при этом нижний полюс опухоли распространяется на переднюю стенку влагалища на протяжении 20 мм
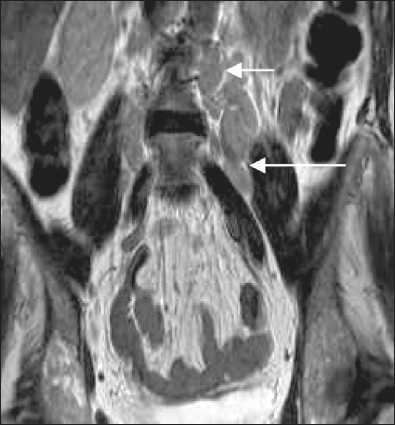
Рис. 4. Парааортально, паракавально и по ходу общих подвздошных сосудов с обеих сторон визуализируются цепочки увеличенных лимфоузлов, размером от 15 до 45 мм, местами сливающихся в конгломераты
его форма округляется [9]. Поэтому в качестве косвенного признака метастатического поражения лимфоузла предлагается использовать увеличение отношения меньшего диаметра к большему (более 0,8) [12]. Хотя даже мелкие лимфоузлы могут оказаться пораженными, а увеличенные – могут не содержать опухолевой ткани. Нередко к реактивному увеличению лимфатических узлов приводит опухолевый процесс в малом тазу [12, 13]. Вместе с тем при выявлении больших конгломератов лимфоузлов (более 2 см) с наличием участков распада и геморрагий метастатический характер изменений не вызывает сомнений. Есть данные о том, что наличие центрального некроза в лимфоузле может быть использовано для диагностики его метастатического поражения [10]. Положительное прогностическое значение этого признака, независимо от размера узла, равно 100 %. Некроз проявляется на МРТ сигналом, изоинтенсивным жидкости в режимах Т1 и Т2 [1].
Выявленное вовлечение в процесс подвздошных, параректальных, парацервикальных и забрюшинных лимфоузлов позволило оценить лимфогенное распространение процесса и распределить обнаруженные изменения по критерию N системы TNM. При этом было обнаружено увеличение лимфоузлов в поперечнике больше чем на 10 мм в парацервикальной клетчатке – в 2 (3,0 %) и в параректальной клетчатке – в 5 (7,6 %) случаях. Лимфоузлы по ходу наружных подвздошных сосудов были увеличены в 37 (56,1 %) случаях, по ходу внутренних подвздошных сосудов – в 11 (16,7 %), по ходу общих подвздошных сосудов – в 23 (34,8 %) наблюдениях, кроме того, частота увеличения пара-аортальных и паховых ЛУ составила по 17 (25,8 %) наблюдений в каждой группе, паракавальных – в 5 (7,6 %) случаях (рис. 4). В большинстве случаев – у 49 (74,2 %) больных – лимфоузлы имели Т1- и Т2-гипоинтенсивный сигнал, из них у 11 (16,7 %) – структура лимфоузлов была неоднородной из-за наличия жидкостных включений. Контуры лимфоузлов были бугристыми в 54 (81,8 %) случаях.
Описанные по данным МРТ характер роста и степень распространенности опухолевого процесса совпали с данными хирургической ревизии и морфологического исследования у 18 (78,2 %) пациенток из 23 прооперированных. При сопоставлении результатов МРТ и хирургического стадирования было установлено, что по данным томографии у 5 (21,7 %) пациенток опухоль не визуализировалась, в то время как по данным оперативного вмешательства у них был диагностирован РШМ IА стадии. Диагностические ошибки в данном случае объясняются тем, что при стадии IА размеры опухолевого образования не превышали 5 мм. Рак шейки матки ІВ стадии по данным магнитно-резонансной томографии был установлен в 3 (13,0 %) из 4 (17,3 %) случаев. Стадия IIА по данным хирургического стадирования была выявлена у 4 (17,3 %) пациенток, по данным МРТ – у 5 (21,7 %). Ложноположительные результаты МРТ у 3 (4,5 %) пациенток были обусловлены наличием сопутствующей патологии (воспалительный процесс в полости малого таза, миома матки), вследствие чего магнитно-резонансная картина (высокая интенсивность сигнала от шейки матки в Т2-режиме, умеренная неоднородность, нечёткие контуры) была близка к магнитно-резонансным симптомам опухолевого процесса. Ложноотрицательные результаты МРТ отмечены у 5 (7,6 %) пациенток, опухолевый процесс не визуализировался таблица
Динамика распространенности опухолевого процесса у больных рШМ (n=43), получивших химиолучевое лечение по данным контрольных Мрт
При РШМ IIВ, IIIА и IIIВ стадий в силу большой распространенности процесса хирургическое лечение не проводилось, поэтому 43 (65,1 %) больным было назначено химиолучевое лечение и стадирование выполнялось на основании клинического исследования в сопоставлении с данными МРТ. У этой группы пациенток по результатам контрольных МРТ в сроки 3, 6, 9, 12 мес после лечения были проанализированы посттерапевтические изменения первичной опухоли (таблица). Наиболее существенные положительные результаты получены при исследовании через 12 мес. В эти сроки было установлено, что у 14 (32,5 %) больных опухолевое образование в шейке матки не визуализируется. Инфильтрация стромы шейки матки сохранялась у 16 (37,2 %), инфильтрация эндоцервикса – у 12 (27,9 %), распространение опухоли на цервикальный канал – у 7 (16,2 %), переход опухоли шейки на тело матки – у 5 (11,6 %), вовлечение парацервикса – у 4 (9,3 %) пациенток.
Список литературы Оценка степени распространенности рака шейки матки при использовании МРТ
- Березовская Т.П., Шавладзе З.Н., Прошин А.А. Проспективное исследование зависимости между непосредственными/ближайшими результатами лучевого лечения больных раком шейки матки и объемом опухоли, определенным с помощью МРТ и УЗИ//Материалы научной конференции «От лучей Рентгена -к инновациям XXI века». СПб., 2008. С. 73.
- Давыдов М.И., Ганцев Ш.Х. Онкология. М., 2010. 920 с.
- Коломиец Л.А., Чуруксаева О.Н., Шпилева О.В., Уразова Л.Н., Родичева Н.С. Особенности распространения различных типов вирусов папилломы человека (ВПЧ) у пациенток с цервикальными неоплазиями и раком шейки матки в г. Томске//Сибирский онкологический журнал. 2012. № 3. С. 41-45.
- Рубцова Н.А., Новикова Е.Г., Синицын В.Е. Возможности МРТ в предоперационной оценке местной распространенности рака шейки матки//Акушерство, гинекология, репродукция. 2012. Т. 6, № 3. С. 6-13.
- Трухачёва Н.Г., Фролова И.Г., Коломиец А.Л., Чернышова А.Л., Чуруксаева О.Н. Применение МРТ в диагностике рака шейки матки//Материалы 16-й межрегиональной научно-практической конференции с международным участием «Актуальные проблемы медицины». Абакан, 2013. С. 234-236.
- Чуруксаева О.Н. Повышение эффективности лечения больных местно-распространенным раком шейки матки: Автореф. дис.... д-ра мед. наук. Томск, 2013. 41 с.
- Шавладзе З.Н., Березовская Т.П., Прошин А.А. Клинико-диагностические аспекты магнитно-резонансного стадирования рака шейки матки//Медицинская визуализация. 2009. № 5. С. 80-90.
- Шакирова Э.Ж., Муллагалиева А.М., Хасанов Р.Ш., Сухорукова Л.К. Проблемы диагностики и лечения местнораспространенного рака шейки матки//Казанский медицинский журнал. 2007. Т. 88, № 6. С. 628-630.
- Choi H.J., Roh J.W., Seo S.S., Lee S., Kim J.Y., Kim S.K., Kang K.W., Lee J.S., Jeong J.Y., Park S.Y. Comparison of the accuracy of magnetic resonance imaging and positron emission tomography/computed tomography in the presurgical detection of lymph node metastases in patients with uterine cervical carcinoma: a prospective study//Cancer. 2006. Vol. 106 (4). P. 914-922.
- Ebner F., Tamussino K., Kressel H.Y. Magnetic resonance imaging in cervical carcinoma: diagnosing, staging, and follow-up//Magn. Reson. Q. 1994. Vol. 10 (1). P. 22-42.
- Hricak H., Brenner D.J., Adelstein S.J., Frush D.P., Hall E.J., Howell R.W., McCollough C.H., Mettler F.A., Pearce M.S., Suleiman O.H., Thrall J.H., Wagner L.K. Managing radiation use in medical imaging: al multifaceted challenge//Radiology. 2011. Vol. 258 (3). P. 889-905 DOI: 10.1148/radiol.10101157
- Tacikowska M. Dynamic MR imaging of soft tissue tumors with assessment of the rate and character of lesion enhancement//Med. Sci. Monit. 2002. Vol. 8 (2). MT31-35.
- Yang W.T., Lam W.W., Yu M.Y., Cheung T.H., Metreweli C. Comparison of dynamic helical CT and dynamic MR imaging in the evaluation of pelvic lymph nodes in cervical carcinoma//Am. J. Roentgol. 2000. Vol. 175 (3). P. 759-766.
- Zola P., Tripodi E., Zanfagnin V., Baima Poma C., Perotto S., Modaffari P., Martra F., Fuso L. Лечение раннего рака шейки матки: выживаемость, осложнения и экономические аспекты//Сибирский онкологический журнал. 2012. № 3. С. 14-21.


