Оценка структурных изменений миокарда левого предсердия по данным магнитно-резонансной томографии с контрастированием до и после баллонной криоаблации у пациентов с персистирующей фибрилляцией предсердий
Автор: Стукалова О. В., Кирилова В. С., Апарина О. П., Майков Е. Б.
Журнал: Евразийский кардиологический журнал @eurasian-cardiology-journal
Рубрика: Оригинальные статьи
Статья в выпуске: 2, 2023 года.
Бесплатный доступ
Цель. Изучить структурные изменения миокарда левого предсердия по данным магнитно-резонансной томографии с контрастированием у больных с персистирующей формой фибрилляции предсердий до и после баллонной криоаблации и сопоставить результаты с эффективностью проведенного вмешательства.
Левое предсердие, фиброз, фибрилляция предсердий, баллонная криоаблация, магнитно-резонансная томография, легочные вены, структурное поражение
Короткий адрес: https://sciup.org/143180187
IDR: 143180187 | УДК: 616.1 | DOI: 10.38109/2225-1685-2023-2-38-46
Текст научной статьи Оценка структурных изменений миокарда левого предсердия по данным магнитно-резонансной томографии с контрастированием до и после баллонной криоаблации у пациентов с персистирующей фибрилляцией предсердий
Данная статья распространяется на условиях «открытого доступа», в соответствии с лицензией CC BY-NC-SA 4.0 («Attribution-NonCommercial-ShareAlike» / «Атрибуция-Некоммерчески-Сохранение Условий» 4.0), которая разрешает неограниченное некоммерческое использование, распространение и воспроизведение на любом носителе при условии указания автора и источника. Чтобы ознакомиться с полными условиями данной лицензии на русском языке, посетите сайт:
This is an open access article distributed under the terms of the Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International (CC BY-NC-SA 4.0) License , which permits unrestricted use, distribution, and reproduction in any medium, provided the original author and source are credited.
Катетерная аблация при персистирующей форме фибрилляции предсердий (ФП) рекомендована при симптомном течении аритмии и неэффективности по крайней мере одного антиаритмического препарата (ААП) I или III класса [ESC IА] [1]. Однако эффективность вмешательства у данной категории пациентов составляет в среднем 55% и уступает эффективности интервенционного лечения при пароксизмальной форме аритмии (71,5%) [2,3]. Среди факторов, способствующих прогрессированию персистирующей ФП, выделяют: структурное и электрическое ремоделирование левого предсердия (ЛП) [4], сопутствующие заболевания [5], традиционные факторы риска – пол [6], возраст, длительность анамнеза ФП [7], увеличение размеров ЛП [8], а также генетические факторы [9].
В последние годы отмечается рост количества публикаций о роли структурного ремоделирования предсердий, как одного из ключевых факторов прогрессирования ФП [4]. В 2016 году Европейским обществом кардиологов был предложен консенсус, в котором подчеркивается важная роль структурных изменений миокарда предсердий, усугубляющих электрофизиологические изменения в ЛП и являющихся субстратом для прогрессирования ФП [10].
Необходимость в более детальном изучении взаимосвязи между клиническим течением и результатами интервенционного лечения персистирующей ФП требует неинвазивного и безопасного изучения структурных изменений миокарда ЛП у широкой категории пациентов. Данная задача была решена с усовершенствованием технологии магнитно-резонансной томографии (МРТ) с отсроченным контрастированием с возможностью получения изображений высокого разрешения. Применение МРТ с контрастированием высокого разрешения наряду с новым методом обработки МР-изображений позволило визуализировать тонкий миокард ЛП и выявить в нем зоны фиброза, а также постаблационные повреждения [11]. В клинических исследованиях было продемонстрировано, что выраженность фиброзного поражения ЛП ассоциированна с эффективностью интервенционного лечения пароксизмальной и персистирующей ФП [12].
В связи с изложенными выше данными, значительный интерес представляют особенности фиброзного поражения ЛП при персистирующей форме ФП, при которой влияние субстрата на развитие и прогрессирование аритмии может быть более выраженным, чем при пароксизмальной форме. Кроме того, актуально изучение возможной взаимосвязи структурных изменений ЛП при персистирующей ФП с результатами интервенционного лечения аритмии, в том числе при расширенных протоколах вмешательства, при которых предполагается, что источники ФП могут быть устранены без их точной электро-анатомической идентификации [13]. Научный поиск в этом направлении потенциально может привести к усовершенствованию протоколов хирургического лечения персистирующей ФП.
Целью настоящего исследования было изучить эффективность баллонной криоаблации легочных вен (ЛВ) и расширенной криоаблации левого предсердия и связь с исходной выраженностью структурных изменений миокарда левого предсердия по данным МРТ с отсроченным контрастированием.
МЕТОДЫ ИССЛЕДОВАНИЯ
В проспективное рандомизированное исследование были включены пациенты с персистирующей формой ФП, у которых имелись показания к проведению КБА согласно текущим международным и национальным рекомендациям. Пациенты были рандомизированы на две группы методом закрытых конвер- тов. В первую группу включены пациенты, которым планировалось выполнение КБА ЛВ. Во вторую группу были включены пациенты, которым предполагалось выполнение расширенной КБА ЛП, предусматривающей антральную изоляцию ЛВ в сочетании с криоаблацией задней стенки ЛП.
Всем больным в рамках общеклинического обследования перед вмешательством были выполнены: общий и биохимический анализы крови, гормонов щитовидной железы, 12 канальная электрокардиограмма (ЭКГ), холтеровское мониторирование ЭКГ, трансторакальная эхокардиография (ЭХОКГ), мультиспиральная компьютерную томографию (МСКТ) сердца с контрастированием для оценки объема левого предсердия и анатомии ЛВ, МРТ сердца с отсроченным контрастированием до вмешательства и через 3 месяца после КБА. Холтеровское мониторирование ЭКГ с оценкой сердечного ритма проводилось на 1-е сутки после операции, через 3, 6 и 12 месяцев. Пациенты, включенные в текущее исследование, наблюдались в течение 1 года после операции. Критерием эффективности считалось отсутствие зарегистрированной по данным ЭКГ и ХМЭКГ устойчивой (продолжительностью более 30 сек) тахиаритмии (фибрилляции предсердий, трепетание предсердий, предсердной тахикардия), возникающей после окончания трехмесячного периода, либо субъективных ощущений эпизодов учащенного сердцебиения в течении периода наблюдения. Ранними рецидивами считались эпизоды ФП, регистрирующиеся в первые 3 месяца после КБА
Процедура криоаблации
Антральная изоляция ЛВ в обеих группах выполнялась по методике, описанной ранее Conti S. Et al. [25]. В группе № 2 помимо КБА ЛВ проводилась серия аппликаций криобаллоном в области задней стенки ЛП по методике, предложенной Aryana A. et al [24]. Выполнялось от 9 до 13 криоаппликаций в области задней стенки левого предсердия, с длительностью каждого воздействия от 120 до 180 секунд. КБА в области задней стенки ЛП проводилась под контролем температурного датчика в пищеводе.
Магнитно-резонансная томография левого предсердия с отсроченным контрастированием
Всем пациентам с персистирующей формой ФП до и через 3 месяца после криоаблации была выполнена МРТ сердца на магнитно-резонансном томографе с напряженностью поля 1,5 Тл (Magnetom Aera, Siemens, Германия). Для оценки структурных изменений ЛП использовалась новая специализированная последовательность МРТ, которая была разработана в Университете штата Юта, США, – градиентная последовательность IR (inversion-recovery) с подавлением сигнала от жира и изотропным вокселем размером 1,25 x 1,25 x 2,5 мм, реконструированным в 0,625 x 0,625 x 2,5 мм. Данную последовательность выполняли через 15–20 минут после внутривенного болюсного введения контрастного препарата на основе гадолиния (гадо-вист) в дозе 0,15 ммоль/кг. МРТ исследование проводилось на фоне синусового ритма в условиях дыхательной синхронизации при свободном дыхании пациента и синхронизации с ЭКГ. Сбор данных осуществлялся в фазу диастолы предсердий во время выдоха, который определялся по положению правого купола диафрагмы.
В результате получали серию МР-изображений сердца высокого разрешения, на которых был удовлетворительно визуализирован миокард ЛП, без существенных артефактов. Данная серия изображений подвергалась дальнейшему анализу с целью выявления зон фиброза.
Выявление фиброза миокарда левого предсердия
Обработка МР-изображений сердца с отсроченным контрастированием осуществлялась в три этапа: обведение контуров миокарда ЛП, определение в нем зон накопления контрастного препарата, построение трехмерных моделей ЛП с картированными зонами фиброза (рис. 1). После определения топографии ЛП и прилегающих структур на серии МР-изображений сердца при помощи программы для работы с изображениями ImageJ 1.46r (NIH, США) в полуавтоматическом режиме были обведены эпикардиальный и эндокардиальный контуры миокарда ЛП. Обведение контуров ЛП проводилось по специализированному алгоритму с использованием мультипланарных реконструкций сердца [26]. При помощи оригинальной программы LGE Heart Analyze [15] автоматически проводился расчет выраженности фиброза ЛП на основании сравнения отношения интенсивности сигнала вокселей миокарда ЛП (индекс контрастирования) к средней интенсивности сигнала крови с пороговым критерием 1.38, полученным на основании сопоставления интенсивности сигнала миокарда у пациентов с ФП и здоровых лиц, и реконструированы трехмерные модели ЛП.
Методы статистической обработки данных
Для статистического анализа полученных данных использовался пакет программ SPSS Statistics версия 26.0 (SPSS, Chicago, IL, USA). Проверка на нормальность распределения проводилась с использованием критерия Шапиро-Уилка. Для анализа количественных данных с распределением, отличным от нормального, в 2 независимых выборках использовался критерий Манна-Уитни; при оценке количественных данных с нормальным распределением применялся t-критерий Стьюдента (при наличии статистически значимого различия дисперсий использовался t-критерий Стьюдента в модификации Уэлча). Для оценки качественных признаков в 2 группах пациентов был применен хи-квадрат Пирсона или точный критерий Фишера в зависимости от минимального предполагаемого числа. Для признаков, имеющих статистически значимые различия, проводилась оценка шансов с 95% ДИ, а также определение меры связи между номинальными признаками. Для анализа номинальных признаков в 3 и более группах использовались многопольные таблицы сопряженности. При оценке количественных признаков с нормальным распределением в связанных совокупностях на 2 этапах наблюдения применялся парный t-критерий Стьюдента. Для графического отражения эффективности КБА в зависимости от объема вмешательства и степени фиброза по шкале Utah были построены кривые Каплана-Мейера.
РЕЗУЛЬТАТЫ
Клинико-анамнестические характеристики пациентов
В таблице 1 приведены сравнительные клинико-анамнестические характеристики 28 пациентов, включенных в исследование.
Средний возраст пациентов составил 58,5±9,5 года. В составе группы преобладали женщины 22 [78,5%]. Длительность анамнеза ФП составила 12,5±6,5 лет. Продолжительность максимального эпизода ФП – 6,5 месяцев (95%ДИ: 4,5-8,5). Пациенты, включенные в исследование, ранее получали лечение минимум одним неэффективным ААП. Из сопутствующих заболеваний у 21 больного [78,5%] диагностирована АГ, медикаментозно компенсированная. У 3 пациентов [10,7%] на момент первичной госпитализации отмечались явления хронической сердечной недостаточности на фоне тахисистолического течения ФП. На момент включения в исследование явления недостаточности кровообращения были компенсированы. У всех пациентов перед вмешательством при проведении ЭХОКГ отмечалась сохранная ФВ ЛЖ 55±6,9%. Средний объем ЛП по данным ЭХОКГ составил 79,3±15,5 мл. 28 пациентов с персистирующей ФП были рандомизированы на две группы. В группу №1 (КБА ЛВ) вошло 13 (46,4,9%) человек, в группу №2 (КБА ЛВ + задняя стенка ЛП) – 15 (53,6%) человек.
Оценка эффективности вмешательства
Эффективность стандартного и расширенного протокола аблации ЛП была оценена через 12 месяцев (за исключением послеоперационного периода в течение 3 месяцев после КБА).
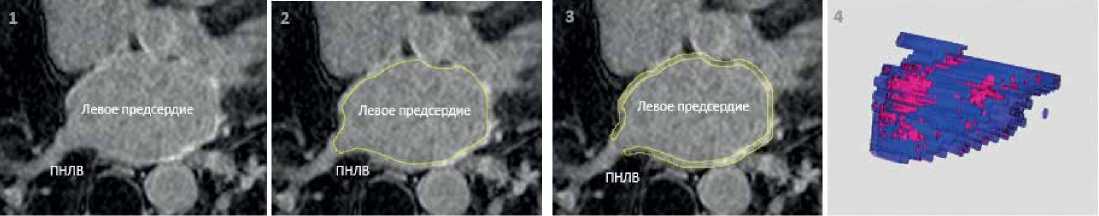
Рисунок 1. Этапы получения трехмерной модели левого предсердия с картированными зонами фиброза:
1. проведение магнитно-резонансной томографии с отсроченным контрастированием высокого разрешения и получение МР-изображений левого предсердия;
2. обведение эндокардиального контура миокарда левого предсердия;
3. получение эпикардиального контура проводится автоматически на заданную толщину миокарда левого предсердия (1,5-3,5 мм);
4. построение трехмерных моделей левого предсердия с картированными зонами фиброза.
Список литературы Оценка структурных изменений миокарда левого предсердия по данным магнитно-резонансной томографии с контрастированием до и после баллонной криоаблации у пациентов с персистирующей фибрилляцией предсердий
- Hindricks G., Potpara T., Dagres N., Arbelo E., et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J. 2021; 42(5):373-498. https://doi.org/10.1093/eurheartj/ehaa612
- Tondo C., Iacopino S., Pieragnoli P., Molon G., et al. 1STOP Project Investigators. Pulmonary vein isolation cryoablation for patients with persistent and long-standing persistent atrial fibrillation: Clinical outcomes from the real-world multicenter observational project. Heart Rhythm. 2018; 15(3):363-368. https://doi.org/10.1016/j.hrthm.2017.10.038
- Takarada K., Overeinder I., Asmundis C., Stroker E., et al. Long-term outcome after second-generation cryoballoon ablation for paroxysmal atrial fibrillation - a 3-years follow-up. J Interv Card Electrophysiol. 2017; 49(1):93-100. https://doi.10.1007/s10840-017-0237-7
- Floria, M., Radu, S., Gosav, E.M., Cozma D., et al. Left Atrial Structural Remodelling in Non-Valvular Atrial Fibrillation: What Have We Learnt from CMR? Diagnostics 2020; 10, 137. https://doi.org/10.3390/diagnostics10030137
- Bizhanov K.A., Аbzaliyev K.B., Baimbetov A.K., Sarsenbayeva A.B., et al.. Atrial fibrillation: Epidemiology, pathophysiology, and clinical complications (literature review). J Cardiovasc Electrophysiol. 2023; 34(1):153-165. https://doi.org/10.1111/jce.15759
- Park Y.J., Park J.W., Yu H.T., Zhu Y., et al. Sex difference in atrial fibrillation recurrence after catheter ablation and antiarrhythmic drugs. Heart. 2022; heartjnl-2021-320601. https://doi.10.1136/heartjnl-2021-320601
- Li Z., Wang S., Hidru T.H., Hidru T.H., Sun Y., et al. Long Atrial Fibrillation Duration and Early Recurrence Are Reliable Predictors of Late Recurrence After Radiofrequency Catheter Ablation. Front Cardiovasc Med. 2022 Mar 25; 9:864417. https://doi.10.3389/fcvm.2022.864417
- Shin S.H., Park M.Y., Oh W.J., Hong S-J., et al. Left atrial volume is a predictor of atrial fibrillation recurrence after catheter ablation. J Am Soc Echocardiogr. 2008; 21(6):697-702. https://doi.10.1016/j.echo.2007.10.022
- Wilson B.D., Wasmund S.L., Sachse F.B., Kaur G., et al. Evidence for a Heritable Contribution to Atrial Fibrillation Associated With Fibrosis. JACC Clin Electrophysiol. 2019; 5(4):493-500. https://doi.10.1016/j.jacep.2019.01.002
- Goette A., Kalman J.M., Aguinaga L., Akar J., et al. EHRA/HRS/ APHRS/SOLAECE expert consensus on atrial cardiomyopathies: definition, characterization, and clinical implication. Europace. 2016; 18(10):1455-1490. https://doi.org/10.1016/j.hrthm.2016.05.028
- Peters D.C., Wylie J.V., Hauser T.H., Kissinger K.V., et al. Detection of pulmonary vein and left atrial scar after catheter ablation with threedimensional navigator-gated delayed enhancement MR imaging: initial experience. Radiology. 2007; 243(3):690-5. https://doi.10.1148/radiol.2433060417
- Marrouche N.F., Wilber D., Hindricks G., Jais P., et al. Association of atrial tissue fibrosis identified by delayed enhancement MRI and atrial fibrillation catheter ablation: the DECAAF study. JAMA. 2014; 311(5):498-506. https://doi.org/10.1001/jama.2014.3
- Aryana A., Baker J.H., Espinosa Ginic M.A., Pujara D.K., et al. Posterior wall isolation using the cryoballoon in conjunction with pulmonary vein ablation is superior to pulmonary vein isolation alone in patients with persistent atrial fibrillation: A multicenter experience. Heart Rhythm. 2018; 15(8):1121-1129. https://doi.org/10.1016/j.hrthm.2018.05.014
- Апарина О.П., Стукалова О.В., Пархоменко Д.В., Миронова Н.А. и соавт. Характеристика струтуры миокарда левого предсердия у больных мерцательной аритмией и здоровых лиц по данным магнитнорезонансной томографии с отсроченным конрастированием (2014). Вестник аритмологии. 2014;77. [Aparina O.P., Stukalova O.V., Parkhomenko D.V., Mironova N.A., et al. Characteristics of the left atrium structure in patients with atrial fibrillation and healthy volunteers according to the data of late gadolinium enhancement cardiac magnetic resonance imaging (2014). Journal of Arrhythmology. 2014;77 (In Russ.)].
- Стукалова О.В., Апарина О.П., Пархоменко Д.В., Миронова Н.А. и соавт. Пат. 2549825 Российская федерация, МПК A61B 5/055. Способ оценки структурных изменений миокарда предсердий у больных с нарушениями ритма сердца. Авторы: заявитель и патентообладатель ФГБУ «РКНПК» МЗ РФ. ‒ №2014105347/14. заявл 14.02.2014, опубл. 27.04.2015, Бюл № 12 ‒ 8 с. [Stukalova O.V., Aparina O.P., Parkhomenko D.V., Mironova N.A., et al. Patent RU 2576816. Russian Federation, МПК A61B 5/055 (2006.01), A61K 49/06 (2006.01) The method of definition of the borders of left atrial myocardium on MR-images with late gadolinium enhancement using multiplanar reconstructions. Owner FSBI RCRPC MH of RF № 2015107013/14(011264) stated.02.03.2015, published. 10.03.2016 (in Russ.)].
- Roka A., Burright I. Remodeling in Persistent Atrial Fibrillation: Pathophysiology and Therapeutic Targets—A Systematic Review. Physiologia. 2023; 3(1):43-72. https://doi.org/10.3390/physiologia3010004
- McGann C., Kholmovski E., Blauer J. Vijayakumar S., et al. Dark regions of no-reflow on late gadolinium enhancement magnetic resonance imaging result in scar formation after atrial fibrillation ablation. Journal of the American College of Cardiology. 2011; 58(2):177-185. https://doi.org/10.1016/j.jacc.2011.04.008


