Оценка токсичного действия диоксида серы на химический состав Hypogymnia physodes (L.) Nyl
Автор: Мейсурова А.Ф.
Журнал: Вестник Тверского государственного университета. Серия: Биология и экология @bio-tversu
Рубрика: Биохимия
Статья в выпуске: 7, 2008 года.
Бесплатный доступ
Предложена методика проведения экспериментов, моделирующих различный уровень загрязнение атмосферы сернистым ангидридом. Дна интерпретация изменений ИК спектров образцов Hypogymnia phsodes (L.) Nyl, выдержанных над парами серной кислоты различной концентрации в течение одной-трех недель. Установлено, что кратковременное воздействие (до 7 дней) паров серной кислоты высокой концентрации менее опасно для лишайника, чем долговременное воздействие (14-21 день) низких концентраций кислоты - 3 и 6%. Предложен ряд токсичности образующихся типов соединений в лишайниках под влиянием сернистого ангидрида.
Диоксид серысреднеустойчивый к загрязнению вид, сульфоны, сульфокислоты, лишайники, экотоксикант, фурье-ик спектроскопия, поллютант
Короткий адрес: https://sciup.org/146116141
IDR: 146116141 | УДК: 582.29:543.42
Текст научной статьи Оценка токсичного действия диоксида серы на химический состав Hypogymnia physodes (L.) Nyl
Лишайники широко используются как биоиндикаторы в экологическом мониторинге, поскольку многие из них проявляют высокую чувствительность к действию таких загрязнителей, как окислы азота [15], фтористый водород, некоторые металлы, окислители, органические соединения. Однако основным токсичным агентом для лишайников остается бесцветный газ – сернистый ангидрид (диоксид серы, SO2). Сернистый ангидрид преобладает в выбросах подавляющего большинства промышленных предприятий энергетической, металлургической промышленности, а также предприятия по производству серной кислоты и переработке нефти. Доля диоксида серы в структуре выбросов атмосферы составляет 42% [16]. Высокая токсичность этого газа определила многочисленные исследования по воздействию последнего на растения, в том числе лишайники. Практически все исследования воздействия SO 2 на лишайники показывают, что с увеличением степени загрязнения диоксидом серы увеличивается проницаемость мембран, что отражается в более высокой электролитической проводимости водных вытяжек и оттоке ионов калия [3]. Сернистый ангидрид легко разрушает клеточные мембраны и, действуя как акцептор или донор электронов, препятствует нормальному транспорту метаболитов [22]. Проходя внутрь, сернистый ангидрид (причем незаряженные молекулы SO2 и однозарядные ионы HSO3- легче проникают через мембраны, чем двухзарядный ион SO32-) разрушает молекулы ферментов, ассоциированных на мембранах. В клетке диоксид серы также взаимодействует с органеллами – митохондриями и хлоропластами, в том числе и с их мембранами, что приводит к весьма серьезным последствиям: изменяются химические реакции, ответственные за такие процессы, как фотосинтез, дыхание, обмен веществ, производство энергии и т.д. Дальнейшее превращение в клетке сернистого ангидрида в серную кислоту и бисульфит вызывает подкисление внутриклеточной среды, что также отражается на активности физиологических процессов.
На биохимическом уровне сернистый ангидрид вызывает изменение белкового и аминокислотного метаболизма в лишайниках на двух уровнях. Во-первых, сульфит ингибирует белковый синтез, воздействуя на молекулы нуклеиновых кислот [14; 20; 26]. Во-вторых, под влиянием сульфита меняется активность ряда ферментов белкового обмена [19]. Под действием сернистого ангидрида снижается концентрация АТФ [21]. Поскольку аденозинфосфаты играют важную роль в обмене веществ живой клетки и служат источником энергии для синтетических процессов, уменьшение их коли- чества может служить еще одной причиной снижения белковых запасов. В своих исследованиях И.А. Бычек высказал предположение о токсичности этого газа и по отношению к липидам (полярным и нейтральным), что влечет за собой перестройку энергетических процессов, изменение активности фотосинтеза и биохимических показателей мембранных структур, поскольку липиды являются их существенной составляющей [2]. Длительное действие сернистого ангидрида на лишайники уменьшает количество хлорофилла. Разрушение хлорофилла может быть вызвано разрывом связей в хлорофилл-белковых комплексах, а также возникновением свободнорадикального окисления [25].
Исследования по оценке токсичного действия SO 2 на лишайники представляют большой интерес, так как могут являться основой методологии биотестирования [1]. В рамках этого направления становится возможным разработка биологического теста качества среды. Особенно это актуально в силу повышенного внимания к проблемам охраны природы и развития природоохранных мероприятий. Например, И.А. Шапиро (1993) при изучении устойчивости к сернистому газу такого биохимического признака, как содержание азотистых веществ, предложила следующие критерии оценки состояния воздуха: снижение количества азота указывает на длительное действие загрязнения диоксидом серы, а повышение пероксидазной активности может свидетельствовать о его начальных стадиях [14]. Особый интерес представляют разработки по диагностике не только существенных, как правило, уже необратимых изменений, но и первоначальных незначительных отклонений, когда еще возможно вернуть систему в прежнее состояние. В этой связи достаточно информативными могут быть данные Фурье-ИК спектроскопического анализа химического состава лишайников [6]. Возможность точной идентификации типов функциональных групп соединений с помощью Фурье-ИК спектроскопии определяет значительный интерес к использованию этого метода. Последний отражает не только химический состав изучаемого объекта, но и фиксирует основные тенденции изменения химического состава в слоевище, которые могут быть вызваны влиянием экотоксикантов, позволяет оценить не только концентрации загрязнителей, но и определить их порог, степень воздействия, разработать методы ранней диагностики направлений трансформации природных систем, находящихся под влиянием техногенной нагрузки.
В этой связи целью нашей работы явилось спектроскопическое исследование воздействия сернистого ангидрида на слоевище Hypogymnia physodes . В задачи работы входило: разработка методики лабораторного моделирования антропогенного загрязнения атмосферы сернистым ангидридом; интерпретация изменений полученных ИК спектров; проведение количественного спектрального анализа; выявление динамики накопления слоевищем лишайника поллютанта и характера его взаимодействия с органическими компонентами слоевища.
Материалы и методы исследования. Объектом исследования служили образцы среднеустойчивого к атмосферному загрязнению вида лишайника H. рhysodes, который в условиях атмосферного загрязнения проявляет наиболее значительные изменения химического состава [12]. Образцы лишайника были собраны весной 2007 г. в экологически чистой зоне, расположенной в 60 км от г. Твери (окрестности д. Ферязкино Калининского р-на Тверской обл.), которую можно считать фоновой [13].
Моделирование различного уровня антропогенного загрязнения воздуха сернистым ангидридом в лабораторных условиях осуществляли следующим образом (табл. 1). Высушенные образцы H. physodes (1-6), собранные в фоновой зоне помещали в эксикаторы над парами диоксида серы. Для этого предварительно в эксикатор наливали 20 мл серной кислоты (H 2 SO 4 ) различной концентрации, опускали медную проволоку и нагревали на слабом пламени. В результате химической реакции выделяется сернистый ангидрид:
2 H 2 SO 4конц. + Cu CuSO 4 + 2 H 2 O + SO 2 ^
Образцы H. physodes выдерживали над парами серной кислоты соответствующей концентрации в течение одной–трех недель.
При записи ИК спектров образцов использовали стандартный метод приготовления таблетки с бромидом калия (KBr) [6; 7; 11]. ИК спектры образцов записывали на Фурье-ИК спектрометре «Equinox 55» немецкой фирмы Bruker.
При проведении количественного спектрального анализа использовали английскую версию пакета OPUS-NT спектрометра «Equinox 55», которая позволяет рассчитать оптическую плотность D. Значение D позволяет судить о концентрации исследуемого вещества.
Таблица 1
Схема выполнения эксперимента
|
Время экспозиции |
Концентрация H 2 SO 4 , в % |
|||||
|
3 |
6 |
12 |
24 |
46 |
98 |
|
|
Номер образца |
||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
|
|
1 неделя |
+ |
+ |
+ |
+ |
+ |
+ |
|
2 недели |
+ |
+ |
+ |
+ |
+ |
+ |
|
3 недели |
+ |
+ |
+ |
+ |
+ |
+ |
Примечание: «+» – ИК спектры данных образцов лишайника были записаны.
При интерпретации ИК спектров образцов лишайника использовали основные отечественные и зарубежные руководства (табл. 2).
Результаты экспериментов. Моделирование различного уровня загрязнения воздуха диоксидом серы в лабораторных условиях дало следующие результаты. Сравнение ИК спектров образцов 1-6 , выдержанных в течение одной недели над парами соответствующего загрязнителя, и образцов этого вида из фоновой зоны показало значительные изменения в химическом составе образца 6. ИК спектр образца 6 демонстрирует существенные изменения сразу в трех частотных областях: появляются полосы на частотах 1424 см-1, вызванные ассиметричными колебаниями группы SO2 (сульфаты – (RO)2SO2), 873 см-1 – симметричными колебаниями группы S-O-C и 711 см-1 -симметричными колебаниями группы SO2 (сульфоамиды – -SO2-N=) (рис. 1).
Величина оптической плотности полосы поглощения 1424 см-1 (D 1424 ) в образце 6 высокая и составляет 0,7, D 873 – 0,19, D 711 – 0,06, что указывает на интенсивный процесс поглощения и накопление экотоксиканта (табл. 3). В то же время в ИК спектре образца 6 исчезают полосы поглощения на частотах 1454 см-1 (деформационные колебания -CH 2 -), 1654 (Амид I). Данный факт позволяет сделать вывод о чувствительности белкового комплекса к действию загрязнителя данной концентрации. Важно отметить, что ожидаемые признаки повреждения на уровне клетки, которые можно было бы ожидать при выдерживании образца данного вида над парами концентрированной серной кислоты в течение 6-7 суток – побледнение слоевища, вызванное потерей хлорофилла, или омертвление (ослизнение), не наблюдаются. По-видимому, в отличие от некоторых высших растений [4], кратковременное воздействие паров концентрированной серной кислоты менее опасно для лишайника H. physodes. Вероятно, поглощенный диоксид серы успевает окислиться и в определенных пределах подвергнуться восстановлению и нейтрализации без появления повреждений слоевища. Токсичность значительно уменьшается при превращении сульфита в сульфат [4].
Таблица 2
Отнесение некоторых характеристических ИК полос поглощения H.physodes
|
Волновое число, см- 1 |
Возможные отнесения |
Источник литературы |
|
1654 |
Амид I |
17; 23; 24; 5 |
|
1619 |
С=О |
18 |
|
1542 |
Амид II |
17; 23; 24; 5 |
|
1454 |
Деформационные колебания -CH 2 - |
9; 18 |
|
1424 |
Ассиметричные колебания группы SO2 (сульфаты – (RO) 2 SO 2 ) |
18 |
|
1313 |
Валентные ассиметричные колебания группы SO2-группы – сульфоны (R-SO 2 R) |
8; 9; 12 |
|
1266 |
Амид III |
5; 12; 23; 24 |
|
1230 |
Валентные асимметричные колебания SO2-группы в сульфокислотах (R-SO 2- -ОН) |
9; 18 |
|
1056 |
Валентные симметричные колебания SO2 |
9 |
|
873 |
Симметричные колебания группы S-O-C |
18 |
|
851 |
Валентные симметричные колебания SO2-группы в сульфокислотах |
9; 12; 18 |
|
805 |
Симметричные колебания группы S-O-C |
12; 18 |
|
780 |
Симметричные колебания группы S-O-C |
12; 18 |
|
711 |
Симметричные колебания группы SO2 (сульфоамиды – -SO 2 -N=) |
9; 18 |
|
666 |
Симметричные колебания группы S-O-C, связанные с образованием сульфонов (R-SO 2 R) |
9; 18 |
|
581 |
Валентные симметричные колебания SO2-группы в сульфокислотах |
9; 18 |
|
533 |
Валентные симметричные колебания SO2-группы в сульфокислотах |
9; 18 |
|
518 |
Симметричные колебания группы S-O-C, связанные с образованием сульфонов (R-SO 2 R) |
9; 18 |
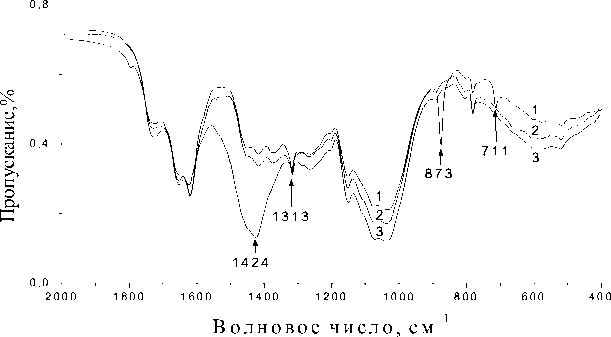
Рис. 1. ИК спектры образцов Hypogymnia physodes , выдержанные в течение 1 недели над парами 98% серной кислотой (1), 12% серной кислотой (2) и собранные в фоновой зоне (3)
ИК спектры образцов данного вида, выдержанные над парами серной кислоты меньшей концентрации (6, 12, 24 и 49%) в течение одной недели отличаются незначительным изменением своего химического состава (табл. 3). В основном на ИК спектрах образцов 2-5 со временем экспозиции одна неделя можно наблюдать изменения интенсивности полос поглощения на частотах 1619 (С=О), 1313 (валентные ассиметричные колебания SO 2 -группы – сульфоны (R-SO 2 R)), 805 и 780 см-1 (симметричные колебания группы S-O-C). Значения D 1313 , D 805 и D 780 в соответствующих образцах данного вида незначительно отличается от соответствующих величин оптической плотности фонового образца. По-видимому, это может свидетельствовать о слабых процессах взаимодействия экотоксиканта при действии паров кислоты данных концентраций с органическими компонентами лишайника в первую неделю экспозиции (табл. 3). Наряду с перечисленными полосами, в ИК спектрах образцов 3, 4 регистрируется слабая полоса поглощения 1542 см-1 (Амид II). В ИК спектре образца 1 полосы поглощения на частоте 1313 см-1 нет, в то же время наблюдается увеличение полосы поглощения 1266 см-1 (Амид III). Появление полосы поглощения Амид II и увеличение интенсивности полосы Амид III вероятно связано с тем, что на свету HSO 3 - в хлоропластах может превращаться в органически связанные группы SH-, которые являются строительным компонентом аминокислот [4], т.е., по-видимому, в какой-то степени токсическое действие сернистого ангидрида оказывается даже полезным. Одинаково низкая интенсивность данной полосы поглощения в образцах 1, 3 и 4 связана с тем, что белки в лишайниках в целом составляют от 1,9 до 3,3% и их количество мало изменяется [8, 10].
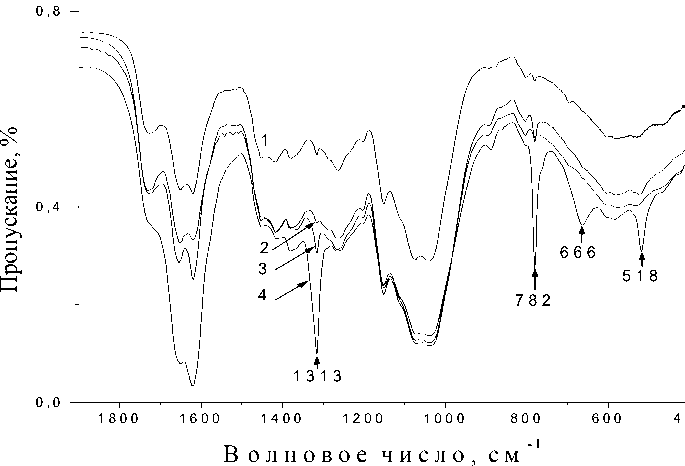
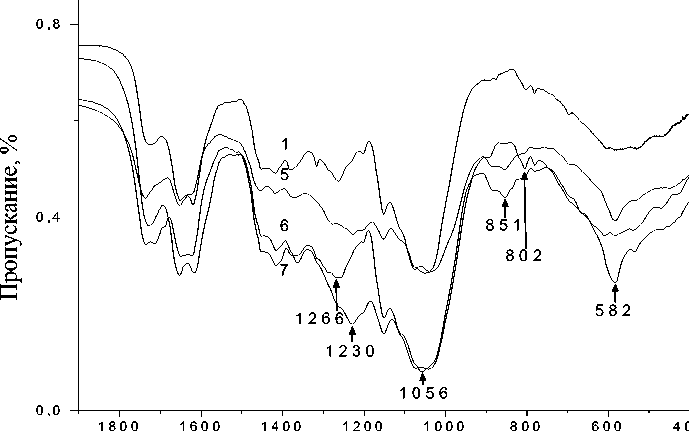
При сопоставлении ИК спектров образцов H. physodes 1-6 , выдержанных в течение двух–трех недель над парами загрязнителя, и образца фоновой зоны наблюдается обратная картина. Если в первую неделю экспозиции ИК спектр образца H. physodes 6 демонстрировал наибольшие изменения химического состава лишайника, то ИК спектры данного образца со временем экспозиции две и три недели незначительно отличаются от ИК спектра образца фоновой зоны (табл. 3). Существенные изменения наблюдаются в ИК спектрах образцов H. physodes , выдержанных над парами 3-ной и 6%-ной серной кислоты в течение двух–трех недель (рис. 2). Необходимо отметить, что образцы лишайника, выдержанные над парами 3 и 6% серной кислоты уже на второй неделе экспонирования обесцвечиваются, что, по всей видимости, связано с разрушением хлорофилла. Вероятно, более длительное воздействие (14-21 день) низких концентраций серной кислоты – 3-ной и 6%-ной опасно для лишайника, а процесс поглощения лишайником загрязнителя – сернистого ангидрида – больше зависит от времени экспонирования, чем от его концентрации.
При сопоставлении ИК спектров образца фоновой зоны и образца 1 со временем экспозиции три недели можно обнаружить 2 наиболее чувствительных интервала -1300–1030 см-1 и 900–500 см-1 (рис. 2). Увеличение времени экспонирования до трех недель над парами кислоты вносит существенные изменения в ИК спектр образца 1. Вместо полосы поглощения 1266 см-1 (Амид III) появляются полосы поглощения вызванные возникновением соединений типа сульфокислоты (R-SO 2- -ОН) – 1230 см-1 (валентные асимметричные колебания SO 2 -группы в сульфокислотах), и увеличивается интенсивность полос поглощения на частотах 851 и 581 см-1 (валентные симметричные колебания SO 2 -группы в сульфокислотах). Исчезновение полосы поглощения Амид III в ИК спектре образца 1 со временем экспозиции три недели может свидетельствовать об уязвимости белкового компонента лишайника. Регистрируемые в ИК спектре образца изменения связанные с уязвимостью белка, могут, возможно, являться причиной изменения окраски лишайников. Происходит разрушение хлорофилла за счет разрыва связей в хлорофилл-белковых комплексах и протекания свободно-радикальных реакций [25]. С появлением сульфокислот в лишайниковом слоевище связаны и другие изменения в ИК спектрах образца 1 со временем экспонирования три недели: вместо двух полос поглощения на частотах 1075 и 1038 см-1 появляется одна полоса поглощения на частоте 1056 см-1.
Таблица 3
Значения оптической плотности (D) различных частотных областей ИК спектров изученных образцов H. physodes
|
Волновое число, см -1 |
Время экспонирования |
Опыт |
Фон |
|||||
|
Концентрация H 2 SO 4 , в % |
||||||||
|
3 1 |
6 1 |
12 1 |
24 1 |
46 1 |
98 |
|||
|
Номер образца |
||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
0 |
||
|
1654 |
1неделя |
0,38 |
0,32 |
0,37 |
0,39 |
0,33 |
- |
0,38 |
|
2 недели |
0,28* |
0,39* |
0,43 |
0,41 |
0,35 |
0,35 |
||
|
3недели |
0,25* |
0,92* |
0,34 |
0,41 |
0,45 |
0,30 |
||
|
1619 |
1 неделя |
0,38 |
0,31 |
0,43 |
0,39 |
0,33 |
0,37 |
0,44 |
|
2 недели |
0,27* |
0,40* |
0,40 |
0,40 |
0,32 |
0,35 |
||
|
3 недели |
0,20* |
1,29* |
0,31 |
0,44 |
0,49 |
0,35 |
||
|
1542 |
1 неделя |
- |
- |
0,06 |
0,12 |
- |
- |
- |
|
2 недели |
- |
- |
- |
- |
- |
0,08 |
||
|
3 недели |
- |
- |
0,06 |
- |
- |
- |
||
|
1454 |
1 неделя |
0,29 |
0,24 |
0,25 |
0,26 |
0,25 |
- |
0,24 |
|
2 недели |
0,19* |
0,29* |
0,27 |
0,25 |
0,27 |
0,25 |
||
|
3 недели |
0,20* |
0,24* |
0,24 |
0,26 |
0,30 |
0,22 |
||
|
1424 |
1 неделя |
- |
- |
- |
- |
- |
0,7 |
- |
|
1313 |
1 неделя |
- |
0,24 |
0,25 |
0,26 |
0,25 |
0,29 |
0,31 |
|
2 недели |
- |
0,34* |
0,33 |
0,32 |
0,26 |
0,29 |
||
|
3 недели |
- |
0,79* |
- |
0,30 |
0,32 |
0,25 |
||
|
1266 |
1 неделя |
0,35 |
0,28 |
0,28 |
0,27 |
0,26 |
0,24 |
0,25 |
|
2 недели |
- |
0,32* |
0,32 |
0,29 |
0,30 |
0,29 |
||
|
3 недели |
- |
0,29* |
0,36 |
0,31 |
0,35 |
0,23 |
||
|
1230 |
2 недели |
0,49* |
- |
- |
- |
- |
||
|
3 недели |
0,39* |
- |
0,35 |
- |
- |
0,22 |
0,21 |
|
|
1056 |
2 недели |
0,65* |
- |
- |
- |
- |
- |
- |
|
3 недели |
0,85* |
- |
0,77 |
- |
- |
- |
||
|
873 |
1 неделя |
- |
- |
- |
- |
- |
0,19 |
- |
|
2 недели |
0,04* |
- |
- |
- |
- |
- |
||
|
3 недели |
0,06* |
- |
- |
- |
- |
- |
||
|
851 |
1 неделя |
- |
- |
- |
- |
0,01 |
- |
- |
|
2 недели |
0,06* |
- |
- |
- |
0,01 |
- |
||
|
3 недели |
0,06* |
- |
- |
- |
- |
- |
||
|
805 |
1 неделя |
0,03 |
0,02 |
0,05 |
0,02 |
0,02 |
0,01 |
0,02 |
|
2 недели |
- |
0,02* |
0,05 |
0,02 |
0,01 |
0,04 |
||
|
3 недели |
- |
0,03* |
0,01 |
0,02 |
0,03 |
0,01 |
||
|
780 |
1 неделя |
0,02 |
0,02 |
0,06 |
0,03 |
0,03 |
0,04 |
0,08 |
|
2 недели |
- |
0,05* |
0,05 |
0,05 |
0,02 |
0,04 |
||
|
3 недели |
- |
0,31* |
0,01 |
0,04 |
0,04 |
0,04 |
||
|
711 |
1 неделя |
- |
- |
- |
- |
- |
0,06 |
- |
|
666 |
3 недели |
0,07* |
0,17* |
- |
- |
- |
- |
- |
|
581 |
1 неделя |
- |
0,10 |
- |
- |
- |
- |
- |
|
2 недели |
0,23* |
0,11* |
- |
- |
- |
- |
||
|
3 недели |
0,18* |
0,14* |
0,16 |
- |
- |
- |
||
|
533 |
3 недели |
0,12* |
- |
- |
- |
- |
0,09 |
- |
|
518 |
1 неделя |
- |
- |
- |
- |
- |
- |
0,09 |
|
2 недели |
- |
0,09* |
- |
- |
- |
- |
||
|
3 недели |
- |
0,22* |
- |
- |
- |
- |
||
Примечание: * – изменение цвета (пожелтение); «-» – отсутствие полос поглощения в ИК спектрах.
В олновое число, см
Рис. 2. ИК спектры образцов Hypogymnia physodes :
1 – собран в фоновой зоне; 2 – 4 – экспонированы над 3%-ной серной кислотой в течение одной недели (2), двух недель (3) и трех недель (4); 5 – 6 – экспонированы над 6%-ной серной кислотой в течение одной недели (5), двух недель (6) и трех недель (7)
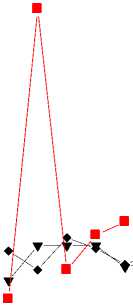
При сравнении ИК спектров образца 2 со временем экспонирования две и три недели и образца фоновой зоны обнаружены изменения на частотах 1313, 782 и 518 см-1, связанные с возникновением соединений типа сульфонов (R-SO2R) [12, 18]. С увеличением времени экспонирования до трех недель значения D1313 и D782 в ИК спектре образца 2 увеличиваются от 0,24 до 0,79 и 0,02 до 0,31 соответственно (рис. 3). К трем неделям экспонирования величины D1313 и D782 оказываются максимальными. Существенно и увеличение значения D1619 – в четыре раза – 1,29. Увеличение интенсивности последней полосы, по-видимому, связано с началом деструкционных процессов. Более того, в ИК спектре образца 2 со временем экспозиции три недели, помимо отмеченных изменений, появляется дополнительная полоса поглощения на частоте 666 см-1 (симметричные колебания группы SО2 в сульфонах). Величина D666 в ИК спектре образца 2 со временем экспозиции 3 недели высокая – 0,12.
1 4 D 1619
1,0
D 1313
D 780
0,4 1 —* 1 неделя
0,7
0,5
0,0
0,2
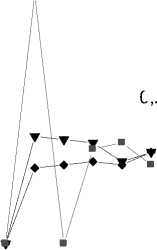
—▼— 2 недели
—■ — 3 недели
0 ,0
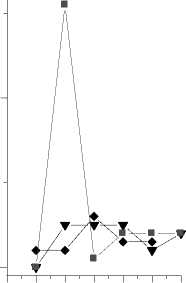
0123456 01234560123456
№ образа
Рис. 3. Изменение величины оптической плотности (D) некоторых полос поглощения в образцах 1-6
Таким образом, Фурье-ИК спектроскопическое исследование химического состава образцов H. physodes, испытавших воздействие паров серной кислоты различной концентрации в течение одной–трех недель, показало, что определяющим фактором для лишайников, по-видимому, в первую очередь является время экспозиции, а не концентрация данного поллютанта. ИК спектры образцов 1-5 со временем экспозиции одной неделя демонстрируют незначительные изменения. Существенными являются изменения в ИК спектре образца, выдержанного над парами 98%-ной серной кислоты в течение 7 суток. Однако, вероятно, для лишайника данные изменения химического состава не являются необратимыми, не наблюдаются даже ожидаемые внешние морфологические изменения. Появление полос поглощения в ИК спектре образца 6 со временем экспозиции одна неделя, ответственных за наличие сульфатов -(RO) 2 SO 2 (1424 см-1), свидетельствует о низкой токсичности поглощенного токсиканта, поскольку последний в первую неделю экспозиции успевает окислиться и, в определенных пределах, подвергнуться восстановлению и нейтрализации.
Опасным для лишайника H. physodes оказывается долговременное воздействие (14-21 день) низких концентраций кислоты – 3-ной и 6%-ной. Если в первую неделю экспозиции ИК спектры образцов 1-2 демонстрировали незначительные изменения, то в последующее время ИК спектры этих образцов свидетельствуют о продолжительной реакции, сопровождающейся видимыми морфологическими изменениями – побледнением и пожелтением. В этой связи среднеустойчивый к атмосферному загрязнению вид H. physodes лучше использовать в качестве индикатора низких концентраций за-
Вестник ТвГУ. Серия «Биология и экология». Вып. 7, 2008 грязнителя в атмосфере. Хроническое воздействие экотоксиканта низких концентраций приводит к накоплению их слоевищем с образованием соединений типа сульфонов - R-SO2R (1313, 782, 666 и 518 см-1) и сульфокислот - R-SO2—ОН (1230, 1056, 851 и 581 см-1) в количестве, превышающем способность ткани к ее детоксикации при нормальном метаболизме, вызывая серьезные, возможно уже необратимые, физиологобиохимические изменения. На основе химических особенностей образующихся в лишайнике соединений [18] под влиянием поллютанта, а также степени вызываемой ими морфоструктурных изменений можно предложить следующий ряд токсичности данных типов соединений для лишайника:
сульфооксиды > cульфокислоты > сульфоны > сульфаты
(-S=O) (-SO 2 -ОН) (R-SO 2 R) (RO) 2 SO 2
Воздействие малых доз экотоксиканта, его накопление слоевищем и преобразование в природных условиях может быть очень длительным процессом. Весьма редко можно встретить длительное воздействие высоких доз эктоксиканта, как это имеет место в нашем эксперименте. Однако исследование токсичного действия сернистого ангидрида на химическую структуру лишайника методом Фурье-ИК спектроскопии позволит путем сопоставления экспериментальных данных с природными системами прогнозировать состояние и уровень жизнедеятельности лишайникового слоевища. Информация о накопленном слоевищем экотоксиканте, форме его взаимодействия с химическими компонентами лишайника во времени может полезна для регистрации качественного и количественного загрязнения атмосферы, а также ранней диагностики уровня жизнедеятельности лишайникового слоевища.
В дальнейшем целесообразно проведение дополнительных спектральных исследований, которые позволят выяснить влияние других загрязнителей атмосферы на химическую структуру лишайника, например соединений хлора – HCl.
Tver State University
Methodology of experiments aimed to model different level of atmosphere pollution by sulfur anhydride was proposed. The interpretation of changes of IR-spectrums of examples of Hypogymnia physodes (L.) Nyl, seasoned under fallows of sulfuric acid of different concentration during 1-3 weeks. It was determined that short-term influence (until 7 days) of fallows of sulfuric acid of high concentration is less harmful for lichens, than long term influence (14-21) of low concentration of sulfuric acid 3-6%. Rank of toxicity for different types of lichens was developed.


