Оценка токсичности и эффективности терапии комбинацией Folfiri и афлиберцепта при метастатическом раке толстой кишки в РФ: первые результаты многоцентрового ретроспективного исследования
Автор: Федянин М.Ю., Владимирова Л.Ю., Чубенко В.А., Загорская Л.А., Беляева А.В., Болотина Л.В., Моисеенко Ф.В., Фахрутдинова О.Л., Белухин С.А., Жабина А.С., Халикова Л.В., Моисеенко В.М., Мещеряков А.А., Артамонова Е.В., Покатаев И.А., Хасанова А.И., Белоногов А.В., Мусаева Х.С., Новикова О.Ю., Страдаева И.Ю., Попова И.Л., Мухаметшина Г.З., Орлова Р.В., Эрдниев С.П., Иванова А.К., Андросова А.В., Феоктистова П.С., Кузьмина Е.С., Карабина Е.В., Некрасова О.В., Шерстнев В.М., Мищенко А.А., Мукова Л.А., Кертиев Б.Х., Косарь Г.И., Осодоева С.Н., Кац А.И., Малина Р.Р., Трякин А.А., Тюляндин С.А.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 2 т.9, 2019 года.
Бесплатный доступ
Цель исследования. Оценить частоту развития и тяжесть нежелательных явлений; изучить клинические факторы, ассоциированные с развитием негематологической токсичности 3-4 степени; оценить непосредственную эффективность выживаемость без прогрессирования при применении комбинации FOLFIRI с афлиберцептом в РФ. Материалы и методы. Проведено ретроспективное многоцентровое исследование. Собраны данные 20 клиник 15 регионов РФ. Статистическая гипотеза отсутствовала. В качестве основного критерия эффективности рассматривалась выживаемость без прогрессирования. Статистический анализ проводился с помощью программ статистического пакета SPSS (IBM SPPS Statistics v. 20). Результаты. Режим FOLFIRI афлиберцепт был назначен у 264 пациентов. Среднее число составило 6 (от 1 до 29). В связи с токсичностью доза афлиберцепта в процессе терапии была редуцирована у 10,1 % пациентов, задержали очередное введение афлиберцепта - у 11,4 %; отсрочка и редукция доз химиопрепаратов в режиме FOLFIRI описана у 20,1 %...
Рак толстой кишки, химиотерапия, афлиберцепт, популяционное исследование
Короткий адрес: https://sciup.org/140243823
IDR: 140243823 | DOI: 10.18027/2224-5057-2019-9-2-53-63
Текст научной статьи Оценка токсичности и эффективности терапии комбинацией Folfiri и афлиберцепта при метастатическом раке толстой кишки в РФ: первые результаты многоцентрового ретроспективного исследования
Афлиберцепт — рекомбинантный гибридный белок с противоопухолевой и антиангиогенной активностью, состоящий из связывающихся с VEGF (эндотелиальными факторами роста сосудов) частей внеклеточных доменов рецептора VEGF 1 и рецептора VEGF 2, соединенных между собой доменом Fc (фрагмента способного к кристаллизации) иммуноглобулина G1 (IgG1) человека, одобрен к применению в РФ при раке толстой кишки. По результатам рандомизированного исследования III фазы (VELOUR), добавление антиангиогенного препарата улучшает показатели продолжительности жизни (ОР = 0,817, р = 0,0032), времени до прогрессирования (ОР = 0,758, р = 0,00007) и частоту объективного эффекта (19,8% против 11,1%, р = 0,0001). Препарат зарегистрирован в сочетании с режимом FOLFIRI во второй линии лечения больных метастатическим раком толстой кишки. При оценке токсичности афлиберцепта в группе пациентов, получавших на первой линии бевацизу-маб, отметим, что применение афлиберцепта в комбинации с FOLFIRI ассоциировано не только с осложнениями, характерными для антиангиогенных препаратов, но и с большим процентом случаев диареи и нейтропений [1].
В предварительных результатах наблюдательного проспективного международного исследования ASQoP частота осложнений, связанных с исследуемым препаратом, составила 98,7%, что аналогично данным регистрационного исследования VELOUR (99,2%). При этом частота нежелательных
Рисунок 1. Карта регионов, принимавших участие в исследовании (выделены темным).
явлений 3–4 степени между сравниваемыми исследованиями значимо не различалась: 18% против 21,4% соответственно. Несколько реже встречались астения 3–4 степени (13,6% против 16,9%), диарея 3–4 степени (15,3% против 19,3%), стоматит 3–4 степени (10,7% против 13,7%). Однако частота артериальной гипертензии 3–4 степени была выше в наблюдательном исследовании (24,1% против 19,3%) [2]. В данной работе включены центры, принимающие участие в клинических исследованиях, следовательно, и пациенты, включенные в данную работу, не полностью отражают действительную клиническую практику врача-онколога.
Нами было инициировано многоцентровое ретроспективное исследование по оценке переносимости и эффективности афлиберцепта у больных метастатическим раком толстой кишки в РФ.
Материалы и методы
Дизайн исследования — ретроспективное многоцентровое исследование по оценке токсичности применения афлиберцепта в комбинации с режимом химиотерапии FOLFIRI в реальной клинической практике в РФ.
-
• Собраны данные 20 клиник из 15 регионов (рисунок 1).
-
• Статистическая гипотеза отсутствует.
Задачи исследования:
-
• оценить частоту развития и тяжесть нежелательных явлений при применении комбинации FOLFIRI с афли-берцептом;
-
• изучить клинические факторы, ассоциированные с развитием негематологической токсичности 3–4 степени;
-
• оценить непосредственную эффективность и выживаемость без прогрессирования при применении комбинации FOLFIRI с афлиберцептом.
Статистический анализ
В качестве основного критерия эффективности рассматривалась выживаемость без прогрессирования, рассчитывавшаяся с момента начала терапии с включением афлиберцепта до даты прогрессирования и/или смерти от любой причины или даты последнего наблюдения. Ситуации, когда пациент не имел прогрессирования заболевания или не умер, рассматривались как цензурированные события. Выживаемость рассчитывалась по методу Каплана-Майера. Сравнение групп больных по выживаемости проводилось с помощью лог-ранк теста, теста Breslow-Wilcoxon, Tarone-Ware или с помощью Cox анализа, в зависимости от статистической ситуации. Для переменных, отражающих различные признаки, применялись методы описательной статистики. Многофакторный анализ проводился с помощью пошагового регрессионного анализа Cox в случае изучения выживаемости, или биноминального регрессионного анализа, если речь шла об определенном событии. Статистический анализ проводился с помощью программ статистического пакета SPSS (IBM SPPS Statistics v. 20).
Результаты
Характеристика пациентов и терапии
Собраны данные 278 больных метастатическим раком толстой кишки, которым проводилась терапия с включением афлиберцепта. С режимом FOLFIRI афлиберцепт был назначен у 264 пациентов (95%). Характеристика пациентов, соответствующая критериям включения (n=264), представлена в таблице 1.
Как видно из таблицы 1, популяция больных, получающих афлиберцепт, полностью отражает типичные характеристики пациентов во второй и последующих линиях терапии в РФ: 47% больных с мутацией в генах RAS, 97% больных с ECOG 0–1, среднее число органов, поражённых метастазами — 2. Выявлено, что существенной части пациентов в РФ комбинация FOLFIRI и афлиберцепта назначалась во второй линии терапии (68,9%). Тем не менее, 30,2% пациентам афлиберцепт назначался в третьей и последующих линиях лечения, двум пациентам — в первой линии.
Таблица 1. Характеристика пациентов
|
Фактор |
n |
% |
|
|
Возраст, среднее (мин-макс, σ) |
58 (23–77, 9.1) |
||
|
Пол |
женский |
136 |
51,5% |
|
Статус генов RAS |
wtRAS |
98 |
37,1% |
|
mRAS |
124 |
47% |
|
|
mBRAF |
1 |
0,4% |
|
|
не исследовался |
41 |
15,5% |
|
|
T |
2 |
13 |
4,9% |
|
3 |
95 |
36% |
|
|
4 |
101 |
38,3% |
|
|
Нет данных |
55 |
20,8% |
|
|
N |
0 |
52 |
19,7% |
|
1 |
74 |
28% |
|
|
2 |
68 |
25,8% |
|
|
Нет данных |
70 |
26,5% |
|
|
M |
0 |
77 |
29,2% |
|
1 |
182 |
68,9% |
|
|
Нет данных |
5 |
1,9% |
|
|
ECOG |
0 |
99 |
38,1% |
|
1 |
154 |
59,2% |
|
|
2 |
6 |
2,3% |
|
|
Нет данных |
1 |
0,4% |
|
|
Количество предшествующих линий терапии (среднее, мин-макс.) |
1,4 (0-5) |
||
|
Афлиберцепт назначен в |
1 линии |
2 |
0,8% |
|
2 линии |
182 |
68,9% |
|
|
3–5 линии |
80 |
30,3% |
|
|
Метастазы в печени |
201 |
76,1% |
|
|
Метастазы в легкие |
110 |
41,7% |
|
|
Метастазы в кости |
13 |
5% |
|
|
Число органов, поражённых метастазами (среднее, мин-макс.) |
2 (0-6) |
||
Таблица 2. Распределение пациентов в зависимости от характера сопутствующей патологии
Практически 41 % больных по поводу сопутствующей патологии получали сопроводительную терапию. Чаще всего это были препараты, воздействующие на сердечнососудистую систему: ингибиторы АПФ или ингибиторы рецептора к ангиотензину (21,2%), β-блокаторы (12,9%) или блокаторы кальциевых каналов (7,6%) (табл. 3). Семь пациентов на момент начала терапии афлиберцептом получали низкомолекулярные гепарины.
Таблица 4. Причины прекращения терапии афлиберцептом в сравнении с результатами исследования VELOUR
|
Причины отмены афлиберцепта |
Настоящее исследование N (%) |
VELOUR (%) |
|
Прогрессирование |
131 (49,6%) |
49,8% |
|
Нежелательные явления |
32 (12,1%) |
26,6% |
|
Отсутствие препарата |
4 (1,5%) |
– |
|
Продолжает терапию |
68 (25,8%) |
23,1% |
|
Завершение запланированного объема терапии |
29 (11%) |
– |
Таблица 3. Распределение пациентов в зависимости от характера сопутствующей терапии
|
Фактор |
n |
% |
|
Сопутствующая терапия |
109 |
41,3% |
|
Ингибиторы АПФ/АР |
56 |
21,2% |
|
β-блокаторы |
34 |
12,9% |
|
Блокаторы Са каналов |
20 |
7,6% |
|
Низкомолекулярные гепарины |
7 |
2,7% |
|
Нестероидные противовоспалительные средства |
3 |
1,1% |
|
Метформин |
10 |
3,8% |
|
Дезагреганты |
16 |
6,1% |
|
Диуретики |
7 |
2,7% |
|
Ингибиторы протонной помпы |
13 |
4,9% |
|
Статины |
4 |
1,5% |
Среднее число курсов FOLFIRI с афлиберцептом составило 6 (от 1 до 29), как и в исследовании VELOUR. Данные по дозам и срокам введения препаратов удалось собрать у 150 пациентов (56,8%). В связи с токсичностью доза афлиберцепта в процессе терапии была редуцирована у 10,1 % пациентов, очередное введение афлиберцепта задержано у 11,4%; отсрочка и редукция доз химиопрепаратов в режиме FOLFIRI описана у 20,1 %.
Основной причиной прекращения терапии в нашем исследовании явилось прогрессирование болезни (49,6%). Следует подчеркнуть низкий процент прекращения терапии в связи с нежелательными явлениями — 12,1 %, что более чем в 2 раза ниже в сравнении с исследованием VELOUR. Только у 6 пациентов (2,1 %) афлиберцепт был полностью отменен в связи с токсичностью, и была продолжена только химиотерапия.
Несмотря на то, что терапия афлиберцептом должна проводиться до прогрессирования или непереносимой токсичности, у 11% больных онкологи прекратили терапию, мотивировав это завершением запланированного числа курсов лечения (табл. 4).
Эффективность терапии
Нами оценена непосредственная эффективность терапии в режиме FOLFIRI + афлиберцепт и выживаемость без прогрессирования пациентов. Частота объективных эффектов в нашей работе составила 20,3% (45/222) среди пациентов с данными обследования, что соответствует результатам регистрационной работы VELOUR (19,8%). Контроль болезни зарегистрирован у 41,7% (n=163/264) на всей группе больных и 73,4% (163/222) среди пациентов с данными обследования.
При медиане наблюдения за пациентами в 6 месяцев, медиана выживаемости без прогрессирования составила 5 месяцев (95 ДИ 4,1–5,8 месяцев) (рис. 2).
Полученные результаты хуже показателей выживаемости без прогрессирования в исследовании VELOUR — 6,9 месяцев.
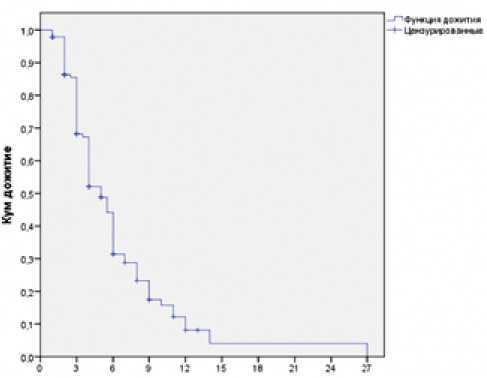
Рисунок 2. Выживаемость без прогрессирования на всей группе пациентов.
Если ограничиться данными пациентов, которым проводилась терапия с включением афлиберцепта только во второй линии терапии, то медиана выживаемости без прогрессирования составила 6 месяцев (95% ДИ 5,3–6,6 месяцев), что соответствует результатам исследования VELOUR (рис. 3). При этом отмечена тенденция к более высоким показателями выживаемости без прогрессирования при применении афлиберцепта во второй линии лечения в сравнении с другими линиями (ОР 1,3, 95% ДИ 0,8–2,1, р=0,1 по Tarone-Ware, р=0,2 по log rank тесту).
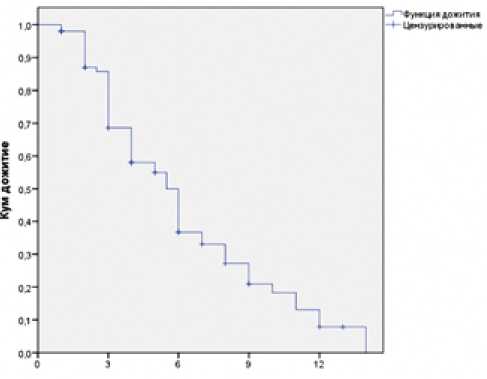
Рисунок 3. Выживаемость без прогрессирования у пациентов, которым проводилась терапия по схеме FOLFIRI с афлиберцептом во второй линии лечения.
Отдельно нами проведено сравнение выживаемости без прогрессирования пациентов, которым афлиберцепт назначался совместно с режимом FOLFIRI или другими режимами химиотерапии (рис. 4). Отметим отсутствие статистически значимых отличий между группами пациентов, которым проводилось назначение стандартного режима химиотерапии FOLFIRI с афлиберцептом и комбинацией афлиберцепта не по показаниям (ОР 0,7, 95% ДИ 0,3–1,8, р=0,4). В обеих группах медиана выживаемости без прогрессирования составила 5 месяцев.
При сравнении выживаемости без прогрессирования в группе больных, которым проводилась терапия FOLFIRI + афлиберцепт во второй линии и афлиберцепта с другими режимами, также не обнаружено статистически значимых отличий (ОР 0,8, 95% ДИ 0,3–2,0, р=0,6).
Оценка переносимости терапии
Нежелательные явления любой степени зарегистрированы у 72% пациентов, и чаще они были ограничены 1–2 степенью (62,1 %). При этом негематологические осложнения развились у 64% (3–4 степень — у 17,9%). Гематологические осложнения в первичной документации представлены только у 17,9% пациентов (табл. 5).
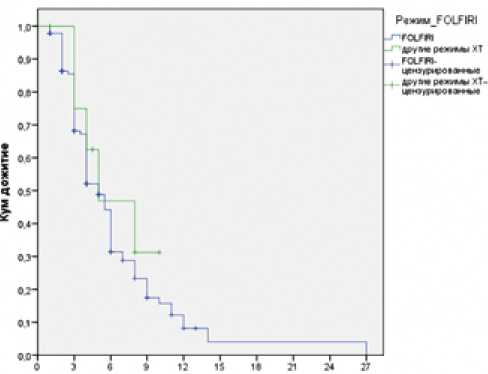
Рисунок 4. Выживаемость без прогрессирования пациентов в зависимости от режима химиотерапии.
Следует отметить меньшую частоту репортирования осложнений, связанных с антиангиогенным действием аф-либерцепта, в сравнении с данными исследования VELOUR (табл. 6), хотя спектр токсических реакций аналогичен регистрационному исследованию. В популяции больных в РФ превалировали такие осложнения, как артериальная гипертензия, тошнота, диарея, астения, нейтропения и дис-фония. Однако токсичность 3–4 степени регистрировалась редко, преимущественно в виде артериальной гипертензии.
Факторы, ассоциированные с развитием негематологических нежелательных явлений (НЯ) 3–4 степени
С учетом высокой частоты развития НЯ негематологического профиля был проведен однофакторный анализ влияния признаков на риск развития данного вида токсичности 3–4 степени. Результаты анализа представлены в таблице 7.
На следующем этапе проведен многофакторный анализ, результаты которого представлены в таблице 8.
Таблица 5. Частота развития нежелательных явлений
|
Нежелательные явления |
n |
% |
|
Нежелательные явления |
190 |
72% |
|
Нежелательные явления 1–2 степени |
164 |
62,1% |
|
Нежелательные явления 3–4 степени |
63 |
23,9% |
|
Негематологические нежелательные явления |
169 |
64,0% |
|
Негематологические нежелательные явления 1–2 степени |
141 |
53,4% |
|
Негематологические нежелательные явления 3–4 степени |
47 |
17,9 % |
|
Гематологические нежелательные явления |
79 |
29,9% |
|
Гематологические нежелательные явления 1–2 степени |
52 |
19,7% |
|
Гематологические нежелательные явления 3–4 степени |
20 |
7,6 % |
Таблица 6. Спектр нежелательных явлений в сравнении с исследованием VELOUR
|
Нежелательное явление |
Настоящее исследование |
VELOUR |
||
|
1–2 степень n (%) |
3–4 степень n (%) |
Все степени (%) |
3–4 степень (%) |
|
|
Лейкопения |
14 (5,3%) |
1 (0,4%) |
78% |
16% |
|
Нейтропения |
31 (11,7%) |
18 (6,8%) |
67% |
37% |
|
Фебрильная нейтропения |
0 |
1 (0,4%) |
Нет данных |
Нет данных |
|
Тромбоцитопения |
12 (4,5%) |
0 |
48% |
3% |
|
Анемия |
16 (6,1%) |
0 |
Нет данных |
Нет данных |
|
Артериальная гипертензия |
73 (27,7%) |
32 (12,1%) |
41% |
19% |
|
Протеинурия |
2 (0,8%) |
0 |
62% |
8% |
|
Тромбоз |
3 (1,1%) |
3 (1,1%) |
Нет данных |
Нет данных |
|
Кровотечения |
1 (1,5%) |
0 |
37,8% |
3% |
|
Астения |
29 (11%) |
4 (1,5%) |
18% |
5% |
|
Тошнота |
43 (16,3%) |
0 |
53,4% |
1,8% |
|
Рвота |
9 (3,4%) |
0 |
32,9% |
2,8% |
|
Диарея |
30 (11,4%) |
10 (3,8%) |
69% |
19% |
|
Дисфония |
24 (9,1%) |
0 |
25% |
0,5% |
|
Стоматит |
7 (2,7%) |
0 |
50% |
13% |
|
Снижение веса |
6 (2,3%) |
1 (0,4%) |
31,9% |
2,6% |
|
Абдоминальные боли |
7 (2,7%) |
0 |
27% |
4% |
|
Ладонно-подошвенный синдром |
4 (1,5%) |
0 |
11% |
3% |
|
Повышение трансаминаз печени |
3 (1,1%) |
0 |
62% |
3% |
По результатам многофакторного анализа лекарственная терапия по поводу сопутствующей патологии и число линий терапии, предшествующих афлиберцепту, явились независимыми предсказывающими факторами развития НЯ 3–4 степени негематологического профиля.
Таблица 7. Однофакторный анализ влияния признаков на риск развития негематологических нежелательных явлений 3–4 степени
|
Фактор |
ОШ* |
95% ДИ* |
р |
|
Возраст |
0,7 |
0,4–1,3 |
0,2 |
|
Статус гена RAS |
0,8 |
0,5–1,1 |
0,1 |
|
Индекс Т |
1,0 |
0,8–1,1 |
0,6 |
|
Индекс N |
0,9 |
0,8–1,01 |
0,08 |
|
Синхронные метастазы |
0,6 |
0,2–1,1 |
0,1 |
|
Статус по шкале ECOG |
1,1 |
0,8–1,7 |
0,5 |
|
Количество предшествующих линий терапии |
1,5 |
1,1–2,1 |
0,02 |
|
Метастазы в печени |
2,4 |
0,98–6,1 |
0,06 |
|
Метастазы в легкие |
0,8 |
0,4–1,4 |
0,4 |
|
Число органов с метастазами |
1,1 |
0,8–1,5 |
0,5 |
|
Количество курсов афлиберцептом |
1,0 |
0,9–1,1 |
0,7 |
|
Сопутствующая патология |
1,5 |
0,7–3,1 |
0,3 |
|
• Ишемическая болезнь сердца |
1,0 |
0,5–1,9 |
0,9 |
|
• Артериальная гипертензия |
1,3 |
0,7–2,5 |
0,4 |
|
• Нарушение ритма сердца |
0,8 |
0,2–3,9 |
0,8 |
|
• Кардиомиопатия |
0,8 |
0,1–6,5 |
0,8 |
|
• Хроническая сердечная недостаточность |
1,6 |
0,7–3,9 |
0,3 |
|
• Сахарный диабет |
2,0 |
0,8–5,3 |
0,1 |
|
• Заболевания желудочно-кишечного тракта |
1,2 |
0,6–2,5 |
0,6 |
|
• Заболевания мочевыводящей системы |
2,2 |
0,8–5,7 |
0,1 |
|
• Тромбоз/ТЭЛА |
1,6 |
0,3–7,9 |
0,6 |
|
Сопутствующая терапия |
2,0 |
1,1–3,7 |
0,03 |
|
• Ингибиторы АПФ/АР |
2,3 |
1,1–4,5 |
0,02 |
|
• β-блокаторы |
1,8 |
0,8–4,2 |
0,2 |
|
• Блокаторы Са каналов |
4,4 |
1,7–11,4 |
0,002 |
|
• Низкомолекулярные гепарины |
0,8 |
0,1–6,5 |
0,8 |
|
• Нестероидные противовоспалительные средства |
2,3 |
0,2–26,2 |
0,5 |
|
• Метформин |
5,0 |
1,4–18,1 |
0,01 |
|
• Дезагреганты |
1,6 |
0,5–5,1 |
0,4 |
|
• Диуретики |
3,6 |
0,8–16,7 |
0,1 |
|
• Ингибиторы протонной помпы |
0,8 |
0,2–3,9 |
0,8 |
|
• Статины |
1,5 |
0,2–15,2 |
0,7 |
*ОШ — отношение шансов, ДИ — доверительный интервал.
Обсуждение
Проведение пострегистрационных исследований является обычной практикой для новых препаратов, в том числе и в сфере онкологии. Как правило, такие работы проходят в крупных клиниках, принимающих участие в клинических исследованиях, применяются строгие критерии включения больных, и в итоге полученные результаты сложно экстраполировать на общую популяцию. По этой причине стало практикой проведение наблюдательных пострегистрационных исследований, посвященных оценке эффективности
Таблица 8. Результаты многофакторного анализа влияния признаков на риск развития негематологических нежелательных явлений 3–4 степени
|
Фактор |
B |
Стд. Ошибка |
Вальд |
ст.св. |
р |
ОШ* |
95% ДИ* для ОШ |
|
|
Нижняя |
Верхняя |
|||||||
|
Сопутствующая терапия |
,686 |
,329 |
4,348 |
1 |
,037 |
1,985 |
1,042 |
3,782 |
|
Количество линий терапии |
,406 |
,175 |
5,393 |
1 |
,020 |
1,500 |
1,065 |
2,113 |
*ОШ — отношение шансов, ДИ — доверительный интервал.
и токсичности различных препаратов и схем противоопухолевой терапии в обычных клиниках на менее отобранных пациентах. Что касается афлиберцепта, то отмечены некоторые различия между результатами регистрационного исследования и наблюдательными исследованиями в различных популяциях больных метастатическим раком толстой кишки. Так, в подгруппе пациентов исследования ASQoP из Италии у 27.5% больных введение афли-берцепта было прекращено в связи с токсичностью чаще, чем в исследовании VELOUR, наблюдались кровотечения 1–2 степени (у 30,5%). Качество жизни при терапии FOLFIRI + афлиберцепт значимо не ухудшалось [3]. В испанском исследовании была выше частота дисфонии и протеинурии, а также отмечена прямая взаимосвязь между развитием артериальной гипертензии и уменьшением риска прогрессирования (HR: 2.68 (1.32 to 5.43) p: 0.001). Афлиберцепт был эффективен независимо от предшествующего лечения другим моноклональным антителом [4]. Афлиберцепт хорошо переносился жителями Германии, Австрии и Швейцарии, не ухудшая качество жизни, с частотой развития артериальной гипертензии 3–4 степени в 15,2%, диареи 3–4 степени — в 5,4%, стоматитов — в 3,9% случаев. Частота достижения ОЭ составила 33%, медиана выживаемости без прогрессирования — 6,9 месяцев, продолжительности жизни — 14,5 месяцев [5]. При этом возраст и предшествующая терапия моноклональными антителами не влияли на эффективность комбинации FOLFIRI и афлиберцепта [6]. Опыт клиники США интересен тем, что, как и в России, у 75,2% больных афлиберцепт назначался не только по показаниям (во второй линии), но и на более поздних этапах лечения. Несмотря на это, медиана выживаемости без прогрессирования составила 8 месяцев, а частота токсических реакций была аналогична или даже меньше по сравнению с данными VELOUR [7].
В нашем исследовании при назначении комбинации FOLFIRI с афлиберцептом во второй линии частота объективных эффектов и выживаемости без прогрессирования соответствовала результатам VELOUR и другим данным реальной клинической практики. Сохраняется высокая частота отмены препарата в связи с токсическими реакциями. При этом, в отличие от регистрационного исследования, в РФ отмечена меньшая частота диареи, тошноты, астении. Возможно, это связано, в большей степени, с недостоверной регистрацией нежелательных эффектов врачами в своей клинической практике. Не исключается и особенность пациентов не обращать внимание на НЯ легких степеней тяжести и не доводить эту информацию до лечащего врача.
Учитывая высокий процент больных, которым прекращена терапия в связи с осложнениями лечения, мы провели дополнительный анализ для выявления факторов, ассоциированных с нежелательными негематологическими явлениями 3–4 степени, которые и явились основной причиной отмены. К таким факторам относятся наличие сопутствующей патологии, требующей медикаментозной коррекции, и число линий терапии, предшествующих афлиберцепту. Данная информация определяет необходимость более тщательного мониторирования состояния пациента с целью не только более раннего лечения возникших осложнений, но и введения профилактических мер по их возникновению.
Частота осложнений 3–4 степени на терапии по схеме FOLFIRI с афлиберцептом даже в условиях повседневной практики находится на уровне 18–24%, это ставит перед исследователями задачи по возможности редукции доз химиопрепаратов в данном режиме или переходу на поддерживающую терапию после окончания запланированного количества курсов лечения. Так, в работе Pentheroudakis с соавторами исследователи оценили возможность назначения режима FOLFIRI с афлиберцептом в первой линии терапии, и, в случае отсутствия прогрессирования после 12 курсов, перехода на поддерживающую терапию афлиберцептом в монорежиме. Авторы работы достигли медианы выживаемости без прогрессирования в 8,4 месяца, а продолжительности жизни — 20,9 месяцев. При этом из 600 зарегистрированных побочных эффектов терапии только 57 из них развились на поддерживающем этапе лечения [8]. Это говорит о необходимости изменения дозы именно химиотерапевтической составляющей лечения. Попытки разделения дозы иринотекана на 1-й и 3-й дни одного курса в режиме FOLFIRI3 в комбинации с афлиберцептом, по данным небольшого проспективного исследования II фазы, показали обнадеживающие результаты. При сохраняющейся эффективности лечения (ОЭ — 43,3%, медиана выживаемости без прогрессирования — 11,3 месяца) данная схема продемонстрировала лучшую переносимость (нежелательные явления 3–4 степени зарегистрированы у 56,7% пациентов) [9]. Однако в литературе не удалось найти результаты исследований по комбинации афлиберцепта только с иринотеканом, что, возможно, могло бы повлиять на длительность терапии второй линии за счет потенциально менее токсичного подхода. С учетом российской клинической практики, где афлиберцепт в большинстве случаев назначается во 2 линии лечения, а фторпиримидины, входящие в 1 линию, используются в качестве продленной поддерживающей терапии, применение монотерапии иринотеканом в сочетании с афлиберцептом представляется возможной лечебной стратегией и требует изучения.
Основным недостатком проведенной работы является ее ретроспективный характер и возможное влияние опыта различных клиник, принимающих участие в исследовании, на показатели выживаемости и доступ к препарату.
Заключение
Частота объективных эффектов, выживаемость без прогрессирования и частота отмены афлиберцепта в связи с токсическими реакциями при применении комбинации FOLFIRI + афлиберцепт во второй линии среди пациентов в РФ аналогична результатам исследования VELOUR. В РФ отмечена меньшая частота диареи, тошноты, астении, что может быть связано с особенностями регистрации НЯ. Сопутствующая патология, требующая медикаментозной коррекции, и число линий терапии предшествующих афлиберцепту, по-видимому, являются факторами риска для развития негематологических явлений 3–4 степени.
Список литературы Оценка токсичности и эффективности терапии комбинацией Folfiri и афлиберцепта при метастатическом раке толстой кишки в РФ: первые результаты многоцентрового ретроспективного исследования
- Van Cutsem E, Tabernero J, Lakomy R, et al. Addition of aflibercept to fluorouracil, leucovorin, and irinotecan improves survival in a phase III randomized trial in patients with metastatic colorectal cancer previously treated with an oxaliplatin-based regimen. J Clin Oncol. 2012 Oct 1;30 (28):3499-506.
- Riechelmann R, Srimuninnimit V, Kavan P. Aflibercept plus FOLFIRI for 2nd line treatment of metastatic colorectal cancer (mCRC): Long-term safety observation from the global aflibercept safety and quality-of-life (QoL) program (ASQoP). Annals of Oncology (2016) 27 (6): 149-206.
- Pastorino A, Di Bartolomeo M, Maiello E, et al. Aflibercept Plus FOLFIRI in the Real-life Setting: Safety and Quality of Life Data From the Italian Patient Cohort of the Aflibercept Safety and Quality-of-Life Program Study. Clin Colorectal Cancer. 2018 Sep;17 (3):e457-e470.
- Montes AF, Lago NM, Rúa MC, et al. Efficacy and safety of FOLFIRI/aflibercept in second-line treatment of metastatic colorectal cancer in a real-world population: Prognostic and predictive markers. Cancer Medicine. 2018;1-8.
- Hofheinz R, Thaler J, Von Moos R, et al. Quality of life (QoL) and therapy management in metastatic colorectal cancer (mCRC) patients treated with FOLFIRI and aflibercept in Germany, Switzerland, and Austria (GSA): Interim results of the noninterventional QoLiTrap-study. Journal of Clinical Oncology 34, no. 4_suppl (February 1 2016) 681-681.
- Hofheinz RD, Derigs H, Piringer G, et al. Interim analysis of the non-interventional study QoLiTrap (AIO-LQ-0113) in patients with metastatic colorectal cancer (mCRC) treated with aflibercept (AFL) + FOLFIRI: Efficacy according to age group ≤65 and >65 years. Annals of Oncology. 2018;29 (suppl_8).
- Ivanova JI, Saverno KR, Sung J, et al. Real-world treatment patterns and effectiveness among patients with metastatic colorectal cancer treated with ziv-aflibercept in community oncology practices in the USA. Med Oncol. 2017 Nov 4;34 (12):193.
- Pentheroudakis G, Kotoula V, Koliou GA, et al. AMALTHEA: Prospective, Single-Arm Study of the Hellenic Cooperative Oncology Group (HeCOG) Evaluating Efficacy and Safety of First-Line FOLFIRI + Aflibercept for 6 Months Followed by Aflibercept Maintenance in Patients With Metastatic Colorectal Cancer. Clin Colorectal Cancer. 2018 Dec;17 (4):e631-e637.
- Carola C, Ghiringhelli F, Kim S, et al. FOLFIRI3-aflibercept in previously treated patients with metastatic colorectal cancer. World J Clin Oncol. 2018 Sep 14; 9 (5): 110-118.


