Оценка токсичности отходов нефтедобычи методами биотестирования
Автор: Сипулинов Ринат Батыркатович, Карагайчева Юлия Владимировна, Шилова Наталья Александровна, Рогачева Светлана Михайловна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Промышленная экология
Статья в выпуске: 5-2 т.17, 2015 года.
Бесплатный доступ
Проведена оценка токсичности бурового шлама и отработанного бурового раствора на основе полиакриламида с использованием биотестов на основе культуры зеленой протококковой водоросли Scenedesmus quadricauda и ветвистоусых рачков Daphnia magna Straus. Изучена фитотоксичность водных вытяжек из бурового шлама на редисе Raphanus sativus L. Исследуемые образцы были отнесены к 3 классу опасности, показана возможность культивирования растений на почвах, загрязненных отходами бурения.
Буровой раствор, буровой шлам, полиакриламид, класс опасности, биотестирование, фитотоксичность
Короткий адрес: https://sciup.org/148204124
IDR: 148204124 | УДК: 502.171;
Текст научной статьи Оценка токсичности отходов нефтедобычи методами биотестирования
В настоящее время на территории Российской Федерации происходит активное освоение нефтяных месторождений. Одной из глобальных проблем нефтедобывающей отрасли является загрязнение почв нефтепродуктами, которое происходит при их транспортировке, авариях на нефтепроводах и при размещении отходов бурения в районах нефтедобычи. Большую часть отходов бурения составляют буровые шламы (БШ) и отработанные буровые растворы (ОБР). Их токсичность во многом зависит от первоначальной рецептуры бурового раствора, физико-химический состав и технологические параметры которого определяются условиями бурения [1, 2]. В нашей стране широкое распространение получили буровые растворы на основе полиакриламида, который относится к 3-4 классу опасности [3].
Выбор наиболее оптимального метода ремедиации загрязненных территорий зависит от степени токсичности отходов бурения, оценка которой затруднена из-за отсутствия универсальной рецептуры приготовления буровых растворов и многокомпонентного неконтролируемого состава буровых шламов [4]. Поэтому для определения класса опасности этих отходов решающая роль отводится экспериментальным
биологическим методам, учитывающим комплексное воздействие всех компонентов исследуемой пробы на биоту [5].
Цель исследования: определить с помощью методов биотестирования класс опасности БШ и ОБР на основе полиакриламида и оценить фитотоксичность водных вытяжек из буровых шламов.
Экспериментальная часть. В экспериментах использовались усредненные пробы БШ и ОБР, отобранные на месторождениях ОАО «Газпромнефть-Ноябрьскнефтегаз» ЯмалоНенецкого автономного округа. При оценке класса опасности отходов в качестве тест-объектов использовались культуры зеленой протококковой водоросли Scenedesmus quadri-cauda и ветвистоусых рачков Daphnia magna Straus. Культуру водорослей выращивали на среде Прата в конических плоскодонных колбах объемом 250-500 см3 в люминостате при стандартных условиях. Культуру рачков дафний выращивали в климатостате Р2, согласно аттестованной методике [6]. Кормом дафний служила зеленая протококковая водоросль S. quadricauda. Для определения токсичности БШ и ОБР использовали методики, внесенные в Федеральный реестр [6, 7]. Водные вытяжки из БШ и ОБР для дафний готовили на культивационной воде с рН 7,0 - 7,5, для водорослей – на дистиллированной воде. В качестве показателей токсичности использовали выживаемость дафний и изменение уровня флюоресценции хлорофилла водорослей. Измерения интенсивности флуоресценции проводили на спектро-флуориметре «Флюорат-02-Панорама». При оценке острой токсичности с помощью D. magna продолжительность опытов составляла 96 часов, с использованием S. quadricauda - 72 часа. Класс опасности устанавливали по кратности разбавления водных вытяжек, при которой вредное воздействие на гидробионты отсутствовало [5].
Фитотоксичность БШ оценивали с использованием семян редиса посевного Raphanus sativus L. (сорт Корунд). Подготовленные семена закладывали в чашки Петри на фильтровальную бумагу и заливали 5 мл исследуемого раствора. Контролем служили семена, помещенные в дистиллированную воду. Семена инкубировали в термостате при температуре 20°С в течение 72 часов. В эксперименте оценивали всхожесть семян (в %), среднюю длину ростка и корня в мм. Разницу показателей до 10% по сравнению с контролем не принимали во внимание, и образец считали экологически чистым, разница в 10–30% указывала на слабую токсичность почвы, от 30 до 50% – на среднюю степень, а выше 50% – на высокую степень фитотоксичности пробы [8].
Все эксперименты проводились в 3-кратной повторности. Математическую обработку полученных данных проводили с использованием компьютерной программы МS Excel 2000. Рассчитывали среднее арифметическое, доверительный интервал и стандартное отклонение. Статистическая достоверность всех представленных результатов оценивалась с использованием t-критерия Стьюдента и составляла 95%.
Результаты и их обсуждение. Для определения класса опасности отходов с помощью методов биотестирования обязательным являя-ется использование не менее двух тест-объектов из разных биологических таксонов или групп [5]. Если разные тест-системы проявляют неодинаковую реакцию, в качестве результата следует учитывать наиболее чувствительный ответ [9]. В работе для определения класса опасности БШ и ОБР на полиакриламидной основе в качестве тест-объектов использовались следующие культуры: зеленые протококковые водоросли Scenedesmus quadricauda , и ветвистоусые рачки Daphnia magna Straus; оценку фитотоксичности проводили на редисе посевном R. sativus L.
Первоначально определяли класс опасности ОБР. В качестве показателя токсичности использовали смертность дафний и изменение уровня флюоресценции хлорофилла водорослей. На рис. 1 представлена диаграмма, описывающая зависимость выживаемости дафний от концентрации суспензии ОБР и времени проведения эксперимента. Острая токсичность (гибель более 50% организмов) была обнаружена на 2-е сутки эксперимента в растворах с содержанием ОБР выше 1%. При экспозиции 96 ч острый токсический эффект отмечен в растворах с концентрацией 0,001-0,1%. Отсутствие смертности наблюдалось в растворе с минимальной концентрацией 0,0001%.
Далее было изучено влияние растворов водных вытяжек ОБР на снижение численности водорослей S. quadricauda , которое фиксировали по уменьшению интенсивности флуоресценции их хлорофилла . На рис. 2 представлена диаграмма, описывающая зависимость интенсивности флуоресценции хлорофилла водорослей от концентрации водной вытяжки ОБР. В исследуемых растворах с содержанием ОБР от 10,0% до 0,001% наблюдалось снижение численности клеток в среднем на 45-50%, при концентрации ОБР 0,0001% – на 27%. При 50%-ной концентрации ОБР – число клеток водорослей уменьшалось на 87%.
Таким образом, по итогам биотестирования было установлено, что водная вытяжка исследуемого ОБР оказывает токсическое действие на S. quadricauda и D. magna. Исследуемые тест-организмы проявили различную чувствительность по отношению к анализируемым пробам, наиболее чувствительными оказались водоросли. Так как согласно [9] в качестве окончательного результата берется наиболее чувствительный ответ, а установление класса опасности ведется в зависимости от кратности разведения водной вытяжки, при которой не выявлено воздействия на гидробионтов, то исследуемый ОБР был отнесен к 3 классу опасности.
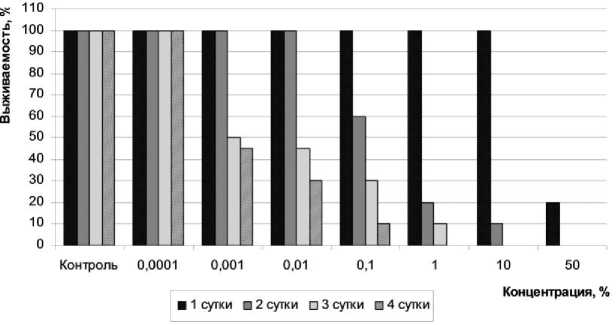
Рис. 1. Зависимость выживаемости D. magna от концентрации водной вытяжки ОБР и времени проведения эксперимента
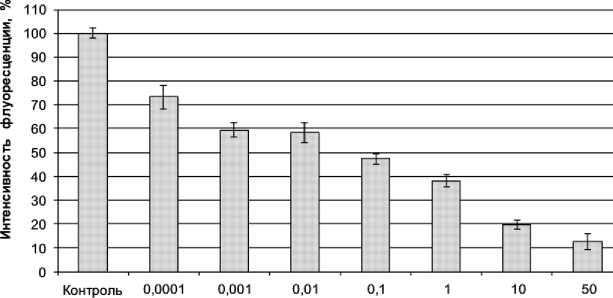
Концентрация, %
Рис. 2. Зависимость интенсивности флуоресценции хлорофилла S. quadricauda от концентрации водной вытяжки ОБР
На следующем этапе нашей работы была проведена оценка степени токсичности БШ. Проводимые ранее эксперименты показали, что наиболее чувствительным тест-объектом к действию ОБР является S. quadricauda, поэтому дальнейшие исследования было решено проводить на данном организме. Известно, что зелёные протококковые водоросли S. quadricauda, являются первичным звеном пищевой цепи в пресных водоёмах, выполняя роль продуцентов. Аналогичную функцию в наземных экосистемах выполняют биотеста было выбрано однолетнее растение редис посевной R. sativus L., являющееся стандартным биотестом. Диаграмма зависимости интенсивности флуоресценции хлорофилла S. quadricauda от концентрации водной вытяжки БШ представлена на рис. 3. Острый токсический эффект, т.е. снижение отклика биотеста на 50% и более, отмечен в растворах с содержанием БШ 0,01%. Минимальная из исследуемых концентраций 0,0001% приводит к уменьшению интенсивности флуоресценции хлорофилла на 17%.
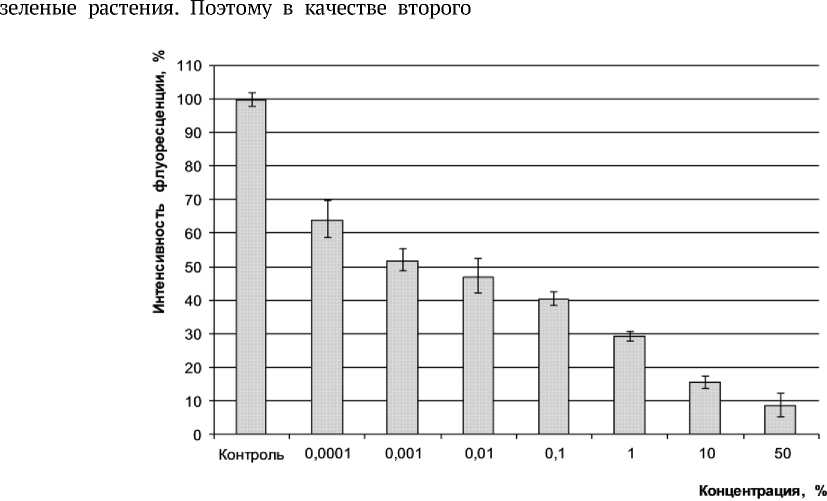
Рис. 3. Зависимость интенсивности флуоресценции хлорофилла S. Quadricauda от концентрации водной вытяжки БШ
Для оценки фитотоксичности водной вытяжки из БШ был использован метод определения скорости прорастания семян R. sativus L в чашках Петри. В экспериментах использовались 50, 25, 10, 5, 1%-ные водные растворы вытяжки. Результаты фитотестирования представлены в табл. 1. Из данных, представленных в табл. 1, видно, что увеличение концентрации водной вытяжки отхода в растворе ведет к снижению степени прорастания семян. Максимальный процент снижения исследуемого показателя - 28% отмечен в пробах с концентрацией вытяжки 50%. Острого токсического эффекта отмечено не было.
При определении ростовых характеристик проростков, было отмечено, что начиная с десятикратного разведения пробы, наблюдается некоторое угнетение семян [10]. При содержании БШ в пробе в концентрации 1% и 5% наблюдается усиление роста корня на 16-18%, что можно объяснить ответной реакцией растения на присутствие органического углерода в почве. Отмечено, что длина побега по сравнению с контролем не изменяется. Для наглядности представления результатов исследований (табл. 1) нами построены графики зависимости относительных показателей процента прорастания, длины корня и побега растения от концентрации водной вытяжки БШ в растворах (рис. 4).
Таблица 1. Параметры прорастания семян R. sativus в растворах водной вытяжки БШ
|
Концентрация вытяжки из БШ, % |
Показатель |
|||||
|
всхожесть семян, |
средняя длина корня, |
средняя длина побега |
||||
|
% |
% от контроля |
мм |
% от контроля |
мм |
% от контроля |
|
|
контроль |
96,0±1,4 |
100 |
17,3 ± 1,1 |
100 |
14,8 ± 0,8 |
100 |
|
1 |
93,0±0,9 |
96,9±1,1 |
20,0 ± 1,9 |
115,9±2,4 |
14,9 ± 0,9 |
100,2±0,2 |
|
5 |
87,0±1,7 |
90,6±1,8 |
20,4 ± 1,4 |
117,9±1,4 |
14,5 ± 0,4 |
97,8±1,1 |
|
10 |
80,0±2,1 |
83,3±1,9 |
12,0 ± 0,4 |
69,0±1,1 |
11,0 ± 1,0 |
74,2±1,2 |
|
25 |
73,0±1,7 |
76,0±2,1 |
10,9 ± 0,9 |
63,0±2,4 |
11,7± 0,6 |
78,8±1,5 |
|
50 |
69,0±1,7 |
71,9±0,4 |
11,2 ± 0,7 |
64,9±0,4 |
9,1 ± 1,4 |
61±1,7 |
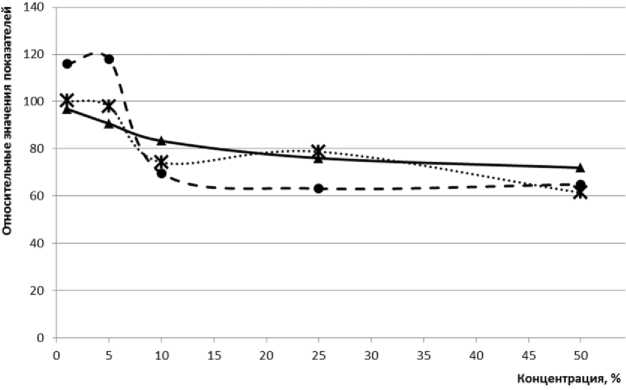
—*— Всхожесть семян — •- Длина корня " -Ж • • Длина ростка
Рис. 4. Зависимость относительных показателей прорастания, массы корня и побега R. sativus от концентрации водной вытяжки БШ
Выводы: фитотестирование не выявило острого токсического действия БШ на растения, было отмечено, что низкие концентрации обладают стимулирующим воздействием на корневую систему R. sativus L. . Это свидетельствует о возможности культивирования растений на почвах, загрязненных отходами бурения. На основе данных биотестирования можно заключить, что наибольшую чувствительность к содержанию ОБР и БШ в водной среде проявляют водоросли S. quadricauda, и исследованные образцы БШ и ОБР могут быть отнесены к 3-му классу опасности.
Список литературы Оценка токсичности отходов нефтедобычи методами биотестирования
- Булатов, А.И. Охрана окружающей среды в нефтегазовой промышленности/А.И. Булатов, П.П. Макаренко, В.Ю. Шеметов. -М.: Недра, 1997. 314 с.
- Мстиславская, Л.П. Основы нефтегазового производства/Л.П. Мстиславская, М.Ф. Павлинич, В.П. Филиппов. -М.: 1996. 248 с.
- РД 51-1-96 Инструкция по охране окружающей среды при строительстве скважин на суше на месторождениях углеводородов поликомпонентного состава, в том числе сероводородсодержащих (утв. Минтопэнерго РФ от 21.01.96, Минприроды РФ от 10.08.96.)
- Мазлова, Е.А. Проблемы утилизации нефтешламов и способы их переработки. -М.: Изд. дом «Ноосфера», 1997. 128 c.
- Критерии отнесения опасных отходов к классу опасности для окружающей природной среды (утв. приказом МПР РФ от 15 июня 2001г. № 511)
- ФР. 1.39.2007.03222. Биологические методы контроля. Методика определения токсичности воды по смертности и изменению плодовитости дафний. -М.: Акварос, 2007. 41с.
- ФР.1.39.2001.00284 Методика определения токсичности вод, водных вытяжек из почв, осадков сточных вод и отходов по изменению уровня флуоресценции хлорофилла и численности клеток водорослей. -М.: Акварос, 2001. 42 с.
- Галицкая, П.Ю. Тестирование отходов, почв, материалов с использованием живых систем: Учебно-методическое пособие/П.Ю. Галицкая, С.Ю. Селивановская, Р.Х. Гумерова. -Казань: Казанский университет, 2011. 47 с.
- Терехова, В.А. Биотестирование как метод определения класса опасности отходов//Экология и промышленность России. 2003. №12. С. 27-29.
- СП 2.1.7.1386-03. Санитарные правила по определению класса опасности токсичных отходов производства и потребления. -М.: Авангард, 2003. 20 с.


