Оценка токсичности производных бензимидазола и их влияние на функциональные показатели пресноводных рачков Ceriodaphnia dubia Richard, 1894
Автор: Фомичева Е.М., Савина Л.И.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Биологические науки
Статья в выпуске: 1, 2024 года.
Бесплатный доступ
В последнее время в связи с активным развитием фармацевтической промышленности возникла острая проблема загрязнения окружающей среды синтетическими биологически активными соединениями. Одним из наиболее часто встречаемых фармакофоров в лекарственных средствах является бензимидазольный цикл. Содержащие его вещества уже в микроколичествах способны оказывать токсическое действие на живые системы. К тому же, являясь чужеродными для природы, они не включаются в метаболические процессы и долгое время не подвергаются разложению. Оценка токсичности производных бензимидазола, ее стабильности в водной среде, влияния бензимидазолов на биологические параметры позволит спрогнозировать возможные изменения популяционных показателей цериодафний и других гидробионтов. Цель работы оценка токсичности производных бензимидазола и их влияния на выживаемость и плодовитость пресноводных рачков Ceriodaphnia dubia Richard, 1894.
Бензимидазол, производные бензимидазола, токсичность, стабильность токсичности, цериодафнии, плодовитость, численность потомства
Короткий адрес: https://sciup.org/14129932
IDR: 14129932 | УДК: 574.24 | DOI: 10.34014/2227-1848-2024-1-148-161
Текст научной статьи Оценка токсичности производных бензимидазола и их влияние на функциональные показатели пресноводных рачков Ceriodaphnia dubia Richard, 1894
Введение. Продукты фармацевтических предприятий являются широко встречаемыми в природе ксенобиотиками [1]. Они выпускаются десятками тысяч тонн и, попадая в окружающую среду, не разрушаются в течение длительного времени, нарушают процессы самоочищения почв и водоемов [2, 3]. Даже небольшие количества биологически активных веществ, с учетом их персистентности и комбинированного действия, могут приводить к существенным изменениям как на уровне популяции, так и на уровне биоценозов.
В состав многих лекарственных препаратов входят производные бензимидазола [4]. Это обусловлено широким спектром их биологической активности. Они находят применение в медицине, фармацевтике, ветеринарии, сельском хозяйстве [5–15]. Особенно часто соединения этого класса гетероциклов используются в качестве антимикробных средств. Появление резистентных к ним организмов вызывает необходимость синтеза их новых производных [16, 17].
Таким образом, существует необходимость проведения исследований по изучению влияния производных бензимидазолов на жизненные функции организма, что позволит прогнозировать появление биологических и экологических рисков при попадании этих соединений в окружающую среду.
Цель исследования. Оценка токсичности производных бензимидазола и их влияния на выживаемость и плодовитость пресноводных рачков Ceriodaphnia dubia Richard, 1894.
Материалы и методы. Исследования проводили согласно стандартным методикам на синхронизированной культуре Ceriodaph-nia dubia Richard, 1894. Культивирование и эксперименты на рачках выполняли в контролируемых условиях в климатостате при температуре воздуха +22…+24 °С с фотопериодом 16 ч освещения и 8 ч темноты.
В качестве токсикантов использовали 1H-бензимидазол и его производные: 2-ме-тил-1Н-бензимидазол, 2-(трифторметил)-1Н-бензимидазол, 5,6-диметил-1Н-бензимидазол, 5,6-диметил-7-нитро-1Н-бензимидазол, 2-(три-фторметил)-5-бром-1Н-бензимидазол, 5,6-ди-метил-1Н-бензимидазол-7-амин, калиевую соль пиридо[1,2-а]бензимидазол-7-карбоновой кислоты. Из исследуемых соединений только калиевая соль пиридо[1,2-а]бензимидазол-7-карбоновой кислоты хорошо растворима в воде. Все остальные бензимидазолы растворяются в воде только в присутствии диметилсульфоксида (ДМСО). ДМСО, согласно литературным данным, относится к веществам, малотоксичным для животных. Однако есть данные об усилении токсичности растворяемых веществ при его использовании [18]. Во всех сериях экспериментов по определению острой токсичности веществ использовали дополнительный контроль: отстоянная аэрированная вода + ДМСО. В дальнейших исследованиях хронического действия и стабильности токсичности применяли только калиевую соль пиридо[1,2-а]бензимидазол-7-карбоновой кислоты.
Определение острой и хронической токсичности производных бензимидазола проводили в соответствии со стандартной методикой (Методика определения токсичности воды и водных вытяжек из почв, осадков сточных вод, отходов по смертности и изменению плодовитости цериодафний. Федеральный реестр (ФР). ФР.1.39.2007.03221. 2007). Для выявления острой токсичности проводили определение LC 50 за 24 и 48 ч в зависимости от целей эксперимента. Использовали по три повторности для контрольной и опытной групп, в каждой повторности по 10 особей. Для выявления хронического токсического действия использовали концентрацию 20 мг/л, что составляет 0,3 от LC 50 за 48 ч. Рачков в возрасте не более 24 ч по одному помещали в стеклянные емкости с 15 мл исследуемого раствора. Применяли три повторности по 7 самок на одну повторность. Один раз в двое суток проводили учет смертности и родившейся молоди в опыте и контроле, пересадку выживших самок в свежеприготовленный раствор токсиканта (опыт) и отстоянную аэрированную воду (контроль). Хронические испытания проводили до последней выжившей цериодафнии (38 сут). Кормление рачков производили суспензией дрожжей и зеленых протококковых водорослей Chlorella sp . Показателями токсического действия служили смертность, изменение продолжительности жизни и плодовитости рачков по сравнению с контролем.
Для оценки стабильности токсичности вещества и продуктов его распада проводили токсикологическое исследование согласно стандартной методике (Методические указания по разработке нормативов качества воды водных объектов рыбохозяйственного значения, в том числе нормативов предельно допустимых концентраций вредных веществ в водах водных объектов рыбохозяйственного значения (утв. Приказом Федерального агентства по рыболовству от 04.08.2009 № 695)). В исследовании использовали одну концентрацию вещества LС50 за 24 ч. Раствор с данной концентрацией по 100 мл вносили в стеклянные колбы. Каждый вариант соответствовал постановке эксперимента в определенный день исследований. Далее на исходные, 3, 5, 7, 10, 15, 20-е и 30-е сут от начала эксперимента в соответствующие емкости вносили по 10 односуточных цериодафний. Перед каждым внесением цериодафний раствор тщательно перемешивали. Через 24 ч после внесения учитывали число погибших особей. Опыты проводили в 3-кратной повторности. Каждому опыту соответствовал контроль.
Статистическую значимость различий в значениях контрольных и опытных вариантов оценивали с помощью U-критерия Манна – Уитни (Mann – Whitney U test). Уровень значимости для всех видов сравнения принимали 0,05 (p≤0,05).
Результаты и обсуждение. В результате определения медианной летальной концентрации (LC 50-48 ) отмечена разная токсичность производных бензимидазола для цериодаф-ний (табл. 1, рис. 1). Выявлено наличие зависимости уровня проявления токсического эффекта от строения исследуемых гетероциклов.
Введение заместителей в молекулу органического вещества, как правило, способствует изменению его физико-химических свойств, реакционной способности, процессов превращения в организме, а соответственно, и изменению степени проявления токсического эффекта.
Таблица 1
Table 1
Значение медианной летальной концентрации (LС 50-48 ) для исследуемых веществ Median lethal concentration (LC 50-48 ) values for the test substances
|
№ соединения Substance number |
Исследуемое вещество Test substance |
Формула Formula |
Значение LC 50-48 , мг/л LC 50-48 value, mg/l |
||
|
1 |
1H-бензимидазол 1H-benzimidazole |
5 6 |
4 7 |
3 N 2 N 1 H |
102,3 |
|
2 |
2-метил-1Н-бензимидазол 2-methyl-1H-benzimidazole |
с |
N N H |
>— CH3 |
109,7 |
|
3 |
5,6-диметил-1Н-бензимидазол 5,6-dimethyl-1H-benzimidazole |
H 3 C H 3 C |
N N H |
14,45 |
|
|
4 |
5,6-диметил-1Н-бензимидазол-7-амин 5,6-dimethyl-1H-benzimidazol-7-amine |
H 3 C H 3 C |
NH 2 |
N N H |
46,03 |
|
№ соединения Substance number |
Исследуемое вещество Test substance |
Формула Formula |
Значение LC 50-48 , мг/л LC 50-48 value, mg/l |
|
5 |
5,6-диметил-7-нитро-1Н-бензимидазол 5,6-dimethyl-7-nitro-1H-benzimidazole |
HC 3 N HC N 3 H NO 2 |
6,46 |
|
6 |
2-(трифторметил)-1Н-бензимидазол 2-(trifluoromethyl)-1H-benzimidazole |
N 1 Г CF3 N H |
41,69 |
|
7 |
2-(трифторметил)-5-бром-1Н-бензими-дазол 5-bromo-2-(trifluoromethyl)-1H-benzimidazole |
Br N Y L)-CF 3 N H |
2,4 |
|
8 |
калиевая соль пиридо[1,2-а]бензи-мидазол-7-карбоновой кислоты potassium pyrido[1,2-a]benzi-midazole-7- carboxylate |
12 9 8 N 3 O 4 O 7 N 65 OK |
69,18 |
Как видно из данных табл. 1, наличие заместителей различной электронной природы и их расположение в бензимидазоле по-разному влияли на острую токсичность веществ. Введение двух метильных групп в молекулу гетероцикла (соед. 3) приводило к увеличению в 7 раз токсичности данного вещества по сравнению с 1Н-бензимидазолом (1). Присутствие одного метильного заместителя в положении 2 гетероцикла (2) делало его наименее токсичным из всех исследуемых соединений. Наличие аминогруппы (4) в 5,6-диметил-1Н-бензимидазоле значительно увеличивало значение LC50-48, в то время как присутствие нитрогруппы (5) усиливало более чем в 2 раза токсичность вещества по сравнению с 5,6-ди-метил-1Н-бензимидазолом (3) и почти в 16 раз относительно незамещенного бензимидазола (1). Большая токсичность нитропроизвод- ного вещества (5) хорошо согласовывалась с литературными данными [19]. Замещение всех атомов водорода в метильной группе 2-метил-1Н-бензимидазола (2) на фтор (6) почти в 3 раза усиливало токсичность по сравнению с веществом 2. Присоединение к 2-(три-фторметил)-1Н-бензимидазолу (6) атома брома в положение 5 гетероцикла также приводило к усилению токсичности. Так, 2-(три-фторметил)-5-бром-1Н-бензимидазол (7) являлся наиболее токсичным из исследованных веществ. Введение галогенов в молекулу является широко используемым приемом для увеличения биологической активности соединения [20]. Калиевая соль пиридо[1,2-а]бензи-мидазол-7-карбоновой кислоты имела наиболее низкое значение токсичности среди исследуемых веществ.
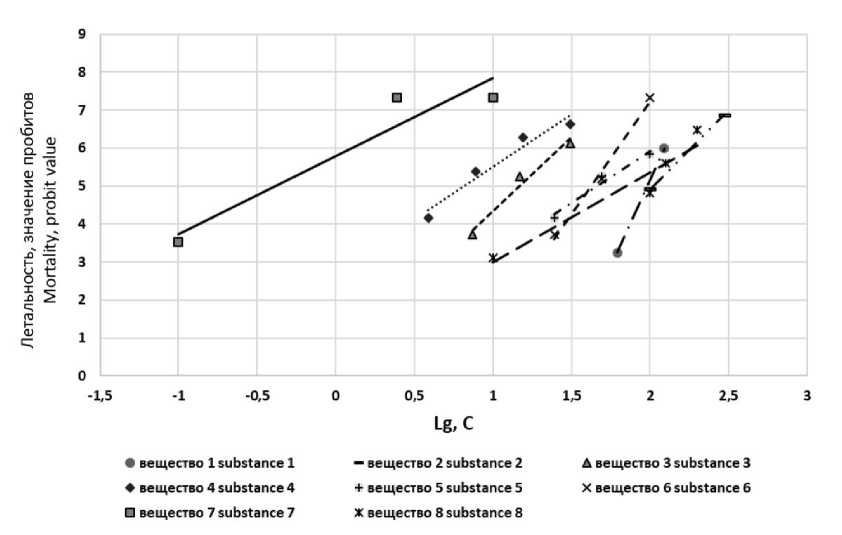
Рис. 1. Линейная зависимость летальности цериодафний от логарифма концентрации исследуемого вещества (вещество 1 – 1Н-бензимидазол, вещество 2 – 2-метил-1Н-бензимидазол, вещество 3 – 5,6-диметил-1Н-бензимидазол, вещество 4 – 5,6-диметил-1Н-бензимидазол-7-амин, вещество 5 – 5,6-диметил-7-нитро-1Н-бензимидазол, вещество 6 – 2-(трифторметил)-1Н-бензимидазол, вещество 7 – (трифторметил)-5-бром-1Н-бензимидазол, вещество 8 – калиевая соль пиридо[1,2-а]бензимидазол-7-карбоновой кислоты)
Fig. 1. Linear dependence of ceriodaphnia lethality on the test substance concentration logarithm (substance 1 – 1H-benzimidazole, substance 2 – 2-methyl-1H-benzimidazole, substance 3 – 5,6-dimethyl-1H-benzimidazole, substance 4 – 5,6-dimethyl-1H-benzimidazol-7-amine, substance 5 – 5,6-dimethyl-7-nitro-1H-benzimidazole, substance 6 – 2-(trifluoromethyl)-1H-benzimidazole, substance 7 – 5-bromo-2-(trifluoromethyl)-1H-benzimidazole, substance 8 – potassium pyrido[1,2-a]benzimidazole-7-carboxylate)
Таким образом, 1Н-бензимидазол, 2-ме-тил-1Н-бензимидазол и калиевая соль пири-до[1,2-а]бензимидазол-7-карбоновой кислоты, согласно классификации веществ по острой токсичности для гидробионтов [21], относятся к малотоксичным соединениям; 5,6-диметил-1Н-бензимидазол, 5,6-диметил-1Н-бензимида-зол-7-амин, 5,6-диметил-7-нитро-1Н-бензими-дазол, 2-(трифторметил)-1Н-бензимидазол – к среднетоксичным; 2-(трифторметил)-5-бром-1Н-бензимидазол – к обладающим высокой степенью токсичности.
Несмотря на относительную генетическую однородность особей цериодафний синхронизированной культуры степень проявления токсического эффекта в группе может отличаться. При анализе линейной зависимости
«доза – эффект» в исследуемой подгруппе тест-объектов отражается соотношение гиперреактивных (чувствительных) и гипореак-тивных (резистентных) особей. При наличии пологой зависимости «доза – эффект» вещества считаются наиболее опасными для особей, обладающих гиперчувствительностью к токсиканту. В случае с высокой крутизной зависимости вещества считаются более опасными для всей популяции в силу того, что даже незначительное увеличение концентрации может привести к развитию эффекта у большей части особей [22]. Таким образом, можно предположить, что 2-(трифторметил)-5-бром-1Н-бензимидазол, 5,6-диметил-1Н-бен-зимидазол-7-амин и калиевая соль пири-до[1,2-а]бензимидазол-7-карбоновой кислоты будут наиболее опасны для особей с высокой чувствительностью к токсиканту. Для всей популяции будут наиболее опасны 1Н-бензими-дазол, 2-метил-1Н-бензимидазол и 2-(три-фторметил)-1Н-бензимидазол.
Токсическое действие бензимидазолов связано с их способностью приводить к увеличению проницаемости мембран, возрастанию сродства к рецепторным белкам, нарушению процессов утилизации питательных веществ [2, 23]. Бензимидазолы применяются как противоопухолевые средства в силу их способности приводить к разрыву нитей ДНК либо выступать интеркаляторами [24].
С учетом того, что только калиевая соль пиридо[1,2-а]бензимидазол-7-карбоновой кислоты обладает относительно низкой токсичностью, хорошо растворима в воде и тем самым представляет наибольшую опасность для гидробионтов при поступлении в водный объект, ее использовали для проведения дальнейших исследований.
Хронические пожизненные испытания на цериодафниях позволяют выявить влияние токсиканта на выживаемость, продолжительность жизни, плодовитость рачков, что является важным индикатором возможных популяционных изменений. По показателю выживаемости и средней продолжительности жизни статистически значимых отличий от контрольной группы не выявлено (р=0,84) (табл. 2). В контроле минимальная продолжительность жизни составила 3 сут, максимальная – 38, в опыте – 3 и 31 сут соответственно.
Для выявления влияния калиевой соли пи-ридо[1,2-а]бензимидазол-7-карбоновой кислоты на репродуктивную функцию рачков рассчитывались следующие показатели: общая численность потомства, среднее число родившейся молоди на одну самку, среднее число пометов на одну самку, среднее время отрож-дения молоди, среднее число молоди в помете (табл. 2).
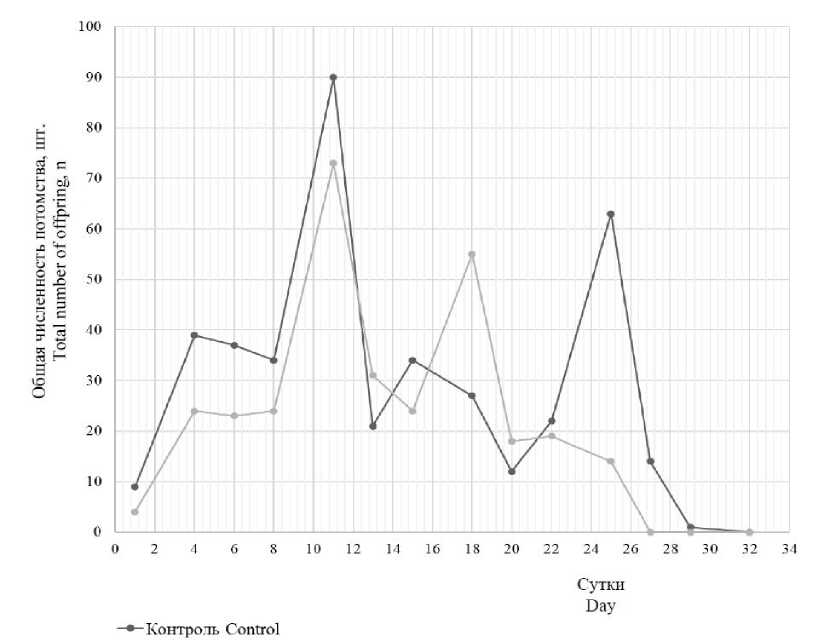
Общая динамика рождаемости в опыте и контроле имела сходный характер, хотя несколько сдвигались пики численности потомства (рис. 2).
Таблица 2
Table 2
Изменение показателей плодовитости цериодафний в хроническом токсикологическом эксперименте с калиевой солью пиридо[1,2-а]бензимидазол-7-карбоновой кислоты
Changes in ceriodaphnia fertility rates in a chronic toxicological experiment with potassium pyrido[1,2- a ]benzimidazole-7-carboxylate
|
Показатель Parameter |
Контрольная группа (n=21) Control group (n=21) |
Экспериментальная группа (n=21) Experimental group (n=21) |
|
Средняя продолжительность жизни самки, сут Average lifespan, days |
23,7±1,4 |
24,04±1,94 |
|
Общая численность потомства, шт. Total number of offspring, n |
407 |
322 |
|
Среднее число родившейся молоди на одну самку, шт. Average number of offspring born per female, n |
19,38±3,12 |
17,35±1,88 |
|
Среднее число пометов на одну самку, шт. Average number of litters per female, n |
5,95±0,52 |
5,57±0,66 |
|
Среднее время отрождения молоди, сут Average hatching time, days |
3,19±0,44 |
3,09±0,34 |
|
Среднее число особей в помете, шт. Average litter size, n |
2,47±0,28 |
2,29±0,26 |
калиевая соль пиридо [1,2-а] 6ензимидазол-7-карбоновой кислоты potassium pyiido [ 1,2-a]benzimidazoIe-7-carboxy late
Рис. 2. Динамика общей численности потомства Ceriodaphnia dubia в хроническом эксперименте при действии калиевой соли пиридо[1,2-а]бензимидазол-7-карбоновой кислоты
Fig. 2. Dynamics of the total number of Ceriodaphnia dubia offspring in a chronic experiment under potassium pyrido[1,2- a ]benzimidazole-7-carboxylate
Статистически значимых отличий в плодовитости цериодафний при действии калиевой соли пиридо[1,2-а]бензимидазол-7-карбо-новой кислоты не выявлено. Несмотря на то что в опытном варианте общая численность потомства была на 20 % ниже по сравнению с контролем, среднее число родившейся молоди на одну самку достоверно не отличалось от контрольной группы (р=0,338350). Также не обнаружено и статистически значимых различий по среднему числу особей в помете (р=0,81088), среднему числу пометов на одну самку (р=0,378616) и среднему времени от-рождения молоди (р=0,371027). В опытной группе все исследуемые показатели были незначительно ниже, чем в контрольной группе, но эта разница не обусловливалась прямым действием токсиканта.
Таким образом, при хронической экспозиции рачков в растворе с калиевой солью пи-ридо[1,2-а]бензимидазол-7-карбоновой кислоты в концентрации 20 мг/л отмечено незначительное уменьшение всех показателей плодовитости, но статистически значимых различий не выявлено. Возможно, это связано как со слабой токсичностью соединения при использовании его в данной концентрации, так и с особенностями биологической активности. Известно, что некоторые производные бензимидазола обладают актопротекторной активностью [25]. Прослеживается тенденция к уменьшению общей численности потомства, что может негативно сказаться на популяционных показателях рачков при увеличении периода воздействия данного производного бензимидазола. Чувствительность к токсиканту на популяционном уровне зависит от таких факторов, как возрастные группы и временные рамки периода воздействия [26]. В стандартных токсикологических исследованиях используются рачки возрастом не более 24 ч, не учитываются возрастные и половые особенности реагирования тест-объектов [27], поэтому влияние на другие возрастные группы требует дальнейшего изучения. К тому же при увеличении периода воздействия возможно накопление токсической нагрузки за счет как материальной, так и функциональной кумуляции, что может привести к серьезной дисфункции организма в долгосрочной перспективе.
Для оценки степени возможного влияния химического вещества на окружающую среду одним из важнейших показателей является оценка стабильности токсичности вещества, так как она определяет длительность действия на организм как самого токсиканта, так и продуктов его распада. Необходимость исследования стабильности токсичности связана с тем, что химико-аналитические методы не позволяют определить остаточную суммарную токсичность вещества и продуктов его превращения. На протяжении 30 сут проводили наблюдение за изменением токсичности калиевой соли пиридо[1,2-а]бензимидазол-7-карбоновой кислоты по показателю смертности цериодаф-ний. Значение медианной летальной концентрации исследуемого токсиканта принимали по данным острого токсикологического эксперимента за 24 ч – 158,49 мг/л. В ходе исследования выявлена разная летальность цериодаф-ний в зависимости от периода экспозиции, что говорит об изменении токсичности раствора (рис. 3).
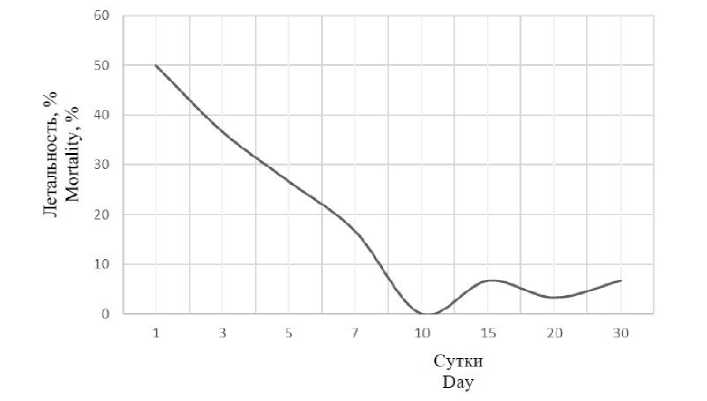
Рис. 3. Изменение летальности цериодафний за 30 сут в растворе калиевой соли пиридо[1,2-а]бензимидазол-7-карбоновой кислоты (158,49 мг/л)
Fig. 3. Changes in of ceriodaphnia mortality over 30 days in the solution of potassium pyrido[1,2- a ]benzimidazole-7-carboxylate (158,49 mg/l)
На протяжении первых 10 сут экспозиции наблюдалось постепенное снижение летальности цериодафний до 0, что говорит о низкой персистентности вещества и снижении токсичности раствора. К 15-м сут летальность це-риодафний выросла до 6,7 %, к 20-м сут снизилась до 3,3 % и к 30-м сут вернулась к значению 15-х сут. Согласно методическим рекомендациям проведения токсикологических экспериментов достоверность получаемых ре- зультатов считается надежной, если даже в контрольной группе гибель тест-объектов не превышает 10 % (Приказ Росрыболовства от 4.08.2009 № 695). Поэтому отличия в гибели тест-организмов в пределах 10 %, вероятно, не обусловлены однозначным действием токсиканта. Наблюдавшаяся динамика изменения токсичности калиевой соли пиридо[1,2-а]бен-зимидазол-7-карбоновой кислоты, включавшая как снижение, так и незначительное по- вышение токсичности на протяжении всей экспозиции, может быть связана с образованием промежуточных продуктов, их взаимодействием или дальнейшим преобразованием.
Заключение. Результаты острых токсикологических экспериментов показывают, что токсичность бензимидазолов обусловлена их физико-химическими свойствами и может представлять серьезную опасность для гидробионтов при массовых сбросах их производных в водные объекты. Согласно значениям LC50-48, полученным для цериодафний, некоторые из исследуемых производных относятся к веществам, обладающим высокой степенью токсичности, и могут представлять угрозу для особей с низкой степенью резистентности к данной группе химических со- единений. Однако необходимо отметить, что слабая растворимость большинства изученных производных бензимидазолов и низкая степень стабильности токсичности позволяют предполагать относительно невысокий уровень их воздействия на окружающую среду. Отсутствие хронического действия на репродуктивную функцию, показанное на примере калиевой соли пиридо[1,2-а]бензимидазол-7-карбоновой кислоты, с одной стороны, подтверждает условную безвредность бензимидазолов для гидробионтов, но с другой стороны, эти данные получены для одного из наименее токсичных производных. Таким образом, требуются дальнейшие токсикологические исследования влияния производных бензимидазолов на гидробионтов.
Исследование выполнено в рамках Программы развития ФГБОУ ВО «Ярославский государственный университет им. П.Г. Демидова», проект № П2-ГМ1-2021.
Список литературы Оценка токсичности производных бензимидазола и их влияние на функциональные показатели пресноводных рачков Ceriodaphnia dubia Richard, 1894
- Козырев С.В., Кораблев В.В., Якуцени П.П. Новый фактор экологического риска: лекарственные вещества в окружающей среде и питьевой воде. Научно-технические ведомости СПбГПУ. Наука и образование. 2012; 4: 195-201.
- Васин А.Е., Белоусова З.П., Зарубин Ю.П., Пурыгин П.П. Изучение токсичности некоторых производных бензимидазола. Бутлеровские сообщения. 2015; 41 (3): 119-123.
- Шугалей И.В., Илюшин М.А., Судариков А.М. Расширение фармацевтического рынка как дестабилизирующий экологический фактор. Известия Санкт-Петербургского государственного технологического института (Технического университета). 2018; 43: 81-86.
- Bansal Y., Silakari O. The therapeutic journey of benzimidazoles: a review. Bioorg Med Chem. 2012; 20 (21): 6208-6236.
- Soni L.K., Narsinghani T., Sethi A. Anti-microbial benzimidazole derivatives: synthesis and in vitro biological evaluation. Med. Chem. Res. 2012; 21 (12): 4330-4334.
- Shah K., Chhabra S., Shrivastava S.K., Mishra P. Benzimidazole: a promising pharmacophore. Med. Chem. Res. 2013; 22 (11): 5077-5104.
- Ajani O.O., Aderohunmu D. V., Ikpo C.O., Adedapo A.E., Olanrewaju I.O. Functionalized Benzimidazole Scaffolds: Privileged Heterocycle for Drug Design in Therapeutic Medicine. Arch. Pharm. Chem. Life Sci. 2016; 349 (7): 475-506.
- Власова Ю.Н., Иванова Е.В., Бойкова О.И., Атрощенко Ю.М., Шахкельдян И.В. Выявление зависимости «структура-свойство» в ряду 1,2,5-замещенных бензимидазолов. Вестник современных исследований. 2018; 7.3 (22): 414-418.
- Агацарская Я.В., Яковлев Д.С., Мальцев Д.В., Семёнова Ю.В., Салихов Д.А., Султанова К.Т., Ани-симова В.А. Нейрорецепторные эффекты антимегренозного агента 9-диэтилааминоэтил-2-(4-ме-токсифенил)имидазо[1,2-А]бензимидазола. Вестник Волгоградского государственного медицинского университета. 2019; 1 (69): 120-124.
- Мухторов Л.Г., Власова Ю.Н., НикишинаМ.Б., КаримовМ.В., Атрощенко Ю.М., Шахкельдян И.В. Синтез и характеристика амидных производных 2-[2-П-аминофенил)этил]бензимидазола. Вестник филиала Московского государственного университета им. М.В. Ломоносова в городе Душанбе. 2021; 3 (19): 70-79.
- Комарова Е.Ф., Вереникина Е.В., Гончарова А.С., Шевченко Н.А., Морковник А.С., Жуковская О.Н., Лукбанова Е.А., Ходакова Д.В., Курбанова Л.З., Миндарь М.В., Заикина Е.В., Галина А.В. Мишени противоопухолевого действия производных бензимидазола. Современные проблемы науки и образования. 2022; 5. URL: https://science-education.ru/ru/article/view?id=31978 (дата обращения: 15.12.2022).
- Черетаев И.В., Коренюк И.И., Ноздрачев А.Д. Нейротропные, психоактивные и обезболивающие свойства бензимидазола и его производных: физиологические механизмы. Российский физиологический журнал им. И.М. Сеченова. 2017; 103 (4): 381-390.
- СурковаЕ.О., СкрипкаМ.О., МирошниковМ.В. Изучение влияния производных бензимидазола на поведение мышей в открытом поле. Молодежь и медицинская наука: тезисы VII Всероссийской межвузовской научно-практической конференции молодых ученых с международным участием. 2019: 80.
- Лысенко Т.А. Изучение влияния некоторых новых производных бензимидазола на выживаемость животных при циркуляторной гипоксии. Международный научно-исследовательский журнал. 2022; 5-2 (119): 198-201.
- Спасов А.А., Кучерявенко А.Ф., Смирнов А.В., Сиротенко В.С., Паньшин Н.Г., Гайдукова К.А., Ди-ваева Л.Н. Антитромботическая активность нового производного диазепино[1,2-а]бензимидазола на модели тромбоза легочной артерии у мышей. Экспериментальная и клиническая фармакология. 2020; 83 (5): 15-18.
- Гуляев А.С., Семёнова С.К., Архипов И.А. Проблема устойчивости Fasciola hepatica к бензимида-золам: опыт мировой науки. Российский паразитологический журнал. 2012; 1: 104-109.
- Soshnikova A.A., Mazova O.V. The synthesis of some substituted benzimidazoles with the use of the phillips-ladenburg rearrangement. Modern science. 2018; 12-1: 52-55.
- Гремячих В.А., Томилина И.И. Влияние ПХБ-содержащего препарата «Совтол» на биологические параметры ветвистоусого рачка Ceriodaphnia affinis Lillieborg. Токсикологический вестник. 2011; 5 (110): 36-40.
- Кирлан С.А., Кантор Е.А., Димогло А.С., Вовденко М.К. Закономерности связи «структура-активность-токсичность» регуляторов роста и развития растений. Башкирский химический журнал. 2011; 18 (2): 30-34.
- Зайцева Ю.В., Егоров Д.О., Бегунов Р.С., Хлопотинин А.И. Антибактериальная и антибиопленоч-ная активность полифункциональных производных бензимидазола. Acta biomedica scientifica. 2022; 7 (3): 134-141. DOI: 10.29413/ABS.2022-7.3.14.
- Васильков Г.В., Грищенко Л.И. Енгашев В.Г., Осетров В.С. (ред.). Болезни рыб: справочник. Москва: Агропромиздат; 1989. 288.
- Куценко С.А. Основы токсикологии. СПб: ООО «Издательство Фолиант»; 2004. 720.
- КатокЯ.М. Применение и синтез 2-замещенных бензимидазола. Труды БГТУ. Сер. 2. 2020; 2: 50-55.
- Бегунов Р.С., Рызванович Г.А. Синтез пиридо[1,2-а]бензимидазолов и других конденсированных производных имидазола с узловым атомом азота. Успехи химии. 2013; 82 (1): 77-97.
- Катунина Н.П., Стратиенко Е.Н., Цеева Ф.Н., Кухарева О.В., Катунин П.М. Фармакологическая активность новых производных бензимидазола при воздействии экстремальных факторов различного генеза. Ежегодник НИИ фундаментальных и прикладных исследований. 2018; 1: 53-58.
- Thomas W. Duke, Donald I. Mount. Toxic effects on individualds, populations and aquatic ecosystems and indicators of exposure to chemicals. Methods for Assessing Exposure of Human and Non-Human Biota. 1991; 9: 393-404.
- Иванов Д.Е., Сулейманов Р.А., Косарев А.В., Микеров А.Н., Кошелева И.С., Валеев Т.К. Возможности применения методов биотестирования в интегральной оценке качества поверхностных источников водоснабжения населения. Медицина труда и экология человека. 2022; 1: 159-176.


