Оценка уровней фактора роста фибробластов (FGF-23) и маркеров воспаления у пациентов с сахарным диабетом 2 типа и различными стадиями хронической болезни почек
Автор: Василькова О.Н., Мохорт Т.В., Байрашева В.К., Коротаева Л.Е., Ярец Ю.И., Шестовец О.Н., Боровец Я.А., Науменко Е.П.
Журнал: Juvenis scientia @jscientia
Рубрика: Оригинальное исследование
Статья в выпуске: 2 т.6, 2020 года.
Бесплатный доступ
В последнее время активно изучаются воспалительные и регуляторные механизмы, участвующие в возникновении и прогрессировании ангиопатий при сахарном диабете (СД), в том числе и диабетической болезни почек (ДБП). В данной работе мы оценили уровни фактора роста фибробластов (FGF-23) и маркеров воспаления у пациентов с СД 2 типа на различных стадиях хронической болезни почек (ХБП). В исследование было включено 64 пациента с СД 2 типа в возрасте от 34 до 84 лет. Были получены данные об изменении сывороточных уровней FGF-23, фактора некроза опухолей альфа (ФНО-альфа), С-реактивного белка (СРБ), высокочувствительного С-реактивного белка (вчСРБ) и интерлейкина-6 (ИЛ-6) у пациентов с СД 2 типа в зависимости от стадии ХБП. При проведении множественного регрессионного анализа был показан независимый характер взаимосвязи между сывороточными уровнями FGF-23 и креатинина.
Сахарный диабет, диабетическая болезнь почек, фактор роста фибробластов-23, цитокины, воспаление
Короткий адрес: https://sciup.org/14115955
IDR: 14115955
Текст научной статьи Оценка уровней фактора роста фибробластов (FGF-23) и маркеров воспаления у пациентов с сахарным диабетом 2 типа и различными стадиями хронической болезни почек
Funding: This research work was carried out within the framework research supported by the Belarusian Republican Foundation for Fundamental Research (BRFFR) No. М17РМ-113 and by the Russian Foundation for Basic Research (RFBR) according to the research project No 17-5404080.
Диабетическая нефропатия или диабетическая болезнь почек (ДБП) – одно из наиболее частых и грозных осложнений сахарного диабета (СД). Диабетическое поражение почек в настоящее время занимает первое место в структуре причин терминальной почечной недостаточности в развитых странах [1]. Сложность своевременного выявления поражения почек при СД и профилактики его прогрессирования связана с длительным ла- тентным течением процесса. Показано, что прогрессирующие изменения в клубочках и тубулоинтерстиции могут присутствовать у пациентов с нормо- и микроальбуминурией, без клинических проявлений нефропатии [2]. Главным, но не единственным патогенетическим фактором ДБП является гипергликемия. Повреждающий эффект высокого уровня глюкозы, продуктов неферментативного гликирования и оксидативного стресса усугубляются частым наличием у пациентов с СД таких факторов риска поражения почек, как ожирение, артериальная гипертензия и дислипидемия [3].
Известно, что достижение стойкой нормог-ликемии, наряду с коррекцией липидного спектра и нормализацией уровня артериального давления, является необходимым условием для профилактики развития и прогрессирования ДБП. Тем не менее, у значительной части пациентов на фоне проводимой терапии наблюдается неуклонное прогрессирование ДБП, что свидетельствует о влиянии других важных патогенетических факторов, одним из которых выступает системное и локальное воспаление. Доказано, что в патогенезе диабетической нефропатии важную роль играют различные цитокины, которые участвуют в развитии тубулоинтерстициального воспаления в почечных клубочках [4-6]. Изучение роли цитокинов в развитии воспалительного процесса является актуальной задачей современной медицины в связи с разработкой и применением в терапевтических целях антагонистов их провоспалитель-ного действия. Известно, что пациенты с ДБП в сочетании с СД 2 типа характеризуются тяжелым поражением коронарных артерий и плохим сердечно-сосудистым прогнозом, что также диктует необходимость более ранней диагностики и разработки новых подходов к их лечению [7, 8].
Цель исследования – оценить уровни фактора роста фибробластов (FGF-23) и маркеров воспаления у пациентов с СД 2 типа на различных стадиях хронической болезни почек (ХБП).
Пациенты и методы. В обследовании приняло участие 64 пациента (15 мужчин и 49 женщин) с СД 2 типа на разных стадиях ХБП, проходивших лечение в ГУ «Республиканский научно-практический центр радиационной медицины и экологии человека» г. Гомель. Возраст пациентов составил от 34 до 84 лет (средний возраст 48,0±4,5 лет). Лабораторное исследование включало оценку уровня гликированного гемоглобина (HbA1с), липидного спектра крови (общий холестерин, триглицериды, холестерин ЛПВП, холестерин ЛПНП), уровней ФНО-альфа, С-реактивного белка (СРБ), высокочувствительного СРБ (вчСРБ), интерлейкина-6 (ИЛ-6) в сыворотке крови.
Оценивалась функция почек на основании содержания в сыворотке крови креатинина, подсчета СКФ по формуле CKD-EPI, определения уровня альбуминурии. Стадии ХБП определяли в соответствии с критериями NKF-K/ DOQI.
Дополнительные исследования включали определение уровня морфогенетического фосфатурического белка FGF-23. Количественную концентрацию FGF-23 (C-Terminal) в сыворотке крови определяли с использованием коммерческих наборов фирмы «Biomedica» (Австрия) методом иммуноферментного анализа.
Статистическую обработку полученных данных проводили с помощью программы smSTATA 14.2 for Mac (2018). Данные представляли в виде среднее ± стандартное отклонение. При отсутствии подчинения закону нормального распределения оцениваемых переменных, а также для оценки переменных в случае малых выборок использовали непараметрический критерий U-теста Манна-Уитни. Множественный регрессионный анализ проводился для определения влияния про-воспалительных цитокинов на уровень креатинина. Переменные одномерного анализа были отобраны для дальнейшего многомерного регрессионного анализа. За уровень статистической значимости принимали р<0,05.
Результаты. Клинические и лабораторные характеристики пациентов с СД 2 типа в зависимости от стадии ХБП представлены в таблице 1.
Пациенты были сопоставимы по возрасту, продолжительности СД, индексу массы тела (ИМТ), гликированному гемоглобину, показателям липидного спектра крови. Величины клинического систолического АД и клинического диастолического АД достоверно не различались между группами. Однако были
Таблица 1
|
Параметры |
ХБП 1 n=16 |
ХБП 2 n=18 |
ХБП 3 n=14 |
ХБП 4 n=8 |
ХБП 5 n=8 |
P ANOVA |
|
Возраст, лет |
56,2±9,4 |
60,6±8,9 |
63,1±7,2 |
57,5±8,7 |
61,2±15,0 |
0,13 |
|
Стаж СД, лет |
11,5±9,6 |
11,9±9,6 |
11,3±7,9 |
14,7±4,7 |
10,2±7,3 |
0,41 |
|
ИМТ, кг/м2 |
37,2±22,2 |
34,8±6,6 |
36,1±9,0 |
33,4±8,4 |
27,9±6,9 |
0,30 |
|
САД, мм рт ст |
131,8±15,7 |
135,9±13,9 |
131,8±8,7 |
139,2±23,7 |
129,2±30,4 |
0,77 |
|
ДАД, мм рт ст |
87,1±16,7 |
83,6±5,6 |
81,8±6,0 |
84,2±12,0 |
79,2±13,6 |
0,77 |
|
HbA1c, % |
8,6±1,8 |
9,1±1,6 |
8,9±1,7 |
8,9±1,5 |
8,7±1,0 |
0,85 |
|
Холестерин, ммоль/л |
4,9±1,2 |
5,3±0,9 |
5,1±1,6 |
6,8±2,0 |
5,7±1,3 |
0,15 |
|
Триглицериды, ммоль/л |
1,6±0,8 |
1,9±0,8 |
2,3±1,2 |
2,2±1,1 |
1,7±0,9 |
0,07 |
|
Холестерин ЛПНП, ммоль/л |
3,1±1,0 |
3,1±0,7 |
2,8±1,3 |
5,3±1,6 |
3,6±1,2 |
0,12 |
|
Кальций общий, ммоль/л |
2,4±0,2 |
2,4±0,2 |
2,4±0,1 |
2,4±0,1 |
2,5±0,9 |
0,48 |
|
Фосфор, ммоль/л |
1,2±0,2 |
1,2±0,2 |
1,2±0,4 |
1,2±0,1 |
1,8±0,5 |
0,11 |
|
Креатинин, мк-моль/л |
63,1±10,6 |
76,7±9,2 |
112,8±21,9 |
201,0±41,4 |
518,8±132,1 |
0,0001 |
|
Суточная протеинурия, г/сут |
0,02±0,02 |
0,01±0,02 |
0,02±0,03 |
0,96±1,12 |
1,27±1,48 |
0,006 |
|
FGF-23, пкмоль/л |
0,9±1,4 |
0,9±1,4 |
0,9±0,5 |
6,2±4,2 |
9,9±4,5 |
0,0001 |
|
ФНО-альфа, пг/мл |
12,9±7,3 |
13,1±7,5 |
12,2±8,6 |
20,6 ± 9,2 |
34,7±16,2 |
0,028 |
|
СРБ, мг/л |
3,7±2,9 |
4,2±3,9 |
9,3±6,2 |
11,9±6,1 |
22,5±14,6 |
0,0003 |
|
вчСРБ, мг/л |
4,8±3,4 |
5,1±4,1 |
11,1±7,3 |
14,9±8,6 |
31,9±21,5 |
0,0004 |
|
ИЛ-6, мг/мл |
1,7±1,1 |
2,7±2,1 |
2,8±2,7 |
13,9±2,9 |
51,8±11,9 |
0,02 |
Характеристика пациентов с СД 2 типа в зависимости от стадии ХБП
отмечены различия в следующих показателях: уровни СРБ, вчСРБ, ИЛ-6, ФНО-альфа достигали своих максимальных значений при снижении СКФ менее 15 мл/мин (34,7±16,2 пг/мл, 22,5±14,6 мг/л, 31,9±21,5 мг/л, 51,8±11,9 мг/ мл, соответственно, р<0,05).
При исследовании уровня морфогенетического фосфатурического белка FGF-23 выявлено его повышение уже на ранних стадиях ХБП (согласно инструкции к набору реагентов для проведения иммуноферментного анализа, среднее значение у здоровых лиц – 0,8 пк- моль/л) и нарастание его уровня по мере развития почечной недостаточности, вплоть до терминальной стадии (таблица 1, рисунок 1).
Корреляционный анализ выявил достоверную положительную связь между уровнями FGF-23 и ФНО-альфа (r=0,55, p<0,001), FGF-23 и СРБ (r=0,56, p<0,001), FGF-23 и вчСРБ (r=0,57, p<0,001) и FGF-23 и ИЛ-6 (r=0,94, p=0,0051). Между вышеперечисленными цитокинами и уровнем креатинина также имелась достоверная корреляционная связь (креатинин и FGF-23: r=0,37, p=0,004, креатинин и ФНО-
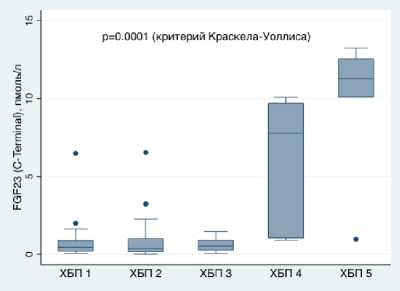
Рисунок 1. Уровень FGF-23 в зависимости от стадии ХБП альфа: r=0,413, p=0,001, креатинин и ИЛ-6: r=0,34, p=0,006, креатинин и СРБ: r=0,33, p=0,01, креатинин и вчСРБ: r=0,43, p=р<0,001).
Далее нами был проведен множественный регрессионный анализ, который показал, что уровень FGF-23, в отличие от концентраций провоспалительных цитокинов, является не- зависимым предиктором сывороточного креатинина (ß=18,87, p=0,015) (таблица 2).
Таблица 2
Множественный регрессионный анализ креатинина со значимыми факторами
|
Переменные |
В |
Р |
95% ДИ |
|
Стаж СД |
1,95 |
0,055 |
-0,04;3,94 |
|
ФНО-альфа |
2,41 |
0,055 |
-0,05;4,88 |
|
Интерлейкин-6 |
2,00 |
0,303 |
-1,85;5,85 |
|
вчСРБ |
0,92 |
0,457 |
-1,54;3,37 |
|
FGF-23 |
18,87 |
0,015 |
3,80;33,94 |
Обсуждение результатов. Диабетическая болезнь почек является одним из наиболее тяжёлых клинических осложнений СД 2 типа и одной из основных причин развития терми-
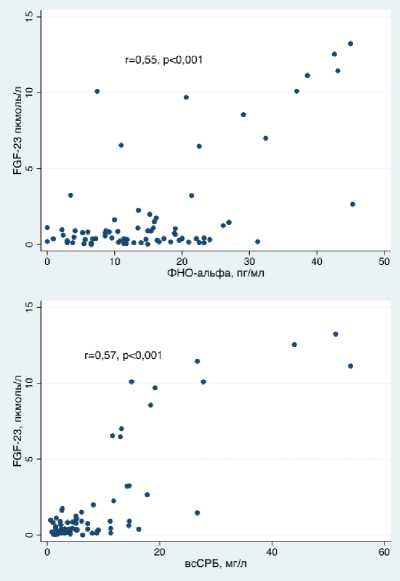
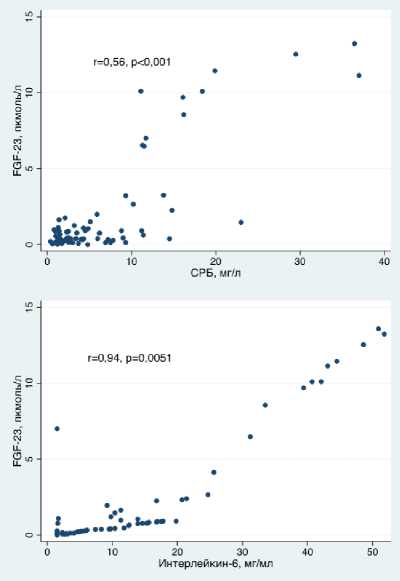
Рисунок 2. Взаимосвязь уровней FGF-23 и маркеров воспаления
нальной стадии хронической болезни почек, что в дальнейшем требует проведения заместительной терапии или трансплантации почек. Одним из мощных факторов повреждения органов и тканей при сахарном диабете считается гипергликемия, которая способствует неконтролируемой активации факторов роста фибробластов и маркеров воспаления. Совокупность всех патологических процессов приводит к активной перестройке соединительной ткани и необратимым изменениям сосудистой стенки, а также быстрому росту атеросклеротических бляшек.
В последнее время активно изучаются воспалительные и регуляторные механизмы, участвующие в возникновении и прогрессировании ангиопатии при СД [9]. По мнению многих исследователей, самостоятельное значение в развитии ДБП имеет системное и локальное воспаление [10-12]. Неблагоприятные почечные эффекты имеют такие цитокины как ФНО-альфа, интерлейкин-1, интерлейкин-6 и другие [13]. Их могут продуцировать не только клетки, которые, согласно традиционным представлениям, участвуют в воспалительных процессах, но также клетки жировой ткани и различных структур почек (в том числе подоциты, мезангиальные и канальцевые эпителиальные клетки) [10]. При этом немаловажным является именно местная продукция цитокинов в почках, которая стимулируется ангиотензином II и альдостероном [14]. Вышеописанные механизмы могут способствовать автономному развитию воспаления в почках, которое может продолжаться, несмотря на коррекцию нарушений углеводного обмена [10].
Известно, что уровень ФНО-альфа в сыворотке крови пациентов с сахарным диабетом в среднем в 3-4 раза выше, чем у здоровых лиц, причём, по данным некоторых авторов, увеличение концентрации этого цитокина наблюдается задолго до появления явных нарушений углеводного обмена [15, 16]. С развитием поражения почек у больных СД 2 типа наблюдается дальнейшее на- растание его уровня [17]. При этом уровень ФНО-альфа прямо коррелирует с альбуминурией и обратно – со скоростью клубочковой фильтрации [18, 19]. Эти данные согласуются с полученными в нашей работе результатами, где уровень ФНО-аль-фа возрастал от ХБП 1 стадии до ХБП 5 стадии с 12,9±7,3 пг/мл до 34,7±16,2 пг/мл при р<0,05 и положительно коррелировал с уровнем креатинина (r=0,413, p=0,001).
В отличие от ФНО-альфа, сывороточный уровень ИЛ-6 значительно возрастает лишь при развитии протеинурической стадии диабетической нефропатии [20, 21]. В нашей работе максимально высокие уровни ИЛ-6 наблюдались у пациентов с ХБП 4 и ХБП 5 и составили 13,9±2,9 и 51,8±11,9 мг/мл, соответственно. Вероятность наличия протеинурии на этой стадии ХБП велика, что еще раз подтверждает согласованность наших результатов с множеством других исследований.
Отдельно необходимо остановиться на обсуждении CРБ, которые многие клиницисты рассматривают как основной показатель активности воспаления. В отношении пациентов с СД следует отметить, что уровень CРБ весьма неспецифичен и не может быть использован для наблюдения за развитием ранних стадий диабетического поражения почек. По мере прогрессирования хронической болезни почек концентрация CРБ возрастает, однако она по-прежнему сильно подвержена влиянию других факторов [22, 23]. В нашей работе были выявлены корреляции слабой силы между СРБ и креатинином, а также вчСРБ и креатинином, однако данные множественного регрессионного анализа не подтвердили наличие независимых связей между этими показателями.
В 2008 г. О. Gutierrez и соавт. [24] стали первыми, кто продемонстрировал сильную связь между уровнем FGF-23 в сыворотке крови и летальностью среди «диализных» пациентов. FGF-23 является фактором роста, секретирующимся остеобластами/остеоцитами. Дей- ствуя на почки путем активации комплекса FGF-рецептор/Клото-ко-рецептор, он выступает как регулятор уровня фосфатов и активатор 1,25-дигидроксивитамина D [25]. На сегодняшний день известно, что уровень FGF-23 в сыворотке крови повышен при ХБП и связан с ростом риска развития сердечно-сосудистых осложнений и смерти пациентов с ХБП [2628]. В проведенном нами исследовании было отмечено, что уровень FGF-23 выше значений, характерных для здоровых лиц, уже на ранних стадиях ХБП, и прогрессирование ХБП ассоциировано с его дальнейшим повышением. Результаты выполненного множественного регрессионного анализа показали, что взаимосвязь FGF-23 и креатинина является независимой (ß=18,87, p=0,015).
Лимитирующими факторами нашего исследования являлись: небольшой объем выборки и отсутствие возможности сопоставить изменения уровня FGF-23 c изменением концентраций других биологически активных веществ, с которыми взаимосвязаны эффекты
FGF-23 (витамин D, паратиреоидный гормон, белок Клото).
Список литературы Оценка уровней фактора роста фибробластов (FGF-23) и маркеров воспаления у пациентов с сахарным диабетом 2 типа и различными стадиями хронической болезни почек
- Шестакова М.В. Сахарный диабет и хроническая болезнь почек: возможности прогнозирования, ранней диагностики и нефропротекции в XXI веке // Тер. архив. 2016. № 6. С. 84-88.
- Shestakova MV. Diabetes mellitus and chronic kidney disease: Possibilities of prediction, early diagnosis, and nephroprotection in the 21st century. Ter. Arkhiv. 2016;(6):84-88. (In Russ.). DOI: 10.17116/terarkh201688684-88
- Бондарь И.А., Климонтов В.В., Рогова И.П., и др. Почки при сахарном диабете. Новосибирск: Изд-во НГТУ; 2008.
- Bondar' IA, Klimontov VV, Rogova IP, et al. Pochki pri saharnom diabete. Novosibirsk: Izd-vo NGTU; 2008. (In Russ.).
- Шестакова М.В., Дедов И.И. Сахарный диабет и хроническая болезнь почек. М.: Медицинское информационное агентство; 2009.
- Shestakova MV, Dedov II. Saharnyi diabet i hronicheskaja bolezn' pochek. Moscow: Medicinskoe informacionnoe agentstvo; 2009. (In Russ.).
- Pérez-Morales RE, del Pino MD, Valdivielso JM, et al. Inflammation in Diabetic Kidney Disease. Nephron 2019;143:12-16. DOI: 10.1159/000493278
- Андреева А.С., Хамнуева А.Ю., Шагун О.В. Роль цитокинов в патогенезе сахарного диабета // Сибирский медицинский журнал. 2005. № 1. С. 5-7.
- Andreeva AS, Hamnueva AJu, Shagun OV. Rol' citokinov v patogeneze saharnogo diabeta. Sibirskii medicinskii zhurnal. 2005;(1):5-7. (In Russ.).
- Газизова Г.Р. Роль воспалительных цитокинов при диабетической нефропатии у беременных с сахарным диабетом 1-го типа // Казанский медицинский журнал. 2013. Т. 94. № 1. С. 105-109.
- Gazizova GR. Rol' vospalitel'nyh citokinov pri diabeticheskoĭ nefropatii u beremennyh s saharnym diabetom 1-go tipa. Kazanskii medicinskii zhurnal. 2013;94(1):105-109. (In Russ.).
- Rydén L, Standl E, Bartnik M, et al. Guidelines on diabetes, pre-diabetes, and cardiovascular diseases: executive summary: The Task Force on Diabetes and Cardiovascular Diseases of the European Society of Cardiology (ESC) and of the European Association for the Study of Diabetes (EASD). European Heart Journal. 2007;28(1):88-136.
- DOI: 10.1093/eurheartj/ehl260
- Aronson D, Edelman ER. Coronary artery disease and diabetes mellitus. Cardiol Clin. 2014;32(3):439-455.
- DOI: 10.1016/j.ccl.2014.04.001
- Ehses JA, Böni-Schnetzler M, Faulenbach M, Donath MY. Macrophages, cytokines and beta-cell death in type 2 diabetes. Biochem Soc Trans. 2008;36(3):340-342.
- DOI: 10.1042/BST0360340
- Пчелин И.Ю., Шишкин А.Н., Лаптева О.А. Роль системного и локального воспаления в развитии диабетической нефропатии // Нефрология. 2011. Т. 15. № 4. С. 21-26.
- Pchelin IY, Shishkin AN, Lapteva OA. Rol' sistemnogo i lokal'nogo vospalenija v razvitii diabeticheskoj nefropatii. Nefrologija. 2011;15(4):21-26. (In Russ.)
- DOI: 10.24884/1561-6274-2011-15-4-21-26
- Moreno JA, Gomez-Guerrero C, Mas S, et al. Targeting inflammation in diabetic nephropathy: a tale of hope. Expert Opin Investig Drugs. 2018;27(11):917-930.
- DOI: 10.1080/13543784.2018.1538352
- Matoba K, Takeda Y, Nagai Y, et al. Unraveling the Role of Inflammation in the Pathogenesis of Diabetic Kidney Disease. Int J Mol Sci. 2019;20(14):3393.
- DOI: 10.3390/ijms2014339
- Kaul K, Hodgkinson A, Tarr JM. Is inflammation a common retinal-renal-nerve pathogenic link in diabetes? Curr Diab Rev. 2010;6:294-303.
- DOI: 10.2174/157339910793360851
- Goldberg RB. Cytokine and cytokine-like inflammation markers, endothelial dysfunction, and imbalanced coagulation in development of diabetes and its complications. J Clin Endocrinol Metab. 2009;94:3171-3182.
- DOI: 10.1210/jc.2008-2534
- Navarro-Gonzalez JF, Mora-Fernandez C. The role of TNF-α in diabetic nephropathy: Pathogenic and therapeutic implications. Cytokine Growth Factor Rev. 2006;17:441-450.
- DOI: 10.1016/j.cytogfr.2006.09.011
- Fornoni A, Ijaz A, Tejada T, et al. Role of Inflammation in Diabetic Nephropathy. Curr Diab Rev. 2008;4:10-17.
- DOI: 10.2174/157339908783502361
- Sahakyan K, Klein B, Lee K, et al. Inflammatory and endothelial dysfunction markers and proteinuria in persons with type 1 diabetes mellitus. Eur J Endocrinol. 2010;162(6):1101-1105.
- DOI: 10.1530/EJE-10-0049
- Ng DP, Fukushima M, Tai BC, et al. Reduced GFR and albuminuria in Chinese type 2 diabetes mellitus patients are both independently associated with activation of the TNF-alpha system. Diabetologia. 2008;51(12):2318-2324.
- DOI: 10.1007/s00125-008-1162-1
- Niewczas MA, Ficociello LH, Johnson AC, et al. Serum concentrations of markers of TNFα and Fas-mediated pathways and renal function in nonproteinuric patients with type 1 diabetes. Clin J Am Soc Nephrol. 2009; 4(1):62-70.
- DOI: 10.2215/CJN.03010608
- Ray A, Huisman MV, Tamsma JT, et al. The role of inflammation on atherosclerosis, intermediate and clinical cardiovascular endpoints in type 2 diabetes mellitus. Eur J Int Med. 2009;20:253-260.
- DOI: 10.1016/j.ejim.2008.07.008
- Nakamura A, Shikata K, Hiramatsu M, et al. Serum interleukin-18 levels are associated with nephropathy and atherosclerosis in Japanese patients with type 2 diabetes. Diabetes Care. 2005;28:2890-2895.
- DOI: 10.2337/diacare.28.12.2890
- Brantsma AH, Bakker SJ, Hillege HL, et al. Urinary albumin excretion and its relation with C-reactive protein and metabolic syndrome in the prediction of type 2 diabetes. Diabetes Care. 2005; 28(10): 2525-2530.
- DOI: 10.2337/diacare.28.10.2525
- Satchell SC, Tooke JE. What is the mechanism of microalbuminuria in diabetes: a role for the glomerular endothelium? Diabetologia. 2008;51(5):714-725.
- DOI: 10.1007/s00125-008-0961-8
- Gutiérrez OM, Mannstadt M, Isakova T, et al. Fibroblast growth factor 23 and mortality among patients undergoing hemodialysis. N Engl J Med. 2008;359:584-592.
- DOI: 10.1056/NEJMoa0706130
- Di Marco GS, König M, Stock C, et al. High phosphate directly affects endothelial function by downregulating annexin II. Kidney Int. 2013;83:213-222.
- DOI: 10.1038/ki.2012.300
- Gao S, Xu J, Zhang S, Jin J. Meta-Analysis of the Association between Fibroblast Growth Factor 23 and Mortality and Cardiovascular Events in Hemodialysis Patients. Blood Purif. 2019;47(S1):24-30.
- DOI: 10.1159/000496220
- Yeung SMH, Binnenmars SH, Gant CM, et al. Fibroblast Growth Factor 23 and Mortality in Patients with Type 2 Diabetes and Normal or Mildly Impaired Kidney Function. Diabetes Care. 2019; dc190528.
- DOI: 10.2337/dc19-0528
- Isakova T, Cai X, Lee J, et al. Longitudinal FGF23 Trajectories and Mortality in Patients with CKD. JASN. 2018; 29(2):579-590.
- DOI: 10.1681/ASN.2017070772


