Оценка устойчивости селекционного материала свеклы столовой к церкоспорозу на фоне эпифитотии в условиях защищенного грунта Московской области
Автор: Козарь Елена Георгиевна, Ветрова Светлана Александровна, Енгалычева Ирина Александровна, Федорова Маргарита Ивановна
Журнал: Овощи России @vegetables
Рубрика: Защита растений
Статья в выпуске: 6 (50), 2019 года.
Бесплатный доступ
Актуальность. Важным признаком, определяющим технологические качества сортов и гибридов свеклы столовой, является прямостоячая, компактная листовая розетка, сохраняющаяся до конца вегетации растений. В связи с этим большое внимание при селекции уделяется устойчивости к болезням, поражающим листья растений, в том числе и церкоспорозу (Cercospora beticola Sacc.). В агроклиматических условиях Московской области заболевание на производственных посевах свеклы столовой редко достигает экономически значимого порога вредоносности, однако в 2019 году в блочной пленочной теплице ФГБНУ ФНЦО наблюдали эпифитотийное развитие церкоспороза на летних посевах, что позволило провести оценку перспективного селекционного материала. Материал и методика. Фитомониторинг на посадках и посевах свеклы столовой опытно-производственного отдела ФГБНУ «Федеральный научный центр овощеводства» проводили методами визуальной диагностики и микроскопирования. Поражение церкоспорозом в селекционном питомнике оценивали по 11-бальной шкале, ранжирование образцов на пять групп устойчивости - по степени развития болезни (R%)...
Свекла столовая, церкоспороз (cercospora beticola sacc.), эпифитотия, линейный материал, устойчивость
Короткий адрес: https://sciup.org/140245801
IDR: 140245801 | УДК: 635.11:631.524.86 | DOI: 10.18619/2072-9146-2019-6-124-132
Текст научной статьи Оценка устойчивости селекционного материала свеклы столовой к церкоспорозу на фоне эпифитотии в условиях защищенного грунта Московской области
Вусловиях жесткой конкуренции на рынке селекционных достижений в настоящее время предъявляются высокие требования к качеству новых сортов и гибридов овощных культур. Для свеклы столовой – это высокая и стабильная урожайность, товарность, привлекательный внешний вид корнеплода и непременно устойчивость к болезням и вредителям. Для механизированного возделы- вания культуры важным признаком является прямостоячая, компактная листовая розетка, с тонкими черешками, сохраняющаяся до конца вегетации растений, что позволяет при уборке использовать комбайны теребильного типа. В связи с этим большое внимание при селекции сортов и гибридов свеклы уделяется устойчивости к болезням листовой розетки растений. В их число входит церкоспо-роз, поражающий листья и черешки растений первого и второго года, а также стебли семенников.
Возбудитель церкоспороза – гриб Cercospora beticola Sacc ., относится к отделу анаморфных грибов и поражает большинство культурных и диких видов Beta, Spinacia oleracea , а также виды Amaranthus, Atriplex, Chenopodium, Plantago и др., всего около 40 видов растений [16, 17, 23, 33]. Первичное инфицирование С. beticola происходит весной, когда пропагулы гриба с каплями дождя попадают на нижние листья свеклы, в результате чего появляются первые окаймленные церкоспорозные пятна, на которых при оптимальных погодных условиях образуются конидии и происходит дальнейшее массовое заражение листьев розетки. При сильной степени развития болезни формируются сливающиеся некротические участки, листья скручиваются вдоль центральной жилки и усыхают.
В годы эпифитотий отмирание пораженных листьев нижнего и среднего ярусов может происходить уже к началу августа. В вегетирующем состоянии остаются только молодые, вновь отрастающие листья в центре розетки, которые не способны обеспечить активный рост и полноценное формирование корнеплода. В результате при слабой степени развития болезни (R=8-16%) недобор урожая корнеплодов свеклы составляет 13-16%, при средней (R= 20-40%) – 32%, а при сильной – до 70%. Интенсивное отрастание новых листьев также вызывает удлинение головки корнеплода, что приводит к дополнительным потерям товарного урожая свеклы. Возрастают потери и при хранении, поскольку корнеплоды, пораженные цер-коспорозом во время вегетации, сильнее поражаются кагатными гнилями [3, 16, 24, 34, 38].
Основным источником инфекционного начала являются растительные остатки, где патоген сохраняется в виде стромовидных образований. Сообщается о возможности первичного заражения в результате прорастания конидий C.beticola на поверхности корней, из которых мицелий проникает в сосудистую систему и диффузно колонизирует растение свеклы [37]. Патоген может сохраняться в виде мицелия или конидий на поверхности головки маточных корнеплодов и на околоплоднике семян, которые также могут быть источником заражения растений [1, 9, 15].
Церкоспороз встречается во всех регионах свеклосеяния РФ. Наиболее экономически значима эта болезнь в Краснодарском и Приморском краях, где условия температуры и влажности обеспечивают частые эпифитотии. В более засушливых центрально-черноземных областях и Сибири церкоспороз развивается слабо и не оказывает существенного влияния на урожай. Борьба с этим возбудителем включает комплекс мер защиты, среди которых основными являются применение фунгицидов и выращивание устойчивых сортов и гибридов свеклы. В начале вегетации экономический порог вредоносности церкоспо-роза достигается уже при среднем балле поражения 0,650,88, то есть при появлении первых признаков болезни [19]. На более поздних стадиях развития растений обработки посевов фунгицидами на юге рекомендуется проводить при достижении следующих порогов вредоносности: до первой декады августа – 5% развития болезни; до второй декады августа – от 10% до 15%; до третьей декады августа - более 15% развития болезни [5]. Однако в последние годы стратегия защитных мероприятий против C. beticola на базе фунгицидов постоянно корректируется, ввиду быстрого появления новых патотипов и рас возбудителя с высокой резистентностью к уже используемым фунгицидам [22, 27-29, 35, 36].
В связи с этим, большое значение в интегрированной системе защиты, имеет использование существующих и выведение новых церкоспороустойчивых сортов и гибридов, что позволяет снизить пестицидные нагрузки и избе- жать больших потерь урожая. При селекции на устойчивость следует учитывать, что Cercospora beticola Sac. имеет множество патотипов и рас, приуроченных к определенным зонам возделывания. Выявлены существенные различия результатов скрещивания сортов свеклы с разным уровнем устойчивости при использовании биотипов патогена разного эколого-географического происхождения. Поэтому предлагаемые для возделывания импортные сорта и гибриды свеклы, характеризующиеся устойчивостью к отдельным расам возбудителей церкоспороза, не всегда проявляют этот признак в новых условиях [12, 13, 25, 26, 31, 32].
В СССР целенаправленная селекция на устойчивость к церкоспорозу была начата на культуре свеклы сахарной в 30-е годы ХХ века. Первые материалы получены методами индивидуального и группового отборов и последующей гибридизацией с итальянскими церкоспороустойчивыми линиями (ручная кастрация). В данных исследованиях отмечали, что уже в первом поколении отборов поражае-мость растений может снижаться на 30%, и за четыре генерации удалось значительно повысить устойчивость селекционного материала к церкоспорозу. Позднее в схему селекционного процесса подключили кумулятивные и реккурентные методы отбора, самоопыление и направленные скрещивания на основе отобранных устойчивых генотипов, что повысило эффективность создания гибридов свеклы сахарной, в том числе и на основе ЦМС - цитоплазматической мужской стерильности [7, 8].
При создании устойчивых к церкоспорозу межлинейных гибридов F 1 на основе ЦМС большую роль играет подбор родительских компонентов, что определяет не только продуктивность, но и устойчивость к биотическим факторам [4, 6, 14]. Поэтому оценка на устойчивость к болезням создаваемых стерильных ms-линий (А), фертильных mf-линий закрепителей стерильности (В) и опылителей (С) и полученных на их основе гибридов F 1 является важным этапом селекционного процесса. Целенаправленное использование ЦМС в селекции свеклы столовой на базе ФГБНУ ФНЦО (ВНИИССОК) начато с 2007 года. В настоящее время созданы ms- и mf-линии и получены гибриды F 1 . Оценка устойчивости селекционного материала к церкос-порозу была проведена на фоне возникшей в 2019 году эпифитотии в селекционном питомнике.
Материалы и методы
Фитосанитарный мониторинг развития и диагностику болезней на семенных растениях и посевах свеклы столовой в открытом и защищенном грунте опытно-производственного отдела ФГБНУ «Федеральный научный центр овощеводства» проводили на базе лабораторий иммунитета и защиты растений, селекции и семеноводства столовых корнеплодов.
Объектами исследований в 2019 году являлись растения свеклы столовой первого и второго года. Изучено: 66 линий – 28 стерильных (А), 38 фертильных (В, С); 38 гибридов (АхВхС). Линии А, В и С созданы на основе сортовых и гибридных популяций отечественного и иностранного происхождения (Нежность, Акела, Белуши, Glob F 1 , Pablo F 1 , Скалет Суприм F 1 , Ружет F 1 , Red Klaud F 1 и др.)
Маточные корнеплоды после хранения высаживали в групповые и индивидуальные бязевые изоляторы во второй декаде апреля. Посев семян на грядах проводили в третьей декаде июня по трехстрочной схеме 30х10. Площадь делянки составляла от 0,2 до 2м2 в зависимости от наличия семян. Оценку поражения листовой розетки растений церкоспорозом проводили методом визуальной диагностики: на посевах – в фазу технической спелости корнеплодов; на семенных растениях – по мере проявления симптомов в каждом изоляторе. В работе использовали 11-ти бальную шкалу поражения [21].
В пределах каждого селекционного образца по формулам рассчитывали:
распространенность: Р% = n х 100 / N (%), где n – число пораженных растений,
N – общее число учетных растений;
степень развития болезни: R% = n x I ср / N / Б max х 100 (%), где I ср – средний балл (индекс) поражения;
Б max – максимальный балл поражения.
При дифференциации селекционного материала по группам устойчивости использовали следующую градацию в зависимости от степени развития болезни:
-
• устойчивые (I группа) – 0-20,0%;
-
• относительно устойчивые (II группа) – 20,1-25,0%;
-
• средневосприимчивые (III группа) – 25,1-50,0%;
|
Балл |
Симптомы |
0 Здоровая листва
|
0,5 |
Единичные изолированные пятна на нескольких листьях |
1 На 50% наружных листьев появление от одного до нескольких пятен на лист, слияние максимум двух пятен.
|
1,5 |
На 50% наружных листьев появление 20-100 пятен на лист, слияние максимум двух пятен. |
2 Почти все наружные листья покрыты несколькими пятнами, все еще изолированными, слияние максимум двух пятен.
|
2,5 |
На нескольких (2-4) наружных листьях происходит слияние пятен и образование некрозов. Появляются первые пятна на внутренних листьях. |
3 Полностью или почти полностью выросшие листья имеют несколько объединившихся некротических зон диаметром 1-2см.
|
3,5 |
Несколько наружных листьев имеют относительно большие некротические зоны (20-30% площади листа). |
4 На нескольких листьях (2-8) поражение достигает 80-100%.
|
4,5 |
Отмечается сильное поражение всех листьев. |
5 Первоначальная листва полностью разрушена.
-
• восприимчивые (IV группа) – 50,1-79,9%;
-
• очень восприимчивые (V группа) – 80,0-100,0%
В качестве стандартов восприимчивости и устойчивости были выбраны инбредные линии Л-486 из восприимчивого к церкоспорозу гибрида Red Klaud F 1 и Л-539 из устойчивого гибрида Pablo F 1 , выделенные по результатам предварительной токсикологической лабораторной экс-пресс-оценки реакции отделенных листьев на токсин C. Beticola [15]. Их устойчивость была на уровне групповых стандартов восприимчивости и устойчивости, рассчитанных по разработанной на свекле сахарной методике как средневзвешенные показатели у четырех наиболее (Л-434, Л-486, Л-515 и ГК-464) и четырех наименее (Л-410, Л-429, Л-420 и ГК-493) пораженных образцов из разных анализируемых выборок [16]. Идентификацию гриба C.beticola проводили путем прямого микроскопирования биоматериала с типичными симптомами поражения цер-коспорозом и изучения морфологических признаков конидий и конидиеносцев возбудителя согласно общепринятым методикам [2, 11, 15].
Уборку корнеплодов проводили в первой декаде сентября с учетом числа и массы корнеплодов. Математическую обработку результатов проводили методом дисперсионного анализа по Б.А. Доспехову [6] с помощью пакета Microsoft Exel.
Результаты и обсуждение
Факторы возникновения эпифитотии. Условия, определяющие эпифитотийный характер развития церкоспо-роза, хорошо известны. Этому способствует определенное сочетание климатических факторов: повышенная среднесуточная температура (не менее 15 ° С; оптимум 20...30 ° С) и высокая влажность воздуха (более 70%, оптимум – 90-100%), обильные продолжительные теплые осадки и росы [13, 15, 24, 31, 37]. В агроклиматических условиях в Московской области такие условия складываются не часто. Развитие церкоспороза на производственных посевах свеклы столовой преимущественно носит локальный характер и в целом по региону за последние десять лет, благодаря своевременным обработкам, было ниже экономически значимого 5% порога вредоносности (красная линия, рис.1), о чем свидетельствуют ежегодные отчеты Россельхозцентра [20].
На полях и в пленочных экспериментальных теплицах опытно-производственного отдела ФГБНУ ФНЦО, расположенных в Одинцовском районе Московской области, за последние 15 лет также не было отмечено массовых вспышек церкоспороза на посевах свеклы столовой. Проявление заболевания в основном имело очаговый характер с низкой степенью развития (R<3%) и только в пределах отдельных образцов, на листьях которых присутствовали лишь единичные характерные для C. beticola пятна диаметром до 0,5 см. Такая степень инфицирования не вызывала отмирания листьев и не оказывала негативного влияния на урожайность. Подобное проявление заболевания отмечали и на посевах свеклы столовой в усло-
□ Р% dR%
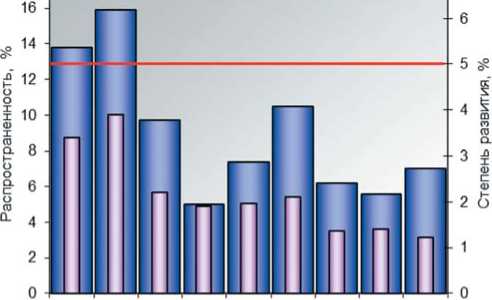
2010 2011 2012 2013 2014 2015 2016 2017 2018
Рис.1. Распространенность (Р, %) и развития (R, %) церкос-пороза на посевах свеклы в Московской области (из отчетов Россельхозцентра за 2010-2018 годы,
Fig.1. Prevalence (P, %) and development (R, %) of cercospo-ra on beetroot in the Moscow region (from the reports of the Rosselhoscenter for 2010-2018,
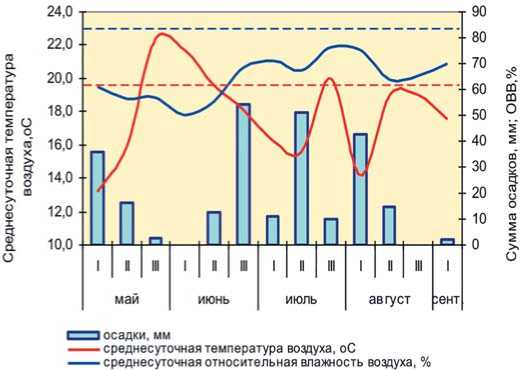
Рис.2. Погодные условия вегетационного периода 2019 года в Одинцовском районе МО: пунктирными линиями отмечены нижние границы оптимумов температуры и влажности воздуха для конидиального размножения C. beticola Fig.2. Weather conditions of the growing season 2019 in Odintsovo district MR: dotted lines marked the lower limits of the optimum temperature and humidity for conidial reproduction of C. beticola

Рис.3. Симптомы проявления церкоспороза на семенных растениях свеклы столовой: А – начало июня (нижние листья стебля); Б – вторая декада августа (листья средней части стебля); В – начало образования конидиеносцев на сливающиеся пятнах (блочная теплица, 2019 год)
Fig.3. Symptoms of Cercospora on seed plants of beetroot: А – early June (lower leaves of the stem); Б – the second decade of August (leaves of the middle part of the stem); В – the beginning of the formation of conidiophores on merging spots (block greenhouse, 2019)
виях открытого грунта в 2019 году, так как для интенсивного развития церкоспороза во время вегетации отсутствовали периоды с оптимальным сочетанием климатических факторов (ОВВ>80% + Т>20 ° С) необходимой продолжительности (рис. 2). Однако, в условиях блочной пленочной теплицы, где влажность и температура воздуха соответственно значительно выше, чем в поле, наблюдалась иная ситуация – эпифитатийное развитие церкоспороза на летних посевах в селекционном питомнике, которое к концу вегетации достигло своего максимума.
Первые симптомы в виде единичных пятен появились на листьях отдельных семенных растений образцов свеклы столовой южного происхождения в нескольких изоляторах в мае. Во второй декаде июня в фазу массового цветения средний балл их поражения составил 0,5-2 (рис. 3 А). Учитывая то, что продолжительность инкубационного периода C. beticola в зависимости от температуры окружающей среды может составлять от 10 до 40 суток [24], можно предположить, что основным началом заражения отрастающих листьев розетки (стеблевых листьев) явились маточные корнеплоды, хотя нельзя исключить и другие источники инфекции. В конце мая и в первой половине июня в теплице складывались благоприятные условия для развития и конидиального размножения патогена. Среднесуточная температура воздуха достигала 26...30 ° С, а относительная влажность воздуха в изоляторах за счет регулярных поливов – 90%.
Установившаяся прохладная погода с конца июня до третьей декады июля послужила сдерживающим фактором для дальнейшего интенсивного развития заболевания, кроме того, изоляторы также в какой-то мере препятствовали его распространению в пределах теплицы. В 20х числах июля произошло повышение температуры воздуха, что привело к новой волне конидиального спороноше-ния церкоспоры на уже зараженных листьях семенных растений, которые стали источником дальнейшего распространения церкоспороза. Это совпало с уборкой изоляторов с целью дозаривания семенников. По-видимому, в этот период и произошло первичное конидиальное инфицирование листовой розетки молодых растений на посевах, расположенных в той же теплице в непосредственной близости от семенников.
В начале августа уже были отмечены первые очаги поражения церкоспорозом на первогодниках, несмотря на то, что среднесуточная температура в первой декаде августа в открытом грунте опустилась ниже минимального предела оптимальных границ развития C.beticola . Резкое повышение температуры с середины августа привело к интенсификации развития болезни и к обильному спороношению патогена (рис. 4). В результате на момент уборки (5 сентября) отмечали 100% поражение селекционных образцов свеклы столовой с высоким индексом поражения большинства растений (от 2 до 4,5 баллов). Возможность такого стремительного развития эпифитотийной ситуации при создании благоприятных условий для развития C. beticola , в своих исследованиях отмечали многие авторы, в том числе и на свекле сахарной [18, 31, 38].
То есть, в 2019 году в условиях теплицы сложился уникальный для Московской области высокий естественный инфекционный фон, что дало возможность провести оценку линейного и гибридного материала свеклы столовой на устойчивость к церкоспорозу.
Сравнительный анализ устойчивости селекционного материала к C. beticola показал , что большая часть образцов из всей совокупности изученных линий в селекционном питомнике оказались восприимчивыми, их общая доля составила 54%, тогда как относительно устойчивых генотипов – только 13% (рис. 5А), что свидетельствует о высокой напряженности инфекционного фона.
В пределах отдельных выборок линейного материала, согласно их использования в селекционном процессе, соотношение генотипов по группам устойчивости значительно отличалось (рис.5Б). Самый высокий процент как сильновосприимчивых, так и устойчивых образцов отмечен среди МС линий А – 40% и 8% соответственно. В пределах фертильных линий В и С доля сильновосприимчивых образцов была более, чем в два раза ниже, однако общая сумма всех восприимчивых образцов (IV+V группы) во всех выборках была на одном уровне и составила 55-56%. Было также отмечено, что в отличие от выборки mf-линий С, среди закрепителей стерильности mf-линий В отсутствовали образцы I группы устойчивости.
Возможно, это связано с тем, что снижение уровня гетерозиготности растений в результате многократного инбридинга (в нашем случае mf-линий В – I 5-6 ) вызывает депрессию хозяйственно ценных признаков и может сопровождаться снижением устойчивости полученных линий к церкоспорозу, что также отмечали другие исследователи и на свекле сахарной [4, 10, 30]. Причем, чередование инбридинга и сибсовых скрещиваний, применяемое при создании mf-линий В с целью преодоления инбредной депрессии, в данном случае, не принесло ожидаемого результата.
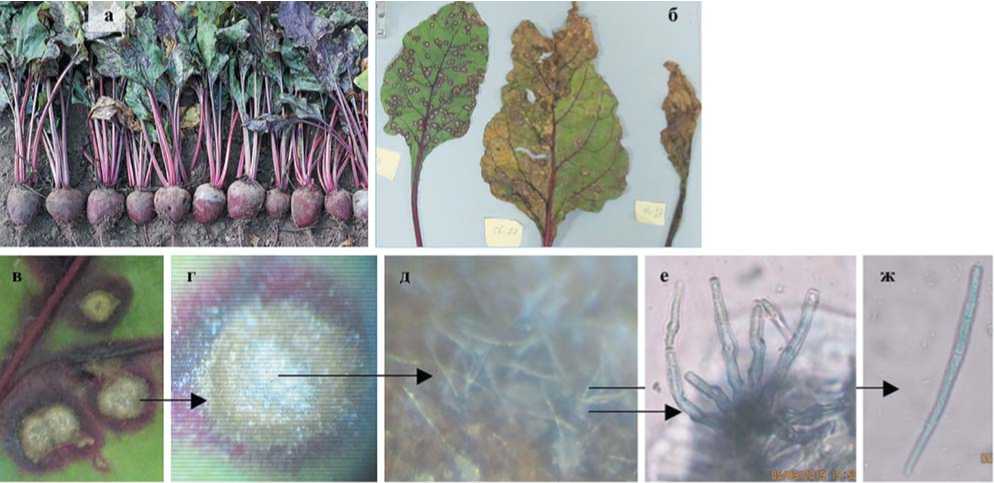
Рис.4. Развития эпифитотии церкоспороза на растениях в первый год вегетации (а); листья розетки с разной степенью поражения (б); окаймленные пятна с интенсивным конидиальным спороношением патогена в центре (в-д); пучок конидие-носцев (е) и конидия C.beticola (ж) при увеличении 10х40 (2019 год)
Fig.4. General view of plants in the period of development of epiphytotys cercospora on plants (a); rosette leaves with different degrees of damage (б); bordered spots with intense conidial sporulation of the pathogen in the center (в-д); bunch of conidiophores (e) and conidia C. beticola (ж) at an increase of 10x40 (2019)
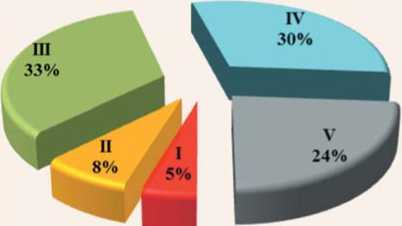
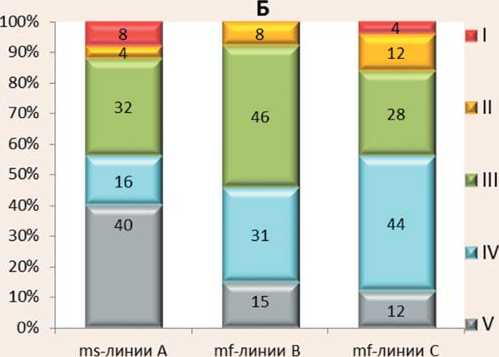
Рис.5. Распределение по группам устойчивости к церкоспорозу по всей совокупности изученных линий селекционного питомника (А) и в пределах соответствующих выборок разных линий разного направления (Б) на фоне эпифитотии (блочная теплица, 2019 год)
Fig.5. Distribution on groups of resistance to Cercospora on all set of the studied lines of selection nursery (A) and within the corresponding samples of different lines of the different direction (Б) against epiphytotys (block greenhouse, 2019)
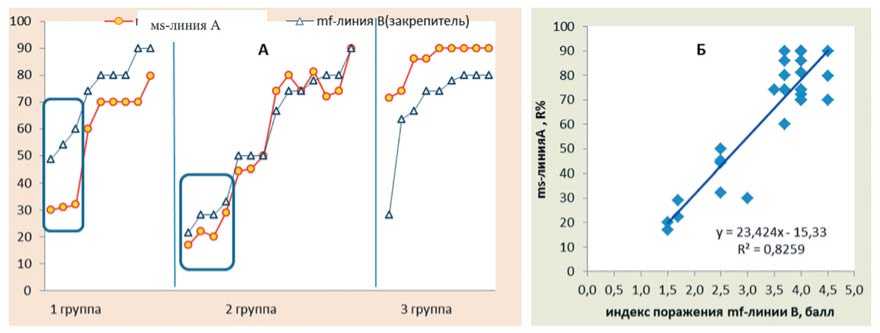
Рис.6. Взаимосвязь между устойчивостью к церкоспорозу mf-линий В и ms-линий А в группах с различным проявлением гетерозиса (А) и в целом по всей совокупности образцов (Б)
Fig.6. The relationship between resistance to Cercospora of mf-lines B and ms-lines A in groups with different manifestations of heterosis (A) and in general over the entire sample population (Б)
Таблица 1. Характеристика выделенных линий свеклы столовой по устойчивости к церкоспорозу и средней массе корнеплода (блочная теплица, 2019 год)
Table 1. Description of the selected lines of beetroot on resistance to cercospora and the average weight of the root crop (block greenhouse, 2019)
|
Номер линии № lines |
Распространенность болезни, Р% Prevalence of the disease, % |
Средний аиндекс поражения, |
Степень развития болезни Degree of disease development |
Группа устойчивости |
Масса корнеплода, кг Weight of root, kg |
|
|
балл Average defeat index |
R% |
отклонение от st. устойчивости, % |
The group resistance |
|||
|
ms-линии А |
||||||
|
410 |
84,6 |
1,0 |
16,9 |
-3,1 |
I |
0,193 |
|
469 |
50,0 |
2,0 |
20,0 |
0,0 |
I |
0,186 |
|
415 |
79,1 |
1,4 |
22,1 |
2,1 |
II |
0,129 |
|
414 |
85,4 |
1,7 |
29,0 |
9,0 |
III |
0,118 |
|
465 |
100,0 |
1,5 |
30,0 |
10,0 |
III |
0,103 |
|
438 |
77,3 |
2,0 |
30,9 |
10,9 |
III |
0,142 |
|
541 |
80,0 |
2,0 |
32,0 |
12,0 |
III |
0,143 |
|
418 |
88,5 |
2,5 |
44,2 |
24,2 |
III |
0,110 |
|
419 |
90,3 |
2,5 |
45,2 |
25,2 |
III |
0,168 |
|
449 |
89,5 |
4,0 |
71,6 |
51,6 |
IV |
0,092 |
|
455 |
90,0 |
4,0 |
72,0 |
52,0 |
V |
0,137 |
|
mf-линии В |
||||||
|
411 |
71,4 |
1,5 |
21,4 |
1,4 |
II |
0,206 |
|
412 |
82,8 |
1,7 |
28,1 |
8,1 |
III |
0,124 |
|
420 |
93,9 |
1,5 |
28,2 |
8,2 |
III |
0,143 |
|
413 |
96,9 |
1,7 |
32,9 |
12,9 |
III |
0,129 |
|
437 |
83,3 |
4,0 |
66,7 |
46,7 |
III |
0,133 |
|
540 |
97,4 |
2,5 |
48,7 |
28,7 |
III |
0,141 |
|
441 |
90,9 |
3,5 |
63,6 |
43,6 |
IV |
0,132 |
|
mf-линии С |
||||||
|
429 |
85,7 |
0,5 |
8,6 |
-11,4 |
I |
0,106 |
|
424 |
75,0 |
1,5 |
22,5 |
2,5 |
II |
0,155 |
|
478 |
82,1 |
1,5 |
24,6 |
4,6 |
II |
0,120 |
|
482 |
100 |
1,5 |
30,0 |
10,0 |
III |
0,148 |
|
542 |
83,3 |
2,0 |
33,3 |
13,3 |
III |
0,078 |
|
428 |
66,7 |
2,5 |
33,3 |
13,3 |
III |
0,077 |
|
422 |
75,0 |
2,5 |
37,5 |
17,5 |
III |
0,130 |
|
527 |
85,7 |
2,5 |
42,9 |
22,9 |
III |
0,142 |
|
474 |
82,4 |
3,0 |
49,4 |
29,4 |
III |
0,082 |
|
475 |
86,7 |
3,0 |
52,0 |
32,0 |
IV |
0,121 |
|
423 |
89,5 |
3,5 |
62,6 |
42,6 |
IV |
0,116 |
|
539-st.У |
68,1 |
1,5 |
20,0 |
0,0 |
I |
0,148 |
|
Груп.st.У |
76,9 |
1,4 |
21,8 |
1,8 |
II |
0,158 |
|
486 st B |
100 |
4,5 |
90,0 |
70,0 |
V |
0,092 |
|
Груп.st.В |
100 |
4,5 |
90,0 |
70,0 |
V |
0,130 |
|
НСР 05 |
10,3 |
|||||

Рис. 7. Различная степень поражения листовой розетки отдельных генотипов в пределах образца на фоне эпифито-тии церкоспороза (на примере Л-441). Обведены генотипы с отсутствием типичных симптомов поражения (2019 год)
Fig. 7. Different degree of leaf rosette lesions of individual genotypes within the sample against the background of Cercospora epiphytotys (for example, L-441). Circled genotypes with the absence of typical symptoms of defeat (2019)
Тем не менее, при опылении ms-линий А отдельными линиями-закрепителями, в полученных комбинациях скрещивания отмечен эффект гетерозиса с повышением устойчивости к церкоспорозу относительно mf-линии В. Об этом свидетельствует присутствие устойчивых к цер-коспорозу генотипов среди анализируемой выборки ms-линий А, полученных с их использованием (рис.5). При сравнительном анализе показателей устойчивости R% соответствующих пар (В и А), mf-линии В были разбиты на три группы (рис. 6А). В первой группе устойчивость полученных ms-линии А была значимо выше; во второй группе – сравнима, а в третьей группе – существенно ниже, чем mf-закрепителя. Процентное соотношение этих групп соответственно составило 26:45:29% от общего числа изученных образцов. При этом, как видно на рисунке 6А, в каждой группе прослеживается четкая взаимосвязь между уровнем устойчивости линий А и В, что подтверждает и корреляционный анализ по всей совокупности проанализированных образцов (r=0,86-0,89). Причем более тесная взаимосвязь выявлена между показателями средний индекс поражения закрепителя и степень развития болезни полученной стерильной линии (рис. 6Б). Это согласуется с данными В.В. Волгина (2007), установившего тесную корреляционную связь (r=0,68-0,73) между родительскими линиями свеклы сахарной и их комбинациями скрещивания по признаку устойчивости к церкоспорозу.
Для селекции на устойчивость к церкоспорозу наибольшую ценность имеют mf-линии В из первой и второй групп, у которых средний индекс поражения в условиях эпифито-тии не превышает 3 баллов при R<60% при наличии гетерозисного эффекта относительно закрепителя и R<30% при его отсутствии. Степень развития болезни у полученных на
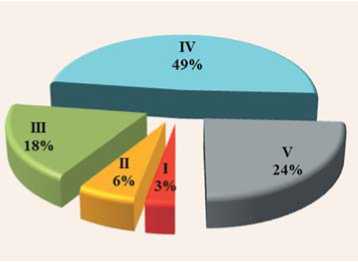
Рис.8. Распределение гибридов F 1 по группам устойчивости к церкоспорозу (блочная теплица, 2019 год)
Fig.8. The distribution of F 1 hybrid of groups of resistance to Cercospora (block greenhouse, 2019)
их основе ms-линий А в данном случае не превышала 30%.
Кроме этого, определенный интерес могут представлять и ряд линий с более высокой степенью поражения, в которых отмечено присутствие отдельных практически иммунных к C.beticola генотипов без признаков поражения листовой розетки (рис. 7). Характеристика выделенных линий представлена в таблице 1.
Среди ms-линий А выделилось пять образцов (Л-410, Л-469, Л-414, Л-415, Л-465), у которых степень развития церкоспороза достоверно не отличалась от стандарта устойчивости и по четыре – среди фертильных линий: Л-411, Л-412, Л-420, Л-413 среди mf-линий В и Л-429, Л-424, Л-478, Л-482 среди mf-линий С. У перечисленных линий также не отмечено достоверного снижения средней массы корнеплода относительно прошлого сезона вегетации (2017 год). Среди выделенных образцов, в популяции которых отмечено расщепление по степени поражения отдельных растений, у одной стерильной линии (Л-449) и трех линий, опылителей (Л-542, Л-428 и Л-474) зафиксировано существенное снижение этого признака, что свидетельствует о пониженной толерантности к поражению церкоспорозом. Тем не менее, внутри каждой из выделенных линий, отобраны индивидуальные генотипы с высокой устойчивостью для дальнейшей работы.
Анализ полученных гибридов F 1 «АхС» показал, что 73% из них оказались восприимчивы и только 9% вошли в I и II группы устойчивости к C. beticola (рис.8), что связано со сложной генетикой устойчивости к церкоспориозу. Установлена полигенная природа признака, причем основные эффекты контролируются по крайней мере четырьмя основными генами [14]. С помощью композитного интервального картирования у свеклы сахарной были выявлены четыре QTL, ассоциированные с резистентностью к патогену на хромосомах III, IV, VII и IX [30]. Характер взаимодействия генов - неполное доминирование с присутствием эпистатических эффектов, где средние значения признака в гибридах F 1 занимают промежуточное место с уклоном к тому или другому родителю в зависимости от доминирования устойчивости или восприимчивости [10, 14]. По данным В.В. Волгина (2007) [4] при скрещивании межлинейных гибридов сростноплод-ных опылителей с раздельноплодными ЦМС-формами, кроме неполного доминирования, в первом поколении также могут проявляться другие типы наследования, что было отмечено и в наших исследованиях на свекле столовой (табл. 2).
В представленной выборке в основном отмечали промежуточный характер наследования по степени развития болезни (R, %). При этом, сверхдоминирование относительно лучшего родителя отмечено у 36% комбинаций, у 20% – доминирование в сторону одного из родителей, у
Таблица 2. Характер проявления признака устойчивости к церкоспорозу у гибридов F 1 свеклы столовой в условиях эпифитотии (пленочная теплица, 2019)
Table 2. The nature of the manifestation of the sign of resistance to Cercospora in hybrid F 1 of beetroot under epiphytotyc conditions (greenhouse, 2019)
|
№ гибридной комбинации |
Степень развития болезни, R% Degree of disease development, R, % |
Hp |
Гипотетический эффект гетерозиса, % The effect of heterosis, % |
|||||
|
$ ms-линия А ms-line A |
8 mf-линия С mf-line С |
F 1 |
||||||
|
R, % |
группа устойчивости The group resistance |
R, % |
группа устойчивости The group resistance |
R, % |
группа устойчивости The group resistance |
|||
|
476 |
74 |
IV |
49 |
III |
20 |
I |
3,2 |
65,2 |
|
480 |
30 |
III |
30 |
III |
23 |
II |
8,5 |
27,4 |
|
505 |
86 |
V |
90 |
V |
47 |
III |
20,4 |
46,4 |
|
507 |
89 |
V |
71 |
IV |
66 |
IV |
1,5 |
17,4 |
|
472 |
90 |
V |
80 |
IV |
71 |
IV |
2,8 |
16,5 |
|
501 |
89 |
V |
91 |
V |
85 |
V |
5,3 |
5,9 |
|
496 |
89 |
V |
71 |
IV |
90 |
V |
1,0 |
-12,5 |
|
452 |
90 |
V |
67 |
IV |
90 |
V |
1,0 |
-14,9 |
|
466 |
74 |
IV |
54 |
IV |
70 |
IV |
0,6 |
-9,4 |
|
427 |
17 |
I |
67 |
IV |
36 |
III |
0,2 |
13,0 |
|
470 |
30 |
III |
80 |
IV |
50 |
III |
0,2 |
9,1 |
|
468 |
20 |
II |
67 |
IV |
40 |
III |
0,1 |
7,7 |
|
457 |
90 |
V |
54 |
IV |
74 |
IV |
0,1 |
-2,8 |
|
461 |
86 |
V |
67 |
IV |
75 |
IV |
0,1 |
1,2 |
|
463 |
86 |
V |
67 |
IV |
76 |
IV |
0,0 |
0,6 |
|
502 |
20 |
I |
90 |
V |
79 |
IV |
-0,7 |
-42,9 |
|
473 |
30 |
II |
49 |
III |
49 |
III |
-1,0 |
-24,4 |
|
467 |
30 |
II |
67 |
IV |
67 |
IV |
-1,0 |
-38,5 |
|
464 |
30 |
II |
54 |
III |
90 |
V |
-4,0 |
-114,3 |
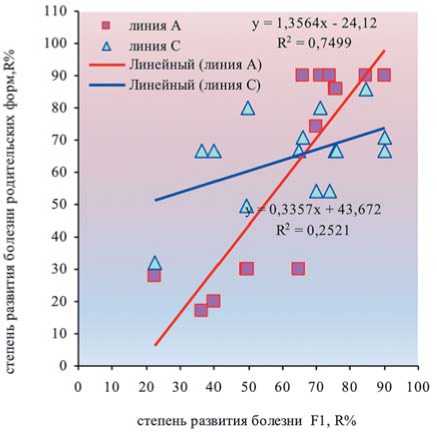
Рис. 9. Взаимосвязь между устойчивостью к церкоспорозу гибридов F1 свеклы столовой на основе ЦМС и родительских компонентов скрещивания ^ms-линий А и Smf-линий С одного образца (5%) – депрессия и высокий отрицательный гетерозис по устойчивости к церкоспорозу (табл.2). Корреляционный анализ выявил более тесную взаимосвязь устойчивости гибридов F1 с устойчивостью материнской ms-линии (r=0,55), чем с линией-опылителем (r=0,32), что, по-видимому, связано с морфогенетическим воздействием цитоплазмы материнской формы на экспрессию (репрессию) генов резистентности-воспри- имчивости, их динамическое взаимодействие, которое установлено также и у свеклы сахарной [14].
В то же время, хотя признак устойчивости ms-компонента в большей мере контролирует его в гибридном потомстве, определенное влияние на устойчивость к цер-коспорозу у ЦМС гибридов оказывает и «повышенная базисная устойчивость опылителя» [4, 16, 35]. По нашим данным это прослеживается и у свеклы столовой, особенно в комбинациях с восприимчивыми материнскими ms-формами (рис.9; табл.2). По устойчивости к церкос-порозу на фоне эпифитотии выделено восемь различных гибридов: 486, 476, 480, 430, 493, 494, 495, 427, что составило 24% от всей совокупности изученных ЦМС гибридов F 1 . В двух из них в качестве опылителя участвовало инбредное потомство из селекционного образца А.5 1427-1, в трех – из селекционного образца П-155, в остальных – инбредные потомства, полученные на основе сортопопуляции Гаспадыня, селекционного образца А.3 1520-09-6 и гибридной популяции Скарлет Суприм F 1 .
Заключение
По данным различных исследователей в последнее десятилетие наблюдается увеличение степени распространенности и вредоносности церкоспороза на посевах свеклы, что совпадает по времени с интенсивным внедрением импортных гибридов в севообороты хозяйств [3]. Основным толчком к прогрессированию церкоспороза свеклы в условиях ЦентральноЧерноземного региона РФ, по мнению [15, 16], является микроэволюция патогена С. beticola в результате смены сортовых популяций с горизонтальной устойчивостью к аборигенным расам патогена гетерозисными гибридами, преимущественно с вертикальной устойчивостью к одной или нескольким расам. Эпифитотии цер-коспороза теперь практически ежегодно регистрируются в Орловской, Курской, Воронежской и Белгородской областях [1]. Не исключено, что вместе с семенным материалом происходит ввоз и новых рас патогена,
агрессивность которых возрастает в условиях нового региона [13, 37]. Быстрое распространение Cercospora beticola , также связано с изменениями климата и общей тенденцией продвижения микозов с юга на север по всему миру [12, 17, 27].
В условиях Московской области в отдельных районах также увеличилась площадь очагов со значительным распространением церкоспороза, где проводятся профилактические обработки фунгицидами [20], что предотвращает его развитие до экономически опасного уровня. Тем не менее, опасность возникновения эпифитотийной ситуации при наличии источника возбудителя и соответствующих погодных условиях не исключается. В частности, это актуально при использовании защищенного грунта, который в последнее время все чаще используется в селекционном процессе ряда овощных культур. Это ставит перед селекционерами и фитопатологами ФГБНУ ФНЦО задачу усиления исследований по выявлению источников и доноров устойчивости к церкоспорозу свеклы столовой для включения их в селекционный процесс при создании новых сортов и гибридов на основе ЦМС.
Эпифитотия церкоспороза, возникшая в условиях блочной пленочной теплицы, позволила сделать важные шаги в этом направлении. В результате оценки селекционного материала выделены наиболее устойчивые линии и лучшие гибриды F 1 по устойчивости к церкоспорозу. Поскольку горизонтальная и вертикальная к отдельным расам устойчивость свеклы к церкоспорозу контролируется большим количеством генов с эпистатическим и аддитивным взаимодействием, определяющим изменчивость признака, зависит от цитоплазматических и экологических факторов и требует изучения большого объема материала для отбора высокой устойчивости [14], селекционный процесс создания устойчивых сортов и гибридов свеклы столовой очень сложен и длителен. В связи с этим, существует необходимость использования искусственных фонов, широкого привлечения современных методов биотехнологии и молекулярного маркирования для его ускорения [3, 15, 16, 30]. Кроме того, важное значение имеет своевременная обработка фунгицидами корнеплодов и семян восприимчивых к церкоспорозу генотипов, ценных по комплексу других селекционно значимых признаков.
Об авторах:
Еlena G. Kozar – Cand. Sci. (Agriculture), leading researcher head of the laboratory of immunity and plant protection
Svetlana A. Vetrova – Cand. Sci. (Agriculture), senior researcher of the laboratory of breeding and seed production of table root crops
Irina A. Engalycheva – Cand. Sci. (Agriculture), head of the laboratory of immunity and plant protection
Margarita I. Fedorova – Dc. Sci. (Agriculture), prof., Principal Scientist of the laboratory of breeding and seed production of table root crops
(In Russ.)
Список литературы Оценка устойчивости селекционного материала свеклы столовой к церкоспорозу на фоне эпифитотии в условиях защищенного грунта Московской области
- Арсеньева М., Смиренская Ю. Свекольные страдания. Агротехника и технологии. 2015. www.agroinvestor.ru.
- Билай В.И., Элланская И.А. Основные микологические методы в фитопатологии. Методы экспериментальной микологии. Киев: Наукова думка. 1982:418-430.
- Буренин В.И. К проблеме церкоспороустойчивости сахарной свеклы (задачи селекции и исходный материал). Сахарная свекла. 2018;(10):2-5.
- Волгин В.В. Теория и практика создания гетерозисных гибридов сахарной свеклы на цмс основе: автореф. дис.. д-ра с.-х. наук: 06.01.05. 2007. 50 с.
- Глазунова Н.Н., Безгина Ю.А., Мазницына Л.В., Шарипова О.В. Системы защиты основных полевых культур юга России. Справочное и учебное пособие для студентов агрономического факультета и факультета защиты растений. Ставрополь: Параграф. 2013. 184 с.
- Доспехов Б.А. Методика полевого опыта. М.: Агропромиздат.1985. 351с.
- Жоржеско Г.Г. Создание селекционных материалов и сортов сахарной свеклы, устойчивых к церкоспорозу, для зоны Северного Кавказа. Повышение эффективности производства сахарной свеклы на Северном Кавказе. Киев: ВНИИС.1985. 30-38 с.
- Макагон А.М., Корниенко А.В., Манько А.Е. Повышение устойчивости гибридов к церкоспорозу. Сахарная свекла. 1980;(10):37-38.
- Милошевич М.Б., Игнатов М.В., Медич-Пап С.С. Наиболее значимые патогены, передающиеся семенами сахарной свеклы. Сборник резюме 4-го Международного симпозиума по защите сахарной свеклы 26-28 сентября. Сербия и Черногория, Нови Сад. 2005. 256 с.
- Павленко Е.А. Принципы подбора церкоспороустойчивых компонентов при создании высокопродуктивны гибридов сахарной свеклы, устойчивых к церкоспорозу: автореф. дис. канд. с.-х. наук. 1991. 24 с.
- Паушева З.П. Практикум по цитологии растений. М: Высшая школа. 1989. 126 с.
- Сиротин А.А., Трифонова М.Ф., Зеленкова В.Н. Оценка устойчивости к местным штаммам церкоспороза исходного генетического материала для создания новых сортов и гибридов сахарной свеклы. Известия Межд. акад. аграрного образования. 2018;(38);136-139.
- Смирнов К.С. Чем опасен церкоспороз и как с ним бороться? Сахарная свекла. 2005;5:14-15.
- Собченко В.Ф. Закономерности наследования признака устойчивости к церкоспорозу и селекционные пути создания высокоустойчивых форм сахарной свеклы: автореф. дис. канд. с.-х. наук. 1993. 22c.
- Стогниенко О.И., Мелькумова Е.А., Корниенко А.В. Церкоспороз сахарной свеклы и методы снижения его вредоносности. Воронеж: ООО "Антарес". 2016. 170 с.
- Стогниенко О.И. Патокомплексы микобиоты сахарной свеклы и методы снижения их вредоносности в ЧЦР России: автореф. дис.. д-ра с.-х. наук: 06.01.05. Рамонь. 2017. 47 с.
- Сычева И.В., Морозова К.А. Оценка хозяйственно-ценных признаков сортообразцов свеклы столовой и толерантность к Cercospora beticola Sacc. Материалы XV Межд.научн.конф. "Агроэкологические аспекты устойчивого развития АПК". 2018:321-323.
- Цыба Я.И. Агробиологическое обоснование защиты сахарной свеклы от церкоспороза в условиях опытного поля центра научных исследований и инновации ООО "СИНГЕНТА". Сборник материалов 71-й научно-практ.конф. "Научное обеспечение агропромышленного комплекса". МИНСЕЛЬХОЗ РФ; ФГБОУ ВО "Кубанский государственный аграрный университет имени И.Т. Трубилина". 2016:62-64.
- https://mgutunn.ru/..
- https://rosselhoscenter.com
- Battialani P., Beltrami G., Meriggi P., Ponti I., Rossi A., Rossi V., Rosso F., Tugnoli V., Zocca A. Nuovi indrizzi di divesa anticercosporica. LInformatore Agrario. 1990;(46):53-70.
- Bolton M.D., Birla K., Rivera-Varas V., Rudolph K.D., Secor G.A. Characterization of CbCyp51 from Field Isolates of Cercospora beticola. Phytopathology. 2012;(102):298-305.
- Braun U., Melnik U.A. Cercosporoid fungi from Russia and adjacent countries. Russian Academy of Sciences. 1997;(1197):112.
- Khan, J., Qi, A., Khan, M.F.R. Fluctuations in number of Cercospora beticola conidia in relationship to environment and disease severity in sugar beet. Phytopathology. 2009;(99);796-801.
- Levelin R.T., Whitney E.D. Inheritance of resistance tu rase C2 of Cercospora beticola in Zugar beet. Group Sciens. 1976;(16):558.
- Mukhopadhyay A.N., Pal V. Variation among the sugar beet isolates of Cercospora beticola from India. Proceedings of the 3-rd International Simposium on Plant Patology. New Dehli, India. 1981;132-136.
- Pethybridge SJ., Vaghefi N., Kikkert JR. Management of Cercospora Leaf Spot in Conventional and Organic Table Beet Production. PMID:. 2017.
- DOI: 10.1094/PDlS-04-17-0528-RE ISBN: 30677334
- Pethybridge S.J., Kikker J.R.t, Hanson L.E., Nelson S.C. Challenges and Prospects for Building Resilient Disease Management Strategies and Tactics for the New York Table Beet Industry. Agronomy. 2018;8(7):112. 10.3390/Agronomy80701 12
- DOI: 10.3390/agronomy8070112
- Piszczek J., Czekalska A. Resistance of cercospora beticola sacc. To fungicides used against this patogen in Poland. F Prog. Plant Prot. 2006,46(1):375-379.
- Setiawan A., Koch G.F., Barnes S.R., Jung C. Mapping quantitative trait loci (QTLs) for resistance to Cercospora leaf spot disease (Cercospora beticola Sacc.) in sugar beet (Beta vulgaris L.). Theoretical and Applied Genetics. 2000. 10.1007 / s001220051421
- DOI: 10.1007/s001220051421
- Slosser L. A., Koch F. Rassenbildung bei Cercospora beticola. Zucker. 1957;(10):489.
- Solel Z., Wahl I. Pathogenic specialization of Cercospora beticola. Phitopatology. 1971;(61):1081-1083.
- Soylu S., Soylu E.M., Kurt S. First report of Cercospora leaf spot on Swiss chard caused by Cercospora beticola Sacc. in Turkey. Plant Pathology. 2003;(52):804.
- Staerkel, C., Boenisch, M. J., Kroger, C., Bormann, J., Schafer, W., and Stahl, D. CbCTB2, an O-methyltransferase is essential for biosynthesis of the phytotoxin cercosporin and infection of sugar beet by Cercospora beticola. BMC Plant Biol. 2013;(13):50. 10.1 186/14712229-13-50
- DOI: 10.1186/14712229-13-50
- Trkulja N.R., Milosavljevic A.G., Mitrovic M.S, Jovic J.B., Toevski I.T, Khan M.F.R. Secor G.A. Molecular and experimental evidence of multiresistance of Cercospora beticola field populations to MBC, DMI and QoI. European Journal of Plant Pathology. 2017,149(4):895-910.
- Vaghefi N. Genotypic Diversity and Resistance to Azoxystrobin of Cercospora beticola on Processing Table Beet in New York. Population Genetics, Plant Pathol. 2015. http://www.academia.edu/Documents/in/Fungicide_Resistance
- Vereijssen J. Cercospora leaf spot in sugar beet. Epidemiology, life cycle components and disease management. Bergen op Zoom, The Netherlands. 2004:198.
- Weiland J., Koch G. Sugarbeet leaf spot disease (Cercospora beticola Sacc.) dagger. Mol Plant Pathol. 2004;5(3): 157-166. 10.1111/j.1364- 3703.2004100218.x.
- DOI: 10.1111/j.1364-3703.2004100218.x


