Оценка влияния биопрепаратов и светодиодного облучения на растения тимьяна обыкновенного в закрытых агроэкосистемах
Автор: Титенков Андрей Владимирович, Князева Инна Валерьевна, Вершинина Оксана Владимировна, Лактионов Юрий Владимирович, Дроботова Елена Николаевна, Каширина Наталья Александровна
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Агрономия
Статья в выпуске: 9, 2024 года.
Бесплатный доступ
Цель исследования - изучение влияния биоудобрений на основе адаптивных PGPR-бактерий на процесс укоренения черенков тимьяна и оценка воздействия светодиодного облучения на качественные показатели биомассы тимьяна обыкновенного. Объект исследования - Тимьян обыкновенный (Thymus vulgaris L.), сорт ‘Крымрозовец’ селекции ФГБУН «НИИСХ Крыма». Оценивали способность к укоренению черенков тимьяна обыкновенного, взятых от маточных растений, посредством применения PGPR-бактерий в контролируемых условиях закрытой агроэкосистемы. На этапе укоренения с применением монокультуры Arthobacter mysorens отмечалось 76 % приживаемости черенков на торфяном субстрате, что соответствовало контрольному варианту (82 %); на минераловатном субстрате наблюдали увеличение приживаемости черенков в 1,8 раз (65 %) по сравнению с контролем (36 %). Обработка черенков тимьяна консорциумом PGPR-бацилл Bacillus sp. снизило приживаемость как на торфяном, так и на минераловатном субстратах по сравнению с контролем. При изучении воздействия светодиодной облученности на качественные показатели биомассы тимьяна обыкновенного наблюдались различия в накоплении эфирного масла и синтезе аминокислот. Наибольший выход эфирного масла (1,01 %) был зафиксирован при обработке ФАР 230 ммоль/м2с, наименьший (0,46 %) - при применении ФАР 106 ммоль/м2с. Общее содержание аминокислот (аргинина, лизина, фенилаланина, лейцина + изолейцина, валина, пролина, треонина и аланина) в биомассе тимьяна, выращенного при пониженной облученности освещения (106 ммоль/м2с), было на 23,9 % выше, чем в растениях, выращенных при повышенной облученности (230 ммоль/м2с). Среди всех проанализированных аминокислот преобладают лейцин + изолейцин (Leu + Ile) с общим содержанием от 901,1 (ФАР - 230 ммоль/м2с) до 1055,2 (ФАР - 106 ммоль/м2с) мг/100 г. Для достижения оптимальных параметров качества получаемого сырья можно рекомендовать выращивание растений в условиях пониженной светодиодной облученности при ФАР 106 ммоль/м2с закрытой агроэкосистемы.
Тимьян, ризобактерии, облученность, укоренение, эфирное масло, аминокислоты, закрытые агроэкосистемы
Короткий адрес: https://sciup.org/140307650
IDR: 140307650 | УДК: 633.82+631.8 | DOI: 10.36718/1819-4036-2024-9-26-35
Текст научной статьи Оценка влияния биопрепаратов и светодиодного облучения на растения тимьяна обыкновенного в закрытых агроэкосистемах
Введение. Лекарственные и эфиромасличные растения, относящиеся к семейству Lamiaceae (Яснотковые), представляют собой ценный растительный ресурс и являются источником биологически активных веществ (БАВ), которые могут быть использованы как биопестициды, биологически активные добавки к продуктам питания и кормам, основа для биомедицинских и биофармацевтических препаратов.
Представители рода Thymus известны своими лечебными свойствами, включая антибактериальные, противомикробные, противовирусные и противогрибковые (T. vulgaris, T. Carma- nicus, T. pubescens, T. kotschyanus, T. persicus, T. daenensis) [1]. Эфирное масло тимьяна обыкновенного входит в десятку самых известных эфирных масел в мире. Его мировое производство оценивается в 1,2 миллиона долларов США. Ежегодный объем мировой торговли тимьяном составляет около 15 000 т. Турция является крупнейшим производителем и экспортером (примерно на 11 000 т в год), за ней следуют Мексика, Греция и Израиль. Основными странами, импортирующими тимьян из Турции, являются США, Германия, Италия и Канада [2].
Естественных популяций тимьяна обыкновенного недостаточно для удовлетворения такого большого и даже растущего спроса на его продукцию. Поэтому актуальной является разработка эффективных приемов размножения и выращивания тимьяна в культуре.
Рост растений могут стимулировать ризобак-терии (PGPR), образующие колонии на их корнях [3]. Одной из стратегий улучшения способности к укоренению древесных пород является использование ризосферных бактерий для стимуляции укоренения. Исследования показали, что ризосферные бактерии влияют на укореняемость черенков эвкалипта [4]. Микробиологический инокулянт Bacillus subtilis 8-32 может быть применен для стимулирования роста корней, побегов и улучшения качества саженцев сосны ( Pinus bungeana Zucc.) в процессе выращивания [5]. Ряд непатогенных ризосферных бактерий, принадлежащих к родам Agrobacterium , Alcaligens, Arthrobacter, Azospirillum, Azotobacter, Bacillus, Brassica, Burkholderia, Enterobacter, Klebsiella, Pseudomonas, Serratia, прямо или косвенно усиливают рост растений [6].
Накопление и конечный состав эфирных масел в растениях в значительной степени зависят от погодно-климатических условий, технологии выращивания и фазы онтогенеза на момент заготовки сырья. Количество и качество света играют важную роль в формировании растений и синтезе в них эфирных масел. Исследования по выращиванию ароматических растений выявили различия по накоплению и составу в них эфирного масла в зависимости от светового спектра во время выращивания [7].
Согласно литературным данным, содержание эфирного масла в сухой биомассе тимьяна колеблется от 0,3 до 4,0 % [8]. N. Gavariс и другие показали, что накопление эфирного масла в биомассе тимьяна из Сербии находится в пределах 0,8–2,6 % [9].
Интенсивность и качество света контролируют реакции растений, включая фитохимичес-кие и физиологические процессы. Во многих исследованиях сообщалось об усилении роста растений и увеличении содержания в них лекарственных компонентов за счет изменения качества освещения в контролируемых условиях закрытых агроэкосистем [10–12].
Цель исследования – изучение влияния биоудобрений на основе адаптивных PGPR-бактерий на процесс укоренения черенков тимьяна и оценка воздействия светодиодного облучения на качественные показатели биомассы тимьяна обыкновенного.
Объекты и методы. Объект исследования – тимьян обыкновенный ( Thymus vulgaris L.), сорт ‘Крымрозовец’ селекции ФГБУН «НИИСХ Крыма» (авторы Платонова Т.В., Серкова А.А.). Растения высотой (23,1 ± 0,3) см, с прямостоячими стеблями, одревесневающими в нижней части. Листья светло-зеленые, мелкие, длиной 7–9 мм и шириной 2 мм, короткочерешковые. По данным конкурсного сортоиспытания массовая доля эфирного масла в свежем сырье – (0,651 ± 0,045) % ((2,576 ± 0,067) % от абсолютно сухого сырья). Особенностью данного сорта является то, что основным компонентом получаемого из его сырья эфирного масла является не типичный для данного вида тимол, а линалоол ((81,0 ± 0,4) %), представляющий ценность, обусловленную сильными антибиотическими, противовоспалительным, анксиолитическим, антиоксидантным и другими ценными свойствами [13–15].
Для проведения опытов по черенкованию тимьяна были использованы биопрепараты на основе консорциума PGPR-бацилл Bacillus subtilis , Bacillus megaterium var phosphaticum (далее Bacillus sp. ) и монокультура Arthobacter mysorens , полученные из ФГБНУ Всероссийского научно-исследовательского института сельскохозяйственной микробиологии (г. Санкт-Петербург).
Размножение тимьяна проводили зелеными черенками длиной (6 ± 1) см. Черенки обрабатывали исходным раствором биоудобрений в концентрации не менее 2,0 млрд КОЕ/мл с экспозицией 30 мин, затем помещали в горшки с торфяным питательным и в кубики с минераловатным субстратами. Контролем служили необработанные черенки тимьяна (рис. 1).
Укоренение черенков тимьяна (n = 50 шт. на вариант) осуществлялось в контролируемых условиях климатической камеры при светодиодном освещении 230 ммоль/м²с, суточной температуре (20 ± 2) °С, фотопериоде 18 ч и относительной влажности воздуха (70 ± 5) % на протяжении 20 сут. Горшки и кубики орошались каждые два дня.

Рис. 1. Необработанные черенки тимьяна (контроль): А – заготовленные зеленые черенки тимьяна сорта ‘Крымрозовец’; Б – варианты рабочих растворов: 1 – контроль (Н 2 О);
2 – Bacillus sp., 3 – Arthobacter mysorens
После завершения этапа укоренения нами были отобраны (n = 20 шт. на вариант) укоренившиеся растения тимьяна на торфяном субстрате (контроль) для проведения дальнейших исследований по влиянию разной облученности светодиодного освещения на качественные показатели. Выращивание растений осуществлялось в климатической камере с суточной температурой (23 ± 2) °С, относительной влажностью воздуха (60 ± 5) % и фотопериодом 16 ч. Полив осуществлялся каждые 72 ч питательным раствором, содержащим основные питательные элементы со значениями: pH (5,9 ± 0,3) и электропроводность (EC) 1,2 мСм · см–1.
При проведении исследований были установлены два варианта облученности со спектральным составом в диапазоне от 380 до 780 нм (рис. 2):
-
1. Вариант облученности ФАР (фотосинтетическая активная радиация) на уровне растений – 106 ммоль/м2с с параметрами: синий/blue (18 ммоль/м2с), зеленый/green (47 ммоль/м2с), красный/red (38 ммоль/м2с) и дальний красный (3 ммоль/м2с) спектр.
-
2. Вариант облученности ФАР на уровне растений – 230 ммоль/м2с с параметрами: си-ний/blue (40 ммоль/м2с), зеленый/green (104 ммоль/м2с), красный/red (80 ммоль/м2с) и дальний красный (6 ммоль/м2с) спектр.
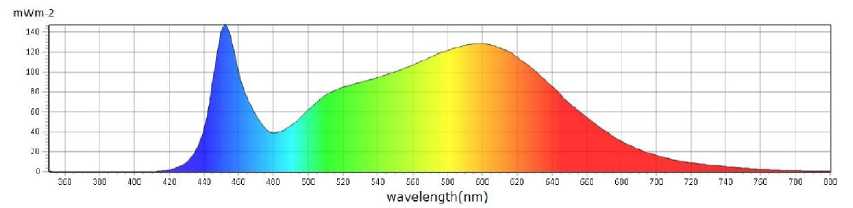
Рис. 2. Спектральный состав освещения (пропорции B:G:R ~ 17:45:35) при выращивании растений тимьяна
Измерения интенсивности освещения проводили на уровне растений с использованием спектрального измерителя ФАР MK350D Compact Spectrometer (UPRtek Corp. Miaoli County, Тайвань).
Определение массовой доли аминокислот проводили методом капиллярного электрофореза с использованием аналитического комплекса на основе системы капиллярного электрофореза «Капель-205» (Россия).
Массовую долю эфирного масла определяли в свежесрезанном сырье методом гидродистилляции по Гинзбергу. Масса навески свежего сырья для определения содержания эфирного масла составляла 50 г, повторность 3-кратная.
Статистическую обработку результатов проводили по стандартным методикам. Использовали НСР и тест Дункана для проверки значимости полученных данных при уровне вероятности p ≤ 0,05.
Результаты и их обсуждение. Применение PGPR-бактерий для черенкования в качестве средства, стимулирующего корнеобразование, не было широко изучено для тимьяна. Мы стремились оценить способность к укоренению черенков, взятых от маточных растений, посред- ством применения PGPR-бактерий в контролируемых условиях закрытой агроэкосистемы.
В результате исследований влияния типа субстрата и биоудобрений было подсчитано количество прижившихся черенков после трех недель роста (рис. 3).
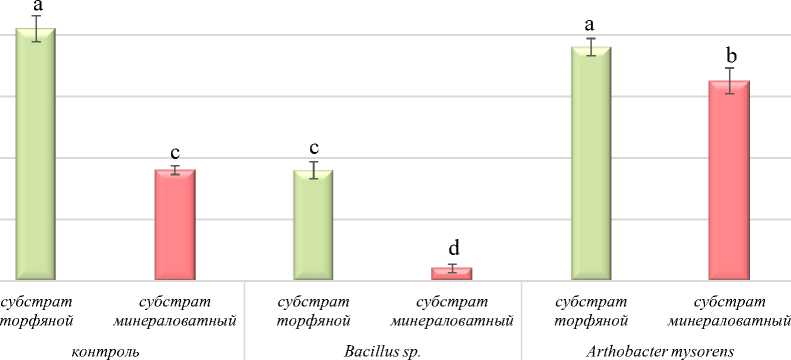
Рис. 3. Влияние биоудобрений и типа субстрата на процесс приживаемости черенков тимьяна на 20-е сут наблюдений, %
Установлено, что на этапе укоренения с применением монокультуры Arthobacter mysorens отмечалось 76 % приживаемости черенков на торфяном субстрате, что соответствовало контрольному варианту (82 %). Анализ приживаемости черенков тимьяна на минераловатном субстрате показал ее увеличение в 1,8 раз
(65 %) по сравнению с контролем (36 %) при использовании Arthobacter mysorens. Черенки имели хорошо развитую корневую систему. Обработка Arthobacter mysorens превзошла другие обработки как на торфяном, так и на минераловатном субстратах по укореняемости черенков тимьяна (рис. 4).

Рис. 4. Укоренившиеся зеленые черенки тимьяна сорта ‘Крымрозовец’ на 20-е сут наблюдений: 1 – субстрат минераловатный (контроль); 2 – субстрат минераловатный Bacillus sp.; 3 – субстрат минераловатный Arthobacter mysorens;
4 – субстрат торфяной (контроль); 5 – субстрат торфяной Bacillus sp.; 6 – субстрат торфяной Arthobacter mysorens
Применение биоудобрений на основе консорциума PGPR-бацилл Bacillus sp. снизило приживаемость черенков на торфяном субстрате в 2,7 раза и составило 36 % по сравнению с контрольным вариантом. Черенкование тимьяна на минераловатном субстрате не только подавляло развитие корневой системы, но и приводило к массовой гибели черенков. Общий средний процент выживших укорененных черенков составил всего 4 %.
Принимая во внимание растущий в последнее время интерес в мировом масштабе к выращиванию лекарственных растений в закрытом грунте, а также учитывая генотипическую и видовую зависимость световых реакций, мы провели исследования по влиянию разной светодиодной облученности на качественные показатели биомассы тимьяна.
Результаты показали, что между исследуемыми параметрами облученности светодиодного освещения наблюдались значительные различия по содержанию эфирного масла в биомассе тимьяна. Наибольший выход эфирного масла (1,01 %) был зафиксирован при обработке ФАР 230 ммоль/м2с, наименьший (0,46 %) – при использовании ФАР 106 ммоль/м2с. Среднее процентное содержание эфирного масла при обработке ФАР 230 ммоль/м2с увеличилось на 120 %, чем при обработке ФАР 106 ммоль/м2с.
В соответствии с требованием статьи ФС.2.50097.18 «Тимьяна обыкновенного трава» содержание эфирного масла должно быть не менее 1 % в сухом сырье. По данным 3 лет наблюдений у вида тимьяна обыкновенного разных сортов, выращенных в открытом грунте, общее содержание масла находилось в пределах 1,24 % (сортов Медок и Deutsche Winter); 1,33 (сорта Di Roma) и 1,6 % (образец из Чехии), которые соответствовали требованиям. Остальные образцы только в отдельные годы соответствовали необходимому критерию [16].
Разная облученность светодиодного освещения повлияла на высоту растений тимьяна. Наименьшая высота была зафиксирована при облученности ФАР 106 ммоль/м2с и составила (21,1 ± 0,2) см, что соответствовало параметрам растений используемого в опыте сорта тимьяна, выращиваемого в открытом грунте. При увеличении облученности до 230 ммоль/м2с высота растений составила (32,3 ± 0,3) см. Как показано на рисунке 5, биомасса тимьяна была значительно увеличена (в 1,4 раза) по массовой доле сухого вещества 37,7 % под светодиодным облучением с ФАР 230 ммоль/м2с. Воздействие более низкой облученности 106 ммоль/м2с способствовало меньшему накоплению доли сухого вещества – 25,9 %. Причина значительного накопления биомассы и сопутствующего быстрого развития тимьяна связано с повышением ФАР.

Рис. 5. Внешний вид тимьяна сорта ‘Крымрозовец’, выращенного при разной облученности светодиодного освещения на 82-е сут наблюдений: А – при ФАР 106 ммоль/м2с (вариант 1);
Б – ФАР 230 ммоль/м2с (вариант 2)
Наибольшее количество незаменимых аминокислот человек получает с пищей, и основная их доля поступает из растений. В отличие от людей и животных растения сами синтезируют все протеиногенные аминокислоты [17]. Аминокислоты являются биоактиваторами, обеспечивающими растению энергию для компенсации потерь, вызванных дыханием.
Нами был исследован аминокислотный состав биомассы тимьяна (20 аминокислот). Среди всех проанализированных аминокислот преобладают лейцин+изолейцин (Leu+Ile) с общим содержанием от 901,1 (ФАР – 230 ммоль/м2с) до 1055,2 (ФАР – 106 ммоль/м2с) мг/100 г (рис. 6).
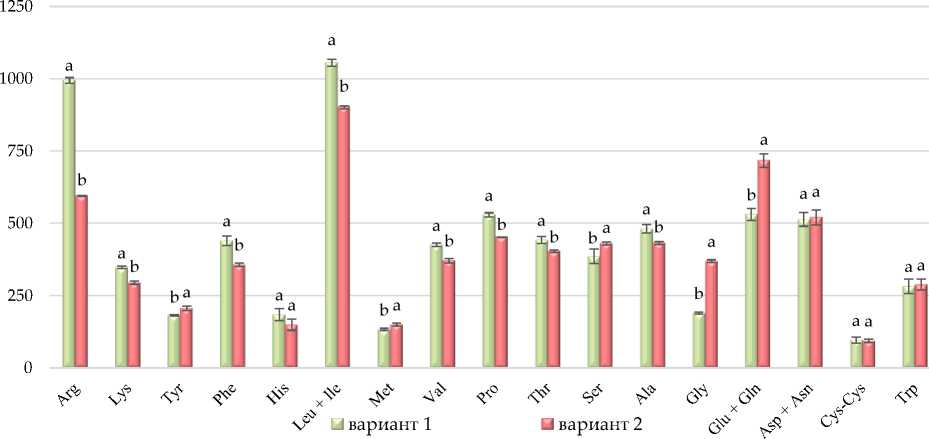
Рис. 6. Общее содержание аминокислот в биомассе тимьяна сорта ‘Крымрозовец’ (вариант 1 (ФАР – 106 ммоль/м2с); вариант 2 (ФАР – 230 ммоль/м2с)), мг/100 г воздушно-сухого сырья
В условиях пониженной облученности освещения (вариант 1) отмечали существенное увеличение содержания следующих аминокислот: аргинина, лизина, фенилаланина, лейци-на+изолейцина, валина, пролина, треонина и аланина. Накопление аргинина имеет высокое соотношение азота к углероду, растения склонны накапливать азот в виде аргинина, когда азота много. Наибольшее количество аргинина в биомассе тимьяна соответствовало значению – 994,4 мг/100 г при ФАР 106 ммоль/м2с (вариант 1) по отношению к 595,0 мг/100 г при ФАР 230 ммоль/м2с (вариант 2).
Незаменимые аминокислоты, такие как лизин, метионин, треонин и триптофан, часто присутствуют в растениях в низких концентрациях, ограничивая их питательную ценность [18]. В наших исследованиях накопление лизина и треонина было статистически достоверно увеличено при пониженной облученности освещения (ва- риант 1) и составило 345,9 и 442,7 мг/100 г соответственно (см. рис. 6).
Повышенная облученность (вариант 2) положительно повлияла на накопление в биомассе тимьяна метиониновой аминокислоты (150,2 мг/100 г), а также тирозина, серина, глицина, и на комплекс глутаминовой кисло-ты+глутамин.
Таким образом, общее содержание аминокислот (аргинина, лизина, фенилаланина, лейци-на+изолейцина, валина, пролина, треонина и аланина) в биомассе тимьяна, выращенного при пониженной облученности освещения (106 ммоль/м2с), было примерно на 23,9 % выше, чем в растениях, выращенных при повышенной облученности (230 ммоль/м2с).
Различные варианты светодиодной облученности не повлияли на содержание гистидина, аспарагиновой кислоты + аспарагинтрипто-фана, цистина и триптофана.
Заключение. Условия освещения по-разному повлияли на ростовые процессы и накопление биологически активных веществ в биомассе тимьяна, выращенного в закрытой агроэкосистеме. Использование облученности в области ФАР 106 ммоль/м2с привело к снижению интенсивности формирования вегетативных побегов и соответственно к снижению массовой доли сухого вещества до 25,9 %. Также наблюдали снижение эфирного масла до 0,46 % при пониженной облученности. Однако при этом содержание большинства аминокислот, таких как аргинин, лизин, фенилаланин, лейцин + изолейцин, валин, пролин, треонин и аланин, в растительной продукции тимьяна возрастало. Повышенная облученность ФАР 230 ммоль/м2с в значительной степени способствовала повышению содержания эфирного масла до 1,01 % в биомассе тимьяна и ряда аминокислот (метионина, серина, глицина и на комплекс глутаминовой кислоты + глутамина).
Список литературы Оценка влияния биопрепаратов и светодиодного облучения на растения тимьяна обыкновенного в закрытых агроэкосистемах
- Экология и питание. Проблемы и пути решения / М.Б. Ребезов [и др.] // Фундаментальные исследования. 2011. № 8, ч. 2. С. 393–396.
- Воропинова О.А., Германова Ю.И., Малкина Л.В. Состояние и динамика социально значимых заболеваний в регионах Северо-Кавказского федерального округа // Медицинский вестник Северного Кавказа. 2014. Т. 9, № 1. С. 63–66.
- Тагирова П.Р., Касьянов Г.И. Пищевые добавки из семян и кожицы ягод винограда // Научные труды КубГТУ. 2015. № 9. C. 281–296.
- Sanjiv A., Akkinappally V. Tomato lycopene and its role in human health and chronic diseases // CMAJ, 2000. 163(6). P. 739–744.
- Chandra K., George J., Ahmad N. Resveratrol-based combinatorial strategies for cancer management // Ann N Y Acad Sci. 2013. Jul; 1290(1). P. 113–121.
- Эффекты комбинированного действия ресвератрола и индол-3-карбинола / Н.В. Трусов [и др.] // Бюллетень экспериментальной биологии и медицины. 2010. Т. 149, № 2. С. 174–179.
- Avato P., Argentieri P. Cite as Brassicaceae: a rich source of health improving phytochemi-cals // Phytochemistry Reviews. 2015. Vol. 14. Is. 6. P. 1019–1033.
- Broccoli and radish sprouts are safe and rich in bioactive phytochemicals / N. Baenas [et al.] // Postharvest Biology and Technology Vol. 127. 2017. P. 60–67.
- HPLC Separation of Sulforaphane Enantio-mers in Broccoli and Its Sprouts by Transfor-mation into Diastereoisomers Using Deriva-tization with (S)-Leucine / M. Okada [et al.] // J. Agric. Food Chem. 2017–65 (1). P. 244–250.
- Казахмедов Р.Э., Магомедова М.А. Элементы возделывания овощных культур для производства биологически активных добавок // Проблемы развития АПК региона. 2018. № 2 (34). С. 58–60.
- Казахмедов Р.Э., Казахмедов Э.Р., Магомедова М.А. Роль, место, особенности БАД в профилактике социально значимых заболеваний и перспективы получения экологически безопасного сырья для их производ-ства в условиях южного Дагестана // Известия Дагестанского ГАУ. 2019. № 1. С. 45–52.
- ГОСТ 8756.13-87. Продукты переработки плодов и овощей. Методы определения сахаров. М.: Стандартинформ, 2010. 12 с.
- ГОСТ 24556-89. Продукты переработки плодов и овощей. Методы определения витамина C. М.: Издательство стандартов, 2003. 11 с.
- Вигоров Л.И. Метод определения Р-актив-ных веществ // Труды III семинара по БАВ. Свердловск, 1972. 362 с.
- ГОСТ P 54037-2010. Продукты пищевые. Определение содержания водорастворимых антиоксидантов амперометрическим методом в овощах, фруктах, продуктах их переработки, алкогольных и безалкогольных напитках. М., 2010. 10 с.
- Методическое и аналитическое обеспечение исследований по садоводству. Краснодар: ГНУ СКЗНИИСиВ, 2010. 300 с.
- Черноусова Н.И., Яшин Я.И. Определение суммарного содержания антиоксидантов в семенах фруктов, ягод, овощей амперометрическим методом // Фенольные соединения: фундаментальные и прикладные аспек-ты: сб. науч. ст. по мат-лам X Междунар. симпозиума (Москва, 14–19 мая 2018 г.) / отв. ред. Н.В. Загоскина. М., 2018. С. 550–555.
- Генералов И.И. Определение фитоалексина ресвератрола в местных растительных источниках // Достижения фундаментальной, клинической медицины и фармации: мат-лы 67-й науч. сессии сотрудников ун-та (Витебск, 2–3 февраля 2012 г.). Витебск, 2012. С. 274–275.


