Оценка влияния ингибитора натрий-глюкозного котранспортера 2 типа в сочетании с инсулином на метаболические параметры и морфофункциональные изменения почек крыс с экспериментальным сахарным диабетом
Автор: Лебедев Д.А., Лихоносов Н.П., Тучина Т.П., Байрашева В.К., Бабенко А.Ю.
Журнал: Juvenis scientia @jscientia
Статья в выпуске: 11, 2017 года.
Бесплатный доступ
Ингибиторы натрий-глюкозного котранспортёра 2 типа относятся к новому классу пероральных препаратов для лечения сахарного диабета (СД) 2 типа, оказывающих свой эффект через уменьшение почечной реабсорбции глюкозы. Помимо сахароснижающего эффекта, для данной группы описывают различные плейотропные эффекты. В статье описывается влияние дапаглифлозина, одного из представителей этого класса, на морфофункциональные изменения почек крыс и метаболические параметры на фоне 4-недельной терапии экспериментального СД. В ходе исследования получены данные о том, что добавление дапаглифлозина к инсулину крысам со стрептозотоцин-индуцированным СД позволяет уменьшить выраженность гломерулосклероза, мезангиальной экспансии и альбуминурии.
Ингибитор натрий-глюкозного котранспортёра 2 типа, дапаглифлозин, сахарный диабет, нефропротективные свойства
Короткий адрес: https://sciup.org/14110434
IDR: 14110434 | УДК: 615.036.8 | DOI: 10.15643/jscientia.2017.11.008
Текст научной статьи Оценка влияния ингибитора натрий-глюкозного котранспортера 2 типа в сочетании с инсулином на метаболические параметры и морфофункциональные изменения почек крыс с экспериментальным сахарным диабетом
Funding : The reported study was funded by Russian foundation of basic research (RFBR) according to the research project №17-54-04080.
Введение. Сахарным диабетом (СД) 2 типа болеют не менее 380 миллионов человек во всем мире, или более 8% всего взрослого населения. По оценкам специалистов, к 2035 году СД будут страдать более 592 миллионов (10%) [1]. Остаются нерешенными не только вопросы профилактики и полного излечения СД 2 типа и его почечного осложнения – диабетической нефропатии (ДН), но и адекватной компенсации заболевания. По данным Сунцова Ю.И. и соавт., целевой уровень гликированного гемоглобина (HbA1c менее 7%) достигается не более чем у 13% больных СД. При этом нормализации веса, артериального давления (АД) и показателей липидограммы удаётся достигнуть лишь у 7% пациентов [2]. В связи с этим продолжается работа по созданию препаратов, эффективно корректирующих не только гипергликемию, но и другие метаболические нарушения, и по возможности благоприятно влияющих на прогноз в отношении ДН.
Традиционные сахароснижающие препараты (ССП) направлены на устранение дисфункции бета-клеток, нивелирование инсулинорезистентности или увеличение поглощения глюкозы тканями [3]. Понимание роли почек в метаболизме глюкозы привело к созданию нового класса ССП – ингибиторов натрий-глюкозного котранспортера 2 типа (НГЛТ-2), или глифлозинов. Механизм действия ингибиторов НГЛТ-2 связан с ингибированием реабсорбции глюкозы в почках и увеличением ее экскреции с мочой, тем самым достигается снижение уровня глюкозы в крови [4-6]. Сахароснижающий эффект глифлозинов сопоставим с другими противодиабетическими препаратами, является инсулин-независимым и не зависит от исходного состояния бета-клеток поджелудочной железы, что обуславливает низкий риск гипогликемий [6-8]. Дапаглифлозин является одним из трёх представителей класса ингибиторов НГЛТ, зарегистрированных в настоящее время на территории Российской Федерации [3]. Способность дапаглифлозина уменьшать плазменную концентрацию глюкозы напрямую зависит от скорости клубочковой фильтрации и, ожидаемо, снижается при хронической болезни почек [8].
Благодаря существенному увеличению глюкозурии лечение дапаглифлозином, помимо снижения уровня HbA1c, приводит к уменьшению массы тела и умеренному снижению АД [8-9]. С другой стороны, продолжают публиковаться исследования о возможных нефропротективных свойствах данного класса препаратов [10-12]. Считается, что положительное влияние ингибиторов НГЛТ-2 на функцию почек, помимо улучшения метаболического статуса, связано с уменьшением клубочковой гиперфильтрации, системного и интрагломерулярного давления, что приводит к замедлению развития и прогрессирования хронической болезни почек [7]. Так, терапия дапаглифлозином обладает мягким диуретическим эффектом, что может являться одной из причин улучшения течения артериальной гипертензии [11]. Однако, вероятнее всего, ведущим механизмом потенциальной нефропротекции является устранение клубочковой гиперфильтрации [13, 14]. Ингибирование реабсорбции глюкозы и натрия в НГЛТ-2, экспрессируемых проксимальными канальцами почек, сопровождается подавлением тубулогломерулярной обратной связи и компенсаторным стойким снижением внутриклубочкового давления [15].
В проксимальных канальцах имеется еще один транспортер, который отвечает за реабсорбцию натрия – натрийводородный транспортер 3 (НВТ3). Данный переносчик тесно связан с метаболизмом глюкозы [16]. Его функциональная активность изменяется при возникновении СД [17]. При экспериментальном СД продемонстрировано, что ингибиторы НГЛТ-2 могут функционально взаимодействовать с НВТ3, снижая активность последнего и увеличивая натрийурез [18]. При этом известно, что терапия инсулином сопровождается повышением активности НВТ3 и увеличением реабсорбции натрия. Это может приводить к развитию гиперволемии, увеличению содержания Na+ и Са2+ в стенках сосудов и способствовать вазоконстрикции [17]. Характер морфофункциональных почечных изменений при использовании дапаглифлозина в комбинации с препаратами, обладающими свойствами уменьшать натрийурез, прежде всего инсулином, до настоящего времени не исследован.
Целью данного исследования явилась оценка влияния терапии ингибитором НГЛТ-2 дапаглифлозином на метаболические параметры и морфофункциональные почечные изменения у крыс с экспериментальным СД, получающих терапию инсулином.
Материалы и методы исследования . Все экспериментальные животные содержались в условиях, соответствующих Постановлению «Санитарно-эпидемиологические требования к устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев)» (от 29.08.2014 г.).
В исследование было включено 30 самцов крыс стока Wistar в возрасте 10 месяцев, которых содержали в условиях 12/12-часового светотемнового режима при свободном доступе к питьевой воде и пище. Крысы были случайным образом разделены на 2 группы: контроль без СД (n=10) и крысы, у которых индуцировался экспериментальный СД (n=20). Моделирование СД производилось путем однократной внутрибрюшинной инъекции диабетогенного вещества стрептозотоцина (СТЗ) в дозе 65 мг/кг, растворенного в свежеприготовленном цитратном буфере (pH 5,5) [19]. Контрольные животные получали внутрибрюшинно инъекцию натриевого цитратного буфера. Цитратный буфер и раствор СТЗ готовился по ранее описанной методике [20] с использованием реагентов фирмы AppliChem (Испания).
Для отбора крыс в опыт производилась оценка уровня гликемии через 10 дней после инъекции СТЗ. Критерием СТЗ-индуцированного СД был уровень гликемии ≥ 7 ммоль/л, оцененной в плазме крови глюкометром Contour TS Bayer (Германия) из хвостовой вены после не менее чем 10 часов голода.
Крысы с подтверждённым СД были разделены на 2 подгруппы:
-
1) диабетический контроль – 6 животных со СТЗ-индуцированным СД, получавшие в течение последующих 4 недель инсулин НПХ (Eli Lilly, США) в дозе 0,2 единицы/кг подкожно (группа СД инсулин);
-
2) группа СД инсулин+дапаглифлозин – 14 крыс с экспериментальным СД, получавшие в течении 4 недель дополнительно к инсулину НПХ (0,2 единицы/кг) дапаглифло-зин (Astra Zeneca, Великобритания), растворенный в воде в питьевой воде в дозе 0,1 мг/кг/сутки.
По окончании 4 недель крысы выводились из эксперимента. Перед этим животные на 3 часа помещались в метаболические камеры для сбора мочи, определялся объём выделившейся мочи. Концентрацию альбумина определяли на анализаторе HemoCue Albumin 201 (Швеция) фотометрическим методом, рассчитывалась экскреция альбумина за 24 часа. В последующем крысы выводились из эксперимента, ткань почки забиралась для морфологической оценки.
Для светооптической микроскопии кусочки паренхимы почки на сутки фиксировали в нейтральном 4% формалине, проводили в спиртах возрастающей крепости и заливали в парафин. С использованием микроскопа фирмы LEICA DM 750 (Германия) выполнялась светооптическая микроскопия серийных полутонких парафиновых срезов, окрашенных гематоксилин-эозином. Полуколичественным методом рассчитывался индекс гломерулосклероза по методике, предложенной Bilous R.W. et al. [21]. Для каждой экспериментальной группы были рассчитаны средние значения индексов, полученные для каждой крысы в группе. Отношение области мезангия к общей площади клубочков использовали для определения степени тяжести гломерулосклероза, результат оценивали в произвольных единицах. В каждом срезе оценивали 25 клубочков с последующим подсчетом степени гломерулосклероза и площади экспансии мезангия (в %).
Статистический анализ данных производили с использованием пакета статистических программ STATISTICA 10 (StatSoft Inc., США). Результаты представлены при нормальном распределении в виде среднего арифметического±стандартного отклонения (М±SD), при асимметричном – в виде медианы и интерквартильного размаха (25 квартиль – 75 квартиль). При сравнении нескольких выборок использовался непараметрический критерий Краскелла – Уоллеса, при сравнении 2-х групп между собой – критерий Манна – Уитни. Нулевую статистическую гипотезу об отсутствии различий отвергали при p <0,05.
Результаты .
Метаболические параметры. В конце эксперимента в группе крыс, получавших дапаглифлозин и инсулин, наблюдалось снижение гликемии по сравнению с крысами, получавшими только инсулин – 8,6 ммоль/л (5,6 – 13,9) и 10,2 ммоль/л (7,8 – 16,4), соответственно (p=0,001). В контрольной группе без СД средний уровень гликемии составил 4,5 ммоль/л (4,1 – 5,6), р<0,01 при сравнении с группами крыс с СД. В начале исследования средняя масса тела составила: в группе контроля без СД – 324,7 г., в группе СД инсулин – 330,6 г., а в группе СД инсулин+дапаглифлозин – 311,0 г. (р=0,25 при сравнении одновременно 3 групп). Масса тела в обеих группах крыс с СД снижалась на протяжении 4 недель, в отличие от контрольной группы крыс без СД. В группе СД инсулин и дапаглифлозин отмечалось более выраженное снижение массы тела в конце эксперимента (-52,0 г (-43,0 – (-67,0)) по сравнению как с группой монотерапии инсулином (-36,0 (-29,0 – (-43,0), р=0,025), так и с крысами без СД, у которых наблюдалось увеличение массы тела к концу эксперимента на 21,0 г (19,0 – 23,0), р=0,001 (Рис. 1).
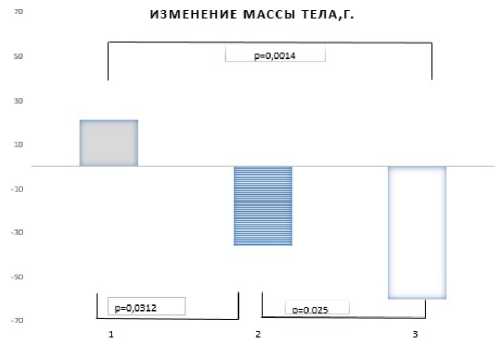
Рисунок 1. Изменение массы тела в исследуемых группах крыс за 4 недели эксперимента (1 – группа контроля без СД, 2 – группа СД инсулин, 3 – группа СД инсулин+дапаглифлозин)
В группе крыс с СД, получавших лечение инсулином и дапаглифлозином, cуточный диурез составил 78,1 мл (74,5 – 81,7) и был значимо выше как по сравнению с контрольными животными (18.4 (15,9-22,3), р=0,009), так и при сравнении с группой СД инсулин – 29,4 мл (27,7 – 31,1), р=0,006. Также получены значимые различия по концентрации глюкозы в суточной моче между группой крыс, которые получали дапаглифлозин в комбинации с инсулином (96,4 (96,2 – 102,8) ммоль/л), и группой монотерапии инсулином –4,35 ммоль/л (3,65 – 5,05), р=0,002.
Показатели альбуминурии по окончании эксперимента. При анализе показателей альбуминурии в исследуемых группах выявлены значимые различия между сравниваемыми группами крыс с СД. Так, в группе, получавшей только инсулин, величина альбуминурии составила 91,8 мг/24ч (74,1 – 108,5), в то время как в группе СД инсулин+дапаглифлозин альбуминурия была почти в 2 раза ниже – 50,95 мг/24ч (41,3 – 60,2), р=0,012 (Рис. 2).
Гистологическая характеристика образцов тканей почек крыс . Срезы почек, окрашенных гематоксилин – эозином, в контрольной группе без СД имели классическую структуру почечной ткани (Рис. 3).
АЛЬБУМИН СУТОЧНОЙ МОЧИ.МГ/24Ч
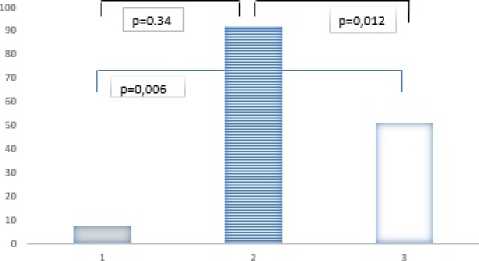
Рисунок 2. Величина суточной экскреции альбумина с мочой у крыс в зависимости от получаемой терапии (1 – группа контроля без СД, 2 – группа СД инсулин, 3 – группа СД инсулин+дапаглифлозин)
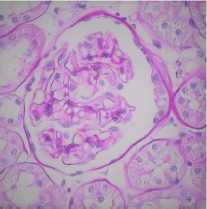
Рисунок 3. Световая микроскопия почек крыс контрольной группы без СД (окраска гематоксилин-эозин, увеличение x600). Видно нормальное строение клубочков без признаков гломерулосклероза и клеток канальцев с отсутствием признаков гипертрофии
В свою очередь, в гистологических препаратах почек крыс группы СД инсулин выявлялся выраженный кортикальный гломерулосклероз, пролиферация мезангиальных элементов и частичное сужение пространств Боумена (Рис. 4). При этом в большей части проксимальных извитых канальцев наблюдалась их гипертрофия, вакуолизация и пикнотические ядра (Рис. 5).
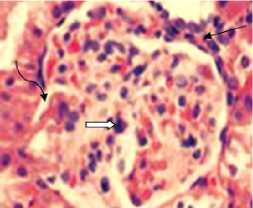
Рисунок 4. Морфологические изменения клубочков почек при световой микроскопии в группе крыс с СД, получавших монотерапию инсулином (гематоксилин – эозин, увеличение x600). Прямой черной линией указан кортикальный гломерулосклероз. Изогнутая черная линия указывает на сужение пространства Боумена. Фигурной стрелкой указана пролиферация клеток мезангия
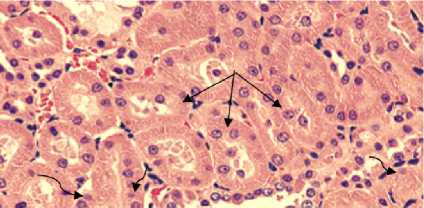
Рисунок 5. Морфологические изменения канальцев при световой микроскопии в группе крыс, получавших монотерапию инсулином (гематоксилин – эозин, x400). Прямые черные линии указывают на гипертрофию клеток почечных канальцев. Изогнутые черные линии указывает на пикнотические ядра
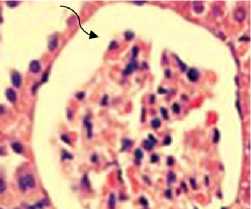
Рисунок 6. Морфологические изменения клубочка при световой микроскопии в группе крыс, получавших терапию дапаглифлозином и инсулином (гематоксилин – эозин, увеличение х600). Прямой черной линией указана повышенная клеточность. Изогнутая черная линия указывает на нормальное пространство Боумена
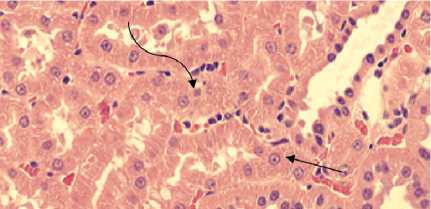
Рисунок 7. Морфологические изменения канальцев при световой микроскопии в группе крыс, получавших терапию дапаглифлозином и инсулином (гематоксилин – эозин, x400). Прямой черной линией указана гипертрофия отдельной клетки почечных канальцев. Изогнутая черная линия указывает на пикнотическое ядро
Крысы, получавшие инсулин и дапаглифлозин, имели меньшую выраженность дегенеративных процессов в почках по сравнению с группой крыс на инсулине (Рис. 6). Многие почечные клубочки характеризовались гиперклеточно-стью с нормальными пространствами Боумена, в то время как в проксимальных извитых канальцах наблюдалась слабо выраженная вакуолизация и отдельные пикнотиче-ские ядра и меньшая гипертрофия канальцевого эпителия (Рис. 7).
Морфометрический анализ выраженности гломерулосклероза продемонстрировал значимые различия в индексе гломерулосклероза между группой крыс СД инсулин+дапаглифлозин и группой крыс с СД, получавших монотерапию инсулином – 0,6 произвольных единиц (0,5 – 0,7) и 1,1 произвольных единиц (1,0 – 1,2), соответственно (р=0,005) (Рисунок 8). Кроме того, выявлено значимое различие в площади мезангия между группой терапии дапаглифлозином и контрольной группой крыс с СД – 28,0% (23,0 – 32,0) и 37,0% (33,0 – 41,0), соответственно (р=0,008) (Рисунок 9). При этом обе группы значимо отличались от крыс без СД как по степени гломерулосклероза, так и по площади клубочка, приходящейся на мезангиальный компонент (р<0,001) (Рис. 8 и Рис. 9, соответственно).
Обсуждение результатов . Ингибиторы НГЛТ-2 индуцируют экскрецию глюкозы с мочой пропорционально количеству глюкозы, фильтрующейся через почки, уровень которой, в свою очередь, зависит от скорости клубочковой фильтрации и концентрации глюкозы в плазме [22]. В ходе проведённого нами исследования показано улучшение гликемического контроля при добавлении дапаглифлози-на к инсулину у крыс со стрептозотоцин-индуцированным СД (модель СД 1 типа). Эти данные подтверждают известные гликемические эффекты дапаглифлозина при СД 2 типа [3-5, 8-9] и согласуются с исследованием другого ингибитора НГЛТ-2 ипраглифлозина у крыс с экспериментальным СД 1 типа [23].
Уменьшение канальцевой гипертрофии и выраженно-
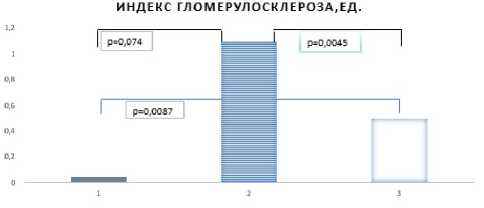
Рисунок 8. Индекс гломерулосклероза в исследуемых группах (1 – группа контроля без СД, 2 – группа СД инсулин, 3 – группа СД инсулин+ дапаглифлозина)
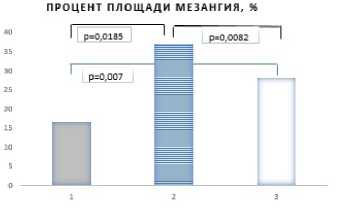
Рисунок 9. Процент площади мезангия в исследуемых группах (1 – группа контроля без СД, 2 – группа СД инсулин, 3 – группа СД инсулин+дапаглифлозин)
сти альбуминурии в группе крыс с СД, получавших дапа-глифлозин, по сравнению с крысами контрольной группы с СД свидетельствует о том, что добавление дапаглифлозина способствует ослаблению замедлению развития морфофункциональных проявлений ДН. Полученные данные соотносятся с результатами экспериментальной работы по оценке влияния эмпаглифлозина на морфофункциональные параметры почек мышей [24]. Однако в ходе нашего исследования, в отличие от исследования Vallon V. et al., ингибитор НГЛТ-2 добавлялся к инсулинотерапии, способной уменьшать натрийурез и, тем самым, потенциально ослаблять нефропротективные возможности препарата [25].
Одним из вероятных механизмов реализации, обнаруженных у дапаглифлозина нефропротективных свойств может являться прямое улучшение гликемического контроля. Известно, что гипергликемия является одним из ведущих факторов развития ДН [28]. При этом редукция тубулотоксичности глюкозы, которая является мощным стимулятором экспрессии таких ростовых факторов, как трансформирующий фактор роста бета (TGF-бета), сосудистый эндотелиальный фактор роста (VEGF) и инсулиноподобный фактор роста (IGF), способствует замедлению пролиферативных процессов в клубочках [29, 30]. Тем не менее, нельзя исключить плейотропное воздействие дапаглифлозина на почки, в частности, за счёт устранения гиперфильтрации. В нашем исследовании не производилась оценка величин клубочковой фильтрации. Тем не менее, известна способность препарата устранять клубочковую гиперфильтрацию, являющуюся пусковым механизмом развития ДН [13]. Причиной клубочковой гиперфильтрации является увеличение реабсорбции натрия в проксимальных канальцах, связанное с их гипертрофией и дополненное котранспортом глюкозы [26]. Этот процесс приводит к снижению дистальной доставки натрия и последующей активации тубулогломе-рулярной обратной связи и пропорционально большему снижению сосудистого сопротивления афферентной артериолы по сравнению с эфферентной. Блокада НГЛТ-2 снижает проксимальную реабсорбцию натрия, что, как полагают, приводит к увеличению дистальной доставки натрия к плотному пятну, подавлению тубулогломерулярной обрат- ной связи и компенсаторному стойкому снижению внутри-клубочкового давления [27].
В ходе клинических исследований дапаглифлозин продемонстрировал способность умеренно снижать уровень АД [31, 32]. Нормализация АД является важным фактором профилактики и замедления развития ДН [33]. По данным нашего исследования, показано увеличение суточного диуреза при добавлении в терапию дапаглифлозина. Это подтверждает его известное диуретическое свойство, которое, в свою очередь, может приводить к снижению АД [34]. Однако прямое измерение уровня АД и оценка вну-триклубочковой гемодинамики в нашем исследовании не проводились.
Таким образом, полученные результаты свидетельствуют о том, что добавление дапаглифлозина к инсулиноте-рапии крысам с экспериментальным СД 1 типа уменьшает экспансию гломерулярного матрикса, степень выраженности гломерулосклероза и уровень экскреции альбумина с мочой по сравнению с крысами контрольной группы с СД. Данный нефропротективный эффект может являться следствием как улучшения гликемического контроля, так и изменения почечной гемодинамики.
Список литературы Оценка влияния ингибитора натрий-глюкозного котранспортера 2 типа в сочетании с инсулином на метаболические параметры и морфофункциональные изменения почек крыс с экспериментальным сахарным диабетом
- International Diabetes Federation. IDF Diabetes Atlas, 6th ed. Brussels: International Diabetes Federation, 2013.
- Сунцов Ю.И., Болотская Л.Л., Маслова О.В., Казаков И.В. Эпидемиология сахарного диабета и прогноз его распространенности в Российской Федерации//Сахарный диабет. 2011. №1. С. 15-18
- Алгоритмы специализированной медицинской помощи больным сахарным диабетом, 8-й выпуск/под ред. И.И. Дедова //Сахарный диабет. 2017. Т. 20, № 1S. С. 1-121
- Bays H. Sodium glucose co-transporter type 2 (SGLT2) inhibitors: targeting the kidney to improve glycemic control in diabetes mellitus//Diabetes Ther. 2013;4(2):195-220.
- Kalra S. Sodium glucose co-transporter-2 (SGLT2) inhibitors: a review of their basic and clinical pharmacology//Diabetes Ther. 2014;5(2):355-66.
- Sha S, Devineni D, Ghosh A, et al. Canagliflozin, a novel inhibitor of sodium glucose co-transporter 2, dose dependently reduces calculated renal threshold for glucose excretion and increases urinary glucose excretion in healthy subjects//Diabetes Obes Metab. 2011;13(7):669-72.
- Kalra S., Singh V., Nagrale D. Sodium-Glucose Cotransporter-2 Inhibition and the Glomerulus: A Review//Adv Ther, 2016;33:1502-1518.
- Zhang M, Zhang L, Wu B, Song H, An Z, Li S. Dapagliflozin treatment for type 2 diabetes: a systematic review and meta-analysis of randomized controlled trials.//Diabetes Metab Res Rev. 2014 Mar;30(3):204-21 DOI: 10.1002/dmrr.2479
- Avogaro A, Giaccari A, Fioretto P, Genovese S, Purrello F, Giorgino F, Del Prato A consensus statement for the clinical use of the renal sodium-glucose co-transporter-2 inhibitor dapagliflozin in patients with type 2 diabetes mellitus.//S. Expert Rev Clin Pharmacol. 2017 Jul;10(7):763-772 DOI: 10.1080/17512433.2017.1322507
- Satirapoj B Sodium-Glucose Cotransporter 2 Inhibitors with Renoprotective Effects.//Kidney Dis (Basel). 2017 Jul;3(1):24-32 DOI: 10.1159/000471765
- Lovshin J.A., Gilbert R.E. Are SGLT2 inhibitors reasonable antihypertensive drugs and renoprotective?//Curr Hypertens Rep. 2015 Jun;17(6):551 DOI: 10.1007/s11906-015-0551-3
- Jaikumkao K., Pongchaidecha A., Chatsudthipong V., Chattipakorn S.C., Chattipakorn N., Lungkaphin A. The roles of sodium-glucose cotransporter 2 inhibitors in preventing kidney injury in diabetes.//Biomed Pharmacother. 2017 Oct; 94:176-187. doi: 10.1016/j.biopha.2017.07.095.
- Tonneijck L., Muskiet M.H., Smits M.M., van Bommel E.J., Heerspink H.J., van Raalte D.H., Joles J.A. Glomerular Hyperfiltration in Diabetes: Mechanisms, Clinical Significance, and Treatment.//J Am Soc Nephrol. 2017 Apr;28(4):1023-1039 DOI: 10.1681/ASN.2016060666
- Zanoli L, Granata A, Lentini P, et al. Sodium-glucose linked transporter-2 inhibitors in chronic kidney disease.//Sci World J. 2015;2015:6 DOI: 10.1155/2015/317507
- De Nicola L, Gabbai F.B., Liberti M.E., Sagliocca A., Conte G., Minutolo R. Sodium/glucose cotransporter 2 inhibitors and prevention of diabetic nephropathy: targeting the renal tubule in diabetes.//Am J Kidney Dis. 2014;64(1):16-24.
- Dominguez Rieg J.A., de la Mora Chavez S., Rieg T. Novel developments in differentiating the role of renal and intestinal sodium hydrogen exchanger 3.//Am J Physiol Regul Integr Comp Physiol. 2016 Dec 1;311(6):R1186-R1191 DOI: 10.1152/ajpregu.00372.2016
- Tiwari S, Riazi S, Ecelbarger CA. Insulin's impact on renal sodium transport and blood pressure in health, obesity, and diabetes.//Am J Physiol Renal Physiol. 2007 Oct;293(4)
- Panchapakesan U, Pegg K, Gross S, et al. Effects of SGLT2 inhibition in human kidney proximal tubular cells-renoprotection in diabetic nephropathy?//PLoS One. 2013;8(2)
- Tesch G.H. Rodent models of streptozotocin-induced diabetic nephropathy//Nephrology (Carlton). 2007. Vol. 12(3). P. 261-266.
- Байрашева В.К. Моделирование сахарного диабета и диабетической нефропатии в эксперименте//Современные проблемы науки и образования. 2015;4: 460(11)
- Bilous RW, Mauer SM, Sutherland DE, Steffes MW (1989). Mean glomerular volume and rate of development of diabetic nephropathy//Diabetes 38: 1142-1147.
- Komoroski B, Vachharajani N, Boulton D et al. Dapagliflozin, a novel SGLT2 inhibitor, induces dose-dependent glucosuria in healthy subjects//Clin Pharmacol Ther 2009; 85: 520-526.
- Tahara A, Kurosaki E, Yokono M, et al. Effects of sodium-glucose cotransporter 2 selective inhibitor ipragliflozin on hyperglycaemia, oxidative stress, inflammation and liver injury in streptozotocin-induced type 1 diabetic rats//J Pharm Pharmacol 2014; 66:975-87
- Vallon, V., Gerasimova, M., Rose, M., Masuda, T., Satriano, J., Mayoux, E. et al. (2014) SGLT2 inhibitor empagliflozin reduces renal growth and albuminuria in proportion to hyperglycemia and prevents glomerular hyperfiltration in diabetic akita mice//Am J Physiol Renal Physiol 306: F194-204
- Fuster D.G., BobulescuI A., ZhangJ, Wade J., Moe O.W. Characterization of the regulation of renal Na+/H+ exchanger NHE3 by insulin//Am J Physiol Renal Physiol 292: F577-F585, 2007
- Melsom T., Mathisen U.D., Ingebretsen O.C., et al. Impaired fasting glucose is associated with renal hyperfiltration in the general population//Diabetes Care. 2011;34(7):1546-51
- Malatiali S., Francis I., Barac-Nieto M. Phlorizin prevents glomerular hyperfiltration but not hypertrophy in diabetic rats//Exp Diabetes Res 2008: 305403
- Kanwar Y.S., Sun L., Xie P., Liu F.Y., Chen S. A glimpse of various pathogenetic mechanisms of diabetic nephropathy//Annu Rev Pathol 2011; 6(1): 395-423
- Singh A. et al. High glucose causes dysfunction of the human glomerular endothelial glycocalyx//Am. J. Physiol. Renal Physiol. 2011 300, F40-F48.
- Raz I. et al. Role of insulin and the IGF system in renal hypertrophy in diabetic Psammomys obesus (sand rat)//Nephrol. Dial Transplant. 18, 1293-1298 (2003).
- Brown RE, Gupta N, Aronson R. Effect of Dapagliflozin on Glycemic Control, Weight, and Blood Pressure in Patients with Type 2 Diabetes Attending a Specialist Endocrinology Practice in Canada: A Retrospective Cohort Analysis//Diabetes Technol Ther. 2017 Aug 22. , DOI: 10.1089/dia.2017.0134
- Wilding J, Bailey C, Rigney U, Blak B, Kok M, Emmas C. Dapagliflozin therapy for type 2 diabetes in primary care: Changes in HbA1c, weight and blood pressure over 2 years follow-up//Prim Care Diabetes. 2017 Oct;11(5):437-444. 2017.04.004 DOI: 10.1016/j.pcd
- Giunti S, Barit D, Cooper ME. Mechanisms of diabetic nephropathy role of Hypertension//Hypertension. 2006;48(4):519-26.
- Kawasoe S, Maruguchi Y, Kajiya S, Uenomachi H, Miyata M, Kawasoe M, Kubozono T, Ohishi M. Mechanism of the blood pressure-lowering effect of sodium-glucose cotransporter 2 inhibitors in obese patients with type 2 diabetes//BMC Pharmacol Toxicol. 2017 Apr 10;18(1):23 DOI: 10.1186/s40360-017-0125-x


