Оценка влияния экспрессии хемокиновых рецепторов CXCR4, ССR10 в опухолевой ткани на показатель безрецидивной выживаемости больных раком ободочной кишки
Автор: Орлова Р.В., Иванова А.К., Раскин Г.А., Кутукова С.И., Андросова А.В.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 1 т.9, 2019 года.
Бесплатный доступ
Учитывая рост заболеваемости раком ободочной кишки, поиск новых вариантов лечения остается высоко актуальным для данной группы пациентов. Определение хемокиновых рецепторов в опухолевой ткани может стать дополнительным фактором прогноза и использоваться при планировании адъювантной терапии.
Рак ободочной кишки, хемокиновые рецепторы, прогностический фактор, адъювантное лечение
Короткий адрес: https://sciup.org/140243809
IDR: 140243809
Текст научной статьи Оценка влияния экспрессии хемокиновых рецепторов CXCR4, ССR10 в опухолевой ткани на показатель безрецидивной выживаемости больных раком ободочной кишки
Заболеваемость раком ободочной кишки, как в мире, так и в нашей стране, неуклонно растет (рис.1). За последние 20 лет рак ободочной кишки переместился в структуре онкологической заболеваемости населения Российской Федерации с шестого на второе место [1,2].
По данным Каприна А. Д. и соавт., в 2016 году из всех впервые выявленных случаев рака ободочной кишки, удельный вес больных с I–II стадиями составил 46,3%. Из них радикальному лечению подлежало 63,6% больных; из них 68,7% больным выполнено хирургическое лечение и 31,3% проведено комплексное лечение, которое включало в себя операцию и адъювантную химиотерапию [1].
Рисунок 1. Распространенность злокачественных новообразований ободочной кишки в России в 2006– 2016 годах. (Каприн А. Д и соавт., 2016 г).
В известном исследовании MOSAIC, 64% больных (n=575) со II стадией заболевания имели высокий риск рецидива, и 3летняя безрецидивная выживаемость в группе адъювантной химиотерапии по схеме FOLFOX4 составила 85,4%, а в группе адъювантной химиотерапии по схеме LV+5FU — 80,4%. В исследовательском анализе вероятность 6-летней общей выживаемости у пациентов со II стадией заболевания, относящихся к группе высокого риска, составила 85,0% и 83,3% в группах FOLFOX4 и LV5FU2, соответственно (ОР 0,91; 95% ДИ 0,61–1,36; p = 0,648, [3]). Отдельное внимание заслуживают пациенты с микроса-теллитной нестабильностью (MSI-H): по результатам оценки 17 исследований у пациентов с MSI-H при II стадии 5-летняя общая выживаемость составила 90% после только хирургического лечения без проведения адъювантной химиотерапии [4]. В большинстве случаев показатели выживаемости зависят не только от уровня проводимого лечения, но и от биологических особенностей опухоли. Так, известными прогностическими факторами, определяющими раннее метастазирование у больных после радикального лечения, являются: глубина опухолевой инвазии (параметр Т), статус регионарных лимфоузлов (параметр N), морфологическая дифференцировка опухоли, лимфоваскулярная или периневральная инвазия, позитивные края резекции, перфорация опухоли, повышение уровня раково-эмбрионального антигена (РЭА) [5].
Тем не менее, до сих пор остается открытым вопрос: почему у пациентов с благоприятными факторами прогноза (ранняя стадия, высокая дифференцировка опухоли) через 6–12 месяцев могут возникнуть отдаленные метастазы и, наоборот, пациенты с неблагоприятными факторами прогноза (местнораспространенный процесс, повышенный уровень РЭА после хирургического лечения, глубокая инвазия — T4) длительное время могут находиться в ремиссии?
Метастазирование является сложным, многоступенчатым биологическим процессом, за каждый этап которого отвечают определенные агенты. В настоящее время далеко не все факторы, отвечающие за процесс метастазирования, известны и хорошо изучены. К одним из таких факторов могут быть отнесены цитокины. Так, из семейства цитокинов самым первым был исследован хемокиновый рецептор 4 (CXCR4), и определена его связь с появлением метастазов в легких при раке молочной железы [6].
Хемокины были впервые идентифицированы и получены в 1977 году, и первым — CXC-хемокин 4. В настоящее время обнаружено около 50 хемокинов, относящихся к 4 подсемействам, и идентифицированы 20 хемокиновых рецепторов [7].
Как известно, хемокины индуцируют хемотаксис многих типов клеток и являются необходимыми компонентами оптимальных межклеточных взаимодействий в индукции иммунологического ответа. В настоящее время хемокины представлены в основном четырьмя большими семействами: СХС (а), СС (в), С (у) и СХ3С (8). Хемокины каждого из них взаимодействуют со своими поверхностными рецепторами: соответственно CXCR, CCR, CR, CX3CR [8].
Известно, что некоторые опухолевые клетки экспрессируют хемокиновые рецепторы, что во многих случаях способствует усилению роста опухоли. К настоящему времени наибольшее количество работ посвящено изучению хемокинов семейства СХС, к которому относятся IL-8, IP-10, Mig, SDF-lcc, GROa, CXCL10, CXCL12 и др. [8,9].
Исследование по CXCR4, который экспрессируется многими опухолями, показало, что, как правило, он ассоциируется с резким усилением ангиогенеза, развитием метастазов и более агрессивным течением опухолевого процесса; очень часто этот рецептор обнаруживается в метастатических клетках [10,11].
Гипотеза о том, что хемокиновые рецепторы участвуют в процессе метастазирования в строго определенные органы, подразумевает, что в организме существуют очаги, выделяющие хемокины в системный кровоток. Наиболее вероятно, что клетки, синтезирующие данные цитокины, находятся в участках наиболее частого метастазирования опухолей. Gassmann et al. продемонстрировали путем использования прижизненной им-мунофлуоресцентной микроскопии, что лиганд CXCL12 (рецептор CXCR4) секретируется эндотелиальными и Купферовскими клетками печени.
Muller et al. предположили, что регионарное метастазирование опухолевых клеток во многом схоже с процессами перемещения дендритных клеток в лимфатические узлы. Было показано, что опухолевые клетки при раке молочной железы и меланоме экспрессируют рецепторы CXCR4 и ССR7, соответственно, и лигандами для них являются CXCL12/SDF-1 (alpha) и CCL21/6Ckine. Эти лиганды в большом количестве секретируются в лимфатических узлах, печени и красном костном мозге — в местах наиболее часто выявляемых метастазов при данных типах опухолей [12]. Таким образом, была показана роль экспрессии данных рецепторов в распространении метастазов при меланоме и раке молочной железы.
Zeelenberg блокировал работу рецептора CXCR4 путем трансфекции внутрь клеток рака толстой кишки линии гена SDF-1, сцепленного с геном KDEL. SDF-KDEL задерживается в эндоплазматическом ретикулуме за счет KDEL-рецептора, и, связывая CXCR4 рецепторы, предотвращает их выход на поверхность клетки. При культивировании данных клеток in vivo было отмечено значительное снижение частоты метастазирования в легкие и печень и показано, что нарушение процессов метастазирования происходило не только из-за нарушения процессов проникновения в ткани, доказанное ранее, но и из-за нарушения функционирования микрометастазов [13].
Sehgal et al. обнаружили, что рецептор СXCR4 экспрессируется в 57% случаев глиом головного мозга. Введение в культивируемые клетки анти-CXCR4 последовательности нуклеотидов, приводило к прекращению экспрессии данного рецептора. Клетки, подвергшиеся трансфекции, приостанавливали процессы деления и пролиферации [14]. Таким образом, было показано, что хемокиновые рецепторы также участвуют в процессах деления и пролиферации клеток глиом.
-
D. Uchida et al. путем подсчета клеток плоскоклеточного рака головы и шеи методами проточной цитометрии обнаружили, что повышение количества клеток, экспрессирующих рецептор CXCR4, увеличивает частоту метастазирования в регионарные лимфатические узлы [15].
Изучение зависимости метастазирования рака ободочной кишки от уровня экспрессии хемокиновых рецепторов в опухолевой ткани является действительно высоко актуальным.
Цель исследования
Определить зависимость показателей выживаемости у пациентов раком ободочной кишки II стадией (T4N0M0) от экспрессии хемокиновых рецепторов (CXCR4, ССR10) в опухолевой ткани.
Материалы и методы
В ретроспективное одноцентровое исследование было включено 53 больных раком ободочной кишки, которые проходили лечение в СПб ГБУЗ ГКОД в 2011 году и находились под нашим наблюдением в течение 5 лет. Все пациенты подвергались радикальному хирургическому лечению и имели одинаковую стадию процесса — рT4N0M0; адъювантная химиотерапия им не проводилась. Данная группа была схожа по объему хирургического вмешательства (на первичной опухоли и путях регионарного метастазирования), морфологическому исследованию и режиму последующего наблюдения.
Пациенты находились под динамическим контролем в течении 5 лет после хирургического вмешательства, и им выполнялись диагностические процедуры согласно стандартам наблюдения пациентов с колоректальным раком. Режим наблюдения пациентов, включенных в данное исследование, был следующим: 1) Физикальный осмотр каждые 3–6 месяцев в течении 2 лет, далее каждые 6 месяцев до 5 лет.
-
2) Определение РЭА в крови больного каждые 3–6 месяцев в течение 2 лет, далее каждые 6 месяцев до 5 лет.
-
3) КТ органов грудной клетки, брюшной полости и малого таза каждые 6–12 месяцев до 5 лет.
-
4) Фиброколоноскопия 1 раз в год.
Данный режим наблюдения выполнили 100% пациентов, включенных в исследование.
Распределение по гендерному и возрастному признакам было следующим: 26 мужчин и 27 женщин в возрасте от 28 до 76 лет, средний возраст составил 59.41±8.62 год, медиана возраста — 61 год.
Как видно из таблицы 1, первичные опухоли располагались в различных отделах ободочной кишки и имели различную степень дифференцировки (G1, G2). Всем пациентам было выполнено хирургическое лечение и определен риск раннего метастазиро-
Таблица 1. Характеристика больных раком ободочной кишки, подвергшихся радикальному хирургическому лечению, рT4N0M0 (n=53)
Медиана наблюдения за больными составила 60 месяцев. С момента наблюдения в различные сроки были диагностированы отдаленные метастазы, в связи с чем все пациенты были разделены на 2 группы.
Больные, у которых в течение 5 лет появились отдаленные метастазы после хирургического лечения, составили 1 группу (31 пациент), а во 2 группу вошли пациенты, которые наблюдались в течение 5 лет после проведенной операции без прогрессирования опухолевого процесса (22 пациента).
Гистологические препараты и блоки всех пациентов были исследованы на экспрессию хемокиновых рецепторов CXCR4, ССR10 иммуногистохимическим методом. Материал поступал в лабораторию в виде фрагментов опухоли, залитых в парафин, и гистологических препаратов. Первым этапом выполнялся пересмотр гистологических препаратов. При микроскопическом исследовании выбирался блок с опухолью и нормальной слизистой. С данного блока нарезались срезы толщиной 4 мкм, которые помещали на стёкла с поли-L-лизиновым покрытием. Срезы подсушивались, депарафинировались и подвергались демаскировке антигенов при помощи цитратного буфера в условиях водяной бани, t = 95oC, 30 минут, после чего они остывали при комнатной температуре и промывались трис-буфером с твином. Каждый срез обводился парафиновым карандашом, после чего осуществлялось ингибирование эндогенной пероксидазы 3% перекисью водорода в течение 20 минут. Затем на каждый срез наносилось первое антитело — анти-CCR10, экспозиция длилась 30 минут на термостолике в условиях водяной бани при температуре 30oC. Антитело к CXCR4 инкубировалась в течение ночи при температуре +2 — +8oС (в условиях холодильной камеры), демаскировка антигенов на данном срезе не проводилась, в остальном протокол иммуногистохимического исследования
Таблица 2. Уровень экспрессии хемокиновых рецепторов)
Для выявления корреляционных взаимосвязей использовался критерий корреляции Спирмена, для сравнительных характеристик использовался критерий Манн-Уитни, для оценки общей выживаемости использовался метод Каплана-Майера, для оценки влияния прогностических факторов на показатели выживаемости использовалась регрессионная модель Кокса. Все подсчеты производились с помощью программы Statistica (версия 10.0), MedCalc (версия 18.10.2).
Результаты
В таблице 3 наглядно представлены уровни хемокиновых рецепторов в исследуемых группах. В 1 группе большинство пациентов имело уровень хемокиновых рецепторов 30% и выше, тогда как в 2 группе превалировал низкий уровень экспрессии хемокинового рецептора CXCR4 и, что важно отметить, у 9 больных уровень был негативным (0%).
При динамическом наблюдении у I группы пациентов было выявлено прогрессирование опухолевого процесса в промежутке от 1 до 44 месяцев в виде метастазов в различные органы. Локализация метастазов, их число, а также количество пораженных органов представлены в таблице 4 (см. след. стр.).
Как видно из таблиц, у наибольшего количества пациентов отмечалось поражение печени, и преимущественное большинство больных имели множественные метастазы в различные органы.
Медиана безрецидивного периода составила 9,5 месяцев (± 0,47).
При исследовании CXCR4 получены следующие результаты: среднее значение данного показателя составило 50,00% ± 29,01%
Таблица 3. Уровень экспрессии хемокинового рецептора
CXCR4 в исследуемых группах
|
1 группа (n=31) |
2 группа (n=22) |
р |
|
|
Низкий уровень |
5 (16.2%) |
16 (72.8%) |
< 0.001 |
|
Средний уровень |
17 (54.8%) |
2 (9%) |
< 0.001 |
|
Высокий уровень |
9 (29%) |
4 (18.2%) |
0.258 |
(95% ДИ от 39,36% до 60,64%) и варьировало в диапазоне от 0,00% до 95,00%. Медиана данного показателя — 50,00% (95% ДИ от 35,86% до 62,07%).
У всех пациентов данной группы экспрессия хемокинового рецептора CCR 10 оказалась равна 0.
Во 2 группе больных медиана безрецидивного периода не была достигнута: все пациенты пережили 60 месяцев наблюдения без рецидива заболевания.
При исследовании CXCR 4 получены следующие результаты: среднее значение данного показателя составило 27,73% ±7,58% (95% ДИ от 11,97% до 43,49%) и варьировало в диапазоне от 0,00 до 95,00%. Медиана данного показателя составила 15,00% (95% ДИ от 0,00% до 30,47%).
У всех пациентов данной группы экспрессия хемокинового рецептора CCR 10 была равна 0.
В таблице 7 указана взаимосвязь уровня экспрессии хемоки-нового рецептора CXCR4 и показателей безрецидивной выживаемости по группам и уровням экспрессии.
При сравнении двух групп по уровню экспрессии CXCR4 с использованием критерия Манна-Уитни мы обнаружили, что в 1 группе уровень экспрессии оказался достоверно выше, чем во 2 группе (U=201,50; Z= 2,535 р=0,0113) (рис. 1).
С целью оценки влияния уровня экспрессии CXCR4 на безре-цидивную выживаемость, нами была построена регрессионная модель Кокса, которая достоверно показала наличие этой зависимости, р=0.0157 (95% ДИ 1,0024–1,0226).
Медиана безрецидивного периода оказалась достоверно ниже в I группе пациентов, где выявлена высокая экспрессия хемокиновых рецепторов в опухолевой ткани, что дает нам возможность сделать вывод: чем выше экспрессия хемокиновых рецепторов, тем агрессивнее опухоль и хуже показатели без-рецидивной выживаемости.
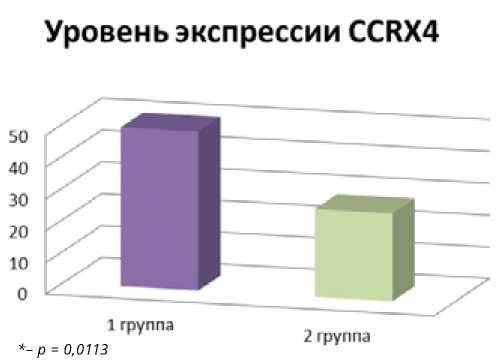
Рисунок 2. Сравнение уровня экспрессии CXCR4 в исследуемых группах.
Таблица 4. Локализация метастазов, их число, количество пораженных органов
|
Локализация метастазов |
Количество пациентов (n) |
|
• Печень |
22 |
|
• Легкие |
7 |
|
• Кости |
1 |
|
• Лимфоузлы брюшной полости и забрюшинного пространства |
7 |
|
• Местный рецидив |
6 |
|
• Другие локализации (брюшина, паховые лимфоузлы, яичники, большой и малый сальник, пупочная область, надключичные лимфоузлы, мягкие ткани брюшной стенки, надпочечники) |
10 |
|
Количество метастазов |
|
|
• 1 |
5 |
|
• более 1 |
25 |
|
• более 4 |
1 |
|
Количество пораженных органов |
|
|
• солитарные |
5 |
|
• множественные |
26 |
Обсуждение
Учитывая результаты нашего исследования, мы можем сделать вывод о том, что высокая экспрессия хемокинового рецептора CXCR4 в опухолевой ткани является неблагоприятным прогностическим фактором и может быть использована в качестве дополнительного аргумента при планировании адъювантной химиотерапии у больных раком ободочной кишки. Так, Yu X et al. в своей работе ассоциируют активацию пары CXCL12/CXCR4 с инвазией и отдаленным метастазированием у больных колоректальным раком [16]. Kim et al. путем анализа общей выживаемости больных раком толстой кишки достоверно доказал, что высокая экспрессия рецептора CXCR4 значительно уменьшает медиану выживаемости пациентов (27 против 10 месяцев, P = 0.036.). Для больных меланомой данная корреляция была недостоверна [17]. Экспрессии хемокинового рецептора ССR10 в опухолевой ткани этой популяции больных выявлено не было, его дальнейшее изучение нецелесообразно, в литературе не описано случаев обнаружения данного рецептора в опухоли ободочной кишки. Однако для однозначного определения значимости экспрессии хемокинового рецептора CXCR 4 у больных раком ободочной кишки необходимы крупные проспективные исследования.
Таблица 7. Зависимость экспрессии хемокинового рецептора CXCR4 и показателей безрецидивной выживаемости
|
I группа |
II группа |
|||||
|
Уровень экспрессии CXCR4 |
низкий уровень |
средний уровень |
высокий уровень |
низкий уровень |
средний уровень |
высокий уровень |
|
Медиана безрецидив-ной выживаемости |
13 месяцев |
10,5 месяцев |
5 месяцев |
Не достигнуто (более 60 месяцев) |
||
Список литературы Оценка влияния экспрессии хемокиновых рецепторов CXCR4, ССR10 в опухолевой ткани на показатель безрецидивной выживаемости больных раком ободочной кишки
- Каприн А. Д., Старинский В. В., Петрова Г. В. Состояние онкологической помощи населению России в 2016 году, Москва 2017 (стр.157).
- Мерабишвили В. М. Злокачественные новообразования в северо-западном федеральном округе России (заболеваемость, смертность, контингенты, выживаемость больных), выпуск третий под ред. Беляева А. М, СПб,2017, стр.22-32.
- Journal of Clinical Oncology,27,19, 01.07.2009.
- D. Sargent ASCO 2014,#3507
- Практические рекомендации по лечению злокачественных опухолей Российского общества клинической онкологии, версия 2017 (стр.261-264).
- Expression pattern of CXC chemokine receptor-4 is correlated with lymph node metastasis in human invasive ductal carcinoma. Masahiro Kato, Joji Kitayama, Shinsuke Kazama, Hirokazu Nagawa; Breast Cancer Research, October,2003.
- Чердынцева Н. В., Гервас П. А., Литвяков Н. В. с соавт. Хемокины и прогрессия злокачественных новообразований. Медицинская Иммунология.-2006. -Т. 8, -№ 2-3. -С.355-356.
- А. С. Симбирцев Цитокины: классификация и биологические функции//Цитокины и воспаление. 2004. Том 3 № 2. -С.16-22.
- Strieter R. M., Polverini P. J., Kunkel S. L. et al. The functional role of the ELR motif in CXC chemokine-mediated angiogenesis. J Biol Chem. 1995. 270 (45): 27348-57.
- Rivera CG, Bader JS, Popel AS. Angiogenesis-associated crosstalk between collagens, CXC chemokines, and thrombospondin domain-containing proteins. Ann Biomed Eng. 2011; 39 (8):2213-22.
- Бережная Н. М., Чехун В. Ф. Иммунология злокачественного роста -2005
- Muller A, Homey B, Soto H, et al. Involvement of chemokine receptors in breast cancer metastasis. Nature. 2001; 410:50-56.
- Zeelenberg IS, Ruuls-Van Stalle L, Roos E. The chemokine receptor CXCR4 is required for outgrowth of colon carcinoma micrometastases. Cancer Res. 2003 Jul 1; 63 (13):3833-9.
- Sehgal, A., Keener, C., Boynton, AL., Warrick, J., and Murphy, GP. CXCR-4, a chemokine receptor, is overexpressed in and required for proliferation of glioblastoma tumor cells.1998. J. Surg. Oncol. 69, 99-104
- Uchida D, Begum NM, Almofti A, Nakashiro K, Kawamata H, Tateishi Y, Hamakawa H, Yoshida H, Sato M. Possible role of stromal-cellderived factor-1/CXCR4 signaling on lymph node metastasis of oral squamous cell carcinoma. Exp Cell Res 2003. 290: 289-302.
- Yu X et all J Exp Clin Cancer Res. 2019 Jan 24;38 (1):32. 10.1186/s13046-018-1014-x. CXCL12/CXCR4 promotes inflammation-driven colorectal cancer progression through activation of RhoA signaling by sponging miR-133a-3p
- DOI: :10.1186/s13046-018-1014-x.CXCL12/CXCR4
- Kim J, Mori T, Chen SL, Amersi FF, Martinez SR, Kuo C, Turner RR, Ye X, Bilchik AJ, Morton DL, Hoon DS. Chemokine receptor CXCR4 expression in patients with melanoma and colorectal cancer liver metastases and the association with disease outcome. Ann Surg. 2006 Jul; 244 (1):113-20.


