Оценка возможности использования пистии телорезовидной (Pistia stratiotes) и ряски малой (Lemna minor) для фиторемедиации водной среды
Автор: Сорокина Г.А., Злобина Е.В., Бондарева Л.Г., Субботин М.А.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Экология
Статья в выпуске: 11, 2013 года.
Бесплатный доступ
В статье рассмотрены возможности использования пистии телорезовидной (Pistia stratiotes) и ряски малой (Lemna minor) для фиторемедиации водной среды от тяжелых металлов. По выводам авторов, использовать пистию телорезовидную для биоремедиации водной среды целесообразно при концентрации ионов меди от 0,125 мг, ионов цинка от 4 мг, ионов никеля от 5 мг на 1 г веса растения и ниже. В случае с никелем также стоит учитывать гендерную специфику действия этого тяжелого металла на растение.
Пистия телорезовидня (pistia stratiotes), ряска малая (lemna minor), фиторемедиация водной среды, тяжелые металлы
Короткий адрес: https://sciup.org/14082788
IDR: 14082788 | УДК: 502.171.
Текст научной статьи Оценка возможности использования пистии телорезовидной (Pistia stratiotes) и ряски малой (Lemna minor) для фиторемедиации водной среды
Введение. В настоящее время особое значение приобретает проблема очистки сточных вод и вод естественных и искусственных водоемов от большого количества загрязняющих веществ, в том числе тяжелых металлов [1]. Существуют три основных группы методов очистки вод: физические, химические и биологические [2]. Именно последняя группа методов, названная биоремедиацией, в последнее время используется все шире, благодаря относительной дешевизне и простоте выполнения.
Биоремедиация – это одна из способностей природы к самоочищению при воздействии антропогенных загрязнителей. Чаще данный термин используется в значении комплекса методов очистки вод, грунтов и атмосферы с использованием метаболического потенциала биологических объектов – растений, грибов, насекомых, червей и других организмов [3]. В особую группу выделяют очищение вод с помощью зеленых растений – фиторемедиацию, так как высшие растения, в отличие от микроорганизмов, способны накапливать соли тяжелых металлов, долго оставаясь живыми, при этом легче утилизировать их отмершие остатки с накопленными ядовитыми веществами [4]. В настоящее время уже разработаны и активно применяются на практике методики использования нескольких растений-гидробионтов, но важно расширить перечень используемых растений для очистки водоемов, в том числе и от тяжелых металлов [5].
Цель исследований. Изучение способности к фиторемедиации и установление возможности использования пистии телорезовидной ( Pistia stratiotes ), ряски малой ( Lemna minor ) в качестве биосорбента соединений некоторых тяжелых металлов в водной среде.
Объекты и методы исследований. В качестве тест-объекта использовались пистия телорезовидная ( Pistia stratiotes ) и ряска малая ( Lemna minor ). Пистию телорезовидную культивировали на отстоянной водопроводной воде с добавлением среды Штейнберга (2 масс. %) при естественном освещении и комнатной температуре. Ряску малую выращивали при круглосуточном освещении (3500–4000 люкс) и постоянной температуре 22°C, которые обеспечивались климатостатом В2. Средой для культивирования ряски служила чистая среда Штейнберга (100 %).
При изучении адаптации пистии к действию ионов тяжелых металлов в 3 емкости объемом 640 мл к дистиллированной воде добавлялась среда Штейнберга в количестве 2 масс. %. Затем добавляли раствор металла в различных концентрациях в расчете на 1 г веса предварительно взвешенного растения. Для эксперимента отбирались крупные и средние экземпляры с диаметром розетки 6–12 см и массой 4,0–13,0 г. В опытах с медью (соль CuSO 4 ·5H 2 O) первоначально использовались концентрации металла – 0,5; 0,25 и
0,125 мг/г сырого веса. После выявления летальности первых двух концентраций для растений в дальнейшем использовались концентрации 0,125; 0,0625 и 0,031 мг/г сырого веса растения. В экспериментах с цинком использовался раствор соли ZnSO 4 ·7H 2 O с концентрациями ионов цинка 8, 4 и 2 мг/г веса растения. В исследованиях адаптации пистии к воздействию никеля использовался раствор соли NiSO 4 ·7H 2 O в концентрациях, составлявших 5; 2,5 и 1,25 мг ионов никеля в расчете на 1 г веса растения. Для каждой концентрации металла эксперимент проводился в трех повторностях.
Элементный анализ водной среды проводился в Институте химии и химической технологии СО РАН методом масс-спектрометрии с индуктивно-связанной плазмой (ИСП МС) на квадрупольном масс-спектрометре Agilent 7500а (Agilent Technologies, США). Пробы разбавлялись в 125 раз раствором HNO 3 (0,3 масс. %) в деионизированной воде.
Для экспериментов по фиторемедиации был произведен отбор растений, сходных по морфологическим параметрам (диаметр розетки листьев 2,5–3,6 см, стадия 2–3 листьев, отсутствие ярко выраженных некрозов и хлорозов, в случае с ряской брались здоровые 3-листецовые розетки). Растения по 2 экземпляра помещались в емкости объемом 200 мл с добавленной питательной средой и растворами солей меди, никеля и цинка в концентрациях 5 ПДК вр . Для водной среды использовалась вода р. Енисей и дистиллированная вода. Среда и вода смешивались в соотношении, аналогичном соотношению в экспериментах по адаптации растений к внесенным солям тяжелых металлов.
Результаты исследований и их обсуждение. Медь. В ходе дальнейших экспериментов проводилось изучение адаптации пистии телорезовидной к действию ионов меди при максимально возможной дозе металла в расчете на вес растения (табл. 1). Заметные морфологические изменения фиксируются уже при концентрациях ионов меди от 0,0625 мг/г веса растения (0,45–0,77 мг/л). При увеличении концентрации ионов металла окраска листовых пластинок меняется с однородно зеленой через желто-зеленую к бурой. Летальной дозой ионов меди для пистии является 0,25 мг/г веса растения (1,83–2,39 мг/л), т.е. 1,8–2,4 ПДК в [6]. При добавлении меньших концентраций ионов меди растения выживают, со временем восстанавливают тургор оставшихся листовых пластинок, происходит генерация новых листьев и корней, причем довольно активная.
Таблица 1
Морфологические изменения пистии телорезовидной под воздействием ионов меди
|
Концентрация, мг/г (мг/л) |
Время, сут. |
Потеря тургора |
Некрозы, % от площади листа |
Отмирание листьев, % от общего числа |
Отмирание корней, % от общего числа |
Хлорозы, % от площади листа |
Окраска |
|
0,031 (0,250-0,370) |
1 |
- |
0-5 |
0 |
5-10 |
0-10 |
Зеленая |
|
2 |
- |
0-5 |
0 |
5-10 |
0-10 |
Зеленая |
|
|
6 |
- |
0-5 |
0; +10* |
5-10; +50* |
0-5 |
Зеленая |
|
|
0,0625 (0,450-0,770) |
1 |
- |
15-20 |
0 |
30-50 |
20-30 |
Зелено-желтая |
|
2 |
- |
15-20 |
0-10 |
60-80 |
20-40 |
Зелено-желтая |
|
|
6 |
- |
10-20 |
0-10; +10* |
60-80; +20* |
20-30 |
Зелено-желтая |
|
|
0,125 (0,920-1,520) |
1 |
+ |
20-30 |
50-70 |
40-60 |
40-60 |
Зелено-желтая |
|
2 |
+ |
40-50 |
80 |
70-90 |
50-70 |
Желто-зеленая |
|
|
6 |
- |
30-50 |
80; +10* |
100; +10* |
50-70 |
Желто-зеленая |
|
|
0,250 (1,830-2,390) |
1 |
+ |
50-60 |
90-100 |
90-100 |
90-100 |
Желто-зеленая |
|
2 |
+ |
70-80 |
100 |
100 |
100 |
Бледно-зеленая |
|
|
6 |
+ |
100 |
100 |
100 |
100 |
Буро-желтая |
|
|
0,500 (3,660-6,160) |
1 |
+ |
100 |
100 |
100 |
100 |
Бледнозеленая, с белым мучнистым налетом |
|
2 |
+ |
100 |
100 |
100 |
100 |
Желтая, с белым мучнистым налетом |
|
|
6 |
+ |
100 |
100 |
100 |
100 |
Буро-желтая, с белым мучнистым налетом |
* Процент новых генераций корней и листовых пластинок.
Для растений, подвергшихся воздействию высоких концентраций ионов меди (0,25 мг/г веса растения и выше), характерны бледно-желто-зеленая окраска, которая впоследствии переходит в бурую, бурые пятна и мучнистый налет, некрозы в виде размягчившихся тканей листа. Иногда наблюдаются жилки голубозеленого цвета с нижней стороны листа. Максимальный токсический эффект наблюдается через 2–3 сут. после начала эксперимента; через 5–6 сут. начинают появляться новые генерации листьев и корней, новые некрозы не регистрируются.
Гибель взрослых растений наступает при концентрации ионов меди более 1,5 мг/л. На основе полученных результатов можно сделать вывод, что пистия адаптируется в водоеме с содержанием меди ~ 0,125 мг/г сырого веса растений, при этом наблюдается хорошая способность к накоплению металла растениями и, следовательно, очистки водоема от солей меди.
Цинк. В ходе изучения адаптации пистии телорезовидной к действию ионов цинка (табл. 2) выявлено, что летальной дозой ионов цинка для пистии является 8 мг/г веса растения.
Таблица 2
Морфологические изменения пистии телорезовидной под воздействием ионов цинка
|
Концентрация, мг/г (мг/л) |
Время, сут. |
Потеря тургора |
Некрозы, % от площади листа |
Отмирание листьев, % от общего числа |
Отмирание корней, % от общего числа |
Хлорозы, % от площади листа |
Окраска |
|
2,00 (16,2521,56) |
1 |
- |
0-20 |
0-10 |
5-10 |
0-30 |
Зеленая |
|
2 |
- |
5-40 |
0-30 |
5-30 |
10-40 |
Зелено-желтая |
|
|
6 |
- |
10-40 |
0-30 |
10-30; +5* |
10-40 |
Зелено-желтая |
|
|
4,00 (28,1345,63) |
1 |
- |
30-50 |
30-50 |
30-50 |
50-60 |
Желто-зеленая |
|
2 |
+ |
60-70 |
60-70 |
50-80 |
60-70 |
Желто-зеленая, с бурыми пятнами |
|
|
6 |
+ |
60-80 |
60-70 |
60-80 |
60-80 |
Желто-зеленая, с бурыми пятнами |
|
|
8,00 (57,5092,50) |
1 |
+ |
60-80 |
90-100 |
90-100 |
90-100 |
Желто-зеленая |
|
2 |
+ |
90-100 |
100 |
100 |
90-100 |
Желто-зеленая, с бурыми пятнами |
|
|
6 |
+ |
100 |
100 |
100 |
100 |
Желто-зеленая, с бурыми пятнами |
* Процент новых генераций корней и листовых пластинок.
Для растений характерна бурая окраска, некрозы в виде сухих участков тканей листа, хорошо заметные волоски на поверхности листа, потеря несмачиваемости листовых пластинок. При меньших концентрациях растения выживают, со временем восстанавливают тургор оставшихся листовых пластинок, происходит генерация новых листьев и корней, причем довольно активная.
Использовать взрослые экземпляры пистии телорезовидной для очистки воды от соединений цинка целесообразно при концентрации ионов цинка от 4 мг/г и ниже (45 мг/л), что является 45-кратным превышением ПДК в [6] для этого металла.
Никель. В ходе изучения устойчивости пистии телорезовидной к действию ионов никеля превышение ПДК Ni2+ (для питьевой воды 0,02 мг/л [6]) составило до 950, 450 и 130 раз соответственно (табл. 3). Основной токсический эффект никеля проявляется в первые 2–3 сут. после помещения растений в раствор соли металла. При воздействии ионов никеля в концентрации 5 мг/г растения приобретают бледно-желто-зеленую окраску, выражен межжилковый хлороз; площадь листовых пластинок, пораженных некрозами, составляет до 15 %.
При уменьшении концентрации никеля токсический эффект становится менее выраженным, окраска листовых пластинок делается более насыщенной, площадь некрозов уменьшается. При концентрации 1,25 мг/г веса растения регистрируемые морфологические показатели практически не отличаются от нормы.
В отличие от других металлов не было зарегистрировано отмирание листьев или корней, но проявилась иная специфическая реакция: наиболее токсичен никель оказался для молодых генераций (новые листья и «детки»), которые при концентрации 5 мг/г погибли, а при 2,5 мг/г выжили, но потеряли тургор. При этом наблюдалась значительная деформация листовых пластинок молодых генераций.
Полученные результаты показывают, что взрослые экземпляры пистии телорезовидной сохраняют жизнеспособность при действии ионов никеля в концентрациях, превышающих ПДК в [6] в 125 раз. Использование данного растения в целях биоремедиации целесообразно при расчете содержания никеля в воде, подлежащей очистке, от 5 мг/г сырого веса растения и ниже, так как при этом большая часть растений выживет и сохранит способность к выполнению своих функций. Однако при этом стоит учитывать гендерную специфику влияния никеля на растение.
Таблица 3
Морфологические изменения пистии телорезовидной под воздействием ионов никеля
|
Концентрация, мг/г (мг/л) |
Время, сут. |
Потеря тургора |
Некрозы, % от площади листа |
Отмирание листьев, % от общего числа |
Отмирание корней, % от общего числа |
Хлорозы, % от площади листа |
Окраска |
|
1,25 |
1 |
- |
0 |
0 |
0 |
0 |
Зеленая |
|
(2,63- |
2 |
- |
0-5 |
0 |
0 |
0-5 |
Зеленая |
|
3,25) |
6 |
- |
0-5 |
0 |
0 |
0-5 |
Зеленая |
|
2,50 |
1 |
- |
0-5 |
0 |
0 |
0-5 |
Зеленая |
|
(5,00- |
2 |
- |
0-10 |
0 |
0 |
5-10 |
Желто-зеленая |
|
9,00) |
6 |
- |
10-15 |
0 |
0-5 |
5-15 |
Желто-зеленая |
|
1 |
- |
0-5 |
0 |
0 |
0-5 |
Зеленая |
|
|
5,00 (10,00- |
2 |
- |
5-10 |
0 |
0 |
5-15 |
Бледно-желтозеленая |
|
19,00) |
6 |
+ |
10-15 |
0-10 |
0-5 |
15-20 |
Бледно-желтозеленая |
В ходе дальнейших экспериментов изучалась способность пистии телорезовидной и ряски малой к накоплению ионов меди, никеля и цинка, которая определялась по содержанию металлов в водной экспериментальной среде. Пистия телорезовидная наиболее интенсивно поглощает из водной среды медь и цинк, при этом поглощение меди из воды реки Енисей прошло более интенсивно по сравнению с системой с дистиллированной водой (рис., а ). Остаточное содержание меди, так же как и цинка, меньше ПДК, установленного для рыбохозяйственных водоемов [7].
В случае с никелем в воде осталось значительное количество внесенного металла – 4 ПДК в воде реки Енисей и 3 ПДК в дистиллированной воде. Вероятно, это связано с тем, что молодые экземпляры данного вида растений, обладающие высокой чувствительностью к действию ионов никеля, в ходе опыта быстро погибли.
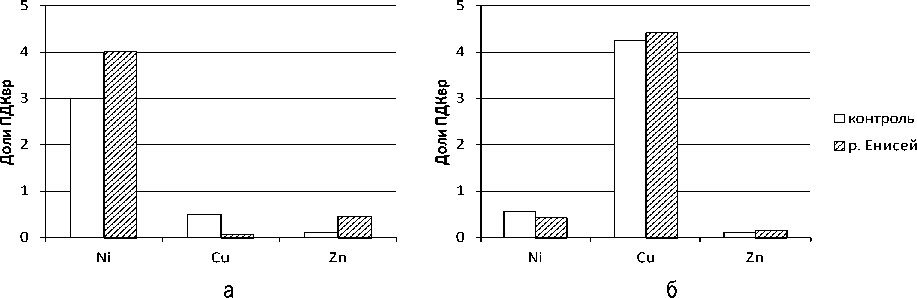
Доли ПДК вр для никеля, меди и цинка в водной среде после суточной экспозиции в дистиллированной воде и воде р. Енисей с добавлением среды Штейнберга (2 масс. %): а – пистия телорезовидная; б – ряска малая
При изучении способности ряски малой накапливать ионы тяжелых металлов в биомассе было показано, что содержание ионов никеля после суточной экспозиции в дистиллированной воде с концентрацией 0,05 мг/л (5ПДК вр ) в 388 раз превысило содержание никеля в контрольных экземплярах (рис., б ). В то время как при экспозиции на воде реки Енисей содержание никеля в биомассе ряски существенно не изменилось. При сравнении морфологических параметров ряски выявлено незначительное воздействие ионов никеля как на дистиллированной воде, так и при экспозиции на воде реки Енисей. Таким образом, ряска малая может хорошо поглощать ионы никеля из водной среды.
При изучении воздействия ионов меди в отличие от воды р. Енисей выявлено влияние на морфологические показатели ряски малой с концентрацией меди 0,005 мг/л. Наблюдалось полное рассоединение розеток на отдельные листецы, опадение корней. Но содержание ионов меди в биомассе ряски при экспозиции на воде реки Енисей было выше более чем в 3 раза по сравнению с экспозицией в дистиллированной воде. Таким образом, накопление меди в ряске малой на природной воде происходит интенсивнее и в меньшей степени оказывает токсическое действие на морфологию растения при суточной экспозиции. Это, вероятно, связано с процессами, обусловленными протеканием процессов маскирования, в результате которых образуются менее токсичные формы соединений меди по сравнению с исходными соединениями.
Токсическое действие цинка (0,05 мг/л) на морфологические параметры ряски в дистиллированной воде проявилось сильнее, чем на воде реки Енисей. При этом содержание цинка в биомассе ряски на природной воде резко снизилось по сравнению с контролем (в 120 раз). То есть наблюдался процесс диффузии исходного содержания цинка из образцов ряски в водную среду.
Выводы
По результатам проведенных экспериментов можно заключить, что пистия телорезовидная хорошо адаптируется в загрязненных медью и никелем водных объектах. При этом использование растений для фиторемедиации эффективно при концентрации ионов меди от 0,125 мг, ионов цинка от 4 мг и ионов никеля от 5 мг на 1 г веса растения и ниже. В случае с никелем стоит учитывать гендерную специфику действия этого тяжелого металла на растение.
Растения пистии телорезовидной и ряски малой интенсивно накапливают тяжелые металлы из водной среды. В целом можно сделать положительное заключение о возможности использования пистии телорезовидной и ряски малой для фиторемедиации водной среды от ионов меди, цинка и никеля.


