Оценка возможности применения эмпирических моделей прогнозирования второй метахронной опухоли после химиотерапии первой в диспансеризации онкологических больных
Автор: Шунько Е.Л., Важенин А.В., Шаназаров Н.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Эпидемиологические исследования
Статья в выпуске: 1 т.21, 2022 года.
Бесплатный доступ
Цель исследования - оценить возможность применения эмпирических моделей прогнозирования второй метахронной опухоли после химиотерапии первой для повышения эффективности диспансеризации онкологических больных. Материал и методы. Объекты исследования - электронные базы данных по химиотерапевтическому лечению онкологических больных, выгрузки из базы данных по лечению больных с первично-множественными злокачественными новообразованиями (ПМ ЗНО) за период 1990-2015 гг., истории болезни и медицинские карты 796 больных с метахронными (ПМ ЗНО): основная группа - 496 пациентов после химиотерапии, контрольная группа - 300 больных после хирургического лечения первой опухоли, размер выборки предварительно не рассчитывался. Результаты. Эмпирические модели прогнозирования второй метахронной опухоли после химиотерапии первой показали наиболее высокую вероятность появления второй метахронной опухоли в трех интервалах времени: 1256,00-1884,00 дней (3,44-5,16 года; HR=2,25; шанс возникновения второй метахронной опухоли составляет 69,2 %), 3768,00-4396,00 дней (10,32-12,04 года; HR=3,86; шанс 79,4 %), 6280,00-6908,00 дней (17,21-18,93 года; HR=2,00; шанс 66,7 %). Заключение. По результатам анализа эмпирических моделей риска для второй метахронной опухоли после химиотерапии первой разработаны поправки в сроки диспансерного наблюдения больных с первично-множественными метахронными злокачественными новообразованиями после химиотерапии первой опухоли. Знание о наиболее вероятных сроках возникновения второй метахронной опухоли после химиотерапии первой позволяет более точно составлять и при необходимости корректировать план диспансерного наблюдения после химиотерапевтического лечения первой опухоли.
Злокачественные новообразования, полинеоплазии, первично-множественные опухоли, метахронные злокачественные опухоли
Короткий адрес: https://sciup.org/140290557
IDR: 140290557 | УДК: 616.006.04-08-037:615.28 | DOI: 10.21294/1814-4861-2022-21-1-5-10
Текст научной статьи Оценка возможности применения эмпирических моделей прогнозирования второй метахронной опухоли после химиотерапии первой в диспансеризации онкологических больных
В современных условиях одной из серьезных проблем в онкологии является рост первичномножественных злокачественных новообразований (ПМ ЗНО), в том числе и после предшествующей химиотерапии первичной опухоли [1]. В ряде популяционных исследований указывается на связь химиотерапии и, в зависимости от цитостатического препарата, различное увеличение частоты ПМ ЗНО у пролеченных пациентов, в том числе лейкемии [2] и лейкоза [3–6]. Кроме того, информация о ПМ ЗНО в официальных статистических формах не разбита по нозологическим группам и недостаточна для анализа данного раздела онкологии, который приобретает все большую актуальность и остроту [7]. В 2018 г. в Российской Федерации 8,8 % всех впервые выявленных злокачественных новообразований составили ПМ ЗНО (54 873 – 37,4 на 100 тыс населения). Синхронные опухоли составили 26,7 %. При этом контингент пациентов с ПМ ЗНО на конец 2018 г. составил 204 792 – 5,4 % от общего числа пациентов, состоящих под диспан- серным наблюдением, в Уральском федеральном округе – 18 004 (6,2 %), в Челябинской области – 6 128 (7,1 %) [8].
Согласно литературным данным, при наличии первично-множественного процесса вторая опухоль при обследовании не диагностируется в 27–35 % [9–11], так как быстрее проявляется активно манифестирующая опухоль. Как правило, в 57,3 % случаев проявления второй опухоли скрываются выраженными проявлениями первой опухоли или сопутствующей неопухолевой патологией, а у 30 % больных вторая опухоль выявляется только в ходе лечения первой [9].
Онкологические больные после химиотерапевтического лечения являются группой риска возникновения полинеоплазий, и только правильная организация динамического наблюдения позволит провести наиболее раннюю диагностику опухолей второй локализации и выполнить органосохраняющее лечение [11, 12]. При этом одним из возможных инструментов прогнозирования метахронных полинеоплазий являются эмпирические модели
Кокса, которые позволяют более точно определить возможные интервалы времени для развития второй метахронной опухоли после химиотерапии первой, что позволяет скорректировать сроки диспансерного наблюдения для данной категории онкологических больных.
Цель исследования – оценить возможность применения эмпирических моделей прогнозирования второй метахронной опухоли после химиотерапии первой для повышения эффективности диспансеризации онкологических больных.
Материал и методы
Исследование является ретроспективным и проведено по архивным данным Челябинского областного клинического центра онкологии и ядерной медицины (ГБУЗ «ЧОКЦО и ЯМ»). Объектами исследования являются истории болезни, медицинские карты, электронные базы данных по химиотерапевтическому лечению онкологических больных в ГБУЗ «ЧОКЦО и ЯМ», выгрузки из базы данных по лечению больных с ПМ ЗНО за период 1990–2015 гг. Изучены истории болезни 796 больных с метахронными ПМ ЗНО. Основную группу составили 496 пациентов после химиотерапии, контрольную группу – 300 больных после хирургического лечения первой опухоли, размер выборки предварительно не рассчитывался.
Этическая экспертиза исследования проведена Этическим комитетом ГБОУ ВПО «ЧелГМА Минздравсоцразвития России» (Протокол № 1 от 25.01.2012) и ГБОУ ВПО «ЮУГМУ Минздрава» (протокол № 5 от 25.05.2016) – исследование разрешено как не противоречащее принципам медицинской этики.
Модели прогнозирования второй метахронной опухоли построены с помощью модуля «Анализ выживаемости STATISTICA» (пакет прикладных программ «Statistica Version 10.0.0.0» для анализа данных на базе персонального компьютера) с применением многофакторного анализа (модель Кокса) с учетом всех осложнений, приведших к изменениям в лечении (схема, интервал между курсами). Соответствие эмпирической модели данным исследования проверялось по критерию χ2.
Результаты
В среднем в группе больных, получивших химиотерапию первой опухоли (n=496), пациенты прожили 67,76 мес от начала лечения первой опухоли и 31,02 мес от момента появления второй метахронной опухоли. Интервал времени между первой и второй опухолями составил в среднем 45,21 мес (95 % ДИ 39,76–50,66), интервал времени от начала химиотерапия (ХТ) первой опухоли до появления второй опухоли составил в среднем 38,72 мес (95 % ДИ 33,60–43,84), в подгруппах живых (n=404) и умерших (n=92) – 40,59 мес (95 % ДИ 34,38–46,79) и 19,26 (95 % ДИ 11,72–
26,80) мес соответственно, различия значимы по критерию однородности дисперсий и результатам однофакторного дисперсионного анализа (LS=6,578; p=0,012 и F=10,028; p=0,002).
Также определены выживаемость больных и риск возникновения второй метахронной опухоли в зависимости от вида химиотерапии (адъювантная, неоадъювантная/адъювантная, неоадъювантная, самостоятельная). В среднем выживаемость для адъювантной ХТ (n=236) составила 74,339 мес, медиана – 68,000 мес; для неоадъювантной ХТ (n=56) – среднее значение 50,357 мес, медиана 55,000 мес; для самостоятельной ХТ (n=136) – среднее значение 61,941 мес, медиана – 53,000 мес; для неоадъювантной/адъювантной ХТ (n=68) среднее значение – 82,333 мес, медиана – 91,000 мес. Риск возникновения второй метахронной опухоли был практически одинаков для всех видов химиотерапии, число терминальных случаев в группе с адъювантной ХТ было несколько выше для интервалов 0–12, 24–36 и 36–48 мес от начала химиотерапии, в группе с неоадъювантной/адъювантной ХТ – для интервалов 0–12 и 96–108 мес, в группе с самостоятельной ХТ – для интервалов 0–12 и 12–24 мес, в группе с неоадъювантной ХТ в интервале от 0 до 72 мес терминальные случаи отсутствовали.
Для построения модели риска появления второй метахронной опухоли учитывались все значимые осложнения лечения, которые приводили к удлинению интервала между курсами, замене химиопрепарата или изменению схемы лечения (степень лейкопении, тромбоцитопении, эритроцитопении, длительность интервала между курсами). В среднем в основной группе больные получили 2,43 курса химиотерапии, длительность ХТ составила 3,31 мес, длительность перерыва в лечении, обусловленная возникшими осложнениями, – 1,5 мес. Осложнения при химиотерапии отмечались у 156 (31,5 %) больных.
На предварительном этапе построения эмпирических моделей было определено, что теоретические распределения, полученные тремя различными методами оценивания (методом наименьших квадратов и двумя методами взвешенных наименьших квадратов – Weight 1, Weight 2, Weight 3), в двух наборах теоретических данных значимо не расходятся с экспериментальными данными (χ2=15,76251 и р=0,166765; χ2=13,34219 и р=0,553256; χ2=16,47435 и р=0,105481 соответственно для набора данных Weight 1, Weight 2, Weight 3), что делает возможным построение моделей прогнозирования второй метахронной опухоли.
Эмпирическая модель «Оценка функции мгновенного риска» (Модель Кокса) для второй метахронной опухоли после химиотерапии первой опухоли (рис. 1) показала, что отношение величин риска (hazard ratio, HR) в экспериментальной и контрольной группах находится в пределах 0,0008,
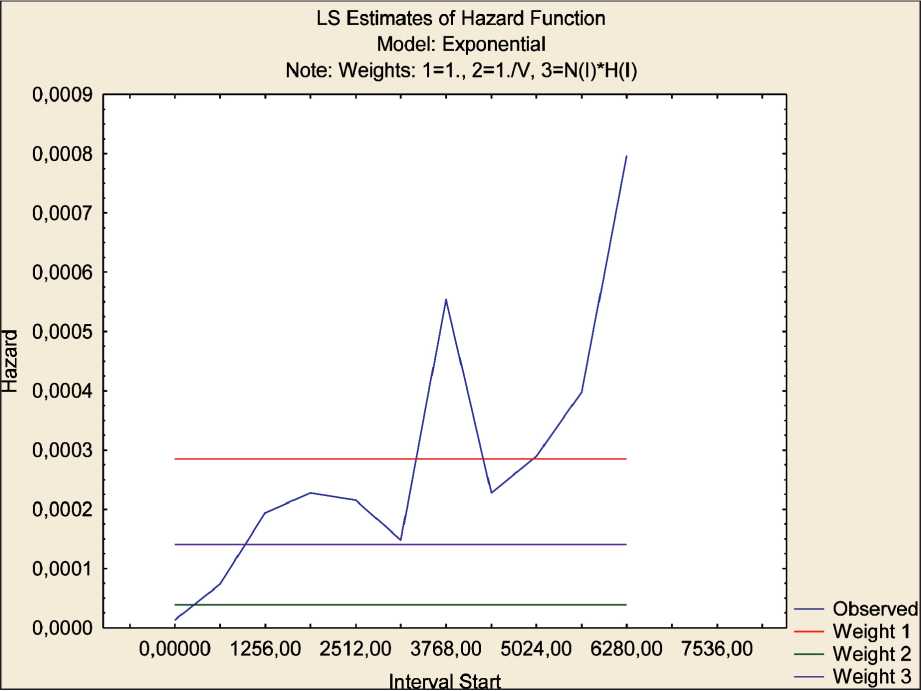
Рис. 1. Модель Кокса «Оценка функции мгновенного риска возникновения второй метахронной опухоли после химиотерапии первой опухоли».
Примечание: по оси Y – риск; по оси Х – дни
Fig. 1. Cox model «Assessment of the function of instantaneous risk of a second metachronous tumor after chemotherapy of the first tumor» Note: Y-axis – risk, X-axis – days
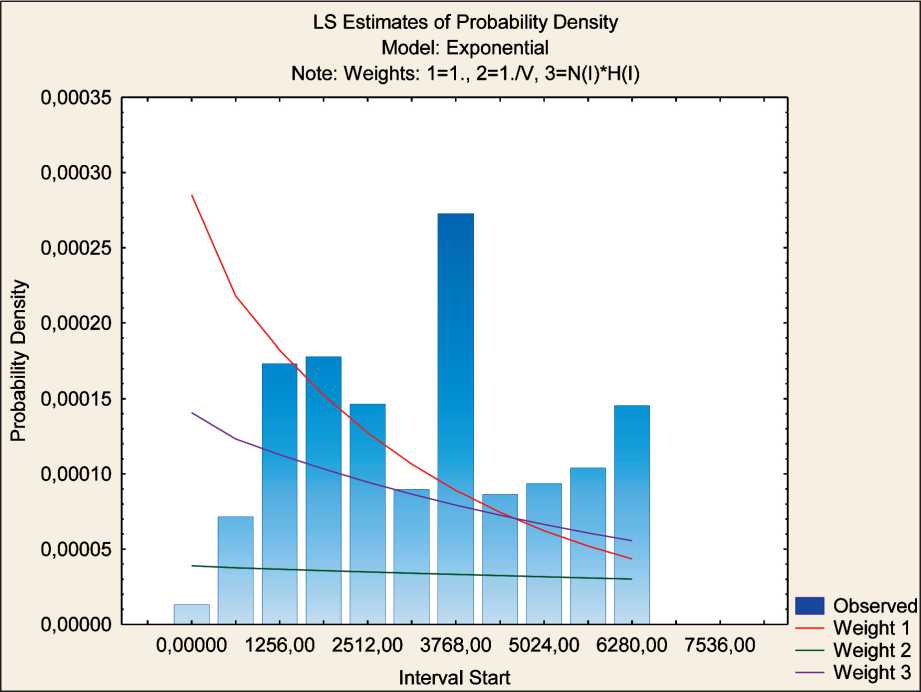
Рис. 2. Экспоненциальная модель «Оценка плотности вероятности возникновения второй метахронной опухоли после химиотерапии первой опухоли».Примечание: по оси Y – плотность вероятности; по оси Х – дни
Fig. 2. Exponential model «Estimation of the probability density of a second metachronous tumor after chemotherapy of the first tumor».
Note: Y-axis – probability density, X-axis – days
что составляет 0,08 % развития второй метахронной опухоли после ХТ по сравнению с пациентами после хирургического лечения первой опухоли. Однако необходимо отметить для пациентов после ХТ несколько периодов выживания с наиболее высоким риском для развития второй метахронной опухоли: 1256,00–1884,00 дней (3,44–5,16 года; HR=2,25; шанс возникновения второй метахронной опухоли составляет 69,2 %), 3768,00–4396,00 дней (10,32–12,04 года; HR=3,86; шанс 79,4 %), 6280,00–6908,00 дней (17,21– 8,93 года; HR=2,00; шанс 66,7 %).
Экспоненциальная модель «Оценка плотности вероятности» для второй метахронной опухоли после химиотерапии первой опухоли (рис. 2) по- казала, что наиболее высокая плотность вероятности (0,00027) для второй метахронной опухоли соответствует 4396,00 дням (12,04 года) от начала ХТ. Достаточно высокие показатели плотности 0,00017 и 0,00018 отмечаются соответственно и для временных отметок 1884,00 дней (5,16 лет) и 2512,00 дней (6,88 года) от начала ХТ; к временной отметке 1256,00 дней (3,44 года) от начала ХТ показатели плотности вероятности и риска для второй метахронной опухоли составляют 0,000054 и 0,000075 соответственно, риск для второй метахронной опухоли составляет 51,2 %, в последующие периоды выживания он не снижается и удерживается выше отметки 58,85 % шанса возникновения второй метахронной опухоли.
Таким образом, построенные эмпирические модели прогнозирования второй метахронной опухоли после химиотерапии первой опухоли показали наиболее высокую вероятность второй метахронной опухоли в трех интервалах времени: 1256,00–1884,00 дней (3,44–5,16 года; HR=2,25; шанс возникновения второй метахронной опухоли составляет 69,2 %), 3768,00–4396,00 дней (10,32– 12,04 года; HR=3,86; шанс 79,4 %), 6280,00–6908,00 дней (17,21–18,93 года; HR=2,00; шанс 66,7 %).
Обсуждение
К настоящему времени в литературе представлено достаточно большое количество исследований по изучению ПМ ЗНО после химиотерапии, но все они основаны на анализе малочисленных групп больных [13, 14]. За последние годы в иностранной литературе представлено несколько эмпирических многомерных моделей регрессии Кокса, но все они выполнены для одной локализации первой опухоли [15–17] и позволяют предположить только возможную локализацию второй метахронной опухоли, но не содержат информации о примерных
Список литературы Оценка возможности применения эмпирических моделей прогнозирования второй метахронной опухоли после химиотерапии первой в диспансеризации онкологических больных
- Rubino C., de Vathaire F., Shamsaldin A., Labbe M., Lê M.G. Radiation dose chemotherapy, hormonal treatment and risk of second cancer after breast cancer treatment. Br. J. Cancer. 2003; 89: 840–6. doi: 10.1038/sj.bjc.6601138.
- Travis L.B., Curtis R.E., Boice J.D., Platz C.E., Hankey B.F., Fraumeni J.F. Second malignant neoplasms among long-term survivors of ovarian cancer. Cancer Res. 1996; 56(7): 1564–70.
- de Vathaire F., Hawkins M., Campbell S., Oberlin O., Raquin M.A., Schlienger J.Y., Shamsaldin A., Diallo I., Bell J., Grimaud E., Hardiman C., Lagrange J.L., Daly-Schveitzer N., Panis X., Zucker J.M., Sancho-Garnier H., Eschwège F., Chavaudra J., Lemerle J. Second malignant neoplasms after a first cancer in childhood: temporal pattern of risk according to type of treatment. Br J Cancer. 1999; 79(11–12): 1884–93. doi: 10.1038/sj.bjc.6690300.
- Dores G.M., Metayer C., Curtis R.E., Lynch C.F., Clarke E.A., Glimelius B., Storm H., Pukkala E., van Leeuwen F.E., Holowaty E.J., Andersson M., Wiklund T., Joensuu T., van’t Veer M.B., Stovall M., Gospodarowicz M., Travis L.B. Second malignant neoplasms among long-term survivors of Hodgkin’s disease: a population-based evaluation over 25 years. J Clin Oncol. 2002; 20(16): 3484–94. doi: 10.1200/JCO.2002.09.038.
- Guérin S., Guibout C., Shamsaldin A., Dondon M.G., Diallo I., Hawkins M., Oberlin O., Hartmann O., Michon J., Le Deley M.C., de Vathaire F. Concomitant chemo-radiotherapy and local dose of radiation as risk factors for second malignant neoplasms after solid cancer in childhood: a case-control study. Int J Cancer. 2007; 120(1): 96–102. doi: 10.1002/ijc.22197.
- Haddy N., Le Deley M.C., Samand A., Diallo I., Guérin S., Guibout C., Oberlin O., Hawkins M., Zucker J.M., de Vathaire F. Role of radiotherapy and chemotherapy in the risk of secondary leukaemia after a solid tumour in childhood. Eur J Cancer. 2006; 42(16): 2757–64. doi: 10.1016/j.ejca.2006.05.034.
- Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2017 году (заболеваемость и смертность). М., 2018. 250 с. [Malignant neoplasms in Russia in 2017 (morbidity and mortality). Moscow, 2018. 250 р. (in Russian)].
- Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2018 году (заболеваемость и смертность). М., 2019. 250 с. [Kaprin A.D., Starinskiy V.V., Petrova G.V. Malignant neoplasms in Russia in 2018 (morbidity and mortality). Moscow, 2019. 250 p. (in Russian)].
- Сельчук В.Ю., Долгов И.Ю., Попова Т.Н. Проблема первичной множественности злокачественных новообразований в историческом аспекте. Российский онкологический журнал. 1998; 5: 51–4. [Sel’chuk V.Yu., Dolgov I.Yu., Popova T.N. The problem of primary multiplicity of malignant neoplasms in the historical aspect. Russian Journal of Oncology. 1998; 5: 51-54. (in Russian)].
- Федоров В.Э., Барсуков В.Ю., Попова Т.Н. Особенности течения и трудности диагностики множественных злокачественных новообразований. Медицинский альманах. 2011; 2(15): 157–60. [Fedorov V.E., Barsukov V.Yu., Popova T.N. Features of the course and difficulties in the diagnosis of multiple malignant neoplasms. Medical Almanac. 2011; 2(15): 157–60. (in Russian)].
- Сметанина В.Д., Иванова П.М., Каратаев П.Д. Заболеваемость первично-множественными опухолями населения Республики Саха (Якутия). Якутский медицинский журнал. 2008; 3: 12–4. [Smetanina V.D., Ivanova P.M., Karataev P.D. The incidence of primary multiple tumors in the population of the Republic of Sakha (Yakutia). Yakut medical journal. 2008; 3: 12–4. (in Russian)].
- Былин М.В., Черемисина О.В., Панкова О.В., Афанасьев С.Г., Добродеев А.Ю. Эффективность комплексной эндоскопической диагностики первичного и первично-множественного рака легкого. Поволжский онкологический вестник. 2017; 2(29): 8–15. [Bylin M.V., Cheremisina O.V., Pankova O.V., Afanasyev S.G., Dobrodeev A.Yu. Efficacy of comprehensive endoscopic diagnosis of primary and multiple primary lung cancer. Oncology Bulletin of Volga Region. 2017; 2(29): 8–15. [in Russian].
- Важенин А.В., Бехтерева Е.И., Бехтерева С.А., Гюлов Х.Я. Очерки первичной множественности злокачественных опухолей. Челябинск, 2000. 213 с. [Vazhenin A.V., Bekhtereva E.I., Bekhtereva S.A., Gyulov Kh.Ya. Essays on primary multiplicity of malignant tumors. Chelyabinsk, 2000. 213 p. (in Russian)].
- Максимов С.Я. Первично-множественные опухоли органов репродуктивной системы. Практическая онкология. 2009; 10(2): 117–23. [Maksimov S.Ya. Primary multiple tumors of the reproductive system. Practical Oncology. 2009; 10 (2): 117-123. (in Russian)].
- Grantzau T., Mellemkjær L., Overgaard J. Second primary cancers after adjuvant radiotherapy in early breast cancer patients: a national population based study under the Danish Breast Cancer Cooperative Group (DBCG). Radiother Oncol. 2013; 106(1): 42–9. doi: 10.1016/j.radonc.2013.01.002.
- Lang B.H., Wong I.O., Wong K.P., Cowling B.J., Wan K.Y. Risk of second primary malignancy in differentiated thyroid carcinoma treated with radioactive iodine therapy. Surgery. 2012; 151(6): 844–50. doi: 10.1016/j.surg.2011.12.019.
- Liu C.H., Chen H.J., Wang P.C., Chen H.S., Chang Y.L. Patterns of recurrence and second primary tumors in oral squamous cell carcinoma treated with surgery alone. Kaohsiung J Med Sci. 2013; 29(10): 554–9. doi: 10.1016/j.kjms.2013.03.001.


