Оценка защитных реакций различных генотипов томата при инфицировании вирусными агентами
Автор: Мэрый Л.И., Андроник Л.И., Смеря С.В., Ерхан И.Ф.
Журнал: Овощи России @vegetables
Рубрика: Защита растений
Статья в выпуске: 1 (57), 2021 года.
Бесплатный доступ
Актуальность. Окислительные реакции (на основе активности пероксидаз, РОХ; полифенолоксидазы, РРО и содержания перекиси водорода), возникающие в ответ на инфицирование или реинфицирование потомства зараженных растений, зависят от типа взаимодействия хозяин-вирус (чувствительный, толерантный, устойчивый) и характера взаимодействия с вирусной инфекцией (первичное инфицирование, реинфицирование второго и третьего поколений). Результаты. Реинфицирование вирусом аспермии томата (ВАТ) или вирусом табачной мозаики (ВТМ) потомства третьего поколения зараженных растений вызвало дифференциальные флуктуации активности POX по сравнению с потомствами, зараженными во втором поколении для генотипов Craigella (Tm-22/Tm-22) и S.pimpinellifolium, или к увеличению для генотипов Rufina и Craigella (Tm-1/Tm-1). У генотипов, содержащие гены устойчивости, Rufina и Craigella, при первичном инфицировании ВТМ различия по отношению к контролю по PPO не наблюдали, тогда как при заражении ВАТ в системах, характеризующихся восприимчивостью, установили достоверные отличия. В результате инфицирования ВТМ у чувствительного генотипа (Elvira) и толерантного (S. pimpinellifolium) отмечено увеличение значений PPO по сравнению с контролем. Одновременно у большинства генотипов, первично/вторично зараженных ВАТ или ВТМ, выявлены статистически достоверные различия по активности РОХ или РРО, и также накоплению перекиси водорода в листьях растений, что свидетельствует о специфических защитных реакциях генотипов.
Вирусы растений, антиоксидантные ферменты, пероксидаза, полифенолоксидаза, перекись водорода
Короткий адрес: https://sciup.org/140257564
IDR: 140257564 | УДК: 64:632.38 | DOI: 10.18619/2072-9146-2021-1-125-129
Текст научной статьи Оценка защитных реакций различных генотипов томата при инфицировании вирусными агентами
Relevance. Oxidative reactions (based on peroxidase activity, POX and polyphenol oxidase, PPO; hydrogen peroxide content) that occur in response to infection or reinfection of the offspring of infected plants depend on the type of host-virus interaction (sensitive,tolerant, stable) andthe nature of the interaction with viral infection (primary infection, reinfection of second and third generations).
Results. Reinfection with tomato aspermy virus (TАV) or tobacco mosaic virus (TMV) of the offspring of third infected tomato generation caused a significant decrease in POX activity compared to successive generations of infected plants (G 2 ) for Craigella (Tm-22/Tm- 22) and S. pimpinellifolium genotypes or an increase for Rufina and Craigella (Tm-1/Tm-1) ones. In genotypes containing resistance genes, Rufina and Craigella, no differences were observed in PPO of TMV primary infection and control, while significant differences were found in case of TAV (susceptibility). As a result of TMV infection, the sensitive (Elvira) and tolerant ( S. pimpinellifoli-um ) genotypes showed an increase in PPO values compared to the control. At the same time, in most genotypes primarily / secondarily infected with TAV or TMV, statistically significant differences were revealed in the activity of POX or PPO, as well as the accumulation of hydrogen peroxide in plant leaves, which indicates specific protective reactions of the genotypes.
В изменяющихся условиях среды обитания главным приоритетом любого организма является выживание и адаптация. Одновременно известно, что геном растений чувствителен к изменению внутренних метаболических процессов и варьированию факторов внешней среды. В качестве первичного ответа на внешние стрессовые воздействия возникает множество физиологических процессов, индуцирующих механизмы устойчивости или толерантности [1]. К числу ключевых защитных реакций относятся окислительный стресс [2], гибель клеток, накопление различных метаболитов с защитными функциями, синтез белков PR ( pathogen related ), а также другие факторы, участвующие в утолщении клеточной стенки и повышении активности ферментов клеточного метаболизма. В случае несовместимых взаимодействий запуск защитных механизмов приводит к возникновению сверхчувствительного ответа (RH), который связан с быстрым апоптозом и локализацией инфекции, приводящих к гибели клетки. Параллельно, с ограничивающим сверхчувствительным ответом часто устанавливается системный сигнал, который передается по растению и защищает его от других последующих заражений. Индукторами таких сигналов являются салициловая кислота, этилен или активные формы кислорода.
По мнению некоторых авторов [3, 4], защитные ферменты пероксидаза (peroxidase, РОХ) и полифенолоксидаза (polyphenol oxidase, PPO) связаны с ответными реакциями растений на стресс. Так, пероксидазы вовлечены во многие процессы, связанные с такими защитными реакциями, как сверхчувствительный ответ, лигнификация, суберизация. С увеличением активности пероксидаз в результате системно индуцированной устойчивости происходит быстрый синтез активных форм кислорода (АФК), вызывающих гибель клетки и подавление активности патогена. Активность PPO наиболее важна на начальных этапах ответной реакции, когда происходит разрушение целостности клеточной стенки и выделение фенольных соединений. PPO катализирует окисление фенолов, что в результате создает неблагоприятную среду для развития патогенов.
Естественные реакции растений при адаптации к стрессу предполагают изменения процессов обмена веществ чтобы соответствовать происходящим изменениям [5]. Многочисленные исследования свидетельствуют об ускорении реакций адаптации потомства растений, полученного в стрессовых условия, в частности при вирусной инфекции (ранее инфицированных) [6, 7].
Цель данного исследования состояла в оценке защитных реакций инфицированных и реинфицированных вирусами генотипов томата по активности окислительных ферментов и накоплению перекиси кислорода.
Материалы и методы
Оценку реакции растений томата на вирусные агенты, вирус табачной мозаики (ВТМ) или вирус аспермии томатов (ВАТ), проводили на 5 генотипах томата, с различным уровнем чувствительности: восприимчивый сорт Elvira, толерантный – дикая форма S. pimpinellifolium (SP) и генотипы, содержащие гены устойчивости к ВТМ – Craigella TM2 (Tm-22/Tm-22), Craigella TM1 (Tm-1/Tm-1) и Rufina (Tm-1/Tm-22).
В соответствии с представленной схемой, опыт включал следующие варианты: контроль – здоровые неинфициро-ванные растения, G 0 – растения первично инфицированные, G 2 – реинфицированное потомство зараженных растений, G 3 – потомства вирусных (зараженных) растений инфицированные повторно через год. В каждом варианте из 5 генотипов, инфицированных ВТМ и ВАТ, были отобраны по 5 растений. На этапе внешнего проявления симптомов собирали листья для определения активности кислых пероксидаз (POX ) и полифенолоксидазы (PPO) методом спектрофотометрии по динамике изменения оптической плотности экстракта [8]. Активность POX оценивали на основе окисления бензидина [по Бояркина], а активность PPO – по окислению п-фенилендиамина и выражали в условных единицах (изменение оптической плотности за 1 секунду на 1 грамм вегетативной массы) в трех биологических и аналитических повторностях. Наличие вирусных частиц у инокулированных растений было подтверждено методом негативного контрастирования с использованием электронной микроскопии [9]. Гистохимическую реакцию определения H 2 O 2 проводили по известным методикам [10] с некоторыми модификациями. Статистическую обработку данных осуществляли с использованием программ Statgraphics Plus5. Статистическую достоверность различий определяли на основе теста F. Графическое представление результатов выполнено с использованием Excel.
Результаты и их обсуждение
Растения генотипов с генами устойчивости и дикая форма при инфицировании ВТМ не проявили специфических симптомов заболевания и лишь небольшие некрозы были отмечены. В то же время, через 12 дней после инокуляции у восприимчивого генотипа были выявлены симптомы диффузной мозаики. В случае инфицирования ВАТ у всех растений проявился незначительный хлороз и деформация листьев. Результатами метода негативного контрастирования было подтверждено наличие в растениях вирусных частиц ВТМ и ВАТ.
Активность пероксидаз (РОХ). В результате анализа активности пероксидаз у растений 5 генотипов томата, инфицированных ВАТ и ВТМ, установлен ряд особенностей, зависящих от поколения, генотипа и использованного вирусного агента. Так, у растений, впервые зараженных ВАТ или ВТМ, значения РОХ существенно уменьшались по сравнению с контролем у генотипов Rufina, Craigella (Tm-1/Tm-1) и Elvira; в то же время у дикой формы S. pimpinellifolium при инфицировании ВТМ значения РОХ возрастали, тогда как у генотипа Craigella (Tm-22/Tm-22) выявленные различия были несущественными. Аналогичные результаты были получены и другими авторами при вирусном инфицировании томата [11].
Статистический анализ значений РОХ в реинфициро-ванных поколениях выявил наличие достоверных различий средних значений по сравнению с контролем у большинства генотипов – Craigella (Tm-22/Tm-22), Craigella (Tm-1/Tm-1), Rufina, S. pimpinellifolium и Elvira, инфицированных ВТМ и ВАТ, за исключением генотипов Craigella (Tm-1/Tm-1) и S. pimpinellifolium , зараженных ВАТ, у которых при повторном инфицировании значения РОХ были ниже контрольных (Рис. 1 A-E).
Схема эксперимента
|
Контроль |
Варианты ВАТ |
Варианты ВТМ |
|
Безвирусное потомства G 2 и G 3 от инфицированных растений |
||
Контроль M
M+ВАТ- G 0 M+ВТМ-G 0
G 2 и G 3 – реинфицирование ВАТ G 2 иG 3 – реинфицирование ВТМ (пометка в Рис.1 -VAT) (пометка в Рис.1 -VMT
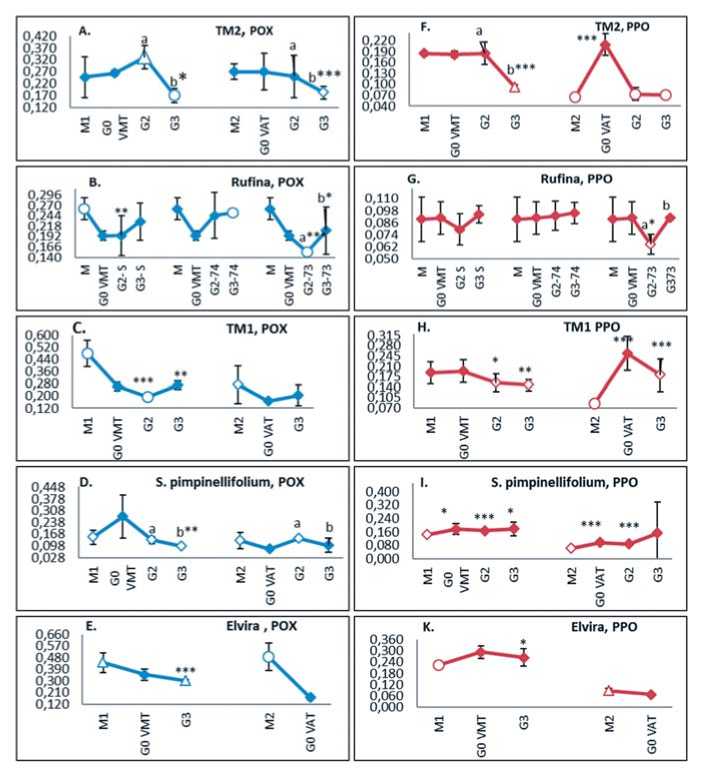
Рис. 1. Средние значения и стандартные отклонения значений активности
РОХ и РРО для генотипов томата инфицированных ВАТ и ВТМ
Примечание: M 1 и M 2 – контроль, соответствующий каждому вирусному агенту (ВАТ и ВТМ). Неокрашенные фигуры указывают варианты с достоверными различиями по отношению к варианту G 0 – растения первично инфицированные; ◄– достоверные различия при P≤0,05; □ – P≤0,01; ○ – достоверно при P≤0,001; *, **, *** – достоверные различия по отношению к контролю при P≤0,05; P≤0,01 и P≤0,001, соответственно; буквы а и б – достоверные различия между последовательными поколениями G 2 и G 3 при P≤0,05. Fig. 1. The average values and standard deviations of the values of the activity of POX and PPO for 5 tomato genotypes infected with TAV and TMV
Результаты оценки реакции потомства зараженных растений на повторное действие биотического фактора (вирус, бактерии) лимитированы лишь для некоторых видов: табак, арабидопсис и репа [7; 12; 13], при этом характер проявления и закрепления изменений указывает на их возможную передачу как минимум в 2-х поколениях. По мнению авторов, биотические факторы вызывают ряд изменений, приводящие к метилированию генетического материала и системной увеличении рекомбинации, способные передаваться в потомстве инфицированных и неинфицированных растений [6].
Специфическим моментом проведенных исследований является сравнительный анализ РОХ в вариантах, включающих реинфицирование растений. В результате сравнения первично инфицированных растений (G 0 ) и реинфицированных (G 2 ) установлено значительное снижение значений РОХ в G 2 для вариантов SP-ВТМ, TM1-ВТМ и Rufina-ВТМ, тогда как у генотипов TM2-ВТМ и SP-ВАТ значения этого показателя возросли (рис. 1. A-E). Кроме того, отмечено статистически достоверное уменьшение значений РОХ при реинфицирование третьего поколения по сравнению с первично инфицированными у генотипов TM2-ВАТ и ВТМ, SP-ВТМ и Elvira-ВТМ. Таким образом, у растений, инфицированных впервые, как правило, значения РОХ больше, чем у реинфицированных.
Аналогичные данные по изменению метаболического профиля выявлены у потомства зараженных растений табака [14]. В то же время полученные нами результаты приводят к идее, обсуждаемой в литературе, о запомина- нии растениями ранее возникших изменений. Это может быть подтверждено и результатами сравнения реинфици-рованных вариантов. Есть мнение, что в случае повторного действия фактора в течение ряда поколений, растения будет реагировать уменьшением потребления метаболитов [15].
В соответствии с полученными результатами установлены различия между потомствами первичного и повторного инфицирования. В результате длительного отсутствия фактора стресса происходит частичное ремоделирование метаболических процессов. Таким образом, выявлена тенденция снижения РОХ в растениях, реинфи-цированных в третьем поколении, по сравнению с последовательно реинфицированными поколениями для генотипов Craigella (Tm-22/Tm-22) и S. pimpinellifolium , как ВАТ, так и ВТМ. Для генотипов с геном устойчивости Tm-1 (Rufina и Craigella (Tm-1/Tm-1)) в варианте инфицирования ВТМ, наоборот, отмечено увеличение активности в G 3 по сравнению с G 2 .
Активность полифенолоксидазы (РРО). Анализ активности полифенолоксидазы (РРО) в варианте с ВТМ выявил для генотипов, содержащих гены устойчивости (Tm-1, Tm-22 и Tm-1/Tm-22), отсутствие статистических различий между контрольными и первично зараженными растениями, а для толерантной формы (S. pimpinellifolium) и чувствительного сорта (Elvira) установлено достоверное увеличение значений РРО у инфицированных растений по сравнению с контролем (рис. 1. F-K). При заражении ВАТ показано значимое увеличение РРО у растений G0 по сравнению с контролем для генотипов TM1, TM2 и SP. Следовательно, увеличение значений РРО у первично инфицированных растений по сравнению с контролем, в основном, проявляется в случаях совместимых взаимодействий.
У спонтанной формы S. pimpinellifolium влияние как ВТМ, так и ВАТ индуцировало возникновение существенных различий по РРО в контрольных вариантах по сравнению с G 2 иG 3 , которые также выражали тенденцию значительного роста (рис. 1 I). Для генотипа TM1 выявлены различия между контролем и G 3 и G 2 , при этом действие ВАТ приводило к увеличению значений РРО в G 3 в сравнении с контролем, тогда как ВТМ уменьшал значения РРО в G 2 и G 3 по отношению к контролю (рис. 1 F).
В результате сравнения вариантов с различным фито-санитарным статусом взаимодействий установлено, что у растений первично инфицированных (G 0 ) и реинфициро-ванных (G 2 или G 3 ) происходит значительное уменьшение значений PPO как для TM1, так и для TM2 вне зависимости от анализируемого вируса. В этом случае можно говорить о более слабой реакции растений на повторное действие вирусной инфекции, в некоторых вариантах такие же результаты были подтверждены и для POX.
При инфицировании ВТМ в ряду поколений G 2 и G 3 существенные различия по РРО отмечены только для генотипов, содержащих гены устойчивости, TM2 и Rufina. Обобщая вышесказанное, следует отметить, что в случае заражения ВТМ генотипов с генами устойчивости к этому вирусу не обнаружено различий между впервые инфицированными и контрольными растениями, но в случае заражения ВАТ реакция генотипов иная, связанная с восприимчивым типом ответа.
В то же время в случае инфицирования ВАТ и ВТМ реакция дикой и восприимчивой формы заключалась в изменении значений РРО. Принимая во внимание поливалентную роль РРО, особенно в качестве индикатора патогенеза, возможна зависимость ответных реакций от типа взаимодействий – совместимое или несовместимое. Особый интерес представляют различия, возникающие в результате сравнении вариантов одного генотипа при первичном и повторном инфицировании (G 2 или G 3 ), а также различия в ряду последовательно реинфицированных поколений G 2 и G 3 .
Гистохимическая реакция на наличие перекиси водо рода (ПВ). Накопления активных форм кислорода (АФК), в том числе H2O2, имеют важное значение для растения, в первую очередь, в локализации патогена и образовании сверхчувствительного ответа, впоследствии вызывая активацию генов для предотвращения системного эффекта на уровне растительного организма [16]. В то же время, на первом этапе происходит высвобождение умеренного количества АФК, а на втором этапе, который происходит позже, отмечается синтез АФК в гораздо больших количествах. Роль двухфазного ответа очень важна для обеспечения защитной реакции, так как в случае совместимых взаимодействий происходит только первый этап синтеза. Анализы, проведенные через 72 часа после инфицирования, выявили гистохимические накопления ПВ в местах поражений, вызванных механической инокуляцией. Впоследствии избыточные накопления были обнаружены в листьях верхних ярусов, которые не подвергались инокуляции и механическому травмированию. Следует отметить, что в динамике отмечено варьирование в зависимости от генотипа и варианта (рис. 2). Так, в случае инфицирования ВТМ через 14 дней после инокуляции у растений G2 выявлено более интенсивное накопление ПВ по сравнению с G0 и G3 для генотипов Rufina и S. pimpinellifolium, а для восприимчивого сорта Elvira и генотипов с генами устойчивости TM1 и TM2 отмечены большие накопления ПВ у первично инфицированных растений и уменьшение в реинфицирование последующих поколений G2 и G3. Этот факт может быть представлен по интенсивностью окрашивания в соответствии с накоплением АФК по следующей схеме: M < G3 < G2 < G0 (для TM1, TM2 и Elvira) или M < G3 < G0 АФК, в частности перекись водорода, обладают двойным действием, вызывая реструктуризацию клеточных органелл, некротизацию клеток, приводящие к изолированию патогена (i) и сигналы индукции антиоксидантного эффекта и активацией генов, связанных с патогенезом (ii) [16]. Предполагается, что при совместимом взаимодействии ранняя активация антиоксидантных ферментов может сопровождаться индукцией сигналов АФК, участвующих в защитных реакциях хозяина. Однако реакция антиоксидантных ферментов в таких системах очень разнообразна, и может быть зарегистрировано как увеличение, так и снижение активности антиоксидантных ферментов [17]. Известно, что такие флуктуации окислительного стресса являются проявлением стратегий репликации вирусов [18]. В случае совместимых инфекций быстрая и эффективная передача сигналов АФК приводит к частичному подавлению синтеза вирусных компонентов [19; 20]. На ранних стадиях патогенеза на короткое время активируются антиоксидантные ответы, которые препятствуют передаче сигналов SRO, необходимых для инициации защитных ответов. На поздних стадиях патогенеза наблюдается дисбаланс метаболизма антиоксидантных ферментов. Эффективность защитных реакций при взаимодействии растения с вирусом определяется скоростью реакции хозяина, которой способствует раннему накоплению и локализации АФК в местах заражения. При менее эффективном антиоксидантном ответе допускается определенная степень репликации вируса и развития окислительного стресса [16]. В то же время роль АФК и метаболизма антиоксидантных ферментов в развитии реакций вирус-хозяин, а также в генерации сигналов патогенности в местах, удаленных от места инокуляции, а также в последующих поколениях, остается неясной. Информация о дифференцированном ответе растений в последующих поколениях при первичном или повторном инфицировании вирусами рассматривается как проявление памяти на воздействие фактора стресса, имеющее эпигенетический характер [21], основанной на взаимодействие генотип х патоген и проявленной в последующих поколениях в виде изменений биохимического статуса при повторном действии фактора. Заключение Дифференцированный уровень активности POX, PPO и накопления перекиси водорода у растений томата в результате инфицирования ВАТ или ВТМ зависит от комбинации генотип-вирус и фитосанитарного статуса (первичное инфицирование или реинфицирование). Первичное инфицирование томатов вирусами ВАТ или ВТМ вызывает достоверные изменения активности пероксидаз по сравнению со здоровыми, а также реин-фицироваными растениями (за исключением генотипа Craigella (Tm-22/Tm-22). В зависимости от типа взаимодействия (совместимое или несовместимое) установлены четкие различия для уровня активности РРО у инфицированных и контрольных растений. Так, при несовместимом взаимодействии, заражение ВТМ генотипов с генами устойчивости не приводило к возникновению различий Рис. 2. Макроскопическая экспрессия накопления перекиси водорода в листьях растений инфицированных ВАТ или ВТМ: A, B – G0 и G2 через 6 дней после инокулирования ВТМ, S.pimpinellifolium и F, G – через 14 дней после инокулирования S.pimpinellifolium; C, D, E – контроль, G0 иG2, соответственно при инфицировании ВАТ, TM1; H, I, J – G0, G2, G3 – инфицирование ВТМ, Rufina (x 15); K, L, M, N, O – генотипы G0 Elvira, S. pimpinellifolium, TM1, TM2, Rufina,соответственно на 12 день после инокулирования ВТМ . Fig. 2. Macroscopic expression ofhydrogen peroxide accumulation in leaves infected with TAV or TMV между контрольными и инфицированными растениями, тогда как у толерантного и восприимчивого генотипов активность PPO у инфицированных растений возрастает. Увеличение PPO описано для всех анализированных комбинациях хозяин-патоген инфицированных ВАТ, характеризующихся совместимым типом взаимодействия. Интенсивность накопления перекиси водорода при инфицировании ВАТ или ВТМ зависит от реакции генотипа, выражая тенденции увеличения у восприимчивых генотипов и при повторном инфицировании. Выявленные различия в проявлении активности POX, PPO или накоплению перекиси водорода в зависимости от фитосанитарного статуса растений – первичном или реинфицировании потомства зараженных растений, проявляются в подавление активности антиоксидантных ферментов при повторном заражение, и более усиленном накоплении перекиси водорода, уровень которого зависит от комбинации генотип-вирус. Об авторах: Ирина Федоровна Ерхан – младший начный сотрудник Aboutthe authors: Liliana I. Marii – Cand. Sci. (Biology), Head of the laboratory, Larisa I. Andronic – Cand. Sci. (Biology), Director of the institute Svetlana V. Smerea – Cand. Sci. (Biology), Deputy Director Irina F. Erhan – Junior Researcher • Литература / References 1. Arnholdt-Schmitt B. Stress-Induced Cell Reprogramming. Role for Global Genome Regulation? Plant Physiology. 2004;(136):2579–2586. 2. Nath M., Bhatt D., Prasad R. et al. Reactive oxygen species generation-scavenging and signaling during plant-arbuscular Mycorrhizal and Piriformospora indica interaction under stress condition. Front Plant Sci. 2016;(7):1574-1584. 3. Taranto F., Pasqualone A., Mangini G. et al. Polyphenol oxidases in crops: Biochemical, physiological and genetic aspects. Int. J. Mol. Sci. 2017;18(2):377-393. 4. Almagro L., Gómez Ros L., Belchi-Navarro S. et al. Class III peroxidases in plant defense reactions. Journal of Experimental Botany, 2009;60(2):377–390. 5. Saijo Y., Loo E. Plant immunity in signal integration between biotic and abiotic stress responses. New Phytologist, 2020;(225):87–104. 6. Kathiria P., Sidler C., Golubov A. et al. Tobacco mosaic virus infection results in an increase in recombination frequency and resistance to viral, bacterial, and fungal pathogens in the progeny of infected tobacco plants. Plant Physiol. 2010;153(4):1859-1870. 7. Boyko A., Kovalchuk I. Genetic and epigenetic effects of plant–pathogen interactions: An evolutionary perspective. Molecular Plant, 2011;4(6):1014–1023. 8. Ермаков А.И., Арасимович В.В., Ярош Н.П. и др. Методы биохимического исследования растений. Л.: Агропромиздат. 1987. 430 с. 9. Hitchborn J.H., Hills G.I. The use of negative staining in the electron microscopic examination of plant viruses in crude extracts. Virology. 1965;(27):528-540. 10. Thordal-Christensen H., Zhang Z., Wei Y. and Collinge, D. B. Subcellular localization of H2O2 in plants. H2O2 accumulation in papillae and hypersensitive response during the barley-powdery mildew interaction. Plant J. 1997;(11):1187-1194. 11. Matkovics B., Szabo L., Varga S. I. Study of host-parasite interaction in tomato plants. Acta Biologica Szeged. 1981;27(1-4):17-23. 12. Boyko A.,Kathiria P., Zemp F. et al. Transgenerational changes in the genome stability and methylation in pathogen-infected plants: (virus-induced plant genome instability). Nucleic Acids Res. 2007;35(5):1714-1725. 13. Kalischuk M., Johnson D., Kawchuk L. Priming with a double-stranded DNA virus alters Brassica rapa seed architecture and facilitates a defense response. Gene. 2015;557(2):130-137. 14. Mandal R., P., Psychogios N. et al. Progeny of tobacco mosaic virus-infected Nicotiana tabacum plants exhibit trans-generational changes in metabolic profiles. Biocatalysis and Agricultural Biotechnology. 2012;1(2):115-123. 15. Balmer A., Pastor V., Gamir J. et al. The 'prime-one': towards a holistic approach to priming. Trends Plant Sci. 2015;20(7):443-452. 16. Hernández J., Gábor G.M., Clemente-Moreno J. et al. Oxidative stress and antioxidative responses in plant–virus interactions. Physiological and Molecular Plant Pathology. 2016;(94):134-148. 17. Clarke S.F., Guy P.L., Burritt D.J. and Jameson P.E. Changes in the activities of antioxidant enzymes in response to virus infection and hormone treatment. Physiol Plant. 2002;(114):157–164. 18. Glingston R. S., Deb R., Kumar S., Nagotu S. Organelle dynamics and viral infections: at cross roads. Microbes and Infection. 2019;21(1):20-32. 19. Bacsó R., Hafez Y. M., Kiraly Z. and Kiraly L. Inhibition of virus replication and symptom expression by reactive oxygen species in tobacco infected with Tobacco mosaic virus. Acta Phytopathology Entomol Hung. 2011;(46):1–10. 20. Hakmaoui A., Pérez-Bueno M.L., García-Fontana B. et al. Analysis of the antioxidant response of Nicotiana benthamiana to infection with two strains of Pepper mild mottle virus. J. Exp. Bot. 2012;(63):5487-5496. 21. Bilichak A., Ilnytskyy Y., Woycicki R. et al. The elucidation of stress memory inheritance in Brassica rapa plants. Front Plant Sci. 2015;(6):5-23.
Список литературы Оценка защитных реакций различных генотипов томата при инфицировании вирусными агентами
- Arnholdt-Schmitt B. Stress-Induced Cell Reprogramming. Role for Global Genome Regulation? Plant Physiology. 2004;(136):2579-2586.
- Nath M., Bhatt D., Prasad R. et al. Reactive oxygen species generation-scavenging and signaling during plant-arbuscular Mycorrhizal and Piriformospora indica interaction under stress condition. Front Plant Sci. 2016;(7):1574-1584.
- Taranto F., Pasqualone A., Mangini G. et al. Polyphenol oxidases in crops: Biochemical, physiological and genetic aspects. Int. J. Mol. Sci. 2017;18(2):377-393.
- Almagro L., Gómez Ros L., Belchi-Navarro S. et al. Class III peroxidases in plant defense reactions. Journal of Experimental Botany, 2009;60(2):377-390.
- Saijo Y., Loo E. Plant immunity in signal integration between biotic and abiotic stress responses. New Phytologist, 2020;(225):87-104.
- Kathiria P., Sidler C., Golubov A. et al. Tobacco mosaic virus infection results in an increase in recombination frequency and resistance to viral, bacterial, and fungal pathogens in the progeny of infected tobacco plants. Plant Physiol. 2010;153(4):1859-1870.
- Boyko A., Kovalchuk I. Genetic and epigenetic effects of plant-pathogen interactions: An evolutionary perspective. Molecular Plant, 2011;4(6):1014-1023.
- Ермаков А.И., Арасимович В.В., Ярош Н.П. и др. Методы биохимического исследования растений. Л.: Агропромиздат. 1987. 430 с.
- Hitchborn J.H., Hills G.I. The use of negative staining in the electron microscopic examination of plant viruses in crude extracts. Virology. 1965;(27):528-540.
- Thordal-Christensen H., Zhang Z., Wei Y. and Collinge, D. B. Subcellular localization of H2O2 in plants. H2O2 accumulation in papillae and hypersensitive response during the barley-powdery mildew interaction. Plant J. 1997;(11):1187-1194.
- Matkovics B., Szabo L., Varga S. I. Study of host-parasite interaction in tomato plants. Acta Biologica Szeged. 1981;27(1-4):17-23.
- Boyko A.,Kathiria P., Zemp F. et al. Transgenerational changes in the genome stability and methylation in pathogen-infected plants: (virus-induced plant genome instability). Nucleic Acids Res. 2007;35(5):1714-1725.
- Kalischuk M., Johnson D., Kawchuk L. Priming with a double-stranded DNA virus alters Brassica rapa seed architecture and facilitates a defense response. Gene. 2015;557(2):130-137.
- Mandal R., P., Psychogios N. et al. Progeny of tobacco mosaic virus-infected Nicotiana tabacum plants exhibit trans-generational changes in metabolic profiles. Biocatalysis and Agricultural Biotechnology. 2012;1(2):115-123.
- Balmer A., Pastor V., Gamir J. et al. The 'prime-one': towards a holistic approach to priming. Trends Plant Sci. 2015;20(7):443-452.
- Hernández J., Gábor G.M., Clemente-Moreno J. et al. Oxidative stress and antioxidative responses in plant-virus interactions. Physiological and Molecular Plant Pathology. 2016;(94):134-148.
- Clarke S.F., Guy P.L., Burritt D.J. and Jameson P.E. Changes in the activities of antioxidant enzymes in response to virus infection and hormone treatment. Physiol Plant. 2002;(114):157-164.
- Glingston R. S., Deb R., Kumar S., Nagotu S. Organelle dynamics and viral infections: at cross roads. Microbes and Infection. 2019;21(1):20-32.
- Bacsó R., Hafez Y. M., Kiraly Z. and Kiraly L. Inhibition of virus replication and symptom expression by reactive oxygen species in tobacco infected with Tobacco mosaic virus. Acta Phytopathology Entomol Hung. 2011;(46):1-10.
- Hakmaoui A., Pérez-Bueno M.L., García-Fontana B. et al. Analysis of the antioxidant response of Nicotiana benthamiana to infection with two strains of Pepper mild mottle virus. J. Exp. Bot. 2012;(63):5487-5496.
- Bilichak A., Ilnytskyy Y., Woycicki R. et al. The elucidation of stress memory inheritance in Brassica rapa plants. Front Plant Sci. 2015;(6):5-23.


