Оценочные шкалы и показатели диффузионно-тензерной МРТ в прогнозировании регресса двигательного дефицита у пациентов, перенесших церебральный инсульт
Автор: Гизатуллин Р.Р., Ахмадеева Л.Р., Байков Д.Э., Байкова Г.В.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Обзоры
Статья в выпуске: 3, 2024 года.
Бесплатный доступ
Инсульт и последующие вероятные двигательные нарушения являются значимой медико-социальной проблемой. В 2021 г. в Российской Федерации зарегистрировано 500 тыс. впервые выявленных инсультов. К трудовой деятельности в течение первого года после перенесенного инсульта возвращается не более 10 % людей, инвалидами на всю жизнь остаются 30 %. В связи с этим актуальной представляется задача прогнозирования моторных исходов заболевания в различные периоды у пациентов, перенесших церебральный инсульт. Существующие в настоящее время балльные шкалы тяжести состояния в большей степени применяются для характеристики ранних двигательных нарушений, а отдаленные последствия часто остаются не оцененными. Не существует методов прогнозирования степени двигательных нарушений у пациентов, перенесших церебральный инсульт, в долгосрочной перспективе. Объективно информацию о соотношении объема поражения головного мозга и вероятности последующей компенсации двигательного дефицита прижизненно можно получить по нейровизуализационным изображениям. Прогнозирование выраженности двигательных нарушений потенциально возможно путем анализа состояния проводящих путей центральной нервной системы, в первую очередь кортикоспинальных трактов. В настоящей работе представлено наше видение использования клинико-нейровизуализационного метода для прогнозирования регресса моторных последствий перенесенного церебрального инсульта с применением неврологических оценочных шкал и визуализационной оценки состояния кортикоспинальных трактов при магнитно-резонансной томографии на основании анализа современных публикаций. Клинические шкалы, используемые в остром периоде острого нарушения мозгового кровообращения, по данным литературы, коррелируют с оценкой кортикоспинальных трактов, в связи с чем комбинация данных методов является перспективной с точки зрения оценки регресса двигательного дефицита.
Инсульт, двигательный дефицит, реабилитация, нейровизуализация
Короткий адрес: https://sciup.org/14131094
IDR: 14131094 | УДК: 616.831-005.4 | DOI: 10.34014/2227-1848-2024-3-6-16
Текст обзорной статьи Оценочные шкалы и показатели диффузионно-тензерной МРТ в прогнозировании регресса двигательного дефицита у пациентов, перенесших церебральный инсульт
Введение. Церебральный инсульт - одна из ведущих причин инвалидизации, связанная с нарушением моторики у большинства пациентов в острой фазе и медленным регрессом двигательного дефицита в отсроченный период [1]. На сегодняшний день существуют две принципиально различные методики прогнозирования регресса клинических последствий заболевания - оценка состояния поражения структур головного мозга по данным методов нейровизуализации и применение клинических оценочных шкал. Ведущим визуализационным методом выступает магнитно-резонансная томография (МРТ), в т.ч. диффузионно-тензорная МРТ (дМРТ), где одним из основных биомаркеров является
|
оценка фракционной анизотропии (ФА) кортикоспинального проводящего пути (рис. 1). Диффузионно-тензорная МРТ дает возможность получить большое количество дан о H и ст О /НЯ! CD Пирамиды Pyramids Перекрест пирамид Pyramidal decussation Боковой кортикоспинальный тракт Lateral corticospinal tract К скелетной мышце ’ L To skeletal muscle Нижний мотонейрон Lower motor neuron Верхний мотонейрон Upper motor neuron |
ных, количественно и качественно характеризующих циркуляцию и массоперенос в организме человека на основе оценки свободной диффузии молекул [2, 3]. Прецентральная извилина Precentral gyrus Ножка мозга Cerebral peduncle Средний мозг Midbrain Продолговатый мозг 11 / Medulla oblongata Передний кортикоспинальный тракт Anterior corticospinal tract Аксон верхнего мотонейрона Axons from upper motor neuron Спинной мозг Spinal cord Нижний мотонейрон Lower motor neuron |
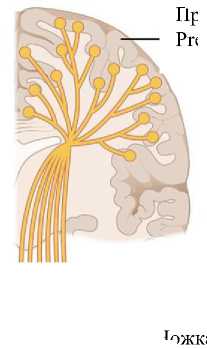
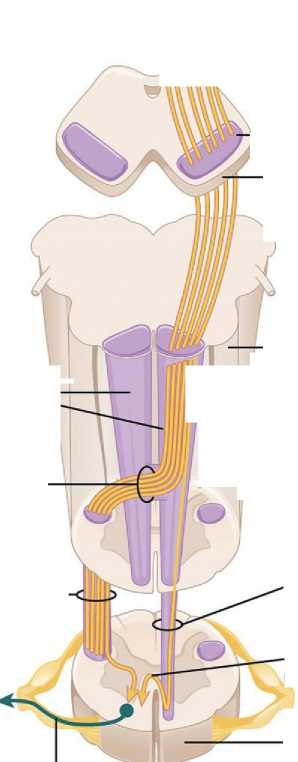
Рис. 1. Кортикоспинальный путь
Fig. 1. Corticospinal tract
Опубликованы данные о корреляции между количественными показателями дМРТ, включая ФА, и клинической картиной в течение первых 24 ч, 2–7 дней и более 7–90 дней от развития инсульта [4–7].
Цель исследования. Анализ предиктивного потенциала комбинации существующих клинических балльных систем оценки двигательного дефицита у пациентов, перенесших инсульт, и диагностических возможностей дМРТ в прогнозировании моторных исходов перенесенного церебрального инсульта на основании современных российских и зарубежных публикаций.
С учетом данных литературы и полученной нами динамики показателей диффузии можно предположить, что в раннем постинсультном периоде наблюдается прогрессирование процесса дезорганизации белого вещества с нарушением аксональной однонаправленности [8–10].
Материалы и методы. В работе рассмотрены и проанализированы доступные медицинской общественности публикации за последние 30 лет, указывающие на возможности характеризовать динамику изменений двигательных нарушений на основе применения клинических оценочных шкал и данных дМРТ для повышения прогностической ценности моделей регресса моторного дефицита после церебрального инсульта.
Результаты и обсуждение. В настоящее время существует значительное количество клинических методик, позволяющих количественно охарактеризовать объем движений в верхних конечностях и подходящих для детального исследования двигательной активности отдельных сегментов, в частности шкала Фугл-Мейера, двигательный функциональный тест Вольфа, шкала оценки движений и тест изучения деятельности руки [11–15]. Большинство проанализированных работ, посвященных восстановлению двигательного дефицита после церебрального инсульта и опубликованных до 2015 г., указывало на преобладающее значение применения шкалы Фугл-Мейера в разные периоды инсульта. Около половины всех выживших после инсульта пациентов в указанных работах имели разнообразные персистирующие неврологические нарушения, коррелирующие с различной степенью инвалидизации, при этом нарушение функций верхних конечностей являлись самыми частыми [16–19]. В последующем в представленных публикациях было отмечено, что до 85 % пациентов обнаруживали двигательный дефицит в руках на начальных этапах восстановления, тогда как функциональные проблемы сохранялись у них в 45–75 % случаев еще 3–6 мес. после перенесенной сосудистой катастрофы [20–22]. Таким образом, для большого числа пациентов актуальными остаются вопросы прогноза и подходов к методам помощи для уменьшения выраженности двигательного дефицита [23–25]. В связи с этим реалистичная оценка ожидаемого результата является актуальной задачей [26, 27].
Из проанализированных нами литературных источников видно, что прогнозы по выживанию, восстановлению моторики и степени адаптации к повседневной жизни расписаны достаточно подробно [28–31]. Однако остается неясной возможность прогнозирования восстановления специфического неврологического дефицита в виде нарушения моторных функций верхних конечностей. Большинство авторов оценивало регресс двигательного дефицита исключительно верхней конечности [32]. В некоторых классических публикациях указывалось на ценность различных предикторов при многомерном подходе [33–36]. Акцент был сделан на то, что степень исходного двигательного дефицита является наиболее важной детерминантой функционального восстановления руки. Так, на основании клинического обследования в острой фазе были спрогнозированы функциональные характеристики верхних конечностей через 12 мес. после инсульта [37]. Выборка состояла из поступивших в профильные отделения пациентов, жизненные показатели которых позволяли включить их в рандомизированные исследования. Однако не было определено четких критериев отбора для оценки двигательного дефицита верхних конечностей. В результате наблюдений авторы подтвердили, что самый быстрый процесс восстановления функций верхних конечностей проходит в течение первых двух месяцев после перенесенной катастрофы, в последующем – в период с двух до шести месяцев - регресс двигательного дефицита также имеет место, но протекает с существенно меньшей скоростью [38, 39].
В более широком аспекте большинство исследователей делает акцент на восстановлении двигательного дефицита, а не на функциональных способностях верхних конечностей, хотя функциональное восстановление, несомненно, более значимо для пациентов в плане качества жизни и устранений последствий перенесенного инсульта. Ряд авторов указывает на очень высокую взаимосвязь (p<0,05) между простым моторным и функциональным восстановлением после инсульта, где прогноз регресса двигательного дефицита пораженной руки у больных с инсультом может оказаться более точным по сравнению с прогнозом функционального восстановления [40-42].
Таким образом, оценка движений верхней конечности, осуществляемая на более ранней стадии инсульта, может рассматриваться как сильная прогностическая детерминанта восстановления двигательной функции на более поздней стадии [43–46]. Также дополнительными переменными, способными внести значительный вклад в прогнозирование регресса двигательного дефицита, могут явиться мышечный тонус и проприоцепция.
На основе проанализированных публикаций можно прийти к заключению, что прогнозирование восстановления движений после инсульта с помощью клинических шкал затрагивает только оценку динамики восстановления двигательного и функционального дефицита в течении 6 мес. после перенесенной цереброваскулярной катастрофы. Наиболее точные результаты регресса двигательных нарушений могут быть спрогнозированы для пациентов, перенесших инсульт с нарушением функции верхних конечностей, при использовании нескольких клинических показателей. Точность прогнозирования существенно возрастает при оценке показателей в динамике.
В последнее десятилетие набирает популярность оценка потенциала восстановления двигательного дефицита после инсульта с помощью нейроанатомических и нейрофизиологических методик, таких как функциональная МРТ с построением проводящих путей головного мозга, оценкой фракционной анизотропии и коэффициента диффузии. Ранее полагалось, что исходное состояние двигательных нарушений верхней конечности является наиболее влиятельным предиктором восстановления функций верхней конечности [47]. При этом не следует забывать, что прогнозирование двигательного восстановления может быть особенно затруднено у пациентов с тяжелыми начальными нарушениями [48]. Тогда степень повреждения кортикоспинального тракта (КСТ) может быть напрямую связана с двигательными нарушениями [49]. Плато двигательных исходов у пациентов с «хроническими» (как часто пишется в зарубежной литературе) стадиями инсульта тесно связано с целостностью КСТ, и в случаях значительного повреждения КСТ по данным МРТ ожидается плохой двигательный результат [50]. Такое повреждение КСТ может быть оценено с использованием различных методов. Ранее сообщалось, что по сравнению с оценкой клинических показателей анализ целостности КСТ по наличию вызванных моторных потенциалов (ВМП) имеет больший потенциал для прогнозирования восстановления двигательного дефицита [49]. Хотя метод ВМП обладает высокой специфичностью (99 %), чувствительность его значительно варьирует (62-94 %). Было показано, что у части пациентов, исходные ВМП у которых отсутствовали, двигательная функция в последующем частично восстанавливалась [26, 49, 50].
В целом оценка целостности КСТ с помощью диффузионно-тензорной визуализации может отражать дегенерацию белого вещества с помощью измерения снижения ФА дистальнее зоны инсульта и количественной оценки вовлеченных волокон проводящих путей [27].
Ниже мы приводим примеры из собственных наблюдений (рис. 2, 3).
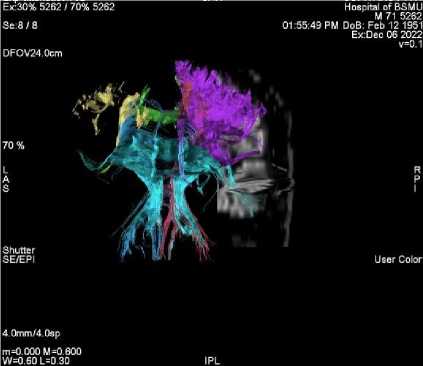
Рис. 2. Трехмерная реконструкция проводящих путей головного мозга, где видно, что на стороне инсульта плотность трактов снижена
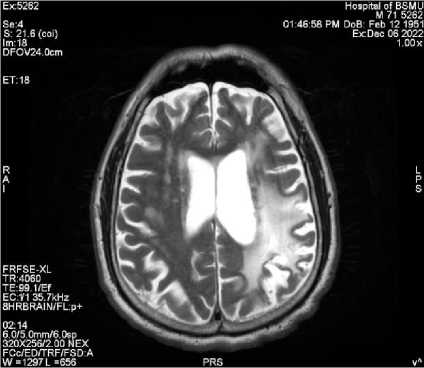
Рис. 3. Т2-изображение пациента, перенесешго инсульт в левом полушарии головного мозга
Fig. 2. 3D reconstruction of the brain pathways, showing that their density on the side of the stroke is reduced
Fig. 3. T2 image of a patient with a left hemisphere stroke
Однако измерения вдоль КСТ при дМРТ в первые несколько недель могут неправильно отражать повреждения волокон, потому что Вал-лерова дегенерация на ранних стадиях обычно малозаметна [24]. Тем не менее возможность объективно стандартизировать полученные изображения при МРТ делают этот метод потенциально притягательным в оценке прогнозирования исходов инсульта [23]. В последующем рядом авторов было проведено исследование, направленное на стандартизацию пространственной нормализации полученных изображений, при которой изображения пораженной области преобразовывались в эталонные изображения нормальных субъектов [30]. Далее авторами была выявлена корреляционная зависимость между поражением КСТ на одной стороне и компенсаторным усилением проводящих путей на другой у пациентов, перенесших инсульт. Также была продемонстрирована зависимость между двигательными функциями и степенью повреждения фрагмента тракта от двигательной коры, тогда как исходная двигательная функция и объем инфаркта были слабыми предикторами эффективности лечения больных, перенесших инсульт и находящихся на восстановительном лечении [31]. В последующем модели прогнозирования динамики состояния пациентов, перенесших церебральный инсульт, включающие в себя и данные о морофологиче-ском повреждении КСТ, и клиническую картину, считались более точными, нежели модели, использующие только один биомаркер, будь то клиническая или нейровизуализационная оценка [32]. Таким образом, оптимальным решением в прогнозировании регресса двигательного дефицита у пациентов, перенесших инсульт, является комбинация нейровизуализационных методик и клинических оценочных шкал, учитывающих объективные неврологические проявления заболевания.
Заключение. Моторное восстановление верхних и нижних конечностей у пациентов, перенесших инсульт, возможно прогнозировать по исходным баллам шкалы Фугл-Мейер, но при этом следует понимать, что получение достоверных данных по восстановлению двигательного дефицита с использованием лишь исходных баллов клинических шкал затруднено, необходимо также оценить морфологическую целостность проводящих путей. Таким образом, на сегодняшний день актуальной методикой оценки регресса двигательного дефицита в результате церебрального инсульта является комбинированный подход на основе данных МРТ с учетом определенных нейрови-зуализационных паттернов и применения клинических количественных оценочных шкал.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
Обзор литературы, написание текста: Гизатуллин Р.Р.
Концепция и дизайн исследования: Ахмадеева Л.Р., Байков Д.Э.
Обсуждение, академическое редактирование текста: Байкова Г.В.
Список литературы Оценочные шкалы и показатели диффузионно-тензерной МРТ в прогнозировании регресса двигательного дефицита у пациентов, перенесших церебральный инсульт
- Van der Vliet R., eds. Predicting upper limb motor impairment recovery after stroke: a mixture model. Annals of Neurology. 2020; 87 (3): 383-393.
- Christidi F., eds. Diffusion Tensor Imaging as a Prognostic Tool for Recovery in Acute and Hyperacute Stroke. Neurology International. 2022; 14 (4): 841-874.
- TennantA., eds. Outcome following stroke. Disability and Rehabilitation. 1997; 19 (7): 278-284.
- Wilkinson P.R., eds. A long-term follow-up of stroke patients. Stroke. 1997; 28 (3): 507-512.
- Wade D.T., Skilbeck C.E., Langton Hewer R. Predicting Barthel ADL Score at 6 months after an acute stroke. Archives of Physical Medicine and Rehabilitation. 1983; 64: 24-28.
- Parker V.M., Wade D.T., Hewer R.L. Loss of arm function after stroke: measurement, frequency, and recovery. International Rehabilitation Medicine. 1986; 8 (2), 69-73.
- Olsen T.S. Arm and leg paresis as outcome predictors in stroke rehabilitation. Stroke. 1990; 21 (2): 247-251.
- Feys H., eds. Predicting motor recovery of the upper limb after stroke rehabilitation: value of a clinical examination. Physiotherapy Research International. 2000; 5 (1): 1-18.
- Henley S., eds. Who goes home? Predictive factors in stroke recovery. Journal of Neurology, Neurosurgery & Psychiatry. 1985; 48 (1): 1-6.
- Wade D.T., Langton Hewer R. Outlook after an acute stroke: urinary incontinence and loss of consciousness compared in 532 patients. Quarterly Journal of Medicine. 1985; 56: 601-608.
- Barer D.H., Mitchell J.R.A. Predicting the outcome of acute stroke: do multivariate models help? QJM: An International Journal of Medicine. 1989; 70 (1): 27-39.
- Kalra L., Smith D.H., Crome P. Stroke in patients aged over 75 years: outcome and predictors. Postgraduate Medical Journal. 1993; 69 (807): 33-36.
- Jimenez J., Morgan P.P. Predicting improvement in stroke patients referred for inpatient rehabilitation. Canadian Medical Association Journal. 1979; 121 (11): 1481.
- Henley S., eds. Who goes home? Predictive factors in stroke recovery. Journal of Neurology, Neurosurgery & Psychiatry. 1985; 48 (1): 1-6.
- Galski T., eds. Predicting length of stay, functional outcome, and aftercare in the rehabilitation of stroke patients. The dominant role of higher-order cognition. Stroke. 1993; 24 (12): 1794-1800.
- Engberg A., Garde B., Kreiner S. Rasch analysis in the development of a rating scale for assessment of mobility after stroke. Acta Neurologica Scandinavica. 1995; 91 (2): 118-127.
- Gowland C. Predicting sensorimotor recovery following stroke rehabilitation. Physiotherapy Canada. 1984; 36: 313-320.
- Loewen S.C., Anderson B.A. Predictors of stroke outcome using objective measurement scales. Stroke. 1990; 21 (1): 78-81.
- Duncan P. W., PropstM., Nelson S.G. Reliability of the Fugl-Meyer assessment of sensorimotor recovery following cerebrovascular accident. Physical Therapy. 1983; 63 (10): 1606-1610.
- De Weerdt W., Lincoln N.B., Harrison M.A. Prediction of arm and hand function recovery in stroke patients. International Journal of Rehabilitation Research. 1987; 10: 110-112.
- De Weerdt W.J.G., Harrison M.A. Measuring recovery of arm-hand function in stroke patients: a comparison of the Brunnstrom-Fugl-Meyer test and the Action Research test. Physiotherapy Canada. 1985; 37: 65-70.
- RandD., Eng J.J. Predicting daily use ofthe affected upper extremity 1 year after stroke. Journal of Stroke and Cerebrovascular Diseases. 2015; 24 (2): 274-283.
- Liu G., eds. Motor recovery prediction with clinical assessment and local diffusion homogeneity after acute subcortical infarction. Stroke. 2017; 48 (8): 2121-2128.
- Puig J., eds. Diffusion tensor imaging as a prognostic biomarker for motor recovery and rehabilitation after stroke. Neuroradiology. 2017; 59: 343-351.
- Bigourdan A., eds. Early fiber number ratio is a surrogate of corticospinal tract integrity and predicts motor recovery after stroke. Stroke. 2016; 47 (4): 1053-1059.
- Hendricks H. T., eds. Systematic review for the early prediction of motor and functional outcome after stroke by using motor-evoked potentials. Archives ofPhysical Medicine and Rehabilitation. 2002; 83 (9): 1303-1308.
- Thomalla G., eds. Diffusion tensor imaging detects early Wallerian degeneration of the pyramidal tract after ischemic stroke. Neuroimage. 2004; 22 (4): 1767-1774.
- Puig J., eds. Wallerian degeneration in the corticospinal tract evaluated by diffusion tensor imaging correlates with motor deficit 30 days after middle cerebral artery ischemic stroke. American Journal of Neuroradiology. 2010; 31 (7): 1324-1330.
- Kunimatsu A., eds. Utilization of diffusion tensor tractography in combination with spatial normalization to assess involvement of the corticospinal tract in capsular/pericapsular stroke: feasibility and clinical implications. Journal of Magnetic Resonance Imaging: An Official Journal of the International Society for Magnetic Resonance in Medicine. 2007; 26 (6): 1399-1404.
- Newton J.M., WardN.S., Parker G.J.M., eds. Non-invasive mapping of corticofugal fibres from multiple motor areas - elevance to stroke recovery. Brain. 2006; 129 (7): 1844-1858.
- Riley J.D., eds. Anatomy of stroke injury predicts gains from therapy. Stroke. 2011; 42 (2): 421-426.
- Kim B., Winstein C. Can neurological biomarkers of brain impairment be used to predict poststroke motor recovery? A systematic review. Neurorehabilitation and Neural Repair. 2017; 31 (1): 3-24.
- BoydL.A., eds. Biomarkers of stroke recovery: consensus-based core recommendations from the stroke recovery and rehabilitation roundtable. International Journal of Stroke. 2017; 12 (5): 480-493.
- Кремнева Е.И. Оценка микроструктуры белого вещества головного мозга по данным диффузионной магнитно-резонансной томографии при церебральной микроангиопатии. Анналы клинической и экспериментальной неврологии. 2020; 14 (1): 33-43.
- Farkhadovna M.Z., eds. Clinical and neuroimaging techniques in prediction of regress of motor deficiency after cerebral stroke for prevention of falls. Journal of Biomedicine and Practice. 2023; 8 (2).
- Туркин А.М. Отек головного мозга - возможности магнитно-резонансной томографии. Вестник рентгенологии и радиологии. 2009; 4-6: 4-11.
- Дробаха В.Е., Кулеш А.А., Шестаков В.В. Фракционная анизотропия белого и серого вещества головного мозга в остром периоде ишемического инсульта как маркер неврологического, когнитивного и функционального статуса. Медицинская визуализация. 2015; 6: 8-15.
- Chen J.L., Schlaug G. Resting state interhemispheric motor connectivity and white matter integrity correlate with motor impairment in chronic stroke. Frontiers Neurology. 2013; 4: 1-7.
- Stinear C.M., Barber P.A., Smale P.R., eds. Functional potential in chronic stroke patients depends on corticospinal tract integrity. Brain. 2007; 130 (pt 1): 170-180.
- Paul T., CieslakM., HenselL., Wiemer V.M., Grefkes C., Grafton S.T., VolzL.J. The role of corticospinal and extrapyramidal pathways in motor impairment after stroke. Brain Communications. 2023; 5 (1): fcac301. DOI: 10.1093/braincomms/fcac301.
- Yu C., Zhu C., Zhang Y. A longitudinal diffusion tensor imaging study on wallerian degeneration of corticospinal tract after motor pathways stroke. Neuroimage. 2009; 47: 451-458.
- Schaechter J.D., Fricker Z.P., Perdue K.L. Microstructural status of ipsilesional and contralesional corticospinal tract correlates with motor skill in chronic stroke patients. Hum. Brain Mapp. 2009; 30: 3461-3474.
- Lindenberg R., Renga V., Zhu L.L. Structural integrity of corticospinal motor fibers predicts motor impairment in chronic stroke. Neurology. 2010; 74: 280-287.
- Кулеш А.А., Дробаха В.Е., Шестаков В.В. Магнитнорезонансная морфометрия головного мозга у пациентов с постинсультными когнитивными нарушениями. Пермский медицинский журнал. 2014; 31 (3): 39-45.
- Rong D., ZhangM., Ma Q. Corticospinal Tract Change during Motor Recovery in Patients with Medulla Infarct: A Diffusion Tensor Imaging Study. BioMed Research International. 2014; 2014: 524096. DOI: http://dx.doi.org/10.1155/2014/524096.
- Beaulieu C. The Biological Basis of Diffusion Anisotropy. In: Johansen-Berg H., Behrens T. Diffusion MRI: From Quantitative Measurement to In Vivo Neuroanatomy. London: Elsevier, 2009. 490.
- Guo J., Wang S., Li R. Cognitive impairment and whole brain diffusion in patients with carotid artery disease and ipsilateral transient ischemic attack. Neurol. Res. 2014; 36 (1): 41-46.
- Fernandez-AndujarM., DoorninkF., Dacosta-Aguayo R. Remote thalamic microstructural abnormalities related to cognitive function in ischemic stroke patients. Neuropsychology. 2014; 28 (6): 984-996.
- ClarkM.E., Payton J.E., Pittiglio L.I. Acute ischemic stroke and hyperglycemia. Crit. Care Nurs. 2014; 37 (2): 182187.
- Marmarelis V.Z., Shin D.C., OrmeM.E., ZhangR. Modelbased quantification of cerebral hemodynamics as a physiomarker for Alzheimer's disease? Curr. Alzheimer Res. 2014; 11 (1): 11 -17.


