Очистка и изучение биохимических свойств пептидазы из Paenibacillus dendritiformis штамм Gor-10s
Автор: Раднагуруева Арюна Арсалановна, Лаврентьева Елена Владимировна, Намсараев Баир Бадмабазарович, Дунаевский Яков Ефимович
Журнал: Вестник Бурятского государственного университета. Философия @vestnik-bsu
Рубрика: Химия
Статья в выпуске: 3, 2013 года.
Бесплатный доступ
Проведена очистка и изучены биохимические свойства пептидазы из Paenibacillus dendritiformis штамм Gor-10s. Показано, что культура обладает высокой субтилизиноподобной активностью. Протеаза стабильна в диапазоне температур от 23 до 60 оС и рН от 6,6 до 12.
Термальный источник, горячинск, бактерии, пептидазы
Короткий адрес: https://sciup.org/148181823
IDR: 148181823 | УДК: 577.151.01
Текст научной статьи Очистка и изучение биохимических свойств пептидазы из Paenibacillus dendritiformis штамм Gor-10s
В гидротермах Бурятии широко распространены микроорганизмы – потенциальные продуценты ферментативных систем, устойчивые к высоким значениям температуры и рН, чем обеспечивается большой интерес с точки зрения изучения механизмов биохимической адаптации микроорганизмов к экстремальным условиям окружающей среды.
Целью работы было выделение и изучение биохимических свойств пептидазы алкалотермофиль-ной бактерии Paenibacillus dendritiformis штамм Gor-10s, выделенной из горячего источника Горя-чинск.
Объекты и методы исследования
Культура Gor-10s выделена из донных осадков горячего источника Горячинск, расположенного в Прибайкальском районе Республики Бурятия. Штамм бактерий культивировали на среде состава (г/л): NH 4 Cl – 0,3; KH 2 PO 4 – 0,3; MgCl 2 – 0,3; CaCl 2 – 0,3; дрожжевой экстракт – 0,5. В качестве источника азота использовали пептон в конечной концентрации 1,5%. Оптимальные значения рН роста бактерий устанавливали карбонат-бикарбонатным буфером до рН 8,5-9,0. Культура инкубировалась при 50оС на комплексной среде в течение трех суток. После инкубации клетки осаждали центрифугированием (12000 об/мин, 15 мин), полученный супернатант использовали для очистки пептидаз.
Определение внеклеточной пептидазной активности проводили согласно методике [1]. Процедура очистки внеклеточных пептидаз включала две последовательные стадии: диализ культуральной жидкости и ионообменную хроматографию.
Диализ проводили для отделения исследуемого фермента от низкомолекулярных веществ. Для этого 2 мл культуральной жидкости помещали в диализный мешочек, пропускающий молекулы, масса которых в среднем не превышает 10 кДа. Диализовали против 800 мл 0,1 М фосфатного буфера с рН 7,0 при 4 °С на магнитной мешалке в течение суток.
Разделение ферментов осуществляли методом ионообменной хроматографии на колонке Mono Q (FPLC), уравновешенной 0,01 М фосфатным буфером с рН 7,0 при скорости 1 мл/мин. Белок, сорбировавшийся на колонке, элюировали градиентом NaCl. В полученных таким образом образцах измеряли концентрацию белка и активность по выбранным субстратам. Однако в этом случае определяли не единицы активности за 1 ч, а увеличение поглощения при 410 нм (А 410) за 12 ч по причине того, что активность резко падала после разделения смеси ферментов на колонке. Далее образцы, составляющие отдельные пики пептидазной активности, объединяли, обессоливали (0,03 М фосфатным буфером, рН 7,0) и концентрировали на ячейке Amicon с мембраной UM 10 (пропускает белки не более 10 кДа) при 4 °С.
В ходе очистки вычисляли параметры полученных препаратов ферментов.
Общая активность (ед.×мл) – определяли как активность фермента во всем объеме препарата фермента.
Удельная активность (ед./мг белка) – определяли в единицах активности на один миллиграмм белка препарата.
Очистка – определяли как отношение удельной активности на данной стадии очистки к исходной удельной активности в культуральной жидкости.
Выход (%) – определяли как процент ферментативной активности на данной стадии очистки от исходной ферментативной активности в культуральной жидкости.
Определение молекулярных масс изучаемых ферментов бактерий проводили при помощи гель-хроматографии на колонке Superdex 75, уравновешенной 0,01 М фосфатным буфером с рН 7,0, содержащим также 0,5М NaCl (для нейтрализации эффекта неспецифической сорбции пептидаз на колонке). Разделение проводили со скоростью 1 мл/мин. Молекулярную массу фермента определяли с помощью калибровочной кривой.
Результаты исследования
Способность к расщеплению синтетических субстратов известного состава определяется строением субстрат-связывающего участка молекулы фермента, строением каталитического участка и является одним из наиболее важных характеризующих его свойств. Поэтому нами были проведены эксперименты по определению субстратной специфичности исследуемого фермента.
Изучение пептидазной активности на специфичном для субтилизин-подобных пептидаз субстрате – GlpAALpNa – показало наличие у штамма Gor-10s наиболее высокой внеклеточной протеолитической активности, которая составила 12,6 ед/мг белка. Результаты исследований указывают на то, что существенный вклад в пептидазную активность культуры Gor-10s, по-видимому, вносят пептидазы с субтилизин-подобной специфичностью, гидролизующие субстраты, содержащие в цепи несколько остатков аланина (GlpAALpNa) [2]. Большое количество бактериальных пептидаз, внеклеточная протеолитическая активность которых представлена в основном субтилизин-подобными пептидазами, согласуется с литературными данными – субтилизины находили в культуральной жидкости многих видов бактерий [3, 4].
Для исследования физико-химических свойств ферментов была проведена очистка фермента, выделенного из культуральной жидкости Paenibacillus dendritiformis штамм Gor-10s. С помощью использованных методов удалось очистить фермент 13,8 раза с выходом 46,7%. Количественные характеристики очистки пептидазы из Paenibacillus dendritiformis представлены в табл. 1.
Таблица 1
Стадии очистки пептидазы, выделенной из культуральной жидкости Paenibacillus dendritiformis штамм Gor-10s
|
Стадия очистки |
Общий белок, мг |
Общая активность, ед |
Удельная активность, ед./мг белка |
Степень очистки |
Выход, % |
|
Культуральная жидкость |
20,56 |
150,4 |
7,32 |
1,0 |
100 |
|
Диализ |
9,53 |
119,8 |
12,57 |
1,7 |
79,7 |
|
Ионообменная хроматография |
0,402 |
69,94 |
173,9 |
13,8 |
46,5 |
С помощью гель-хроматографии была определена молекулярная масса фермента, равная 19-20 кДа.
Активные фракции исследовали с помощью электрофореза. Электрофореграмма фракции, полученной после гель-хроматографии, позволяет считать полученный препарат электрофоретически гомогенным.
Таким образом, выбранный метод очистки позволил получить препарат фермента культуры Gor-10s, который содержал только один фермент с исследуемой активностью. Так как исследуемые культуры бактерий способны расти в экстремальных условиях, было интересно выяснить, насколько адаптированы к экстремальным условиям секретируемые ими ферменты. С этой целью было изучено влияние температуры и рН на активность и стабильность внеклеточной пептидазы штамма Gor-10s, гидролизующей GlpAALpNa.
Определение температурного оптимума и стабильности ферментов осуществлено для диапазона 23-80 оС. Пептидаза культуры Gor-10s стабильна до 60 оС. Оптимум пептидазы Gor-10s составляет 50 оС.
График полученной в эксперименте зависимости активности сериновой пептидазы Paenibacillus dendritiformis штамм Gor-10s от температуры представлен на рис. 1.
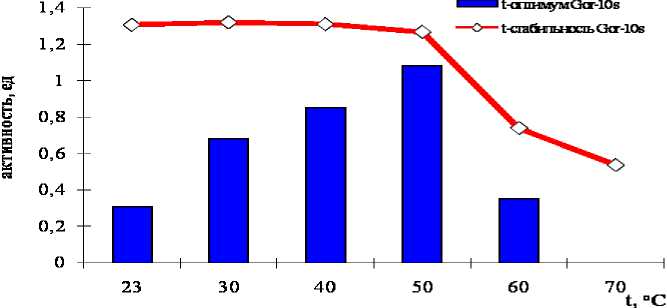
Рис. 1. Температурный оптимум и стабильность субтилизинподобной пептидазы Paenibacillus dendritiformis штамм Gor-10s
В литературе показано, что субтилизинподобные пептидазы характеризуются широким интервалом температурного оптимума и стабильности. По мнению ряда авторов, высокая стабильность пептидаз бацилл обеспечивается гидрофобными и ионными взаимодействиями, а также водородными связями и дисульфидными мостиками в белковой глобуле субтилаз [3, 5].
Исследование рН оптимума и стабильности проведено в диапазоне рН от 3,24 до 12. Фермент штамма Gor-10s активен в относительно узком щелочном диапазоне рН: активность, превышающая 50%, была выявлена на участке рН от 10,3 до 12 с максимумом при рН 11,4. Исследуемый фермент был стабилен при рН 6,6–12.
Известно, что многие бактериальные субтилизин-подобные пептидазы сохраняют активность при высоких значениях рН [5]. Можно предположить, что высокая щелочеустойчивость изученных белков служит адаптационным механизмом бактерий, которая позволяет им функционировать в экстремальных условиях.
Определение природы функциональных групп активного центра показало, что активность внеклеточных пептидаз по субстрату GlpAALpNA у изученного штамма Gor-10s подавляется специфическим ингибитором сериновых пептидаз – фенилметилсульфонилфторидом. Ингибиторы цистеиновых пептидаз – йодацетамид и металлопептидаз – этилендиаминтетраацетат либо совсем не оказывали влияния на активность, либо подавляли активность в незначительной степени.
Согласно полученным результатам, изученная культура активно секретировала сериновые пептидазы, в частности субтилизин-подобные. Внеклеточные пептидазы вынуждены работать в более жестких условиях внешней среды, следовательно, должны иметь более высокую стабильность. Показана широкая вариабельность температурного оптимума и стабильности. Обнаружен широкий рН интервал с высоким значением оптимума. Полученные результаты показали границы приспособляемости и функционирования выделенной пептидазы в экстремальных условиях гидротерм Бурятии.


