Одномоментная операция Озаки и миосептэктомия при выраженном аортальном стенозе
Автор: Кобзев Е.Е., Карпов И.А., Россейкин Е.В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические случаи
Статья в выпуске: 2 т.39, 2024 года.
Бесплатный доступ
Введение. Наличие выраженной асимметричной гипертрофии межжелудочковой перегородки (МЖП) у пациентов с аортальным стенозом (АС) может приводить помимо фиксированной обструкции на уровне аортального клапана (АК) к динамической обструкции выходного тракта левого желудочка (ВТЛЖ). Сохранение повышенного подклапанного градиента способно ухудшать как ранние, так и отдаленные результаты. В то же время хирургическая тактика при сочетании двух патологий в настоящее время не определена.Цель данной работы: анализ результатов одномоментной миосептэктомии по Морроу и операции Озаки.Материал и методы. В исследование включены 13 пациентов с выраженным АС и асимметричной гипертрофией МЖП, которым выполнена реконструкция АК по методике Озаки и миосептэктомия - по Морроу. Средний возраст составил 68 лет [от 50 до 79]. У 12 из 13 пациентов фиброзное кольцо (ФК) АК было менее 21 мм. Оценивались ранние и отдаленные (29,5 мес.) клинические результаты, специфические для миосептэктомии осложнения, гемодинамические параметры на АК и ВТЛЖ.Результаты. На госпитальном этапе умер один пациент. Не было случаев повторного пережатия аорты для протезирования АК, дополнительного иссечения МЖП, острого дефекта МЖП. Одному пациенту потребовалась имплантация постоянного электрокардиостимулятора вследствие полной поперечной блокады сердца. В течение наблюдения летальных исходов не было. У всех пациентов достигнуты хорошие гемодинамические результаты: средняя площадь АК - 2,2 см2 (от 1,4 до 3,0 см2 ); средний трансклапанный градиент - 11 мм рт. ст. (от 6 до 15 мм рт. ст.); толщина МЖП в базальном отделе - 11,2 мм, градиент на ВТЛЖ - 3,9 мм рт. ст.Выводы. В нашей кейс-серии из 13 пациентов с АС и подклапанной обструкцией ВТЛЖ выполнение операции Озаки и миосептэктомии позволило добиться хороших ранних и среднесрочных клинических и гемодинамических результатов. Проведение миосептэктомии является безопасной процедурой, не повышающей риск осложнений. Однако для получения достоверных доказательств преимущества выполнения сочетанного вмешательства и выработки оптимальных рекомендаций необходимо проведение крупных проспективных рандомизированных сравнительных исследований.
Аортальный стеноз, гипертрофическая кардиомиопатия, операция озаки, миосептэктомия
Короткий адрес: https://sciup.org/149145649
IDR: 149145649 | УДК: 616.132-007.271:[616.12-089.844+616.127-089.87] | DOI: 10.29001/2073-8552-2024-39-2-183-189
Текст научной статьи Одномоментная операция Озаки и миосептэктомия при выраженном аортальном стенозе
Известно, что гипертрофия миокарда при аортальном стенозе (АС) является адаптивным механизмом на перегрузку левого желудочка (ЛЖ) давлением. Несмотря на то, что у большинства пациентов с АС гипертрофия носит диффузный характер, у части из них отмечается более выраженная гипертрофия межжелудочковой перегородки (МЖП) в базальных отделах. Наличие утолщенной базальной части МЖП в сочетании с передне-систолическим движением митрального клапана (SAM-синдром) приводят к динамической обструкции выходного тракта ЛЖ (ВТЛЖ), усугубляя обструкцию ЛЖ измененным аортальным клапаном (АК). Миосептэктомия при гипертрофической кардиомиопатии (ГКМП), так же, как и протезирование АК при АС, согласно рекомендациям, являются методами выбора в лечении данных патологий (класс показаний I) [1, 2]. Однако, по данным литературы лишь немногие хирурги выполняют одномоментную резекцию МЖП и протезирование АК [3–8]. Это может объясняться тем, что, во-первых, устранение обструкции при протезировании АК уже снижает постнагрузку и приводит к обратному ремоделированию ЛЖ [9]; во-вторых, миосептэктомия сопряжена с рядом потенциальных осложнений (острый дефект МЖП, атриовентрикулярная блокада).
В последнее десятилетие во многих клиниках для коррекции АС применяется протезирование створок АК из аутоперикарда по методике Озаки с хорошими непосредственными и отдаленными результатами [10]. Сформированный по данной методике клапан обладает отличными гемодинамическими характеристиками, практически аналогичными нативному АК [11]. Таким образом, выполнение операции Озаки в сочетании с резекцией гипертрофированной базальной части МЖП может способствовать более полному и быстрому восстановлению ЛЖ.
Цель работы: представить результаты одномоментной миосептэктомии по Морроу и операции Озаки у 13 пациентов с выраженным АС и асимметричной гипертрофией МЖП.
Материал и методы
В исследование включены 13 пациентов (12 женщин и один мужчина), которым с января 2019 по январь 2024 гг. в нашем центре выполнена миосептэктомия по Морроу и проведена реконструкция АК по методике Озаки. Показанием для протезирования АК во всех случаях был выраженный АС: у восьми пациентов дегенеративной этиоло- гии, у трех – ревматической, у двух – двустворчатый АК (табл. 1). Показанием для выполнения миосептэктомии считали наличие асимметричной гипертрофии ЛЖ ≥ 18 мм, градиента на ВТЛЖ ≥ 30 мм рт. ст., наличие SAM-синдрома. Средний возраст составил 68 лет [от 50 до 79], все пациенты имели III функциональный класс сердечной недостаточности по NYHA. У 12 из 13 пациентов фиброзное кольцо (ФК) АК было менее 21 мм.
Таблица 1. Исходная характеристика пациентов
Table 1. Patient baseline
|
ID |
Возраст / пол |
ИМТ |
ППТ, м2 |
Коморбидность |
Этиология АС |
ФК АК, мм |
Grmax/ Grmean на АК, мм рт. ст. |
МЖП, мм |
Grmax на ВТЛЖ, мм рт. ст. |
SAM |
КДО/ КСО ЛЖ, мл |
ФВ ЛЖ, % |
Euro SCORE II, % |
|
1 |
79/Ж |
24,39 |
1,43 |
АГ, ОНМК, ЖТ |
Д |
19 |
132/60 |
23 |
30 |
Нет |
110/44 |
60 |
1,42 |
|
2 |
72/Ж |
28,67 |
1,66 |
АГ, ХОБЛ |
Д |
20 |
80/40 |
20 |
31 |
Нет |
92/32 |
65 |
0,56 |
|
3 |
63/Ж |
31,2 |
1,72 |
АГ |
Р |
18 |
86/47 |
19 |
31 |
Нет |
93/28 |
70 |
2,33 |
|
4 |
75/Ж |
28,93 |
1,79 |
АГ, ИБС, СД, ХБП |
Д |
20 |
69/40 |
20 |
80 |
Да |
56/19 |
66 |
4 |
|
5 |
63/М |
20,42 |
1,71 |
АГ, ИБС, ХОБЛ |
Д |
21 |
80/40 |
18 |
33 |
Нет |
68/18 |
77 |
1,99 |
|
6 |
71/Ж |
35,57 |
1,9 |
АГ, ОНМК, ЖТ |
ДАК |
21 |
74/44 |
18 |
30 |
Нет |
85/27 |
68 |
1,28 |
|
7 |
70/Ж |
34,97 |
1,77 |
АГ, ИБС, ОНМК |
Д |
19 |
103/59 |
28 |
42 |
Да |
69/27 |
61 |
3,9 |
|
8 |
60/Ж |
34,41 |
1,89 |
АГ, ИБС, СД |
Р |
23 |
100/50 |
21 |
34 |
Нет |
90/40 |
56 |
1,35 |
|
9 |
70/Ж |
29 |
1,85 |
АГ, ИБС, ФП |
Д |
21 |
70/40 |
18 |
30 |
Да |
82/22 |
73 |
4,34 |
|
10 |
71/Ж |
45,18 |
1,84 |
АГ, СД |
Р |
18 |
98/52 |
22 |
35 |
Да |
64/18 |
62 |
6,29 |
|
11 |
70/Ж |
26,71 |
1,65 |
АГ, ИБС, СД |
Д |
18 |
125/73 |
20 |
33 |
Нет |
80/25 |
69 |
3,37 |
|
12 |
70/Ж |
19,63 |
1,33 |
АГ |
Д |
19 |
101/64 |
18 |
31 |
Нет |
50/17 |
66 |
1,11 |
|
13 |
50/Ж |
32,61 |
1,88 |
АГ |
ДАК |
19 |
81/41 |
23 |
31 |
Да |
69/22 |
68 |
1,19 |
Примечание: М – мужской пол; Ж – женский пол; ИМТ – индекс массы тела; ППТ – площадь поверхности тела; АГ – артериальная гипертензия; ИБС – ишемическая болезнь сердца; ХБП – хроническое заболевание почек; ХОБЛ – хроническое обструктивное заболевание легких; СД – сахарный диабет; ФП – фибрилляция предсердий; ОНМК – острое нарушение мозгового кровообращения; ЖТ – желудочковая тахикардия; АС – аортальный стеноз; Д – дегенеративный; Р – ревматический; ДАК – двустворчатый аортальный клапан; ФК АК – фиброзное кольцо аортального клапана; МЖП – межжелудочковая перегородка; ВТЛЖ – выходной тракт левого желудочка; SAM – systolic anterior motion – передне-систолическое движение передней створки митрального клапана; КДО/КСО – конечно-диастолический и конечно-систолический объемы левого желудочка; ФВ ЛЖ – фракция выброса левого желудочка по Simpson; ИММ – индекс массы миокарда.
Из сопутствующих заболеваний преобладали артериальная гипертензия ( n = 13), ишемическая болезнь сердца ( n = 6), ожирение ( n = 6), сахарный диабет ( n = 4), трое больных перенесли острое нарушение мозгового кровообращения или синкопе, у двух пациентов отмечалась желудочковая тахикардия. Минимальное и максимальное значение EuroSCORE II составило 0,56 и 6,29% соответственно, среднее – 2,47%.
Оперативное лечение
Хирургическим доступом у всех пациентов являлась срединная стернотомия. Выполняли забор аутоперикарда размерами 7 × 8 см, его фиксацию на пластине, обработку в течение 10 мин в 0,6% растворе глютарового альдегида и трехкратное промывание по 10 мин в физиологическом растворе. Параллельно после системной гепаринизации проводили стандартное центральное подключение аппарата искусственного кровообращения. Для остановки сердца использовали раствор Custodiol (Dr. Franz Kohler Chemie GmbH, Germany) или теплую кровяную кардиоплегию. После иссечения пораженных створок и тщательной декальцинации ФК АК измеряли дистанцию между комиссурами с помощью сайзеров Озаки, в соответствии с которыми по трафарету выкраивали три створки. Одновременно с выкраиванием створок выполняли расширенную миосептэктомию, избегая повреждения проводящих путей. В случае диффузного утолщения МЖП иссечение производили максимально дистально вплоть до основания папиллярных мышц. Да- лее имплантировали створки в аортальную позицию непрерывным обвивным швом нитями Premilene 4/0 на игле 13. Последним этапом формировали неокомиссуры нитями Premilene 4/0 на игле 17 с использованием фетровых прокладок (рис. 1).
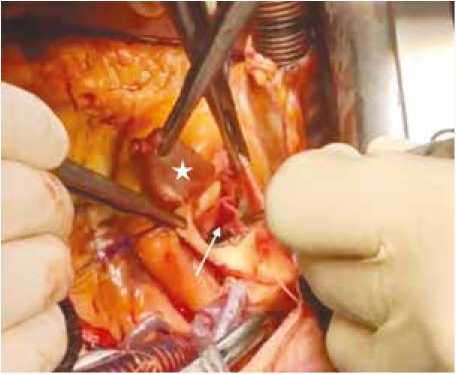
Рис. 1. Интраоперационная фотография: сформированный из аутоперикарда аортальный клапан (белая стрелка), резецированный сегмент гипертрофированной межжелудочковой перегородки (белая звездочка) Fig. 1. Intraoperative image: aortic valve formed from autologous pericardium (white arrow), resected segment of hypertrophied interventricular septum (white asterisk)
При наличии показаний выполняли коронарное шунтирование, коррекцию патологии митрального клапана.
Эхокардиография и магнитно-резонансная томография сердца
Степень выраженности АС устанавливали с помощью трансторакальной эхокардиографии на основании максимального и среднего трансклапанного градиента, площади АК. Дополнительно оценивали толщину МЖП, величину максимального градиента давления на ВТЛЖ, наличие SAM-синдрома. Пациентам с динамической подклапанной обструкцией ВТЛЖ выполняли магнитно-резонансную томографию (МРТ) сердца, на начальном и завершающем этапе операции чреспищеводную эхокардиографию.
Перед выпиской из стационара всем пациентам выполняли трансторакальную эхокардиографию и МРТ сердца (рис. 2).
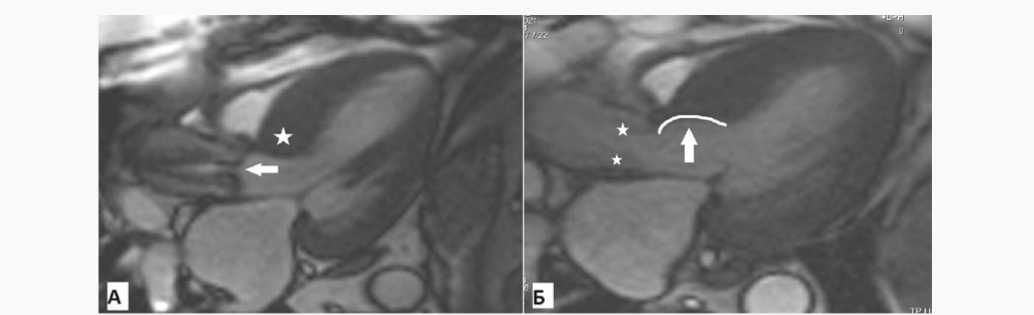
Рис. 2. Магнитно-резонансная томография сердца: А – до операции; стеноз аортального клапана (белая стрелка), выраженная гипертрофия межжелудочковой перегородки до 27 мм (белая звездочка), Б – после операции; резецированный участок межжелудочковой перегородки (белая линия и белая стрелка), неостворки аортального клапана (белые звездочки)
Fig. 2. Magnetic resonance imaging of the heart: A – preoperatively; aortic valve stenosis (white arrow), severe septal up to 27 mm (white asterisk), Б – postoperatively; resected segment of the interventricular septum (white line and white arrow), aortic valve cusps (white asterisks)
Отдаленные результаты
В отдаленном периоде данные получены путем вызова пациентов на контрольное обследование в наш Центр или путем телефонного опроса. Оценивался клинический статус, выполнялась трансторакальная эхокардиография, либо пациент присылал последнюю контрольную эхокардиографию на электронную почту исследователя. Среднее время наблюдения составило 29,5 мес. (от 3 до 52 мес.).
Результаты
Среднее время окклюзии аорты было равно 117 мин (от 92 до 156 мин), среднее время искусственного кровообращения – 133 мин (от 143 до 180 мин). Не было случаев повторного пережатия аорты для протезирования АК с использованием биологического / механического протеза, дополнительного иссечения МЖП вследствие высокого градиента на ВТЛЖ, сохранения SAM-синдрома или вновь появившейся значимой митральной недостаточности, острого дефекта МЖП. Из сопутствующих процедур троим пациентам (№ 5, № 7 и № 11) выполнено коронарное шунтирование, одному (№ 10) – протезирование митрального клапана.
На госпитальном этапе умер один пациент (№ 10) вследствие мезентериального тромбоза. У остальных пациентов послеоперационный период протекал гладко, случаев инфаркта миокарда, нарушения мозгового кровообращения, острой почечной недостаточности, рестернотомий по поводу кровотечений не было. У одного пациента (№ 3) развился послеоперационный делирий, в одном случае (№ 7) потребовалась продленная искусственная вентиляция легких (> 24 ч) вследствие дыхательной недостаточности, одному пациенту (№ 1) выполнена имплантация электрокардиостимулятора вследствие полной атриовентрикулярной блокады. Среднее время пребывания в отделении реанимации и кардиохирургическом отделении после операции составило 3 дня (от 1 до 8) и 12 дней (от 8 до 18) соответственно (табл. 2).
Таблица 2. Данные интраоперационного и послеоперационного периодов
Table 2. Operative and postoperative data
|
ID |
Время ОА, мин |
Время ИК, мин |
Сопутствующие процедуры |
Осложнения |
ОРИТ, дни |
Отделение, дни |
|
1 |
108 |
125 |
Нет |
АВБ |
3 |
10 |
|
2 |
111 |
143 |
Нет |
Нет |
2 |
13 |
|
3 |
107 |
130 |
Нет |
Делирий |
4 |
13 |
|
4 |
128 |
143 |
Нет |
Нет |
2 |
18 |
|
5 |
134 |
165 |
КШ |
Нет |
3 |
11 |
|
6 |
110 |
127 |
Нет |
Нет |
2 |
8 |
|
7 |
92 |
115 |
КШ |
ДН |
7 |
16 |
|
8 |
122 |
153 |
Нет |
Нет |
2 |
10 |
|
9 |
105 |
132 |
Нет |
ФП |
2 |
14 |
|
10 |
156 |
180 |
ПМК |
МТ, смерть |
8 |
29 |
|
11 |
121 |
177 |
КШ |
Нет |
2 |
11 |
|
12 |
99 |
130 |
Нет |
Нет |
2 |
12 |
|
13 |
127 |
145 |
Нет |
Нет |
2 |
12 |
Примечание: ОА – окклюзия аорты; ИК – искусственное кровообращение; КШ – коронарное шунтирование; ПМК – протезирование митрального клапана; АВБ – атриовентрикулярная блокада; МТ – мезентериальный тромбоз; ДН – дыхательная недостаточность; ФП – фибрилляция предсердий; ОРИТ – отделение реанимации и интенсивной терапии.
Эхокардиографические и среднеотдаленные результаты
В течение наблюдения (среднее время – 29,5 мес.; от 3 до 52 мес.) случаев летальных исходов и значимых сердечно-сосудистых событий не было. Все пациенты имели I–II функциональный класс сердечной недостаточности по NYHA. Данные трансторакальной эхокардиографии перед выпиской и при контрольном обследовании представлены в таблице 3. Перед выпиской у пяти пациентов (№ 1, 2, 6, 11, 12) отмечалась аортальная недостаточность I степени, у остальных семи пациентов аортальная регургитация отсутствовала. При контрольном обследовании лишь у одного пациента (№ 5) появилась аортальная недостаточность I степени, случаев нарастания до II+ степени не выявлено.
Перед выпиской средняя площадь АК и индекс площади АК составили 2,4 см2 (от 1,7 до 3,3 см2) и 1,4 см2/м2 (от 1,0 до 1,8 см2/м2) соответственно. После выписки от- мечалось некоторое уменьшение данных показателей: 2,2 см2 (от 1,4 до 3,0 см2) и 1,3 см2/м2 (от 0,8 до 1,7 см2/м2). Средний и максимальный трансклапанный градиенты на госпитальном этапе равнялись 8 мм рт. ст. (от 2 до 20 мм рт. ст.) и 15 мм рт. ст. (от 5 до 24 мм рт. ст.) соответственно. При контрольном обследовании отмечалась тенденция к небольшому увеличению градиентов: 11 мм рт. ст. (от 6 до 15 мм рт. ст.) и 20 мм рт. ст. (от 12 до 30 мм рт. ст.). Перед выпиской средняя толщина МЖП в базальном отделе составила 12,5 мм, максимальный градиент на ВТЛЖ – 6,5 мм рт. ст., при этом у одного пациента (№ 4) отмечался SAM-синдром, градиент на ВТЛЖ – 20 мм рт. ст. и митральная недостаточность II степени, толщина МЖП – 15 мм. При контрольном обследовании средняя толщина МЖП составила 11,2 мм, градиент на ВТЛЖ – 3,9 мм рт. ст. При этом у пациента № 4 отсутствовал SAM-синдром и значимая митральная недостаточность, градиент на ВТЛЖ уменьшился до 14 мм рт. ст.
Таблица 3. Данные трансторакальной эхокардиографии перед выпиской и при контрольном обследовании
Table 3. Transthoracic echocardiography data before discharge and during control examination
|
ID |
Время исследования |
АН |
Площадь АК, см2 |
Индекс площади АК, см2/м2 |
Средний градиент, мм рт. ст. |
Максимальный градиент, мм рт. ст. |
МЖП, мм |
Градиент на ВТЛЖ, мм рт. ст. |
SAM |
МН, степень |
|
1 |
Перед выпиской |
1 |
2,2 |
1,5 |
10 |
18 |
14 |
4 |
Нет |
0 |
|
Наблюдение |
1 |
2 |
1,4 |
11 |
20 |
11 |
2 |
Нет |
0 |
|
|
2 |
Перед выпиской |
1 |
2,7 |
1,6 |
8 |
13 |
12 |
6 |
Нет |
0 |
|
Наблюдение |
1 |
2,5 |
1,4 |
7 |
12 |
11 |
2 |
Нет |
1 |
|
|
3 |
Перед выпиской |
0 |
2,4 |
1,4 |
11 |
21 |
14 |
6 |
Нет |
0 |
|
Наблюдение |
0 |
2,3 |
1,3 |
12 |
24 |
12 |
4 |
Нет |
1 |
|
|
4 |
Перед выпиской |
0 |
3,3 |
1,8 |
6 |
18 |
15 |
20 |
Да |
2 |
|
Наблюдение |
0 |
3 |
1,7 |
12 |
24 |
12 |
14 |
Нет |
1 |
|
|
5 |
Перед выпиской |
0 |
2,4 |
1,4 |
3 |
8 |
10 |
3 |
Нет |
0 |
|
Наблюдение |
0 |
2,2 |
1,3 |
9 |
15 |
10 |
2 |
Нет |
0 |
|
|
6 |
Перед выпиской |
1 |
3,2 |
1,7 |
2 |
5 |
13 |
3 |
Нет |
1 |
|
Наблюдение |
1 |
2,2 |
1,2 |
6 |
14 |
12 |
3 |
Нет |
1 |
|
|
7 |
Перед выпиской |
0 |
3,1 |
1,8 |
7 |
13 |
13 |
4 |
Нет |
1 |
|
Наблюдение |
0 |
3,0 |
1,7 |
9 |
15 |
11 |
3 |
Нет |
1 |
|
|
8 |
Перед выпиской |
0 |
2,9 |
1,5 |
5 |
11 |
11 |
5 |
Нет |
0 |
|
Наблюдение |
0 |
2,5 |
1,3 |
8 |
14 |
10 |
4 |
Нет |
0 |
|
|
9 |
Перед выпиской |
0 |
1,8 |
1,0 |
6,2 |
10,2 |
14 |
17 |
Нет |
1 |
|
Наблюдение |
0 |
1,4 |
0,8 |
15 |
30 |
13 |
5 |
Нет |
2 |
|
|
10* |
После операции |
0 |
2,3 |
1,3 |
20 |
11 |
11 |
3 |
Нет |
1 |
|
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
|
|
11 |
Перед выпиской |
1 |
1,7 |
1,0 |
11 |
24 |
12 |
7 |
Нет |
1 |
|
Наблюдение |
1 |
1,7 |
1,0 |
12 |
26 |
11 |
4 |
Нет |
1 |
|
|
12 |
Перед выпиской |
0 |
1,9 |
1,4 |
9 |
20 |
12 |
5 |
Нет |
1 |
|
Наблюдение |
1 |
1,4 |
1,1 |
15 |
30 |
11 |
2 |
Нет |
1 |
|
|
13 |
Перед выпиской |
0 |
1,8 |
1,0 |
11 |
24 |
12 |
2 |
Нет |
1 |
|
Наблюдение |
0 |
1,8 |
1,0 |
10 |
20 |
10 |
2 |
Нет |
1 |
Примечание: АН – аортальная недостаточность, АК – аортальный клапан; МЖП – толщина МЖП в базальном отделе левого желудочка; ВТЛЖ – выходной тракт левого желудочка; SAM – systolic anterior motion, передне-систолическое движение передней створки митрального клапана; МН – митральная недостаточность; * – умерший на госпитальном этапе пациент.
Обсуждение
Согласно данным литературы, около 10% пациентов с выраженным АС имеют значимую подклапанную обструкцию ВТЛЖ вследствие асимметричной гипертрофии МЖП [6, 12]. Хирургическая тактика при сочетании двух патологий в настоящее время не определена. Сторонники консервативного подхода объясняют отказ от ми- осептэктомии при протезировании АК повышенным риском осложнений (перфорация МЖП, полная поперечная блокада сердца), либо они выполняют сочетанную операцию при наличии только динамической обструкции ВТЛЖ с SAM-синдромом [13, 14].
Однако сохранение подклапанной обструкции после протезирования АК может негативно влиять на ранние и отдаленные результаты. В раннем послеоперационном периоде резидуальная подклапанная обструкция может сопровождаться нестабильной гемодинамикой, низким сердечным выбросом, требующих инотропной поддержки, что еще в большей степени усугубляет обструкцию. По данным J. Ayrebe и соавт., у 6% пациентов через год после протезирования АК сохранялась обструкция ВТЛЖ [15]. J. Mathew и соавт. сообщают о 18 пациентах, которым после успешного протезирования АК в отдаленном периоде потребовалось выполнение миосептэктомии вследствие значимой подклапанной обструкции [16].
Сторонники либерального подхода считают, что миосептэктомия позволяет предотвратить любую резидуальную подклапанную обструкцию, которая может быть замаскирована протезом АК. В качестве показаний для миосептэктомии рассматриваются не только данные эхокардиографии, но и мануальное исследование МЖП после иссечения АК и декальцинации ФК АК [4, 6–8]. В настоящем исследовании мы также придавали важное значение интраоперационному пальцевому обследованию МЖП, поскольку только у пяти пациентов была выявлена классическая динамическая обструкция ВТЛЖ с SAM-синдромом.
J.Y. Lim и соавт. сравнивали результаты протезирования АК в сочетании с миосептэктомией и без таковой [6]. Авторы определили, что вероятность выполнения миосептэктомии была выше у пациентов с узким ФК АК, а также при значении соотношения ВТЛЖ / ФК АК менее 0,7. K. Von Aspern и соавт. в ретроспективном анализе с псевдорандомизацией, включившем 374 пациента, установили, что независимым предиктором выполнения миосептэктомии были возраст (ОШ 1,03; р = 0,04) и узкое ФК АК (ОШ 1,42; р < 0,001) [7]. Наша кейс-серия подтверждает результаты данных исследователей, поскольку у 12 из 13 пациентов ФК АК было менее 21 мм.
Выполнение миосептэктомии при протезировании АК, по данным литературы, не сопровождается увеличением летальности и частоты значимых послеоперационных осложнений, в том числе специфичных для миосептэктомии дефекта МЖП, поперечной блокады сердца. Так, L. Di Tomaso и соавт. [5] и J.Y. Lim и соавт. [6] сообщают об отсутствии случаев острого дефекта МЖП и необходимости имплантации электрокардиостимулятора. В исследовании K. Von Aspern и соавт. также не было случаев острого дефекта МЖП, частота поперечной блокады сердца была несколько больше по сравнению с группой изолированного протезирования АК, однако разница не была статистически значимой (5,3 против 3,7%, p = 0,621) [7]. В нашем исследовании также не было случаев острой перфорации МЖП, имплантация электрокардиостимулятора потребовалась только одному пациенту.
Ряд авторов отмечают положительное влияние дополнения миосептэктомии к протезированию АК на восстановление диастолической функции и обратное ремоделирование ЛЖ в отдаленном периоде. G. Tasca и соавт. [3] сообщают, что через 2,9 года толщина МЖП и индекс массы миокарда имели более значимое уменьшение в группе сочетанной операции (–1,1 ± 1,6 против – 1,6 ± 1,3 мм; p = 0,016); и –16,8 ± 17,8 против –24,6 ± 14,7%; p = 0,004 соответственно). Также в группе миосептэктомии отмечался меньший градиент на протезе АК (17,8 ± 6,8 против 15,5 ± 6,3 мм рт. ст.; p = 0,034), что могло влиять на выраженность обратного ремоделирования ЛЖ.
N. Kayalar и соавт. сообщают [4], что через год после операции у пациентов с миосептэктомией наблюдалось значимое уменьшение массы миокарда (211,4 ± 54,3 против 177,1 ± 45 г; p < 0,05); индекса массы миокарда (113,7 ± 24,3 против 90,0 ± 17,2 г/м2; p < 0,05) и толщины МЖП (13,9 ± 2,5 против 11,4 ± 1,6 мм; p < 0,05) по сравнению с изолированным протезированием АК. В нашем исследовании средняя толщина МЖП в базальном отделе через 29,5 мес. составила 11 мм, градиент на ВТЛЖ – 4 мм рт. ст., средний градиент на АК – 11 мм рт. ст. Небольшое количество наблюдений в нашей кейс-серии не позволяет проводить статистические расчеты. Однако, согласно данным наблюдения, у всех пациентов через 29,5 мес. отмечалось значительное уменьшение толщины МЖП, практически отсутствовала подклапанная обструкция и SAM-синдром.
Заключение
В нашем исследовании, включившем небольшую группу из 13 пациентов с АС и подклапанной обструкцией ВТЛЖ, выполнение операции Озаки, отличительной особенностью которой является практически идентичные нативному АК гемодинамические характеристики, и проведение миосептэктомии позволили добиться хороших ранних и среднесрочных клинических и гемодинамических результатов. Выполнение миосептэктомии при наличии выраженной асимметричной гипертрофии МЖП, планируемой при дооперационном обследовании или непосредственно интраоперационно при протезировании АК, по данным чреспищеводной эхокардиографии и мануального исследования, является безопасной процедурой, не повышающей риск осложнений. Однако для получения достоверных доказательств преимущества выполнения сочетанного вмешательства и выработки оптимальных рекомендаций необходимо проведение крупных проспективных рандомизированных сравнительных исследований.
Список литературы Одномоментная операция Озаки и миосептэктомия при выраженном аортальном стенозе
- 2021 Рекомендации ESC/EACTS по ведению пациентов с клапанной болезнью сердца. Российский кардиологический журнал. 2022;27(7):5160. 2021 ESC/EACTS recommendations for the management of patients with valvular heart disease. Russian Journal of Cardiology. 2022;27(7):5160. (In Russ.). https://doi.org/10.15829/1560-4071-2022-5160.
- Arbelo E., Protonotarios A., Gimeno J.R., Arbustini E., Barriales-Villa R., Basso C. et al.; ESC Scientific Document Group. 2023 ESC Guidelines for the management of cardiomyopathies. Eur. Heart J. 2023;44(37):3503-3626. https://doi.org/10.1093/eurheartj/ehad194.
- Tasca G., Amaducci A., Parrella P.V., Troise G., Dalla Tomba M., Magna Z. et al. Myectomy-myotomy associated with aortic valve replacement for aortic stenosis: effects on left ventricular mass regression. Ital. Heart J. 2003;4(12):865-871.
- Kayalar N., Schaff H.V., Daly R.C., Dearani J.A., Park S.J. Concomitant septal myectomy at the time of aortic valve replacement for severe aortic stenosis. Ann. Thorac. Surg. 2010;89(2):459-464. https://doi.org/10.1016/j.athoracsur.2009.10.065.
- Di Tommaso L., Stassano P., Mannacio V., Russolillo V., Monaco M., Pinna G. et al. Asymmetric septal hypertrophy in patients with severe aortic stenosis: the usefulness of associated septal myectomy. J. Thorac. Cardiovasc. Surg. 2013;145(1):171-175. https://doi.org/10.1016/j. jtcvs.2011.10.096.
- Lim J.Y., Choi J.O., Oh J.K., Li Z., Park S.J. Concomitant septal myectomy in patients undergoing aortic valve replacement for severe aortic stenosis. Circ J. 2015;79(2):375-380. https://doi.org/10.1253/circj.CJ-14-0672.
- Von Aspern K., Bianchi E., Haunschild J., Dahlenburg C., Misfeld M., Borger M.A. et al. Propensity score matched comparison of isolated, elective aortic valve replacement with and without concomitant septal myectomy: Is it worth it? J. Cardiovasc. Surg. (Torino). 2021:62(3):258- 267. https://doi.org/10.23736/S0021-9509.20.11443-5.
- Desai M.Y., Alashi A., Popovic Z.B., Wierup P., Griffin B.P., Thamilarasan M. et al. Outcomes in patients with obstructive hypertrophic cardiomyopathy and concomitant aortic stenosis undergoing surgical myectomy and aortic valve replacement. J. Am. Heart Assoc. 2021;10(18):e018435. https://doi.org/10.1161/JAHA.120.018435.
- Козлов Б.Н., Панфилов Д.С., Базарбекова Б.А., Сондуев Э.Л., Бойко А.М. Непосредственные результаты хирургического лечения аневризмы восходящей аорты в сочетании со стенотическим поражением аортального клапана. Сибирский журнал клинической и экспериментальной медицины. 2023;38(3):135-142. https://doi.org/10.29001/2073-8552-2022-424.
- Ozaki S., Kawase I., Yamashita H., Uchida S., Takatoh M., Kiyohara N. Midterm outcomes after aortic valve neocuspidization with glutaraldehyde-treated autologous pericardium. J. Thorac. Cardiovasc. Surg. 2018;155:2379-2387. https://doi.org/10.1016/j.jtcvs.2018.01.087.
- Базылев В.В., Кобзев Е.Е., Бабуков Р.М., Россейкин Е.В. Операция Ozaki при узком фиброзном кольце аортального клапана - новое решение старой проблемы? Грудная и сердечно-сосудистая хирургия. 2018;60(3):217-225. (In Russ.). https://doi.org/10.24022/0236-2791-2018-60-3-217-225
- Magro P.L., Sousa Uva M. What is the role of septal myectomy in aortic stenosis? Rev. Port. Cardiol. 2022;41(4):341-346. (In Portug., In Engl.). https://doi.org/10.1016/j.repc.2021.02.022. 13. Schulte H.D., Bircks W., Horstkotte D., Kerstholt J., Preusse C.J., Winter J. Asymmetric septal hypertrophy (ASH) in valvular aortic stenosis should not be resected at the time of surgery. Z. Kardiol. 1986;75(Suppl_2):201-206.
- Panza J.A., Maron B.J. Valvular aortic stenosis and asymmetric septal hypertrophy: Diagnostic considerations and clinical and therapeutic implications. Eur. Heart J. 1988;9(Suppl_E):71-76. https://doi.org/10.1093/eurheartj/9.suppl_e.71.
- López Ayerbe J., Evangelista Masip A., Armada Romero E., Mateos González M., González Alujas M.T., García Del Castillo H. et al. Aparición de gradiente dinámico intraventricular después de la sustitución valvular aórtica en pacientes con estenosis aórtica severa. [Predictive factors of abnormal dynamic intraventricular gradient after valve replacement in severe aortic stenosis]. Rev. Esp. Cardiol. 2002;55(2):127-134. (In Span.). https://doi.org/10.1016/s0300-8932(02)76572-x.
- Mathew J., Dearani J.A., Daly R.C., Schaff H.V. Management of subaortic left ventricular outflow tract obstruction after aortic valve replacement. Ann. Thorac. Surg. 2021;112(5):1468-1473. https://doi.org/10.1016/j.athoracsur.2020.11.024


