Одномоментное стентирование ствола левой коронарной артерии и резекция мочевого пузыряпо поводу рака у больного с острым коронарным синдромом без подъема сегмента ST очень высокого риска (клинический случай)
Автор: Сукманова И.А., Пономаренко И.В., Гордеева Д.С.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические случаи
Статья в выпуске: 3 т.40, 2025 года.
Бесплатный доступ
Пациенты с новообразованиями имеют более высокий риск развития сердечно-сосудистых заболеваний (ССЗ). У 90% пациентов острая коронарная катастрофа возникает при прогрессировании рака. Сложность ведения таких больных связана с повышенным риском кровотечений, тромботических осложнений и необходимостью хирургического лечения рака в ближайшее время. В данном сообщении анализируется случай одномоментного стентирования ствола левой коронарной артерии (ЛКА) и резекции мочевого пузыря по поводу распадающейся аденокарциномы у пациента с острым коронарным синдромом без подъема сегмента ST (ОКСбпST) высокого риска. Основным принципом ведения таких пациентов на сегодняшний день остается совместная работа мультидисциплинарной команды и индивидуальный подход.
Острый коронарный синдром, ствол левой коронарной артерии, онкологические заболевания, мультидисциплинарная команда
Короткий адрес: https://sciup.org/149149308
IDR: 149149308 | УДК: 616.132.2-007.272-006.6:[616.62-089.87+616.132.2:615.472.5] | DOI: 10.29001/2073-8552-2025-40-3-188-193
Текст научной статьи Одномоментное стентирование ствола левой коронарной артерии и резекция мочевого пузыряпо поводу рака у больного с острым коронарным синдромом без подъема сегмента ST очень высокого риска (клинический случай)
В настоящее время заболевания системы кровообращения, главным образом ишемическая болезнь сердца (ИБС), и новообразования являются ведущими в структуре основных причин смерти населения Российской Федерации – 43,8 и 13,8% соответственно1. Все больше данных свидетельствует о том, что рак и ИБС связаны общими факторами риска, патологическими механизмами и генетической предрасположенностью [1–6]. Онкологические больные имеют более высокий риск развития сердечно-сосудистых заболеваний (ССЗ), при этом факторы риска повышают риск возникновения нового рака. Данные проспективных исследований Framingham Heart Study и PREVEND подтверждают, что традиционные факторы риска ССЗ, 10-летняя оценка риска развития атеросклеротических ССЗ связаны с повышенным риском развития рака в будущем [4]. Стоит отметить, что преждевременный атеросклероз у молодых людей связан с более высоким риском развития рака. Таким образом, хроническое воспаление, связанное с атеросклерозом, является одним из механизмов канцерогенеза [1, 3].
Доля пациентов с острым коронарным синдромом
(ОКС) и диагнозом рака растет и по последним данным составляет около 3% [2, 6]. У пациентов с онкологическими заболеваниями значительно чаще встречается ОКС без подъема сегмента ST (ОКСбпST), составляя около 85% [7]. Стоит отметить, что почти у 90% пациентов ОКС возникает при прогрессировании онкологического заболевания. По литературным данным, первые 6 мес. после выявления онкологического заболевания сопровождаются максимальным риском развития, прогрессирования ИБС и смертности от ССЗ ввиду рак-индуцированного провоспалительного и протромботического состояния [1, 2, 4, 5, 8]. Согласно большинству научных работ, риск развития тромбоэмболических осложнений, включая инфаркт миокарда, может возникнуть за несколько месяцев до верификации онкологического заболевания и достигает максимума примерно в первые 1–2 года после постановки диагноза злокачественного новообразования [1, 2, 6]. Повышенный риск инфаркта миокарда особенно высок у пациентов с запущенными злокачественными новообразованиями, недифференцированным раком, аденокарциномами и связан с рак-индуцированным провос-палительным и протромботическим состоянием [8].
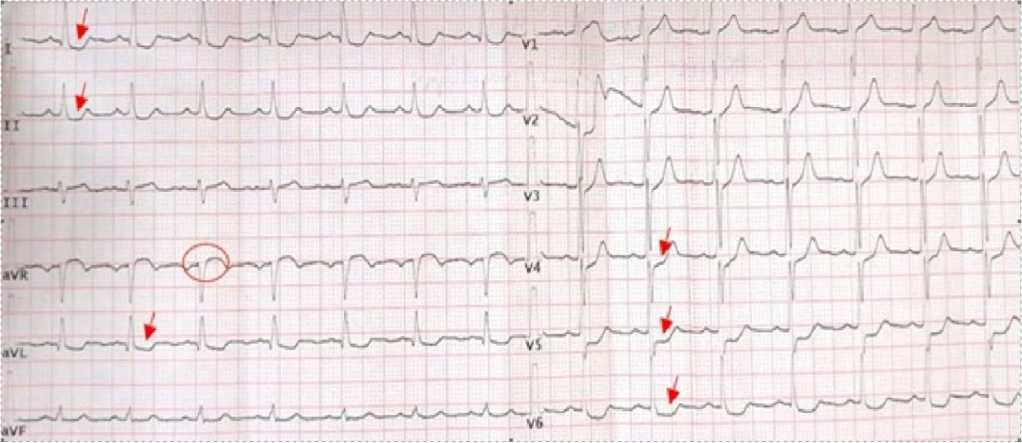
Рис. 1. Электрокардиограмма пациента Х
Fig. 1. ECG of the patient Х
Онкологические пациенты имеют высокий риск тромботических и ишемических осложнений, а также кровотечений после чрескожных коронарных вмешательств (ЧКВ) [2, 8, 9]. В действующих российских рекомендациях по ОКС с подъемом и без подъема сегмента ST отсутствуют данные по тактике ведения больных с ОКС с онкологическими заболеваниями [10]. В связи с ограничением исследований и недостаточной доказательной базой по ведению пациентов с ОКСбпST, высоким ишемическим риском и высоким риском кровотечения мультидисципли-нарный подход остается основополагающим при принятии клинических решений [11–14].
Описание клинического случая
Пациент Х, мужчина 42 лет, поступил в КГБУЗ «Алтайский краевой кардиологический диспансер» 24.11.2022 г. по скорой помощи с жалобами на интенсивные давящие боли за грудиной с иррадиацией в левую руку, нижнюю челюсть.
Из анамнеза. В течение 5 лет страдает гипертонической болезнью с подъемами артериального давления (АД) до 210/120 мм рт. ст. Регулярно принимает лозартан 100 мг, аторвастатин 20 мг, амлодипин 10 мг. Вредные привычки отрицает. Наследственность по ССЗ не отягощена. В течение последних 6 мес. эпизоды макрогематурии, дизурии. Обследовался амбулаторно, патологии не выявлено. Последние 1,5 мес. стал отмечать эпизоды давящих болей, жжения за грудиной на фоне умеренной физической нагрузки с иррадиацией в левую руку, нижнюю челюсть длительностью до 10 мин, самостоятельно купировались в покое. В течение последних 3 дней отмечалось прогрессирование клиники стенокардии.
Внезапное ухудшение 23.11.2022 г. в 21:00 – типичный ангинозный статус, вызвал скорую помощь. По ЭКГ до-госпитально – синусовый ритм, горизонтальная депрессия сегмента ST в I, II, aVL, V4–V6 отведениях до 2 мм, с реципрокной элевацией сегмента ST в aVR до 1,5 мм (рис. 1). На догоспитальном этапе получил аспирин 250 мг, клопидогрел 300 мг, гепарин 5000 МЕ в/в болюсом, морфин дробно в/в с целью обезболивания.
При поступлении состояние средней степени тяже- сти. Индекс массы тела – 35,8 кг/м2, АД – 120/80 мм рт. ст., частота сердечных сокращений – 88 уд/мин, ритм правильный, частота дыхания – 18 в мин, дыхание везикулярное, хрипов нет. Учитывая высокий риск осложнений, выполнена экстренная коронарография, выявлен стеноз терминального отдела ствола левой коронарной артерии (СтЛКА) до 80% с переходом на устье передней межжелудочковой артерии (ПМЖА) и огибающей артерии (ОА); ПМЖА – стеноз устья 80%, ОА – стеноз устья 80%, субокклюзия собственно ОА, диаметр менее 2 мм; правая коронарная артерия (ПКА) – протяженный стеноз в/3 до 60% (рис. 2). Риск по шкале SYNTAX – 25 баллов.
Лабораторно – достоверный прирост маркеров некроза миокарда, микроцитарная анемия средней степени тяжести (гемоглобин 78–72 г/л), умеренный лейкоцитоз (11,2 × 109/л), макрогематурия, в остальном – в пределах референтных значений. По эхокардиографии – фракция выброса левого желудочка (ЛЖ) 64%, гипертрофия стенок ЛЖ, зоны гипо- и акинеза не обнаружены, нарушение диастолической функции ЛЖ по обструктивному типу.
В динамике на фоне рецидивирования ангинозных болей течение заболевания осложнилось острой левожелудочковой недостаточностью. Проводилась в/в инфузия нитратов, морфина, диуретическая терапия, статины, ингибиторы ангиотензин-превращающего фермента, блокаторы кальциевых каналов, препараты железа, монотерапия клопидогрелем, заместительная гемотрансфузия эритроцитарной массой.
Учитывая явления макрогематурии неясного генеза, умеренный риск кровотечения по CRUSADE – 32 б, ARC-HBR (4 больших критерия), антикоагулянты и ацетилсалициловая кислота не назначались. С целью определения источника кровотечения проведена компьютерная томография с контрастированием почек и мочевыводящих путей, диагностировано образование передней стенки мочевого пузыря с признаками распада, прорастанием стенки.
25.11.2022 г. состояние пациента обсуждено мульти-дисциплинарной командой в составе кардиолога, кардиохирурга, рентгенэндоваскулярного хирурга и онкоуролога, принято решение о проведении ЧКВ в объеме стентиро-
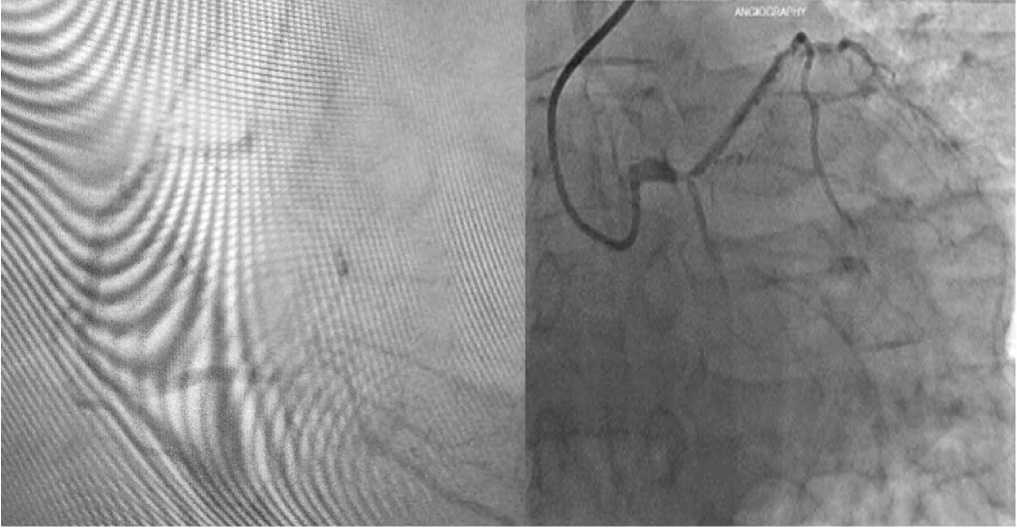
Рис. 2. Ангиографическая картина пациента Х
Fig. 2. Angiographic picture of the patient Х
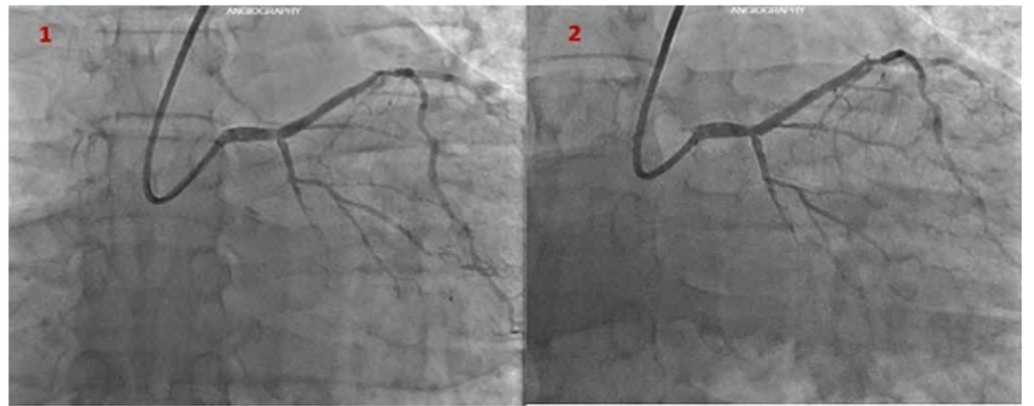
Рис. 3. Коронарография пациента Х: 1 – стентирование ствола левой коронарной артерии – передней межжелудочковой артерии; 2 – итоговый результат после постдилатации стента баллоном и постдилатация через ячейку стента в огибающей артерии
Fig. 3. Coronary angiography of the patient Х: 1 –stenting of the left coronary artery trunk - the anterior interventricular artery; 2 – the final result after postdilation of the stent with a balloon and postdilation through the stent cell in circumflex accent
вания СтЛКА и ПМЖА по неотложным показаниям с последующим оперативным лечением на мочевом пузыре в условиях Алтайского краевого кардиологического диспансера бригадой онкоурологов.
26.11.2022 г. в 06:50 проведено стентирование СтЛКА – ПМЖА стентом с лекарственным покрытием, постдилатация стента баллоном, постдилатация через ячейку стента в ОА (рис. 3). После ЧКВ в связи со снижением гемоглобина до 75 г/л проводилась гемотрансфузия. По ЭКГ после ЧКВ – синусовый ритм, ST на изолинии.
26.11.2022 г. в 10:40 под общей анестезией проведена операция – резекция мочевого пузыря с опухолью. По результатам биопсии верифицирована умеренно дифференцированная аденокарцинома.
27.11.2022 г. пациент переведен с клопидогреля на тикагрелор в дозе 90 мг 2 раза в день (учитывая имеющиеся факторы высокого риска тромбоза стентов).
Послеоперационный период протекал без осложнений, боли ангинозного характера не рецидивировали. В динамике макрогематурия купировалась.
09.12.2022 г. выписан на амбулаторный этап с рекомендациями, направлен на лечение к онкологам.
При выписке: гемоглобин – 95 г/л, тромбоциты – 428 × 109/л, лейкоциты – 9,0 × 109/л, СОЭ – 108 мм/ч, в остальном – без значимых отклонений от референтных значений.
На амбулаторный этап рекомендовано: тикагрелор – 90 мг 2 раза в сутки в течение 12 мес. после стентирования (под контролем гемоглобина, с перерасчетом рисков в динамике через 1 мес.), ацетилсалициловая кислота – 100 мг после обеда постоянно, периндоприл – 5 мг/сут, аторвастатин – 80 мг после ужина, бисопролол – 5 мг/ сут, омепразол – 20 мг утром за 30 мин до еды, железа (III) гидроксид полимальтозат – 100 мг 2 раза в день под контролем гемоглобина. По шкале PRECISE-DAPT – 43 балла, в связи с чем длительность двойной антитромбо-цитарной терапии (ДААТ) будет сокращена до 1–3 мес.
Обсуждение
Согласно рекомендациям ESC по кардиоонкологии (2022), ведение пациентов с ОКС и онкозаболеваниями отличается сложностью из-за хрупкости пациента, повышенного риска кровотечений, тромбоцитопении, тром-бообразования и возможной необходимости выполнения операций в ближайшее время. Из-за потенциально более высокого риска кровотечения предпочтительная антитромботическая стратегия после стентирования коронарных артерий состоит из ДААТ с аспирином и клопи-догрелем. Продолжительность ДААТ должна составлять 1–3 мес. для снижения риска кровотечений [2].
На сегодняшний день ЧКВ является альтернативой операции коронарного шунтирования (КШ) при поражении ЛКА / многососудистом поражении у пациентов с низкой категорией анатомической сложности по SYNTAX (менее 22 баллов) и при отсутствии сахарного диабета. Выбор же стратегии и способ реваскуляризации при многососудистом поражении / вовлечении ствола ЛКА требует специального обсуждения Heart-team-командой и основывается на оценке клиники заболевания, сопутствующей патологии, анатомической тяжести поражения коронарных артерий, риске реваскуляризации, ожидаемой продолжительности жизни [14–18].
В представленном клиническом случае, учитывая наличие у пациента ОКСбпST рефрактерной стенокардии, риск по шкале GRACE – 146 баллов, бифуркационный стеноз СтЛКА, индекс SYNTAX – 25 баллов и активное кровотечение (вследствие распада злокачественного новообразования), мультидисциплинарной командой принято решение о проведении двухэтапного хирургического вмешательства: реваскуляризации миокарда в объеме стентирования СтЛКА и ПМЖА с последующим оперативным лечением на мочевом пузыре в условиях кардиологического стационара по неотложным показаниям.
Представленный пациент имел факторы высокого тромботического риска, характерные для онкологических больных, и геморрагическое осложнение – активное кровотечение из распадающегося онкообразования, потребовавшее проведения гемотрансфузии. После оценки рисков по шкалам CRUSADE (32 балла), PRECISE-DAPT (43 балла), ARC-HBR (4 больших критерия), BARC выявлено, что геморрагические и ишемические (развитие инфаркта миокарда с подъемом или без подъема сегмента ST) риски сопоставимы. В связи с этим после выполнения ЧКВ основных симптомсвязанных артерий (ствол ЛКА и ПМЖА-бифуркационный стеноз) и проведения резекции мочевого пузыря продолжена антиагрегантная монотерапия тикагрелором в дозе 90 мг 2 раза в день без предшествующей нагрузочной дозы. В дальнейшем после полноценного гемостаза возобновлен прием ацетилсалициловой кислоты в дозе 100 мг с рекомендацией минимального периода приема ДААТ (1 мес.).
Кроме того, в настоящее время альтернативой общеизвестным шкалам оценки риска кровотечения у пациентов с ОКСбпST, таким как CRUSADE, PRECISE-DAPT, становится недавно разработанный алгоритм Academic Research Consortium for High Bleeding Risk (ARC-HBR) для определения пациентов с высоким риском кровотечений. Более детализированный подход, включая ана- лиз сопутствующих заболеваний пациента, в том числе активное злокачественное новообразование, позволяет оценить безопасность и эффективность схем лечения пациентов, перенесших ЧКВ. В клинических рекомендациях ESC по ведению пациентов с ОКСбпST (2020) отмечено, что алгоритм ARC-HBR следует использовать в клинической практике, наряду с общеизвестными валидированными шкалами [13, 19].
В связи с ежегодно увеличивающейся распространенностью онкологический заболеваний, широким использованием кардиотоксичных химиопрепаратов и часто встречающимся ОКС у этой категории больных актуальной задачей для профилактики осложнений остается разработка прогностических шкал.
Заключение
Таким образом, важной составляющей при ведении пациентов с ОКС и онкозаболеваниями на сегодняшний день остается совместная работа мультидисциплинар-ной команды врачей и индивидуальный подход, основанный на использовании рискометров.


