Однонуклеотидный полиморфизм опухоли молочной железы и экспрессия АВС-транспортеров после неоадъювантной химиотерапии
Автор: Цыганов Матвей Михайлович, Ибрагимова Марина Константиновна, Слонимская Елена Михайловна, Чердынцева Надежда Викторовна, Литвяков Николай Васильевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 5 (71), 2015 года.
Бесплатный доступ
В настоящее время практически не изученным остается механизм регуляции экспрессии генов АВСтранспортеров, который связан с индивидуальными особенностями организма опухоленосителя и его опухоли, определяемыми генным однонуклеотидным полиморфизмом (SNP - Single Nucleotide Polymorphism). Проведено изучение ассоциации SNP в широкогеномном масштабе с уровнем экспрессии генов АВС-транспортеров после неоадъювантной химиотерапии (НХТ) у 68 больных с морфологически верифицированным раком молочной железы (РМЖ). При помощи количественной ПЦР с обратной транскрипцией в режиме реального времени изучена экспрессия 4 генов АВС: ABCB1, ABCC1, ABCC2, ABCG2 в операционном материале после НХТ. для исследования SNP проводили микроматричный анализ на дНК-чипах высокой плотности, которые содержат более 750 тыс. однонуклеотидных полиморфизмов. В результате биоинформатического анализа было идентифицировано 6 SNP, которые статистически значимо связаны с послеоперационным уровнем экспрессии генов АВС: ABCB1, ABCC1, ABCC2 и ABCG2. Показано, что у носителей редкого генотипа уровень экспрессии всех 4 исследованных генов в опухоли после воздействия химиопрепаратов либо снижен (rs2680835, rs1951366 и rs12018988), либо повышен (rs4676478, rs6896596, rs1154121) по сравнению с носителями частого и гетерозиготного генотипов этих SNP. Обсуждены возможные механизмы влияния выявленных SNP и их генов на экспрессию АВС-транспортеров.
Авс-транспортеры, рак молочной железы, однонуклеотидный полиморфизм, микроматричное исследование
Короткий адрес: https://sciup.org/14056581
IDR: 14056581 | УДК: 618.19-006:615.28:575.113
Текст научной статьи Однонуклеотидный полиморфизм опухоли молочной железы и экспрессия АВС-транспортеров после неоадъювантной химиотерапии
Основной причиной неэффективности химиотерапии считают формирование фенотипа множественной лекарственной устойчивости (МЛУ) опухоли за счет экспрессии энергозависимых белков АВС-транспортеров ( ABCB1 , ABCB3 , ABCC1 , ABCC2 , ABCC5 , ABCG1 , ABCG2 ), выбрасывающих лекарственные препараты из опухолевых клеток против градиента концентрации с затратой энергии АТФ [9, 11]. Наши предыдущие исследования показали, что эффективность неоадъювантной химиотерапии (НХТ) рака молочной железы (РМЖ) связана не с исходным уровнем экспрессии АВС-транспортеров в опухоли, а с его изменением в процессе лечения. Если в процессе НХТ экспрессия генов АВС в опухоли снижается, то наблюдается клинический ответ на химиотерапию, в противном случае формируется фенотип множественной лекарственной устойчивости, ответ на химиотерапию отсутствует и значительно увеличено отдаленное метастазирование [1–3, 21].
Практически не изученным остается механизм регуляции экспрессии АВС-транспортеров, который связан с индивидуальными особенностями организма опухоленосителя и его опухоли, определяемыми генным однонуклеотидным полиморфизмом (SNP – Single Nucleotide Polymorphism). Известны только немногие SNP, которые ассоциированы с уровнем экспрессии АВС-транспортеров. Прежде всего, это полиморфизм самих генов АВС, которые имеют значение для экспрессии генов АВС и работы транспортеров: ABCG2 R482T или R482G, ABCB1 rs1045642, ABCC1 rs35605, GSTP1 rs1695, ABCG2 rs2725264, ABCC2 (rs1885301, rs717620 и rs3740066) и др. [5, 6, 13–15, 25–27, 29, 30]. По данным ряда авторов, экспрессия генов АВС связана и с отдельными полиморфизмами других генов [7, 9, 32]. Наши предыдущие исследования позволили установить 5 SNP генов репарации, апоптоза и фолатного цикла (TP53 rs1042522, TP53 rs8073498, MTH-FR rs1801133, FGFR2 rs2981582 и ATM1 rs664143), которые связаны с регуляцией отдельных генов АВС [4].
Таким образом, анализ литературы свидетельствует о связи полиморфизма с уровнем экспрессии
генов АВС и их регуляцией и делает актуальными исследования по выявлению генов и полиморфных локусов, участвующих в регуляции экспрессии АВС-транспортеров и формировании лекарственной устойчивости опухоли. Следует отметить, что исследования связи генного полиморфизма с экспрессией генов АВС проводятся в мире в узком формате. В одном исследовании изучаются не более 100 полиморфизмов, что не позволяет в полной мере выявить индивидуальные генетические особенности организма и опухоли, связанные с экспрессией генов АВС-транспортеров. Работы по изучению связи SNP c изменением экспрессии генов АВС в процессе химиотерапии отсутствуют, а, как нами было установлено, именно изменение экспрессии АВС-транспортеров определяет эффективность химиотерапии.
Целью исследования явилось изучение ассоциации SNP опухоли молочной железы в широко- геномном масштабе с уровнем экспрессии генов АВС-транспортеров после НХТ.
Материал и методы
В исследование включены 68 больных РМЖ IIA–IIIC стадий, с морфологически верифицированным диагнозом, в возрасте 28–68 лет, в среднем 53,43 ± 0,78 года (табл. 1). В соответствии с «Con-sensus Conference on Neoadjuvant Chemotherapy in Carcinoma of the Breast, April 26–28, 2003, Philadelphia, Pennsylvania» [28] все больные получали 2–4 курса неоадъювантной химиотерапии по схемам FAC (фторурацил, доксорубицин, циклофосфан), CAX (циклофосфан, доксорубицин, кселода) или монотерапию таксотером. Через 3–5 нед после НХТ выполнялась операция, затем проводили 2 курса адъювантной химиотерапии по схеме FAC, лучевая терапия и/или гормональное лечение назначались по показаниям. Исследование проводи-
Таблица 1
Клинико-патологические параметры обследованных больных РМЖ
РНК выделяли из 68 образцов после НХТ с помощью набора RNeasy Plus mini Kit (Qiagen, Germany) в соответствии с инструкцией производителя. Качество и целостность РНК оценивались при помощи капиллярного электрофореза на приборе TapeStation (Agilent Technologies, USA). Показатель RIN составил 5,6–7,8. Для получения кДНК на матрице РНК проводили реакцию обратной транскрипции с помощью набора Re-vertAid™ (Fermentas, Lithuania) со случайными гексануклеотидными праймерами в соответствии с инструкцией к набору. Остальные манипуляции, последовательность праймеров и методика оценки относительной экспрессии генов АВС описаны ранее [21]. В качестве результата оценивался уровень экспрессии исследуемых генов АВС: ABCB1 , AB-CC1 , ABCC2 и ABCG2 относительно гена-рефери GAPDH и нормальной ткани молочной железы, вычисляемый по методу Pfaffl [24] в операционном материале после НХТ.
ДНК выделяли из 68 биопсийных образцов опухолевой ткани с помощью набора QIAamp DNA mini Kit (Qiagen, Germany). Концентрацию ДНК и чистоту выделения оценивали на спектрофотометре NanoDrop-2000 (Thermo Scientific, USA) (от 50 до 150 нг/мкл, А260/А280 = 2,10–2,35; А260/ А230 = 2,15–2,40). Целостность ДНК оценивалась при помощи капиллярного электрофореза на приборе TapeStation (Agilent Technologies, USA), фрагменты ДНК имели массу более 48 kbp.
Результаты исследования и обсуждение
Была проанализирована связь экспрессии генов АВС-транспортеров после НХТ с SNP, которые определялись в опухоли до лечения при помощи микроматриц. Поскольку в предыдущем исследовании наиболее сильная коэкспрессия в процессе НХТ была показана для генов ABCB1 , ABCC1 , ABCC2 и ABCG2 , то анализировали связь SNP с экспрессией именно этих четырех генов. Всего в биоинформатический анализ было включено 749 158 SNP на каждого пациента. В процессе анализа происходила фильтрация первичных данных. В первую очередь из представленного массива данных (749 158 SNP) были исключены мономорфные полиморфизмы, которые имели только один (дикий) или два (дикий и гетерозиготный) генотипа. Далее из анализа исключались SNP с частотами генотипов, не соответствующими ожидаемым при соблюдении равновесия Харди – Вайнберга, поскольку в противном случае выборка по SNP оказывается подразделенной и ее нельзя рассматривать как единую выборку. Следующий фильтр был подобран, исходя из выбора в качестве генотипической модели – рецессивной генотипической модели (редкий генотип против гетерозиготного + частого генотипов), которая была определена согласно информационному критерию Акаике. Эмпирически была подобрана необходимость наличия частоты редкого генотипа не менее 8 %. Все SNP с частотой редкого генотипа исключались из анализа. В итоге для анализа было оставлено 258 586 SNP. Для этих SNP был произведен расчёт уровня статистической значимости различий экспрессии по каждому из четырех генов АВС после НХТ – редкий генотип против гетерозиготного+частого генотипов по лог-линейной регрессии. Далее были выбраны общие для генов ABCB1 , ABCC1 , ABCC2 и ABCG2 SNP. В результате идентифицировано 6 полиморфизмов ( EPHA4 (rs2680835) , SCN10A (rs4676478) , H2AFY (rs6896596) , SLC25A21 (rs1154121) , RTN1 (rs1951366) , RTN1 (rs12018988) ), связанных с послеоперационным уровнем экспрессии четырех генов АВС ( ABCB1, ABCC1, ABCC2 и ABCG2 ) одновременно (рис. 1).
Экспрессия всех четырех исследованных генов АВС у носителей редкого генотипа полиморфизмов EPHA4 (rs2680835), RTN1 (rs1951366) и RTN1 (rs12018988) после проведения НХТ статистически
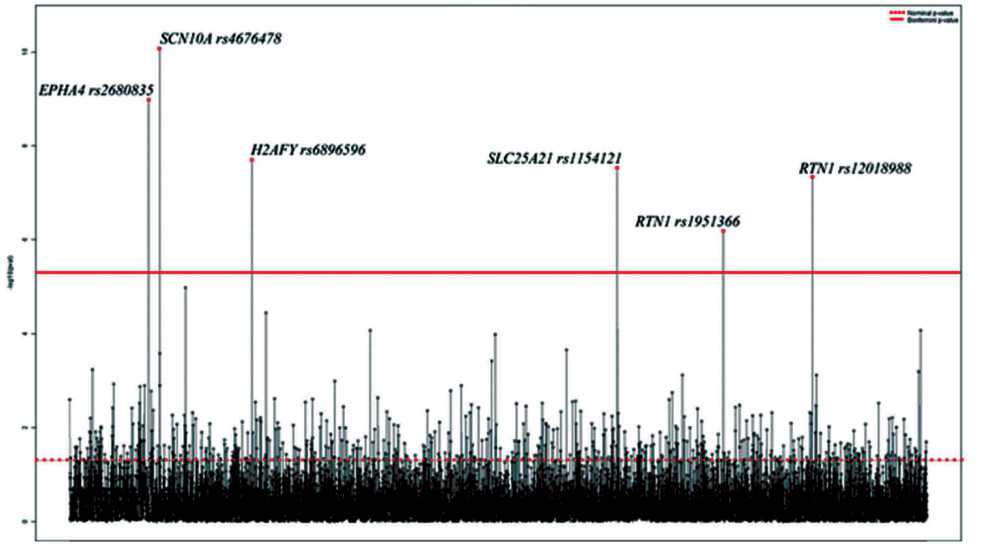
Рис. 1. Уровень статистической значимости связи SNP с экспрессией генов ABCB1, ABCC1, ABCC2 и ABCG2 после НХТ. Примечание: по оси ординат – значение десятичного логарифма уровня статистической значимости (p-level);
по оси абсцисс – однонуклеотидные полиморфизмы (n = 258586 SNP). На рисунке пунктирной линией обозначено значение номинального p-level, равного 0,05, сплошной линией – значение p-level с учетом поправки Бонферрони
значимо ниже, чем у носителей гетерозиготного и дикого генотипов (p-level < 0,01 с учетом поправки Бонферрони) (табл. 2). Для полиморфизмов SCN10A (rs4676478), H2AFY (rs6896596), SLC25A21 (rs1154121) было показано, что у больных с гетерозиготным и диким генотипом уровень экспрессии после НХТ достоверно ниже по сравнению с редким генотипом, в среднем в 2 раза (p-level<0,01 с учетом поправки Бонферрони). Таким образом, однонуклеотидный полиморфизм опухолевых клеток может оказывать влияние на уровень экспрессии комплекса генов АВС после воздействия химиопрепаратов.
Механизм, благодаря которому SNP может оказывать влияние на экспрессию генов АВС, еще предстоит выявить. В настоящее время на основании литературных данных можно только высказать некоторые предположения. Функция полиморфизма EPHA4 (rs2680835), согласно базе данных , неизвестна. По поводу функций гена EPHA4 имеется некоторая информация. В недавних исследованиях было показано, что целенаправленное ингибирование экспрессии генов группы EPHA вызывает устойчивость опухоли молочной железы к трастузумабу [34], но при этом делает опухолевые клетки чувствительными к тамоксифену [10]. Учитывая то, что выведение тамоксифена из опухолевых клеток осуществляется двумя генами лекарственной устойчивости ABCB1 и ABCC2 [31], можно предположить, что мутантный генотип EPHA4 (rs2680835) ингибирует экспрессию этого гена.
Роль гена ретикулона 1 – RTN1 – в формировании лекарственной устойчивости или взаимодействии с генами АВС остается неясной. В единичных исследованиях было показано, что продукт гена
RTN1 может взаимодействовать с белком спастин (SPAST) [22], который, в свою очередь, опосредованно влияет на экспрессию белка тубулина, что делает опухолевые клетки чувствительными к воздействию химиопрепаратов [8].
Для полиморфизма SCN10A (rs4676478) в базе данных показана функция регуляции транскрипции. Сам ген SCN10A кодирует тетродотоксин-резистентный натриевый канал, локализуется на мембране клетки. В недавней публикации показана роль SNP этого гена в индуцированной химиотерапией гастроинтестинальной токсичности [12], в реализации которой также играют роль и полиморфизмы генов АСВ [20].
Согласно базе , полиморфизм гена гистонового белка H2AFY (rs6896596) находится в downstream регионе и участвует в регуляции транскрипции гена H2AFY, который регулирует HDAC (Histone Deacetylase) диацетилазу гистонов (). Также недавно было показано, что HDAC1 и 2 ингибируют экспрессию генов ABCB1 и ABCC2 их продуктов в клеточных культурах colorectal adenocarcinoma и carcinoma [33].
В 2012 г. J. Radosław et al. провели микрома-тричное исследование экспрессии генов АВС-транспортеров и генов семейства транспортеров SLC. Ими была изучена роль данных генов в формировании лекарственной устойчивости к таким химиопрепаратам, как метотрексат, цисплатин, доксорубицин, винкристин, топотекан, а также паклитексел – при раке яичника [18]. Оказалось, что высокий уровень экспрессии генов SLC связан с устойчивостью опухолевых клеток к метотрек-
Таблица 2
Уровень экспрессии генов ABCB1, ABCC1, ABCC2 и ABCG2 в опухоли молочной железы после НХТ в зависимости от генотипа по выявленным полиморфизмам в рецессивной модели наследования
Заключение
В результате проведенного широкогеномного исследования полиморфизмов опухоли молочной железы были идентифицированы 6 SNP, статистически значимо связанных с уровнем экспрессии генов множественной лекарственной устойчивости ABCB1 , ABCC1 , ABCC2 и ABCG2 после НХТ . Показано, что у носителей редкого генотипа уровень экспрессии всех четырех исследованных генов в
Список литературы Однонуклеотидный полиморфизм опухоли молочной железы и экспрессия АВС-транспортеров после неоадъювантной химиотерапии
- Литвяков Н.В. Регуляция экспрессии генов множественной лекарственной устойчивости в опухоли молочной железы при проведении неоадъювантной химиотерапии: Автореф. дис. … д-ра биол. наук. Томск, 2014. 47 с
- Литвяков Н.В. Градиентный феномен экспрессии генов множественной лекарственной устойчивости в опухоли молочной железы при проведении неоадъювантной химиотерапии: связь с прогрессированием заболевания//Сибирский онкологический журнал, 2013. № 4. С. 5-11
- Литвяков Н.В., Гарбуков Е.Ю., Слонимская Е.М., Цыганов М.М., Денисов Е.В., Вторушин С.В., Христенко К.Ю., Завьялова М.В., Чердынцева Н.В. Связь безметастатической выживаемости больных раком молочной железы и вектора изменения экспрессии генов множественной лекарственной устойчивости в опухоли при проведении неоадъювантной химиотерапии//Вопросы онкологии. 2013. Т. 59, № 3 (59). С. 334-340
- Литвяков Н.В., Чердынцева Н.В., Цыганов М.М., Денисов Е.В., Мерзлякова М.К., Гарбуков Е.Ю., Вторушин С.В., Завьялова М.В., Слонимская Е.М. Ассоциация генетического полиморфизма с изменением экспрессии генов множественной лекарственной устойчивости в опухоли молочной железы в процессе неоадъювантной химиотерапии//Медицинская генетика. 2011. Т. 10, № 10. С. 37-43
- Allen J.D., Jackson S.C., Schinkel A.H. A mutation hot spot in the Bcrp1 (Abcg2) multidrug transporter in mouse cell lines selected for Doxorubicin resistance//Cancer Res. 2002. Vol. 62 (8). P. 2294-2299
- Di Francia R., Siesto R.S., Valente D., Spart D., Berretta M. Pharmacogenomics panel test for prevention toxicity in patient who receive Fluoropirimidine/Oxaliplatin-based therapy//Eur. Rev. Med. Pharmacol. Sci. 2012. Vol. 16 (9). P. 1211-1217
- Einert T.R., Schmidt G., Binnig G. Diagnostics//Ann. Oncol. 2012. Vol. 23 (Suppl. 5): P. 12-22 DOI: 10.1093/annonc/mds161
- Errico A., Claudiani P., D’Addio M., Rugarli E.I. Spastin interacts with the centrosomal protein NA14, and is enriched in the spindle pole, the midbody and the distal axon//Hum. Mol. Genet. 2004. Vol. 13 (18). P. 2121-2132
- Gillet J.P., Gottesman M.M. Overcoming multidrug resistance in cancer: 35 years after the discovery of ABCB1//Drug Resistance Updates. 2012. Vol. 15 (1-2). P. 2-4 DOI: 10.1016/j.drup.2012.03.001
- Gökmen-Polar Y., Toroni R.A., Hocevar B.A., Badve S., Zhao Q., Shen C., Bruckheimer E., Kinch M.S., Miller K.D. Dual targeting of EphA2 and ER restores tamoxifen sensitivity in ER/EphA2-positive breast cancer//Breast Cancer Res. Treat. 2011. Vol. 127 (2). P. 375-384. doi: 10.1007/s10549-010-1004-y
- Gottesman M.M., Fojo T., Bates S.E. Multidrug resistance in cancer: role of ATP-dependent transporters//Nat. Rev. Cancer. 2002. Vol. 2 (1). P. 48-58
- He Y.J., Winham S.J., Hoskins J.M., Glass S., Paul J., Brown R., Motsinger-Reif A., McLeod H.L Carboplatin/taxane-induced gastrointestinal toxicity: a pharmacogenomics study on the SCOTROC1 trial//Pharmacogenomics J. 2015 DOI: 10.1038/tpj.2015.52
- Henriksen U., Gether U., Litman T. Effect of Walker A mutation (K86M) on oligomerization and surface targeting of the multidrug resistance transporter ABCG2//J. Cell Sci. 2005. Vol. 118 (7). P. 1417-1426
- Hoffmeyer S., Burk O., von Richter O., Arnold H.P., Brockmöller J., Johne A., Cascorbi I., Gerloff T., Roots I., Eichelbaum M., Brinkmann U. Functional polymorphisms of the human multidrug-resistance gene: multiple sequence variations and correlation of one allele with P-glycoprotein expression and activity in vivo//Proc. Natl. Acad. Sci. USA. 2000. Vol. 97 (7). P. 3473-3478
- Honjo Y., Hrycyna C.A., Yan Q.W., Medina-Pérez W.Y., Robey R.W., van de Laar A., Litman T., Dean M., Bates S.E. Acquired mutations in the MXR/BCRP/ABCP gene alter substrate specificity in MXR/BCRP/ABCPoverexpressing cells//Cancer Res. 2001. Vol. 61 (18). P. 6635-6639
- Huang Y., Sadée W. Membrane transporters and channels in chemoresistance and -sensitivity of tumor cells//Cancer Lett. 2006. Vol. 239 (2). P. 168-182
- Huang Y. Pharmacogenetics/genomics of membrane transporters in cancer chemotherapy//Cancer Metastasis Rev. 2007. Vol. 26 (1). P. 183-201
- Januchowski R., Zawierucha P., Ruciński M., Andrzejewska M., Wojtowicz K., Nowicki M., Zabel M. Drug transporter expression profiling in chemoresistant variants of the A2780 ovarian cancer cell line//Biomed. Pharmacother. 2014. Vol. 68 (4). P. 447-453 DOI: 10.1016/j.biopha.2014.02.002
- Januchowski R., Wojtowicz K., Sujka-Kordowska P., Andrzejewska M., Zabel M. MDR gene expression analysis of six drug-resistant ovarian cancer cell lines//Biomed. Res. Int. 2013 DOI: 10.1155/2013/241763
- Kim H.S., Kim M.K., Chung H.H., Kim J.W., Park N.H., Song Y.S., Kang S.B. Genetic polymorphisms affecting clinical outcomes in epithelial ovarian cancer patients treated with taxanes and platinum compounds: a Korean population-based study//Gynecol. Oncol. 2009. Vol. 113 (2): P. 264-269 DOI: 10.1016/j.ygyno.2009.01.002
- Litviakov N.V., Cherdyntseva N.V., Tsyganov M.M., Denisov E.V., Garbukov E.Y., Merzliakova M.K., Volkomorov V.V., Vtorushin S.V., Zavyalova M.V., Slonimskaya E.M., Perelmuter V.M. Changing the expression vector of multidrug resistance genes is related to neoadjuvant chemotherapy response//Cancer Chemother. Pharmacol. 2013. Vol. 71 (1). P. 153-163 DOI: 10.1007/s00280-012-1992-x
- Mannan A.U., Boehm J., Sauter S.M., Rauber A., Byrne P.C., Neesen J., Engel W. Spastin, the most commonly mutated protein in hereditary spastic paraplegia interacts with Reticulon 1 an endoplasmic reticulum protein//Neurogenetics. 2006. Vol. 7 (2). P. 93-103
- Nakanishi T. Drug transporters as targets for cancer chemotherapy//Cancer Genomics Proteomics. 2007. Vol. 4 (3). P. 241-254
- Pfaffl M.W. A new mathematical model for relative quantification in real-time RT-PCR//Nucleic Acids Res. 2001. Vol. 29 (9). P. e45
- Polgar O., Ozvegy-Laczka C., Robey R.W., Morisaki K., Okada M., Tamaki A., Koblos G., Elkind N.B., Ward Y., Dean M., Sarkadi B., Bates S.E. Mutational studies of G553 in TM5 of ABCG2: a residue potentially involved in dimerization//Biochemistry. 2006. Vol. 45 (16): P. 5251-5260
- Robey R., Honjo Y., Morisaki K., Nadjem T.A., Runge S., Risbood M., Poruchynsky M.S., Bates S.E. Mutations at amino-acid 482 in the ABCG2 gene affect substrate and antagonist specificity//Br. J. Cancer. 2003. Vol. 89 (10). P. 1971-1978
- Sauer G., Brehm G., Schneider S., Nielsch K., Wehrspohn R.B., Choi J., Hofmeister H., Gösele U. Highly ordered monocrystalline silver nanowire arrays//J. Appl. Phys. 2002. Vol. 91 (5): P. 3243-3247
- Schwartz G.F., Hortobagyi G.N. Proceedings of the consensus conference on neoadjuvant chemotherapy in carcinoma of the breast, April 26-28, 2003, Philadelphia, Pennsylvania//Cancer. 2004. Vol. 100 (12). P. 2512-2532
- Taheri M., Mahjoubi F., Omranipour R. Effect of MDR1 polymorphism on multidrug resistance expression in breast cancer patients//Genet. Mol. Res. 2010. Vol. 9 (1). P. 34-40 DOI: 10.4238/vol9-1gmr669
- Tamura A., Wakabayashi K., Onishi Y., Takeda M., Ikegami Y., Sawada S., Tsuji M., Matsuda Y., Ishikawa T. Re-evaluation and functional classification of nonsynonymous single nucleotide polymorphisms of the human ATP-binding cassette transporter ABCG2//Cancer Sci. 2007. Vol. 98 (2). P. 231-239
- Teft W.A., Mansell S.E., Kim R.B. Endoxifen, the active metabolite of tamoxifen, is a substrate of the efflux transporter P-glycoprotein (multidrug resistance 1)//Drug Metab. Dispos. 2011. Vol. 39 (3). P. 558-562 DOI: 10.1124/dmd.110.036160
- Vega-Gálvez A., Di Scalab K., Rodrígueza K., Lemus-Mondacaa R., Mirandaa M., Lópeza J., Perez-Wona M. Effect of air-drying temperature on physico-chemical properties, antioxidant capacity, colour and total phenolic content of red pepper (Capsicum annuum, L. var. Hungarian)//Food Chemistry. 2009. Vol. 117 (4). P. 647-653 DOI: 10.1016/j.foodchem.2009.04.066
- Xu Y., Jiang Z., Yin P., Li Q., Liu J. Role for Class I histone deacetylases in multidrug resistance//Exp. Cell Res. 2012. Vol. 318 (3). P. 177-186 DOI: 10.1016/j.yexcr.2011.11.010
- Zhuang G., Brantley-Sieders D.M., Vaught D., Yu J., Xie L., Wells S., Jackson D., Muraoka-Cook R., Arteaga C., Chen J. Elevation of receptor tyrosine kinase EphA2 mediates resistance to trastuzumab therapy//Cancer Res. 2010. Vol. 70 (1). P. 299-308 DOI: 10.1158/00085472.CAN-09-1845


