Окисление расплавов олово - медь и формирование окалины на этих сплавах
Автор: Денисова Л.Т., Денисов В.М., Биронт В.С., Зеер Г.М., Кирик С.Д.
Журнал: Журнал Сибирского федерального университета. Серия: Техника и технологии @technologies-sfu
Статья в выпуске: 3 т.3, 2010 года.
Бесплатный доступ
Приведены экспериментальные данные по кинетике окисления расплавов Sn-Cu при 1273 К. Определен состав и морфология образующейся окалины. Показана связь кинетики окисления с ликвидусом системы Sn-Cu.
Олово, медь, расплав, окисление
Короткий адрес: https://sciup.org/146114540
IDR: 146114540 | УДК: 669.046:542.943.4
Текст научной статьи Окисление расплавов олово - медь и формирование окалины на этих сплавах
Припои на основе олова часто используют для пайки меди и ее сплавов. Добавки олова в серебряно-медные припои обеспечивают высокую их смачивающую способность и прочность шва. Недостатками меди, как припоя, являются высокая температура плавления и склонность к образованию кристаллизационных трещин при пайке в окислительной среде (образование эвтектики Cu-Cu2O). Для снижения температуры и повышения жидкотекучести в медные припои добавляют олово [1]. Поэтому возникает необходимость исследования поведения расплавов Sn-Cu на воздухе.
Результаты и их обсуждение
Окисление расплавов Sn-Cu изучали в интервале составов от 0 до 90 ат. % Cu при 1273 К методом высокотемпературной гравиметрии [2, 3]. Данные по окислению сплавов Sn-Cu приведены в табл. 1. Из нее следует, что на закон окисления расплавов влияет состав исходных сплавов. Отметим, что для чистой жидкой меди при температуре 1366 К (т.е. при температуре, близкой к ее температуре плавления) отмечен излом на кривой окисления (Δm/s = f(τ); Δm/s – изменение массы образца на единицу времени; τ – время) [3], который при более высоких температурах 1413 и 1476 К не наблюдается. Наличие излома на кинетической кривой окисления Cu при 1366 К было отнесено на счет достижения предела насыщения жидкой меди кислородом. Наличие изломов на кинетических кривых окисления сплавов Sn-Cu (табл. 1) может быть связано с протеканием во времени различных последовательных процессов. В этом случае скорость окисления описывается полным параболическим уравнением
Таблица 1. Законы роста оксидного слоя на расплавах Sn-Cu
|
C Cu , ат. % |
Закон роста* |
C Cu , ат. % |
Закон роста |
|
0 |
Паралинейный, τ = 600 с |
45 |
Параболический, τ = 1800 с |
|
10 |
Параболический |
50 |
Линейный, τ = 1500 с |
|
20 |
Параболический |
Линейный |
|
|
25 |
Параболический, τ = 2200 с |
60 |
Параболический |
|
30 |
Параболический |
70 |
Линейный, τ = 1500 с |
|
35 |
Линейно-параболический, τ = 1500 с |
80 |
Параболический, τ = 2200 с |
|
40 |
Линейный, τ = 480 с |
90 |
* Значение τ – время смены закона роста окалины aS + — bS2 + c = t,
2, где a, b, c – постоянные; δ – толщина образующегося оксидного слоя. При малых значениях τ, т.е. когда скорость окисления близка к истинной, величина δ мала и практически не влияет на скорость окисления [4]. В этом случае вторым членом уравнения (1) можно пренебречь (линейный закон окисления). При больших значениях τ, а следовательно и δ, первым членом уравнения (1) можно пренебречь (параболический закон окисления).
Выше было указано, что для разных сплавов Sn-Cu реализуется разный закон окисления. Можно полагать, что это может быть связано с разным составом и морфологией образующейся окалины на этих сплавах. Для выяснения данного обстоятельства был проведен рентгенофазовый анализ полученных окалин на приборе X’Pert Pro фирмы «Panalytical» (Нидерланды). С помощью растрового электронного микроскопа JEOL JSM 7001 F и энергодисперсионного спектрометра INCA Energy PentaFETx3 получены снимки окалины, образующейся на расплавах Sn-Cu и проведен ее анализ. Все эти данные приведены на рис. 1 и 2 и представлены в табл. 2 и 3.
При анализе данных, приведенных в табл. 2, следует учитывать, что в системе Cu-O возможно существование оксидов CuO, Cu 2 O, Cu 2 O 3 , Cu 3 O 2 и Cu 4 O 3 [5] (некоторые из этих оксидных соединений обнаружены нами в окалинах на сплавах Sn-Cu). Кроме того, установлено, что при равновесных условиях в системе Cu-O при 200…1500 К в широком интервале давлений кислорода возможно существование как индивидуальных фаз Cu2O3, Cu4O3, Cu3O2 и CuO, так и их различных смесей. Степени окисления меди в оксидах и средние степени окисления меди в смесях оксидов закономерно понижаются с ростом температуры и уменьшением парциального давления кислорода:
Cu(3)O 1,5 →Cu(2)O 1,0 →Cu(1,5)O 0,75 →Cu(1,333)O 0,667 →Cu(1,0)O 0,5 .
В работе [6] также сообщено о существовании соединения Cu4O3 и его свойствах.
По данным [7, 8], в системе CuO-SnO 2 имеется соединение SnCuO 3 . Из табл. 2 следует, что ни на одном сплаве в окалине оно не обнаружено. Можно предположить, что это связано с его диссоциацией при температурах эксперимента.
В системе Sn-O образуются два оксидных соединения SnO и SnO2 [9, 10], наличие которых в окалинах на расплавах Sn-Cu обнаружено нами (табл. 2).



Sn La1
0 Ka1
Рис. 1. Характеристические спектры меди, олова и кислорода фрагментов окалины после окисления расплава 70 ат. % Cu – 30 ат.% Sn (увеличение – x10000)
Таблица 2. Влияние исходного состава сплавов Sn-Cu на фазовый состав образующейся окалины
|
Состав расплава Sn-Cu, ат. % |
Состав окалины |
|
90Cu-10Sn |
SnO 2 , Cu 2 O |
|
80Cu-20Sn |
SnO 2 , CuO |
|
70Cu-30Sn |
SnO 2 , CuO |
|
60Cu-40Sn |
SnO 2 , CuO, Cu 2 O |
|
50Cu-50Sn |
SnO 2 , CuO |
|
45Cu-55Sn |
SnO 2 , CuO |
|
40Cu-60Sn |
SnO 2 , CuO |
|
35Cu-65Sn |
SnO 2 , SnO, Cu 4 O 3 |
|
30Cu-70Sn |
SnO 2 , SnO, Cu 4 O 3 |
|
20Cu-80Sn |
SnO 2 |
|
10Cu-90Sn |
SnO 2 |



Sn La1
0 Ka1
Рис. 2. Характеристические спектры меди, олова и кислорода фрагментов окалины после окисления расплава 40 ат. % Cu – 60 ат.% Sn (увеличение – x10000)
Таблица 3. Элементный состав окалины, образующейся на сплавах Sn-Cu
|
Состав расплава Sn-Cu, ат. % |
Элементный состав окалины, ат. % |
|||
|
O |
Cu |
Sn |
N |
|
|
25Cu-75Sn |
78,90 |
1,29 |
19,81 |
- |
|
30Cu-70Sn |
70,99 |
5,61 |
23,40 |
- |
|
40Cu-60Sn |
65,74 |
4,42 |
24,43 |
5,41 |
|
50Cu-50Sn |
70,01 |
9,02 |
20,97 |
- |
|
60Cu-40Sn |
70,05 |
9,87 |
16,54 |
3,54 |
|
70Cu-30Sn |
70,15 |
5,08 |
19,36 |
5,41 |
Из табл. 3 видно, что после окисления на воздухе ряда сплавов Sn-Cu в образующейся окалине присутствует азот (к сожалению, форму его нахождения в окалинах определить не удалось). Ранее подобное явление наблюдали при окислении на воздухе других металлов [11].
По данным [12], азот не растворяется в твердой и жидкой меди до 1673 К. В то же время в системе медь-азот имеются соединения Cu3N и CuN3, которые получают взаимодействием аммиака с оксидами меди. Согласно [13], в меди азот не ионизируется и практически не растворяется.
Из [14] следует, что система Sn-N изучена достаточно плохо, имеется соединение Sn3N, которое разлагается при 633 К.
Эти данные свидетельствуют о том, что азот в расплавах Sn-Cu, по-видимому, не растворяется, а его наличие в окалинах может быть связано с взаимодействием его с образующейся окалиной. Это было отмечено и для других оксидных систем [11], а также подтверждается данными работы [15]. В работе [11] показано, что азот может влиять на скорость окисления металлов и сплавов. Для выяснения, было ли это и в нашем случае, рассмотрим влияние состава расплавов Sn-Cu на скорость их окисления при τ = 600 с. Это значение τ соответствует образованию окалины до изменения закона ее роста на всех сплавах Sn-Cu и истинной скорости окисления. Сопоставление этих данных (рис. 3) с содержанием азота в окалинах (табл. 3) показывает, что между ними нет непосредственной корреляции.
Зависимость v = f(CCu) (рис. 3) имеет довольно сложный характер, что может быть связано с особенностями кластерного строения окисляющегося расплава различного состава, наследующего при соответствующих концентрациях компонентов раствора кристаллографическое строение твердых фаз, при плавлении которых формируется расплав. Сопоставление различных участков экспериментальной кривой изменения скорости окисления расплава от состава сплавов с диаграммой фазового равновесия системы Sn-Cu [12] показывает, что для основных областей ликвидуса системы (ликвидус γ-фазы и ликвидус ε-фазы) наблюдается закономерное изменение скорости окисления расплава с изменением состава сплавов. Разрывы на кривой в области границ между участками ликвидуса (19,1 %, 43,1 % и 86,7 атомн. % Sn) разделяют рассматриваемую кривую на четыре участка. Каждый из участков отвечает области состава сплавов, которые плавятся с формированием кластерной структуры расплава, наследуемой от плавящейся твердой фазы.
Максимум на кривой, соответствующей области ликвидуса γ-фазы, характеризует такое кластерное строение жидкости, как состояние, имеющее высокое сродство к окислителю, в качестве которого выступает кислород. Кстати, в области составов, соответствующих максимуму на этом участке, в составе окалины был обнаружен азот, который мог замещать отдельные атомы кислорода в составе оксидов. Выявленный характер изменения сродства к окислителям по кривым с максимумом или с минимумом не противоречит общим закономерностям зависимости свойств растворов от их состава.
Минимум на кривой, соответствующей области ликвидуса е-фазы (при содержании олова в растворе от 43,1 до 86,7 % атомн.), свидетельствует, наоборот, о высокой устойчивости к окислению кластеров, имеющих строение ε–фазы, т.е. в данном случае проявляется низкое сродство к окислителю, преимущественно к кислороду. Обнаруженное экспериментально содержание азота для точки минимума скорости окисления на рассматриваемом участке кривой – 288 –
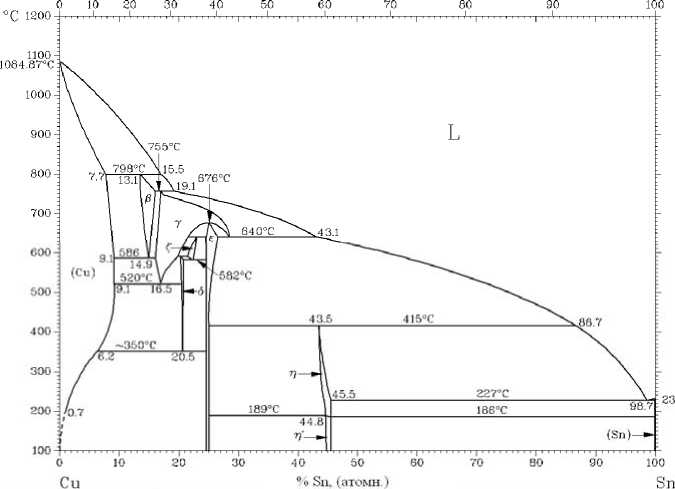
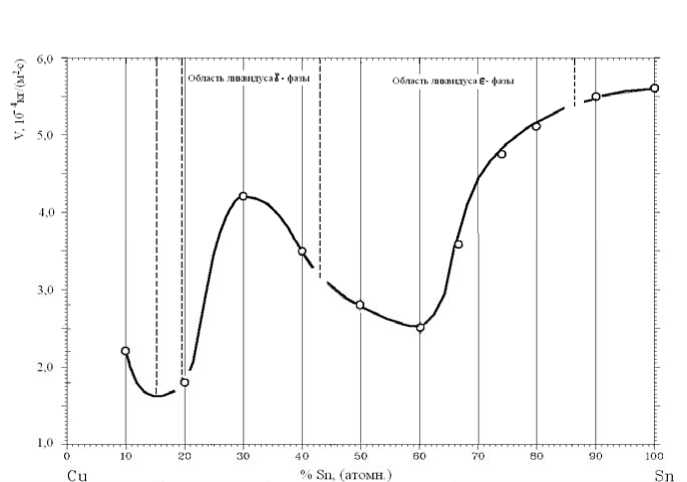
Рис. 3. Диаграмма фазового равновесия (а) и влияние состава расплавов Sn – Cu на скорость их
б
окисления (б)
может быть отнесено также к замещению атомов кислорода в окалине, но в составе кластеров, строение которых наиболее полно отвечает индивидуальной фазе (в данном случае ε–фазе).
Наименьшую склонность к окислению проявляет расплав, образующийся в области ликвидуса в-фазы, при концентрациях олова до 15,5 %. Однако небольшое количество экспериментальных точек в этой области составов не позволяет судить о закономерностях изменения склонности к окислению в данном случае от состава сплавов.
В [2] показано, что при окислении жидких сплавов существенную роль играют поверхностные явления. Олово по отношению к меди поверхностно-активный компонент, а на кривых зависимости поверхностного натяжения от состава отсутствуют различного рода экстремумы [16]. Кроме того, согласно [17], в сплавах на основе меди существует высокая степень поверхностной сегрегации олова. Все это подтверждает правильность высказанного предположения о том, что состав и морфология образующейся окалины оказывает влияние на окисление расплавов Sn-Cu.
Из рис. 1 и 2 видно, что на поверхности окалины проявляется морфология, свидетельствующая о гетерогенном строении вещества, включающего смесь индивидуальных оксидов меди и олова, по-разному распределенных в его составе в зависимости от состава исходного расплава. В случае избыточного содержания меди в исходном расплаве (70 ат. % Cu – 30 ат. % Sn) основу строения окалины составляют крупные кристаллы оксидов меди (рис.1), по поверхности которых распределяются более мелкие частицы оксида олова. Подтверждением такого характера строения окалины являются снимки образца в характеристическом излучении меди и олова (рис.1, CuKa1, SnLa1). Повышение содержания олова в исходном расплаве (рис.2) приводит к увеличению доли оксидов олова в образующейся окалине, которому принадлежит теперь ведущая роль в процессе окисления. Можно отметить более равномерное распред еле -ние кристаллов оксидов меди и олова, которые, однако, не теряют своей индивидуальности в оксидной смеси, соответствующей рассматриваемому слою окалины.
Авторы работы [18] анализировали окисление сплавов Ag-Sn-Cu в твердом состоянии. Подчеркнуто, что зародышеобразование CuO происходит труднее, чем SnO2. Кроме того, расчеты термодинамики окисления Sn и Cu показали, что олово будет первым окисляться при одних и тех же условиях. Отмечено, что вследствие этого частицы CuO образуются преимущественно на SnO2. Экспериментальные исследования установили, что это происходит действительно так при повышенном количестве олова в исходном расплаве. Однако в случае избытка меди в расплаве (рис. 1) при образовании окалины в процессе окисления жидких сплавов Sn-Cu первичными оказываются более крупные кристаллы оксида меди, на поверхности которых распределяются оксиды олова.
Заключение
Изучено окисление расплавов Sn-Cu в интервале составов от 0 до 90 ат. % Cu на воздухе при 1273 К. Установлено, что зависимость скорости окисления жидких металлических растворов от их состава имеет сложный характер и коррелирует с особенностями межчастичного взаимодействия в системе Sn-Cu-O. Показано, что характер окисления жидких растворов обусловлен изменением кластерного строения жидкости в различных концентрационных интервалах, а также составом и морфологией образующегося слоя окалины. Наименьшее сродство – 290 – к окислителю проявляют расплавы, образовавшиеся при плавлении ε- и β-фаз, наибольшее – γ-фазы и растворов на основе олова. При оценке области составов сплавов, проявляющих ту или иную склонность к окислителям можно ориентироваться на области ликвидуса изучаемой системы. В интервалах основных участков ликвидуса ε- и γ-фаз изменение скорости окисления расплавов происходит по непрерывным кривым с экстремумом, соответствующим минимуму и максимуму для указанных выше фаз.


