Окисление жидких сплавов индий-олово и индий-серебро
Автор: Денисова Л.Т., Денисов В.М., Кирик С.Д., Осипович Т.В.
Журнал: Журнал Сибирского федерального университета. Серия: Техника и технологии @technologies-sfu
Статья в выпуске: 4 т.3, 2010 года.
Бесплатный доступ
В статье рассмотрена кинетика окисления расплавов In-Sn и In-Ag в зависимости от состава исходных сплавов кислородом воздуха при 1273 К. Установлено, что в окалине на расплавах In-Sn даже при малом содержании в исходном сплаве индия содержится In2O3, в то время как олово в окалине появляется при содержании в исходном сплаве ≥ 40 ат. %. Увеличение скорости окисления расплавов In-Ag с ростом в них содержания серебра связывают с наличием в этой системе электронного соединения Ag3In.
Индий, олово, серебро, окисление
Короткий адрес: https://sciup.org/146114552
IDR: 146114552 | УДК: 669.046:542.943.4
Текст научной статьи Окисление жидких сплавов индий-олово и индий-серебро
Основой разрывных электроконтактов служит серебро. В качестве функциональных добавок, придающих таким контактам высокий уровень служебных характеристик, часто используют оксиды металлов [1]. Композиция Ag-CdO является универсальным контактным материалом для средненагруженных контактов [2]. Единственный оксид, способный в какой-то мере составить конкуренцию CdO (в большей степени из-за экологической безопасности), – оксид олова SnO2 [1, 2]. Для улучшения эксплуатационных свойств подобных контактов в SnO2 вводят добавки In 2 O 3 (Bi 2 O 3 , WO 3 , MoO 3 ) [1].
Известен способ получения электроконтактного материала Ag-SnO2 окислением расплавов Ag-Sn [3]. Представляется, что легирование SnO 2 оксидом индия можно провести подобным образом, т.е. окислением расплавов Ag-Sn-In. Сведения об окислении таких расплавов в литературе отсутствуют. Имеются лишь данные об окислении расплавов бинарной системы Ag-Sn [4, 5]. С учетом сказанного выше исследовано окисление жидких бинарных сплавов In-Sn и In-Ag.
Результаты и их обсуждение
Кинетику окисления этих расплавов изучали в атмосфере воздуха при 1273 К методом высокотемпературной гравиметрии [6, 7]. Анализ образующейся окалины проводили с исполь-
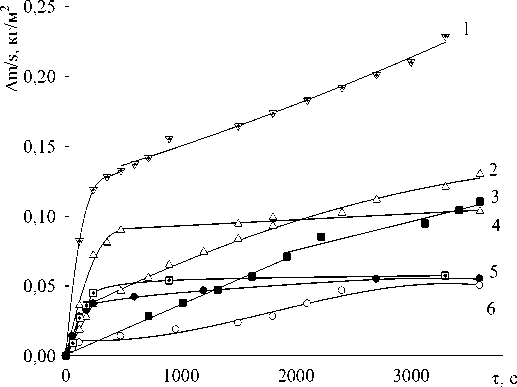
Рис. 1. Окисление расплавов системы In – Sn, ат. %: 1 – 10-90; 2 – 20-80; 3 -100-0; 4 – 40-60; 5 – 50-50; 6 – 80-20
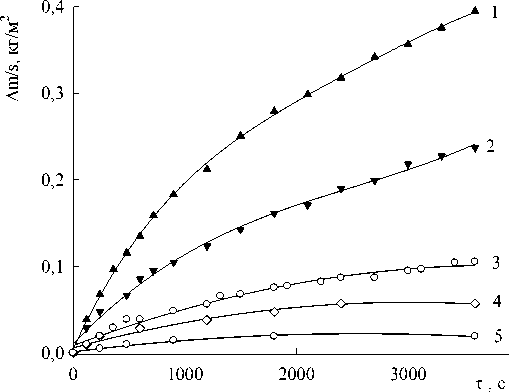
Рис. 2. Кинетика окисления расплавов системы In – Ag, ат. %: 1 – 30-70; 2 – 40-60; 3 -20-80; 4 – 60-40; 5 – 80-20
зованием рентгенофазового анализа на приборе X’Pert Pro фирмы «Panalytical» (Нидерланды). Для приготовления сплавов использовали In – Ин-000; Sn – ОВЧ-000, Ag – 99,99.
На рис. 1 и 2 приведены данные по окислению расплавов In-Sn и In-Ag.
Нами установлено, что в интервале температур 1073^1173 К металлический индий окисляется по параболическому закону и описывается полным параболическим уравнением [8]
aS + —b§2 + c = т, (1)
где δ – толщина образующейся окалины; τ – время; a, b, c – некоторые постоянные. При малых значениях τ второй член уравнения (1) по сравнению с первым мал и им можно пренебречь. В этом случае соотношение (1) отражает линейную зависимость. При больших толщинах слоя – 423 – окалины, наоборот, первый член становится пренебрежимо малым, и уравнение описывает обычный параболический закон. При 1273 К закон окисления индия меняется на линейный с изломом (рис. 1, кривая 3). Низкие значения скоростей окисления жидкого индия и сплавов с его высоким содержанием позволяют полагать, что образующаяся окалина подобна по свойствам таковой на жидком алюминии.
В системе индий-кислород установлено существование оксидов In 2 O 3 и In 2 O [9-12]. Температура плавления первого оксида равна 2183±10 К, а второго – 600 К. Заметим, что равновесная диаграмма состояния In-O содержит только In 2 O 3 [13].
По нашим данным, на чистом In и сплавах In-Sn, содержащих до 30 ат. % Sn, при окислении образуется In 2 O 3 . В этом случае можно полагать, что окисление при наличии In 2 O 3 на жидком индии при 1273 К могло привести к реакции [9]
In2O3 + 4In ↔ 3In2O. (2)
Реакция (2) протекает на межфазной границе твердое – жидкое (In 2 O 3 -In), на которой протекает и реакция окисления. С последней, по-видимому, связано то, что нами не обнаружено соединение In 2 O и отклонение от стехиометрии In 2 O 3 (это соединение обладает небольшой областью гомогенности In2O2,985 [10], In2O2,99 [6]. Согласно [12], In2O3 содержит небольшое избыточное (сверх стехиометрии) количество индия, что приводит к различным результатам измерения некоторых физических свойств (атмосфера над образцом, особенно при повышенных температурах, оказывает влияние на конечный результат). Кроме того, указано, что In 2 O 3 существует только в одной модификации.
Из рис. 1 следует, что сплавы In-Sn при малых значениях τ также окисляются по параболическому закону. Затем, по мере роста толщины слоя окалины для расплавов, содержащих менее 80 ат. % олова, процесс сильно замедляется. Расплавы In+80 ат. % Sn и In+90 ат. % Sn окисляются по параболическому закону.
На рис. 3 видно, что наибольшей скоростью окисления сплавов In-Sn отмечаются те, которые содержат максимальное содержание олова. Можно предположить, что это связано с составом и свойствами образующейся окалины. Проведенный рентгенофазовый анализ этих окалин показал следующее:
Исходный сплав In- 100-0 80-20 70-30 60-40 50-50 40-60 30-70 10-90 0-100
Sn, ат. %
In 2 O 3 +
Окалина In 2 O 3 In 2 O 3 In 2 O 3 In 2 O 3 +SnO 2 In 2 O 3 +SnO 2 In 2 O 3 +SnO 2 не идент. SnO 2 +In 2 O 3 SnO 2
фаза
Из этих данных следует, что в окалине, даже при малом исходном содержании в сплаве индия, содержится In2O3. А олово в окалине появляется при содержании в исходном сплаве ≥ 40 ат. %. Кроме того, в составе ни одной из окалин, образовавшихся на расплавах In-Sn, не обнаружено твердых растворов на основе In2O3, установленных ранее в системе In2O3-SnO2 [13].
Методом электронной оже-спектроскопии авторами работы [14] установлена зависимость состава поверхностного слоя жидких растворов индий – олово при 673 К от объемной концентрации индия. Установлено, что в расплавах индий – олово отклонения состава поверхности – 424 –
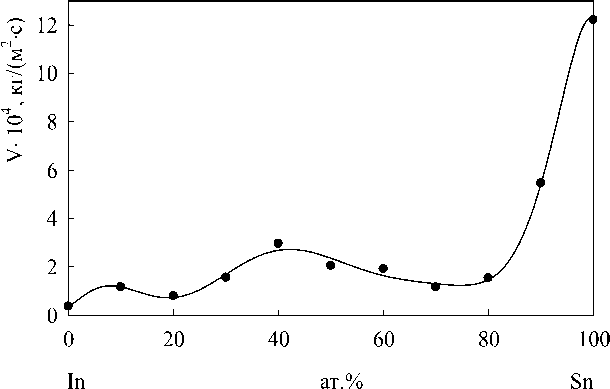
Рис. 3. Влияние состава расплава In - Sn на скорость окисления (т — 250c)
от объемной концентрации носят знакопеременный характер. Отмечено, что на изотерму поверхностной концентрации оказывают существенное влияние адсорбции углерода и его соединений, которые всегда присутствуют на поверхности жидких металлов и сплавов. Показано, что в присутствии этих соединений в разбавленных растворах на основе In и Sn концентрация растворенных атомов на поверхности больше, чем в объеме. Не исключено, что это нужно принимать во внимание при анализе особенностей окисления расплавов In-Sn, тем более что поверхностное натяжение жидких In и Sn мало отличаются между собой [15].
Данные по окислению расплавов In-Ag показаны на рис. 2 и приведены в таблице.
Влияние состава расплавов In-Ag на их окисление показано на рис. 4. Видно, что увеличение содержания в сплаве до 70 ат. % Ag приводит к увеличению скорости их окисления.
Известно [16], что в кислородсодержащей атмосфере менее благородный металл серебряного сплава (в нашем случае индий) окисляется диффундирующим кислородом. Подобное поведение жидких сплавов In-Ag может быть связано со свойствами серебра, в котором наблюдается высокая растворимость кислорода [2, 16]. С ростом концентрации Ag в сплавах In-Ag происходит снижение скорости окисления, одновременно с этим она увеличивается вследствие роста концентрации вносимого с серебром кислорода. Все это приводит к тому, что при высоких содержаниях Ag в расплавах ( > 70 ат. % Ag) первое явление оказывается превалирующим - и, как итог, уменьшение скорости окисления. Можно полагать, что введение в сплав серебра создает условия для внутреннего окисления. Для возникновения внутреннего окисления необходим поток кислорода Jo через матрицу сплава. Он возникает, если кислород в матрице связывается в устойчивые химические соединения (в данном случае возможно образование In2O3 [13]). Этим обусловлен термодинамический критерий внутреннего окисления [16]:
3 A G In 2 О з
>>|A Gog 2 о|,
где AG0 - энергия Гиббса реакций окисления In и Ag.
Таблица. Параметры окисления жидких сплавов In-Ag
|
C Ag , ат. % |
Закон окисления |
Время изменения закона окисления, τ, с |
Коэффициенты корреляции |
|
0 |
Линейный с изломом |
1920 |
0,9964 |
|
20 |
Параболический |
1800 |
0,9861 0,9884 |
|
40 |
Параболический |
2400 |
0,9992 0,9868 |
|
60 |
Линейно-параболический |
240 |
0,9950 0,9945 |
|
70 |
Линейно-параболический |
360 |
0,9981 |
|
80 |
Линейно-параболический |
480 |
0,9999 0,9939 |
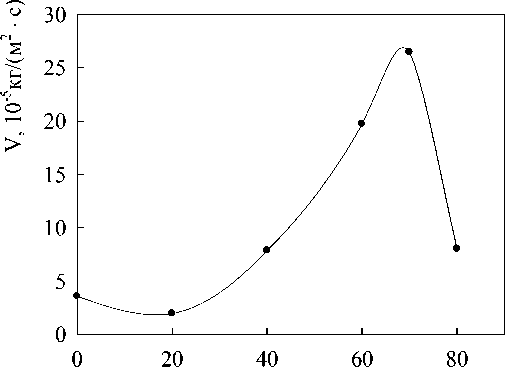
Рис. 4. Влияние состава расплава In-Ag на скорость окисления (τ = 240 c)
СAg, ат.%
Принимают [16], что диффузионный поток Jo должен быть значительно больше потока JAg. Поскольку поток пропорционален коэффициенту диффузии D и градиенту концентрации, то в этом случае получают неравенство вида
C o D . >> C Ag D Ag . (4)
где D o и D Ag – коэффициенты диффузии кислорода и серебра соответственно; CAog – исходная концентрация Ag в сплаве; C E – максимальная растворимость кислорода в серебре при температуре Т. Поскольку D o >> D Ag , неравенство (4) выполнимо практически при всех температурах окисления и при CAog , составляющей не более нескольких атомных процентов [16]. Величина C E определяется парциальным давлением кислорода и достигает максимума при PO → P * ( P * – упругость диссоциации Ag2O). Отметим, что по данным [17] в жидком индии растворимость кислорода составляет 9,2∙10-3 ат. % при 973 К и 37,7∙10-3 ат. % при 1073 К. При более высоких температурах такие сведения приведены в [13]. Давление насыщенного пара чистого индия при температуре эксперимента невелико [9] и может не учитываться.
Известно, что наиболее устойчивым оксидом в системе Ag-O является Ag2O. При записи соотношений (3) и (4) это принималось во внимание. Тем не менее, имеются данные о том, что взаимодействие серебра с кислородом, активированным высокочастотным разрядом (т.е. некоторые особенности взаимодействия в системе Ag-O), на поверхности массивного серебра дает не только окисление с образованием толстой пленки оксида, но и формирование нескольких форм и состояний кислорода, существенно отличающихся по химическим свойствам [18]. Установлено, что происходит образование двух основных типов оксидных структур: в первом случае фиксируется структура купритного типа состава Ag2O; во втором случае кислород, по данным авторов, находится в составе оксидных частиц стехиометрии AgO или в составе окисленных наночастиц с молекулярным характером связи в этих частицах и со стехиометрией AgO „ , где n > 1. Можно полагать, что данные оксиды при температуре нашего эксперимента будут неустойчивы.
Из указанных выше результатов следует, что увеличение содержания Ag в сплавах In-Ag не приводит к монотонному уменьшению скорости их окисления. Эти результаты подтверждают данные авторов [19], которые отметили, что благородные металлы слабо влияют на сопротивление меди окислению. Последнее было установлено для систем Cu-Ag, Cu-Au, Cu-Pt, Cu-Ag-Au и т.д.
Увеличение скорости окисления расплавов In-Ag с ростом в них концентрации серебра может быть, по-видимому, связано со следующим явлением. В работе [5] показано, что катастрофическое окисление расплавов наблюдается у сплавов с наличием электронных соединений. По данным [20] концентрация валентных электронов в таких соединениях равна 3/2, 21/13 и 7/4 электрона на атом. Диаграмма состояния системы In-Ag характеризуется наличием в—фазы (электронное соединение Ag3In , т.е. 3/2) [9]. Если допустить, что поведение электронных соединений подобно описанным в [5], то тогда наличие максимума на кривой v = f (CAg) можно связать с наличием в этой области составов электронного соединения.
Проведенный рентгенофазовый анализ окалин, образующихся на расплавах In-Ag, содержащих 70 и 80 ат. % Ag, показал, что они состоят только из In2O3.
Заключение
Изучена кинетика окисления расплавов In-Sn и In-Ag в зависимости от состава исходных сплавов кислородом воздуха. Установлено, что в окалине на расплавах In-Sn даже при малом содержании в исходном сплаве индия содержится In 2 O 3 , в то время как олово в окалине появляется при содержании в исходном сплаве ≥ 40 ат. %. Увеличение скорости окисления расплавов In-Ag с ростом в них содержания серебра связывается с наличием в этой системе электронного соединения Ag3In.


