Окклюзия ушка левого предсердия при фибрилляции предсердий
Автор: Ганеева Ольга Николаевна
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Нарушения ритма сердца
Статья в выпуске: 4 т.18, 2014 года.
Бесплатный доступ
Представлен обзор нового метода профилактики тромбоэмболических осложнений при фибрилляции предсердий - окклюзии ушка левого предсердия. Сформулированы показания и противопоказания к данной процедуре, описан ход самого вмешательства. Основное внимание уделено рассмотрению современной доказательной базы и обзору клинических исследований.
Фибрилляция предсердий, инсульт, тромбоэмболия, окклюзия ушка
Короткий адрес: https://sciup.org/142140632
IDR: 142140632 | УДК: 616.12-008.313.2-08
Текст научной статьи Окклюзия ушка левого предсердия при фибрилляции предсердий
Фибрилляция предсердий (ФП) – наиболее распространенное нарушение ритма сердца. Известно, что заболеваемость данной аритмией составляет 1–2% [1]. Однако если рассматривать группу пациентов пожилого возраста, то заболеваемость значительно увеличивается и в возрасте старше 80 лет превышает 20% [2].
Проблема лечения ФП далека от решения. Об этом говорит множество подходов к лечению и отсутствие одного, подходящего для большинства пациентов. В целом неблагоприятное влияние аритмии заключается в возможности развития грозных осложнений, среди которых лидируют тромбоэмболические, в частности инсульты. В связи с отсутствием механической систолы предсердий создаются условия для тромбо-образования, особенно в полости ушка левого предсердия (УЛП). По данным ряда работ [1, 3], при ФП на фоне интактного митрального клапана, так называемой неклапанной ФП, до 90% всех тромбов возникает именно у УЛП.
Форма и величина тромбов отличаются полиморфизмом. Однако в целом тромбы значительных размеров и, попадая в системный кровоток, вызывают окклюзию довольно крупных артерий большого круга кровообращения. В связи с этим характерной особенностью инфарктов считаются достаточно большие размеры. Если говорить об инфарктах мозга, то при ФП чаще других поражается средняя мозговая артерия. Инсульты характеризуются выраженным неврологичес- ким дефицитом, значительной смертностью и длительной инвалидизацией.
Важно отметить, что вероятность развития инсульта не зависит от формы аритмии или длительности арит-мологического анамнеза. Для оценки риска используются специальные шкалы, учитывающие наличие или отсутствие специфических факторов риска у пациента. Шкалы носят балльный характер. В настоящее время наиболее широко используется шкала CHA2DS2-VASc, приведенная ниже. Пациенты, набравшие по этой шкале один и более баллов, нуждаются в профилактике инсульта [1].
Фактор риска Баллы
Инсульт, транзиторная ишемическая атака или артериальная тромбоэмболия в анамнезе
Возраст ≥75 лет2
Артериальная гипертензия1
Сахарный диабет1
Застойная сердечная недостаточность/ФВ ≤40%1
Сосудистое заболевание (ИМ в анамнезе, периферический атеросклероз, атеро-1
склеротические бляшки в аорте)
Возраст 65–74 года1
Женский пол1
Предупреждение тромбоэмболических (ТЭ) осложнений у пациентов с ФП является непростой задачей. Глобально все подходы можно разделить на два типа:
влияние на свертывающую систему крови (медикаментозная терапия) и локальные методы (вмешательства на УЛП). Медикаментозная профилактика ТЭ осложнений включает в себя назначение антикоагулянтов.
С тех пор как в клиническую практику вошел вар-фарин, продемонстрировавший невиданную для медикаментозных препаратов эффективность (64% снижение риска инсульта, по данным мета-анализа [4]), казалось, что проблема кардиоэмболических инфарктов будет решена. Однако реальная клиническая практика показывает другое. Трудность подбора дозы, необходимость частого лабораторного контроля, взаимодействие препарата с рядом пищевых продуктов, геморрагические осложнения, необходимость изменения образа жизни и другие ограничения снижают частоту назначения препарата врачами и приверженность пациентов лечению [5].
Появление новых пероральных антикоагулянтов ненамного улучшило ситуацию с медикаментозной профилактикой внутрисердечного тромбоза [6]. Отсутствие лабораторного маркера степени гипокоагуляции, отсутствие антидота, короткий период полувыведения, сложность применения у пациентов с рядом сопутствующих состояний, финансовый аспект не способствуют широкому распространению препаратов данной группы в клинической практике.
Одним из ограничений, связанным с самим принципом системной гипокоагуляции, является определенный процент геморрагических осложнений. Стремясь избежать образования тромбов, мы часто в определенной степени балансируем на грани тромбоз – кровотечение.
Для оценки ежегодного риска кровотечения на фоне приема пероральных антикоагулянтов также разработаны шкалы с балльной системой оценки. Наиболее используемая в настоящее время шкала HAS-BLED представлена ниже.
Фактор риска Баллы
АГ (систолическое АД >160 мм рт. ст.)1
Нарушенная функция печени1
Нарушенная функция почек1
Инсульт1
Кровотечение в анамнезе или предрасположенность к кровотечениям (в т. ч. анемия) Лабильное МНО1
Возраст >65 лет1
Злоупотребление алкоголем1
Прием лекарств, увеличивающих риск кровотечения (антиагреганты, НПВС)
Нетрудно заметить, что некоторые позиции, такие как возраст, артериальная гипертензия (АГ), инсульт в анамнезе, являются как факторами риска тромбоза, так и факторами риска кровотечений. А это значит, что зачастую именно у наиболее угрожаемой в плане развития инсульта категории пациентов медикаментозная профилактика затруднена или противопоказана.
Существуют и альтернативные методики профилактики тромбоэмболии, связанные с воздействием на ушко левого предсердия. Сюда относятся хирургическое удаление, перевязка, клипирование и эндоваскулярная окклюзия УЛП. Первые три подхода рекомендованы и применяются при сопутствующих кардиохирургических вмешательствах и не подходят для широкого круга больных. Наибольший интерес в связи с этим приобретает метод эндоваскулярного вмешательства на УЛП.
Главный принцип данного подхода заключается в механической изоляции ушка левого предсердия, как основной тромбогенной полости, из общего кровотока. Как правило, это достигается при помощи имплантации специальных устройств – окклюдеров, разработанных специально для ушка левого предсердия.
В настоящее время существует несколько окклюде-ров УЛП (рис. 1):
-
• Watchman (Boston Scientific);
-
• Amplatzer Cardiac Plug (St. Jude Medical);
-
• Coherex (Biosense Webster);
-
• Occlutech LAA Occluder (Occlutech International).
В стадии разработки и проведения клинических исследований находятся еще несколько устройств.
Наиболее исследованным устройством является ок-клюдер Watchman (2,7–9).
Окклюдер Watchman (рис. 2) представляет собой саморасширяющуюся нитиноловую структуру, которая обладает памятью формы. Устройство имеет 10 ребер жесткости и покрыто полупроницаемой мембраной с толщиной пор 160 мк. Таким образом, форменные элементы крови проходят через устройство, но любые сгустки крови – нет. Мембрана покрыта полиэтилен-терефталатом, способствующим ускорению процесса эндотелизации и препятствующим тромбообразова-нию на поверхности устройства. Дополнительно по периферии устройства расположены 10 фиксирующих крючков.
Доступно 5 размеров устройства – в диаметре от 21 до 33 мм. Такой размерный ряд необходим в связи с вариабельностью анатомического строения УЛП. Устройство уже помещено в систему доставки.

Рис. 2. Строение окклюдера Watchman.
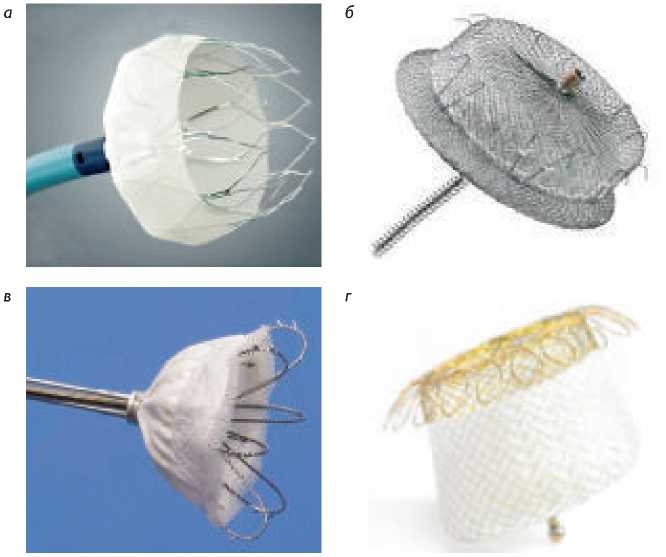
Рис. 1. Окклюдеры ушка левого предсердия: а – Watchman; б – Amplatzer Cardiac Plug; в – Coherex; г – Occlutech.
Противопоказаниями к имплантации окклюдера являются: митральный стеноз; тромбоз ушка левого предсердия; наличие окклюдера межпредсердной перегородки и невозможность транссептального доступа; а также любые другие причины для постоянного приема антикоагулянтов.
Операция выполняется в рентгеноперационной под контролем чреспищеводной эхокардиографии (ЧПЭхоКГ). Перед началом операции при ЧПЭхоКГ исключается тромбоз УЛП, оценивается его морфология, диаметр устья и глубина. В зависимости от полученных данных выбирается размер окклюдера. После пункции бедренной вены система для транссептальной пункции подводится к межпредсердной перегородке (МПП). Наиболее оптимальное место пункции МПП – задненижняя часть овальной ямки. На данном этапе важен контроль положения иглы с помощью ЧПЭхоКГ. После того как инструмент проходит в левое предсердие, обязательно введение гепарина с поддержанием АСТ во время операции на уровне 250–350 с.
Стенка УЛП очень тонкая. Для того чтобы избежать ее повреждения или перфорации, все манипуляции в УЛП осуществляются с использованием катетера с мягким закругленным кончиком типа Pigtail. По специальному интродьюсеру вводится система доставки с устройством соответствующего размера внутри. Рентгеноконтрастные маркеры помогают правильно расположить интродьюсер в УЛП таким образом, чтобы устройство раскрылось на уровне устья ушка.
Контроль положения устройства осуществляется рентгенологически и эхокардиографически. Перед отсоединением устройства от системы доставки проводят тест на стабильность, убеждаются в отсутствии затеков вокруг устройства. Если положение устройства не оптимальное, окклюдер может быть захвачен обратно в систему доставки и переустановлен или при необходимости извлечен.
После имплантации кровоток между полостью левого предсердия и УЛП сохранен. Однако миграция сгустков из ушка в общий кровоток уже не возможна. В течение 4–6 недель происходит полная эндо-телизация устройства и гемодинамическая изоляция ушка. На протяжении этого периода обязателен прием препаратов, препятствующих тромбообразованию на поверхности устройства. В ходе клинических исследований доказана эффективность и безопасность двух схем послеоперационного медикаментозного ведения пациентов. Первая включает в себя 6 недель приема антикоагулянтов и аспирина, в дальнейшем после контрольной ЧПЭхоКГ возможна отмена антикоагулянта, пациент переводится на сочетание плавик-са с аспирином, через 6 мес. после операции плавикс отменяется и пациент остается на пожизненном приеме аспирина. При абсолютных противопоказаниях к антикоагулянтам может быть применена вторая схема: непосредственно после операции назначается комбинация аспирин плюс клопидогрел сроком на 6 мес. В последующем клопидогрел отменяется и пациент продолжает принимать аспирин.
Контрольная ЧПЭхоКГ через 1,5 мес. после операции производится для исключения тромбоза устройства, подтверждения полной гемодинамической изоляции ушка.
Результаты
В эпоху доказательной медицины все утверждения, не подтвержденные результатами клинических исследований, считаются недоказанными. В связи с развитием относительно нового направления в профилактике ТЭ осложнений – окклюзии ушка – проведено и проводится ряд исследований, призванных подтвердить эффективность и безопасность данного метода лечения. Остановимся на наиболее значимых результатах. Все они получены для устройства Watchman. Подчеркнем, что выводы, полученные на одном окклюдере, не могут быть экстраполированы на другой. В настоящее время ни с одним другим девайсом не проведено рандомизированных исследований. Кроме того, единичные работы, в которых проводилось прямое сравнение разных устройств, говорят о том, что процесс эндоте-лизации, воздействие на окружающие ткани и структуры разнятся для разных окклюдеров [10].
Первое крупное рандомизированное проспективное многоцентровое исследование, для которого сейчас уже доступны отдаленные результаты, – PROTECT AF (2,7–8). Включено 707 пациентов с любыми формами неклапанной ФП, которые имели риск инсульта по шкале CHADS2 ≥ 1 и могли принимать варфарин. Рандомизация осуществлялась в соотношении 2 : 1. Группа вмешательства (устройство Watchman) включила 463 пациента, группа контроля (варфарин) – 244 пациента.
Дизайн исследования представлен на рис. 3. После рандомизации пациенты из группы контроля находились на терапии варфарином с достижением целевого уровня МНО 2-3. Пациентам из основной группы через несколько дней после рандомизации выполнялась имплантация окклюдера Watchman, после чего пациенты в течение 45 суток принимали комбинацию варфарина и аспирина. После контрольной ЧПЭхоКГ при отсутствии тромбоза устройства или значимых затеков крови ( ≥ 5 мм) вокруг устройства в полость ушка варфарин отменяли, пациент переводился на комбинацию клопи-догрела и аспирина. Через 6 мес. прием клопидогрела прекращался и пациент оставался на терапии аспирином. Контрольные визиты были запланированы через 45 суток после операции, далее через 6, 9, 12 мес., в последующем дважды в году.
Цель исследования – доказать, что устройство Watchman по основным показателям эффективности и безопасности не уступает варфарину. Суммарная конечная точка эффективности – любой инсульт, смерть от сердечно-сосудистой или неизвестной причины, тромбоэмболия. Суммарная конечная точка безопасности – геморрагические осложнения (в том числе интракраниальные или гастроинтестинальные кровотечения), а также осложнения оперативного вмешательства.
Результаты анализа 4-летнего наблюдения показывают [11], что устройство имеет статистически значимое преимущество перед антикоагулянтной терапией (варфарином) как по суммарной конечной точке, так и по каждому показателю в отдельности, а также общей смертности.
Основная группа продемонстрировала:
снижение суммарной конечной точки на 40% (рs = 0,96) (рис. 4);
снижение сердечно-сосудистой смертности на 60% (p = 0,0045);
снижение общей смертности на 34% (р = 0,0379).
После
Дни 0 операции день 45 день 180
Продолжение исследования
Дни 2–14

Перед имплантацией
Иимплантация устройства Watchman
Прием варфарина
Отмена варфарина/назначение клопидогрела
Отмена клопидогрела
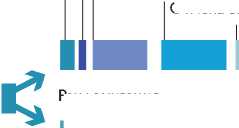
Рандомизация
Прием варфарина
День 0
Продолжение исследования
Рис. 3. Дизайн исследования PROTECT AF.
0,30
0,20
и 0,10
0,00
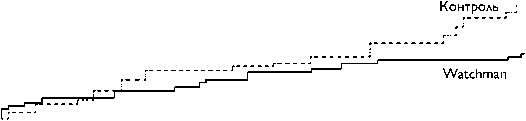
0 6 12 18 24 30 36 42 30 54 60
Время, мес.
Watchman 463 398 382 370 360 345 337 327 317 285 196
Контроль 244 230 218 210 200 188 173 159 147 121 87
Рис. 4. Динамика изменения суммарной конечной точки в исследовании PROTECT AF.
В группе Watchman осложнения наблюдались в 8,7% (рис. 5). Подавляющее количество осложнений в основной группе возникало в день операции, что не удивительно для любой инвазивной процедуры. Самым частым осложнением было развитие гемоперикарда (4,8%). Кроме того, наблюдались следующие события: кровотечения, ишемические инсульты, эмболия устройством, геморрагический инсульт. Следует отметить, что в первой половине исследования осложнения развивались чаще (10%), чем во второй (5,5%). Это связано не только с опытом оперирующего хирурга, но и с изменением рекомендованной техники операции (ис- пользование защитного катетера при манипуляции в УЛП), а также конструктивными изменениями интро-дьюсера (более мягкий кончик, рентгенологические маркеры). Такие изменения потребовали дальнейших исследований безопасности оперативного вмешательства.
Еще одним важным моментом, касающимся динамики осложнений в основной группе, является крайне низкий процент осложнений в отдаленном периоде, в то время как в группе медикаментозной терапии риск осложнений относительно постоянный и с годами носит кумулятивный характер. Все это говорит о том, что
0,30
0,20
Watchman
Контроль
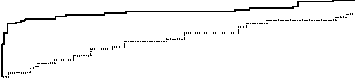
и 0,10
0,00
0 6 12 18 24 30 36 42 30 5460
Время, мес.
Watchman 463 376 364 357 353 341 332 320 310 277190
Контроль 244 228 214 207 195 183 169 153 139 11786
Рис. 5. Осложнения (исследование PROTECT AF).
снижение количества периоперативных осложнений значительно улучшит профиль безопасности окклюде-ра Watchman.
Проведенные в дальнейшем исследования CAP [7] и PREVAIL [9] это доказали. Исследование CAP – регистр, который продолжили клиники, участвовавшие в исследовании PROTECT AF. Критерии включения, исключения, постоперационная медикаментозная схема были идентичными. САР-регистр продемонстрировал улучшение всех показателей безопасности (рис. 6), а также времени и успешности операции (рис. 7), что является следствием изменения техники операции, увеличения опыта хирургов.
Исследование PREVAIL – второе проспективное рандомизированное многоцентровое исследование, проводимое компанией Boston Scientific, целью которого было подтверждение результатов PROTECT AF и улучшение профиля безопасности устройства Watchman. Контингент включенных в исследование пациентов был несколько тяжелее по сопутствующей патологии, имел больший ежегодный риск инсульта (ср. CHADS2 = 2,6 против ср. CHADS2 = 2,2 в исследовании PROTECT AF).
Еще одной особенностью исследования было то, что 25% устройств имплантировались хирургами без предшествовавшего опыта имплантаций окклюдера. 20% центров, участвовавших в PREVAIL, ранее не принимали участия в исследованиях Watchman. Это положение было направлено на минимизацию влияния кривой обучаемости врачей на повышение безопасности процедуры.
В исследование включено 407 пациентов с соотношением Watchman : Контроль = 2 : 1. Анализировали три комбинированные конечные точки. Первая, отражающая общую эффективность метода, представляет собой комбинацию геморрагического, ишемического инсульта, транзиторной ишемической атаки, сердечно-сосудистой смертности и смерти от невыясненной причины. Вторая конечная точка включает ишемические события, возникшие после 7-дневного периода. Эта конечная точка оценивает эффективность метода за исключением острого послеоперационного периода. Третья конечная точка – осложнения в раннем послеоперационном 7-дневном периоде – отражает безопасность вмешательства.
Наибольший интерес в этом исследовании представляет именно безопасность метода. PREVAIL продемонстрировало события третьей конечной точки в 2,2% случаев в группе Watchman. Таким образом, подтвержден низкий процент осложнений, несмотря на участие в исследовании хирургов без опыта подобных операций.
Еще одно исследование, заслуживающее особого внимания, – исследование ASAP. В него включены пациенты с абсолютными противопоказаниями к антикоагулянтной терапии. Целью исследования было подтвердить, что возможно назначение двойной антиагрегантной терапии непосредственно после операции и это не приведет к увеличению числа неблагоприятных событий (тромбоза устройства, инсультов). Пациенты с противопоказаниями к антикоагулянтам ограничены в возможностях профилактики инсуль-
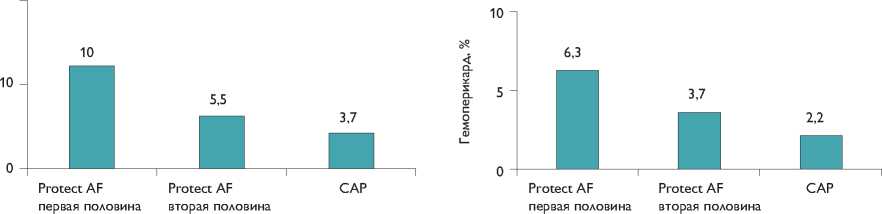
Рис. 6. Динамика количества осложнений при имплантации Watchman.
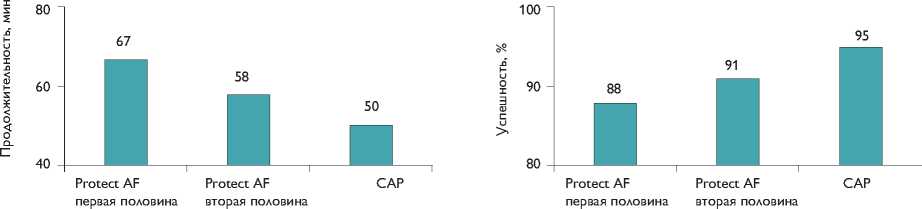
Рис. 7. Сокращение времени операции и повышение ее результативности в разные фазы исследований.
та медикаментозными средствами. Имплантация ок-клюдера – реальный способ профилактики тромбоэмболических осложнений у таких больных, однако до результатов исследования было неясно, насколько правомочно обойтись без антикоагулянтной терапии в послеоперационном периоде.
Исследование ASAP проспективное нерандомизированное многоцентровое, в которое включено 150 пациентов. Сравнение проводилось с расчетной вероятностью инсульта на основании риска по CHADS2 и расчетной вероятностью инсульта у данной группы на фоне приема клопидогрела.
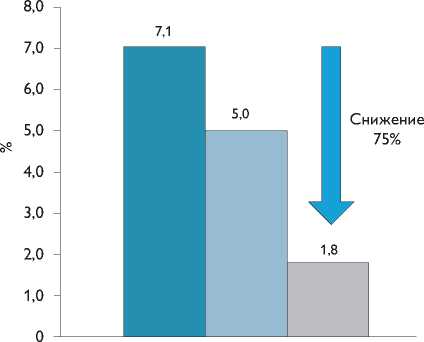
За время наблюдения тромбоз устройства был зафиксирован в 3,5% случаев, что сопоставимо с аналогичными данными на фоне послеоперационного назначения антикоагулянтов. Все тромбы были растворены после назначения низкомолекулярных гепаринов. Частота ишемических инсультов составила 1,8 на 100 па- циент-лет, что достоверно ниже ожидаемого риска, в том числе на фоне приема клопидогрела (рис. 8).
Таким образом, подтверждены возможность, безопасность и эффективность имплантации окклюдера Watchman пациентам с противопоказаниями к антикоагулянтной терапии. Это крайне важно, поскольку сегодня у подавляющего большинства пациентов, которым имплантируется окклюдер, имеются затруднения в назначении антикоагулянтной терапии.
Доказательная база по устройству Watchman постоянно расширяется, проводятся новые исследования. В некоторых из них участвуют ведущие клиники России.
В рекомендациях по ведению пациентов с фибрилляцией предсердий Европейского общества кардиологов (2012) [1] окклюзия ушка предложена пациентам с высоким риском инсульта и противопоказаниями к длительной терапии антикоагулянтами. Класс реко-
Ожидаемая частота инсультов на основе шкалы CHADS2
Ожидаемая частота инсультов на фоне приема клопидогрела
Реальная частота инсультов в исследовании
Рис. 8. Снижение частоты инсультов в исследовании ASAP.
мендаций II B, уровень доказательности В. Отметим, что эти рекомендации формулировались на этапе, когда еще не были получены данные длительного наблюдения и приоритетности устройства Watchman перед терапией антикоагулянтами в исследовании PROTECT AF, данные о безопасности в исследовании PREVAIL. Кроме того, рандомизированные исследования были проведены только с одним окклюдером, что недостаточно для того, чтобы одобрить все известные устройства. Очевидно, что проведение дальнейших исследований, получение доказательной базы для других устройств позволит получить реальные данные о преимуществах и, возможно, недостатках метода. Все это, несомненно, отразится на классе и уровне доказанности в последующих европейских, американских и российских рекомендациях.
Таким образом, окклюзия ушка левого предсердия у пациентов с неклапанной фибрилляцией предсердий – современный, эффективный и безопасный метод профилактики тромбоэмболических осложнений, в частности инсультов, у пациентов высокого риска и с противопоказаниями к антикоагулянтной терапии.
В России данные вмешательства проводятся с конца 2011 г. и хорошо себя зарекомендовали. Практически во всех федеральных округах имеются клиники, обладающие опытом выполнения подобных процедур. В некоторых центрах ведутся научные работы, проводятся сочетанные операции, включающие как аритмо-логические вмешательства (радиочастотная аблация устьев легочных вен), так и окклюзию ушка при соответствующих показаниях.
Однако важно подчеркнуть, что доступной для пациентов помощь будет только тогда, когда врачи общей практики, терапевты, кардиологи, неврологи будут знать о существовании метода и своевременно направлять пациентов в соответствующие стационары. Впрочем, это правомочно в отношении любых вмешательств и способов лечения.


