Окружающая среда, эпидемиология и структура лимфопролиферативных заболеваний в Республике Мордовия
Автор: Зотова Л.В., Плотникова Н.А., Лабзина Л.Я., Коваленко Е.Н.
Журнал: Инженерные технологии и системы @vestnik-mrsu
Рубрика: Проблемы экспериментальной и клинической онкологии
Статья в выпуске: 2, 2006 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/14718734
IDR: 14718734
Текст статьи Окружающая среда, эпидемиология и структура лимфопролиферативных заболеваний в Республике Мордовия
Здоровье населения является основным показателем социального благополучия, нормального экономического функционирования общества и обеспечения экологической безопасности.
По данным ВОЗ, состояние окружающей природной среды вносит в среднем 25 — 30 % вклада в здоровье каждого человека. Основными факторами окружающей природной среды, влияющими на здоровье населения, являются: загрязнение атмосферного воздуха, водных объектов, почв, состояние источников водоснабжения населения, физический фактор (шум) и радиационная обстановка.
В республике на протяжении 10 лет прослеживается тенденция роста злокачественных новообразований, болезней эндокринной системы, крови, кожи, нервной системы, органов чувств, причем такие экологически обусловленные заболевания, как новообразования, составляют 3,5 %, заболевания эндокринной системы — 2 %. Так, в РМ за последние 10 лет показатели первичных случаев злокачественных новообразований имеют четко наблюдаемую тенденцию роста: в 1996 г. этот показатель составил 284 на 100 тыс. населения, а в 2005 г. — 360 (рост составил 21,1 %).
За изученный период (1999 — 2005 гг.) заболеваемость злокачественными опухолями крови выросла в 1,4 раза, а средний темп прироста по лейкозам составил 5,2 %, по неходж-кинским лимфомам (НХЛ) — 7,5 %, по лимфогранулематозу (ЛГМ) — 10,2 %. Кроме того, наблюдается процесс омоложения развития опухолей данной локализации. Доля больных старше 50 лет за последние 20 лет снизилась с 63,2 до 46,5 %. Вместе с тем доля лиц в возрасте 18 — 49 лет возросла с 18 до 46 %, прежде всего за счет возрастной группы 40 — 49 лет (с 3 до 18,6 %) и 20 — 29 лет (с 3 до 14 %). Рост частоты развития лейкозов характерен больше для мужчин, чем для женщин.
Исследование было проведено на базе ГУЗ «Мордовский республиканский онкологический диспансер» (МРОД), ГУЗ «Детская республиканская клиническая больница № 2» (ДРКБ № 2).
Изучение динамики заболеваемости проводилось за период с 1999 по 2005 г. на основе анализа медицинских документов МРОД, ДРКБ № 2, документов Государственного комитета РМ по статистике (расчетная численность постоянного населения), документов Государственного доклада о состоянии окружающей среды РМ. Морфологическая структура изучалась по данным биопсийного и операци-
Проблемы ;
онного материала. За исследуемый период было выявлено 520 больных лейкозами, 229 пациентов с неходжкинс коми лимфомами и 204 случая лимфогранулематоза.
Для дифференциальной диагностики опухолей лимфоидной и кроветворной ткани использовались иммуногистохимические методы исследования с применением моноклональных антител к CD 3, Ki 67, CD 20, CD 30, CD 15, RO 45.
Биохимические результаты получены при исследовании крови больных острыми лейкозами и лимфомами. Определялись следующие показатели: содержание церулоплазмина, каталазы, малонового диальдегида, средних молекул. Контролем служила кровь здоровых людей.
В общей структуре заболеваний крови на данный период лимфомы составили 45,4 % (НХЛ — 24.0 % и ЛГМ — 21,4 %), лейкозы — 54,6 % (рис. 1).
Динамика заболеваемости лейкозами, НХЛ и ЛГМ. за исследуемый период представлена на рис. 2, 3, 4.
За исследуемый период заболеваемость гемобластозами неуклонно возрастала. В целом по РМ заболеваемость лейкозами за период 1999 — 2005 гг. возросла с 5,7 до 7,8 (данные на 100 000 населения). Заболеваемость НХЛ в целом возросла за этот же период с 3,6 до 5,5 на 100 000 населения, а заболеваемость ЛГМ — с
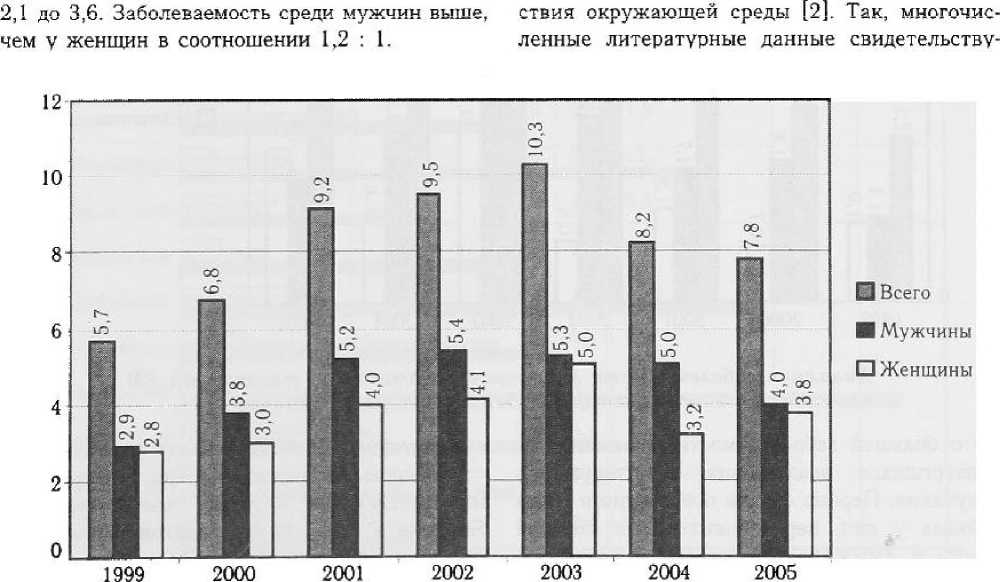
Рисунок 2
Динамика заболеваемости лейкозами на территории РМ за период 1999 — 2005 гг.
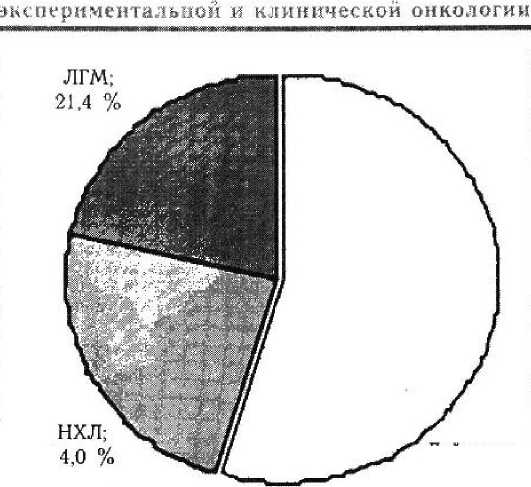
Лейкозы, 54,6 %
Рисунок 1
Структура заболеваемости, гемобластозами в РМ за период 1999 — 2005 гг.
При анализе статистических данных ДРКБ № 2 выявлено, что в общей структуре детской онкопатологии в РМ преобладают острые лейкозы (42,5 %), ЛГМ составляет 12,5 %, НХЛ — 11,7 %.
В настоящее время принято считать, что 80 — 90 % злокачественных опухолей являются результатом неблагоприятного воздей-
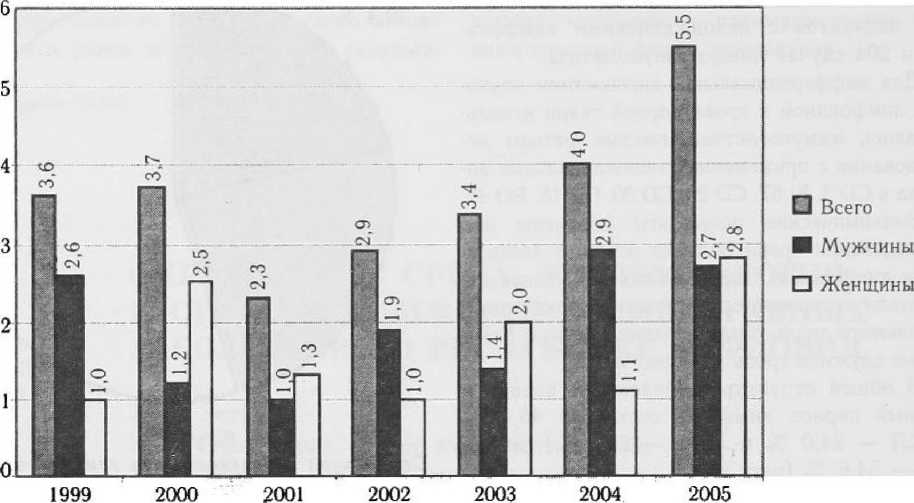
Рисунок 3
Динамика заболеваемости неходжинскими лимфомами на территории РМ за период 1999 — 2005 гг.
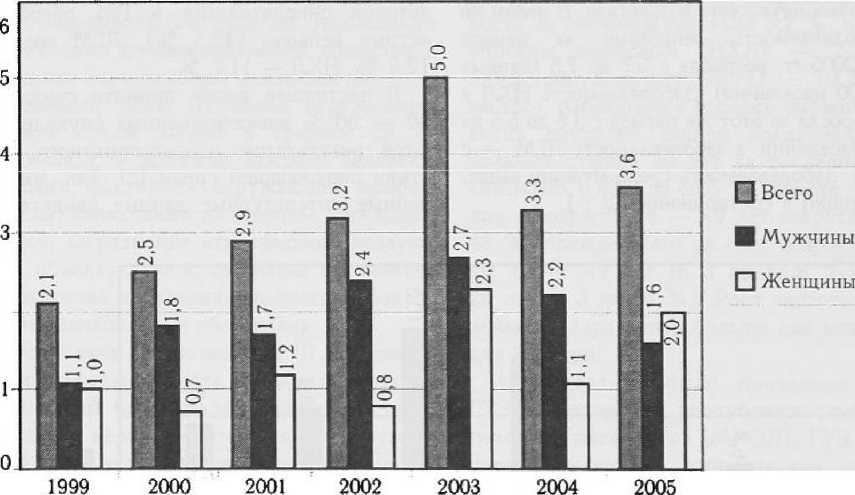
Рисунок 4
Динамика заболеваемости лимфогранулематозом на территории РМ за период 1999 — 2005 гг.
ют о большей заболеваемости лейкозом лиц, подвергшихся воздействию ионизирующего излучения. Первые случаи повышенного риска лейкоза у лиц, переживших взрыв атомной бомбы в Хиросиме и Нагасаки и подвергавшихся лучевой терапии по поводу спондилита, выявлялись через 5 лет после облучения.
Повышенная заболеваемость опухолями системы крови наблюдается среди лиц, переживших аварии на атомных электростанциях. Ядерные испытания на полигонах в области Семипалатинска и Маршалловых островах, а также авария на Чернобыльской АЭС 1986 г. в несколько раз увеличили заболеваемость лейкозами. Развитие лимфом может быть спровоцировано химио- и лучевой терапией. В частности, у лиц, излеченных от ЛГМ, повышен риск развития вторичных крупноклеточных лимфом [3]. Литературные данные о роли экологических факторов в развитии злокачественных опухолей различной локализации подтверждаются многочисленными эпидемиологическими исследованиями [1]. Изучение влияния неблагоприятных факторов окружающей среды на заболеваемость гемобластозами было проведено нами за период с 1999 по 2005 г. '
Данные показатели определяются в немалой степени действием неблагоприятных экологических факторов. Серьезную опасность для.здоровья населения представляют источники электромагнитных полей, в том числе
Средняя заболеваемость гемобластозами, на территории РМ за период 1999 — 2005 гг, («грубый» показатель на 100 000 населения)
республиканский радиоретранслятор РВ-65, который вносит заметный вклад в ухудшение экологической обстановки г. Саранска за счет физических факторов неионизирующей природы.
В частности, заболеваемость органов сердечно-сосудистой системы превышает показатели по республике в 1,8 раза, число отмеченных патологий органов пищеварения в 5,3 раза выше среднестатистических, болезни эндокринной системы — в 1,7 раза, пораженность злокачественными новообразованиями — в 2,2 раза.
При анализе экологической характеристики почв на территории РМ отмечено, что в верхнем слое почв на 6 % площади отмечается превышение средних концентраций тяжелых металлов. Зоны высокого и среднего уровня загрязнения почвенного покрова локализуются в Рузаевке, Ковылкине, Ин cape, Чам-зинке и вблизи них. В южной части территории республики отмечаются участки со средней и умеренной степенью загрязнения. В сельской местности преобладают почвы с умеренным и слабым уровнями загрязнения, В составе загрязнителей почвогрунтов преобладают свинец, цинк, кобальт, никель, медь. Плотность загрязнения почв цезием-137 на 8 % территории превышает 1 Ки/км2
-
Т-4 О Cid Tirxn гз 1 титл г-<5 > л » л п _ п ■эппла еамятлТЛ гплпдп.пи
-
*1U WJ 1 V^fUlir 1Г 1 I И ЛЛГ11, Ц._'у W UVUllirj , 11 ж
ной Госкомгидрометом России, было выявлено, что 6,3 % площади РМ (что соответствует 163 тыс. га, в том числе 150 тыс. га сельхозугодий) подвержены радиоактивному загрязнению цезием-137, с плотностью до 5 Ки/км2
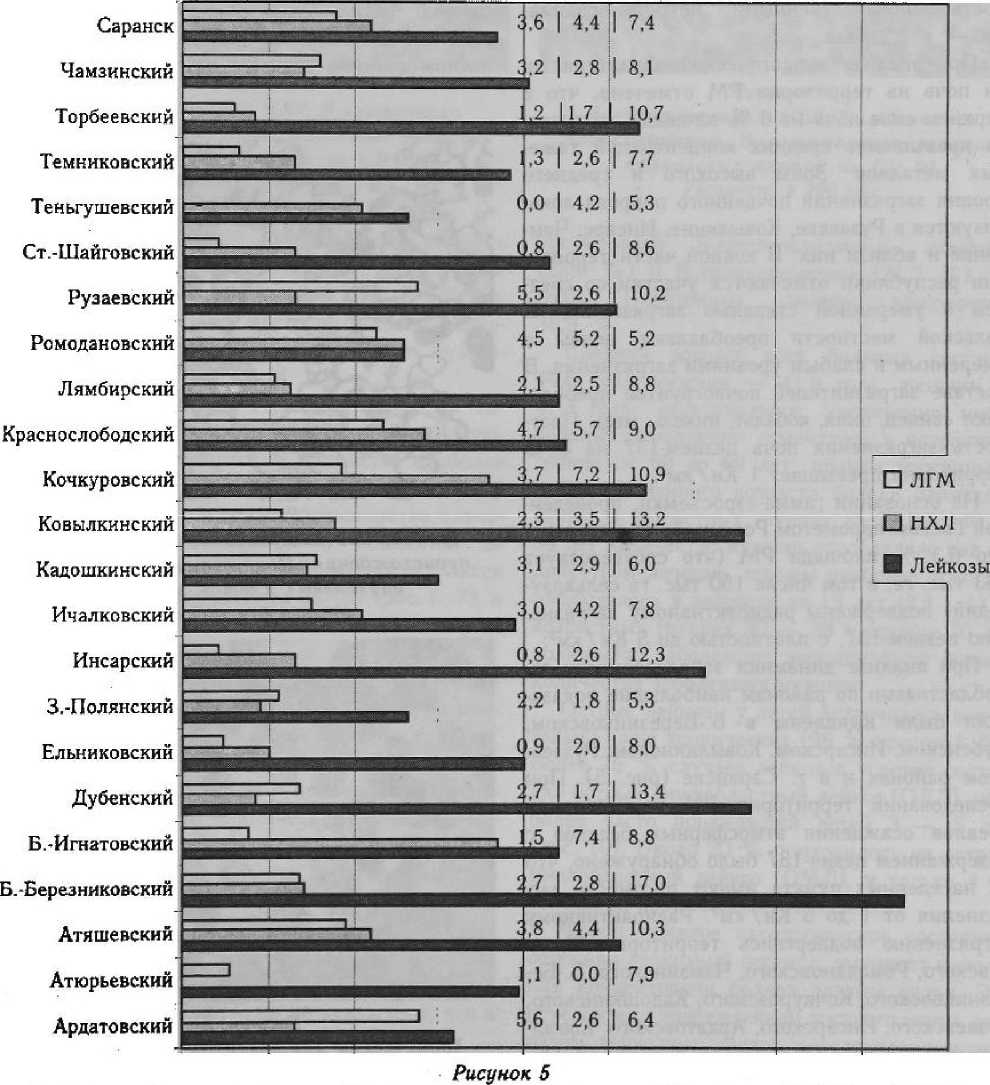
При анализе динамики заболеваемости гемобластозами по районам наибольшие показатели были выявлены в Б.-Березниковском, Дубенском, Инсарском, Ковылкинском, Рузаевском районах и в г. Саранске (рис. 5). При обследовании территории РМ и выявлении ареалов осаждения атмосферных осадков с содержанием цезия-137 было обнаружено, что 42 населенных пункта имеют плотность загрязнения от 1 до 5 Ки/км2. Радиоактивному загрязнению подверглись территории Ичал-ковс кого, Ромодановского, Чамзинского, Б.-Березниковского, Кочкуровского, Кадошкинского, Рузаевского, Писарского, Ардатовского, Ковыл-кинского, Зубово-Полянского районов и Октябрьского района г. Саранска. Наиболее сильно пострадали Ичалковский, Чамзинский,
Б.-Березниковский районы РМ и Октябрьский район г. Саранска. В связи с переменой атмосферных условий и с тем, что выбросы из реактора шли достаточно длительное время, произошло неравномерное, локальное загрязнение отдельных районов.
Наибольшая плотность радионуклидного загрязнения зарегистрирована на территории населенных пунктов Ичалковского района, где имеется обширное пятно, которое захватывает центральную, северо-западную, западную части района. Также здесь обнаружено пятно локального загрязнения цезием-137 мощностью экспозиционной дозы (МЭД) 16 — 24 мкр/ч.
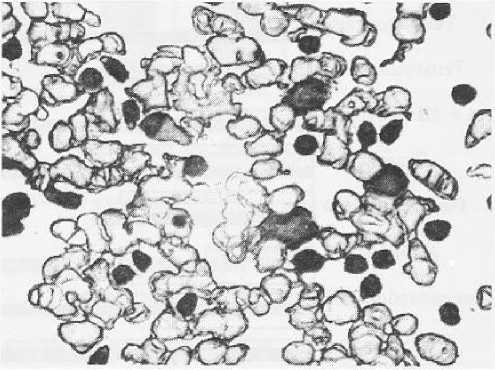
Рисунок 6
Хронический лимфолейкоз В-клеточного происхождения. Положительная реакция опухолевых клеток на Ki 67 Увеличено в 400 раз
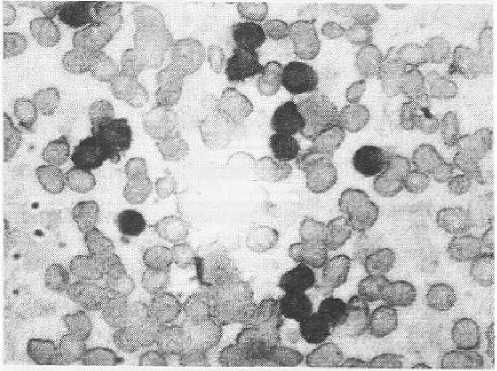
Рисунок. 7
Хронический лимфолейкоз В-клеточного происхождения. Положительная реакция опухолевых клеток на CD-20 Увеличено в 400 раз
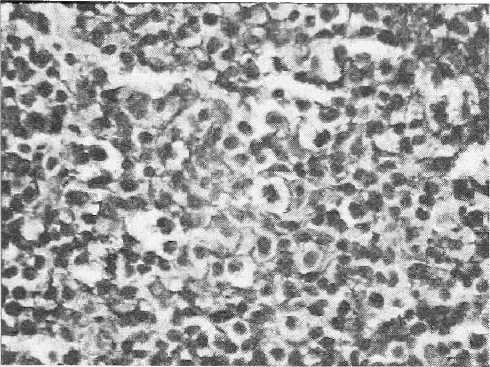
Рисунок 8 Злокачественная НХА В-клеточного происхождения. Положительная реакция опухолевых клеток на CD 30 Увеличено в 200 раз
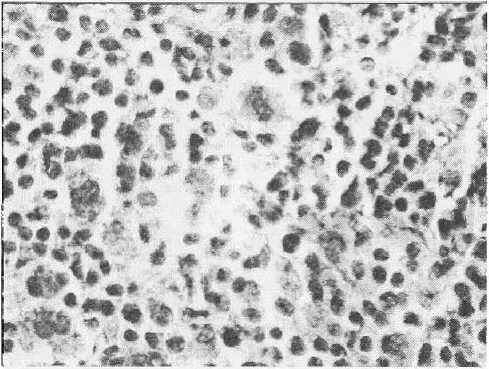
Рисунок 9
Злокачественная НХЛ Т-клеточного происхождения. Положительная реакция опухолевых клеток на CD 30 Увеличено в 200 раз
В отдельных точках этого пятна плотность загрязнения радиоактивными выпадениями колебалась от 1,0 — 3,0 до 2,5 — 5,0 кюри/ км2. На третьем месте по степени радионуклидной загрязненности находится Рузаевский район.
Морфологическая структура опухолей системы крови по РМ распределилась следующим образом. У взрослых пациентов наиболее часто встречался острый миелобластный лейкоз (ОМЛ), подавляющее большинство случаев которого наблюдалось у пациентов до 40 лет. Несколько реже диагностировался хронический лимфолейкоз (ХЛЛ) (рис. 6, 7), в основном встречавшийся у людей старше 60 лет.
Неходжкииские лимфомы — целая группа из более 30 родственных заболеваний, не имеющих характеристик ходжкинской болезни. Неходжкииские лимфомы отличаются значительным разнообразием и по морфологическому строению, и по клиническому течению. Известно, что патоморфологическое разнообразие связано с НХЛ тем, что, хотя большинство из них имеет лимфоидное происхождение, они могут развиваться как из В-, так и Т-клеточ-ных субпопуляций (рис. 8, 9). Лишь немногие НХЛ развиваются из клеток системы моно-нуклеарных фагоцитов, но не исключено, что и они имеют лимфоидное происхождение.
По результатам наших исследований, среди НХЛ преобладали В-клеточные опухоли, которые составили 58,7 %. Наиболее часто диаг- ностировали В-крупноклеточные лимфомы (23,9 %) и В-лимфоцитарные (21,7 %). На долю Т-клеточных лимфом приходилось 36,9 %.
Средний возраст всех больных составил 44,6 года, мужчин — 41,9 года, женщин — 47,3 года. Максимальное увеличение числа больных лимфомами отмечалось в возрастной группе от 60 до 69 лет, причем мужчины и женщины данного возраста болели одинаково часто. В возрастных группах до 29 лет, 40 — 59 лет количество мужчин преобладало над количеством женщин, причем наиболее ярко это наблюдалось в возрасте до 19 лет (2,1 ; 1). В возрастных группах 30 — 39 и старше 70 лет количество заболевших женщин было больше количества заболевших мужчин.
Острые лейкозы у детей встречались значительно чаще хронических (96 % против 4 %). Более 75 % случаев лейкозов у детей составлял острый лимфобластный лейкоз (ОЛЛ), наиболее часто поражавший детей 3 — 5 лет (рис. 10). Около 20 % приходилось на острый миелобластный лейкоз (ОМЛ), и только 4 % составлял хронический миелолейкоз.
Любое тяжелое патологическое состояние, особенно лейкозный процесс, вызывает изменения концентрации белков плазмы крови. Это обусловлено повреждением костного мозга, распадом лейкозных клеток и поступлением продуктов распада в кровь, что приводит к возникновению интоксикационного синдрома. Универсальным субстратом эндогенной инток-
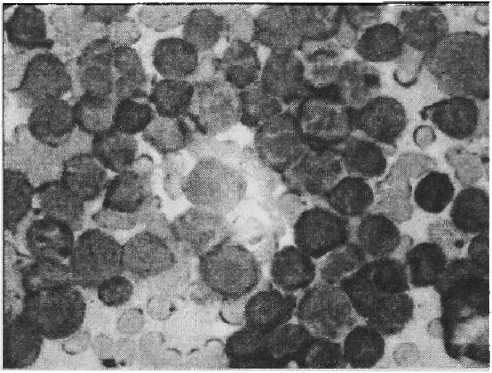
Рисунок 10
Острый лимфобластный лейкоз. Положительная реакция опухолевых клеток на CD 3
Увеличено в 400 раз сикации являются так называемые молекулы средней массы (МСМ), или средние молекулы (СМ). Основная часть СМ представлена олигопептидами с молекулярной массой 300 — 5 000 Д. Основную часть молекул средней молекулярной массы составляют пептиды, гликопептиды, продукты деградации фибриногена, альбумина, тромбина, фрагменты коллагена, а также производные липидов и фосфолипидов.
В ходе исследования нами было определено достоверное увеличение концентрации средне молекулярных пептидов у больных с острыми лейкозами и лимфомами до начала программного лечения: 0,45 ± 0,03 у. е. и 0,41 ± ± 0,06 у. е. соответственно. Содержание средних молекул у здоровых составило 0,24 ± ± 0,05 у. е. при X = 254 нм. В ходе проводимой терапии содержание средних молекул уменьшилось практически в 2 раза: 0,26 ± ± 0,01 у. е. и 0,25 ± 0,04 у. е. соответственно (табл. 1), что свидетельствовало не только о снижении процессов эндогенной интоксикации, но также о нормализации обменных процессов в клетках за счет активации регуляторных механизмов.
К числу белков, участвующих в ответных реакциях острой фазы, относятся С-реактив-ный белок, альфа-1-антитрилсин, гаптоглобин и церулоплазмин. Церулоплазмин представляет собой металлогликопротеин, обладающий антиоксидантным действием и оксидазной активностью. Церулоплазмин является специфическим переносчиком ионов меди и рассматривается исследователями как белок острой фазы, характеризующей напряженность компенсаторной реакции.
Исследование показало, что у больных ОЛ и лимфомами в дебюте заболевания происходило достоверное увеличение церулоплазмина до 167,55 ± 7,87 мг% и 159,33 ± ±4,00 мг%; концентрация на фоне проводи-
Таблица I
Содержание средних молекул в сыворотке крови больных гемобластозами
|
Нозологическая форма |
Средние молекулы, у. е. (здоровые) |
Период |
Средние молекулы, у. е. М ± т |
|
Острый лейкоз |
0,24 ± 0,05 |
До лечения |
0,45 ± 0,03* (л = 13) |
|
В ходе лечения |
0,26 ± 0,01 (л = 13) |
||
|
Лимфомы |
До лечения |
0,41 ± 0,06* (л = 5) |
|
|
В ходе лечения |
0,25 ± 0,04 (л = 5) |
* р < 0,05.
Таблица 2
Содержание церулоплазмина в сыворотке крови больных гемобластозами
|
Нозологическая форма |
Здоровые, мг/% |
Период |
Церулоплазмин, мг% М ± т |
|
Острый лейкоз |
27,0 ± 1,44 у. е. |
До лечения |
167,55 ± 7,87* |
|
В ходе лечения |
84,42 ± 5,01 |
||
|
Лимфомы |
До лечения |
159,33 ± 4,00* |
|
|
В ходе лечения |
95,06 ± 1,79 |
* р < 0,05.
Таблица 3
Содержание МДА в сыворотке крови больных гемобластозами
Полученные результаты не позволяют достоверно судить о балансе антиоксидантно-про-оксидантных систем организма. В связи с этим на следующем этапе нашей работы представлялось актуальным изучение некоторых аспектов окислительно-антиокислительного статуса больных гемобластозами. В настоящее время установлена ведущая роль свободнорадикального механизма повреждения клеточных структур при ряде патологических процессов, в том числе и неопластических. Наиболее информативным является одновременное определение малонового альдегида (МДА) и показателей антиоксидантной ферментативной защиты. По концентрации в крови МДА можно судить об интенсивности перекисных процессов. Повышение МДА в сыворотке крови и тканях происходит при различных патологических состояниях, сопровождающихся усилением перекисного окисления липидов.
Нами было проведено определение концентрации МДА и активности каталазы в сыворотке крови у больных ОЛ и лимфомами. Из табл. 3 и 4 видно, что концентрация МДА, образующегося при кислородной деградации перекисей, до начала химиотерапии повышалась как показатель усиленного перекисного окисления (5,55 ± 0,93 и 8,05 ± 0,35) с одновре менным снижением активности каталазы как основного компонента защитных (антиоксидантных) систем организма (0,45 ± 0,13 и 0,52 ± 0,24).
В ходе проводимой терапии степень интенсивности перекисного окисления липидов немного снижалась (4,23 ± 0,56 и 4,39 ± 0,9), вероятно, не столько за счет активации каталазы, концентрация которой сохранялась на прежнем уровне (0,48 ± 0,13 и 0,58 ± 0,13), а под действием других механизмов антиоксидантной защиты. По динамике изменения этих биохимических показателей можно судить об интенсивности перекисных процессов при ОЛ и лимфомах до лечения и после.
Таким образом, в условиях неоплазии органов гемопоэза происходит активация, главным образом, прооксидантных систем организма на фоне угнетения на первом этапе антиоксидантной защиты, баланс которых в ходе проводимой терапии и воздействия компенсаторных механизмов постепенно начинает восстанавливаться.
Опухоли системы крови представляют серьезную проблему здравоохранения, оказывая существенное влияние на здоровье людей и экономику многих стран мира, увеличивая онкологическую заболеваемость, потерю трудоспособности и смертность населения. В последние годы отмечается повышение частоты данных заболеваний.
Таблица 4
Активность каталазы в сыворотке крови больных гемобластозами
|
Нозологическая форма |
Здоровые |
Период |
Каталаза Af ± m |
|
Острый лейкоз |
1,05 ± 0,5 |
До лечения |
0,45 ± 0,13 |
|
В ходе лечения |
0,48 ± 0,13 |
||
|
Лимфомы |
До лечения |
0,52 ± 0,24 |
|
|
В ходе лечения |
0,58 ± 0,13 |
Установлено, что на территории РМ отмечается рост заболеваемости гемобластозами, обусловленный рядом факторов. Средний возраст всех больных составил 44,6 года, мужчин — 41,9 года, женщин — 47,3 года. В Ичалковском, Рузаевском, Чамзинском районах и Октябрьском районе г. Саранска высокий показатель заболеваемости коррелирует с наибольшей плотностью радиоактивного загрязнения почвы цезием-137.
Анализ существующей ситуации показывает, что нерешенные проблемы с охраной почвы от загрязнения способствуют формированию высокой заболеваемости населения, особенно по следующим классам: новообразования, болезни кро ви и кроветворных органов, органов дыхания, мочеполовой системы, врожденные аномалии.
В результате поступления в организм свинца из почвы в РМ наблюдается постоянный рост заболеваемости органов кроветворной и репродуктивной систем, желез внутренней секреции, а также увеличение доли злокачественных новообразований в общей структуре онкопатологии.
В целях улучшения экологической обстановки в регионе необходима реализация первоочередных мероприятий, принятых республиканской целевой программой «Оздоровление экологической обстановки в Республике Мордовия на период до 2010 года».
Список литературы Окружающая среда, эпидемиология и структура лимфопролиферативных заболеваний в Республике Мордовия
- Григорьев Ю. И. Влияние радиационного и других техногенных факторов на заболеваемость населения/Ю. И. Григорьев, В. Л. Малыгин, С. Н. Сафронов//Гигиена и санитария. 1999. № 6. С. 17 -19.
- Пальцев М. А. Межклеточные взаимодействия/М. А. Пальцев, А. А. Иванов, С. Е. Северин. М.: Медицина, 2003. 287 с.
- Харченко В. П. Современная лучевая терапия/В. П. Харченко, Г. А. Паныпин//Материалы VI ежегодной Российской онкологической конференции 26 -28 ноября 2002 г. М., 2002. С. 43 -51.


