Онкомаркеры СА 125, НЕ 4 как предикторные факторы прогноза у больных с пограничными опухолями яичников
Автор: Васильев А.Н., Красильников С.Э., Войцицкий В.Е., Герасимов А.В., Кулиджанян А.П., Бабаянц Е.В., Сисакян В.Г., Крылышкин М.И., Афанасьева Н.А., Мансурова А.С.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 4 (70), 2015 года.
Бесплатный доступ
Целью исследования являлось выявление уровня онкомаркеров СА 125 и НЕ 4 в сыворотке крови у больных пограничными опухолями яичников в зависимости от стадии заболевания, гистологического типа пограничной опухоли, а также проводимого лечения. Материал и методы. Исследование основано на ретроспективном анализе историй болезни 30 больных пограничными опухолями яичников. Группой контроля являлись 70 пациенток с диагнозом рак яичников и 30 клинически здоровых женщин. Результаты исследования. Показатели экспрессии онкомаркеров СА 125 и НЕ 4 при пограничных опухолях превышают показатели у здоровых женщин. При пограничных опухолях яичников I-II стадий значения онкомаркеров СА 125 и НЕ 4 сопоставимы с аналогичными показателями при раке яичников. Однако при III стадии заболевания наблюдаются рост значений уровня онкомаркеров СА 125 и НЕ 4, которые при раке яичников в несколько раз превышает значения у пациенток с пограничными опухолями яичников. После окончания лечения происходит значимое снижение экспрессии онкомаркеров СА 125 и НЕ 4. Заключение. Онкомаркеры HE 4 в комбинации с CA 125 могут являться предикторными факторами оценки эффективности лечения, инструментом для выявления пациенток, относящихся к группе онкологического риска.
Онкомаркеры са 124, не 4, пограничные опухоли яичников, эффективность лечения
Короткий адрес: https://sciup.org/14056558
IDR: 14056558 | УДК: 618.11-006-036-076
Текст научной статьи Онкомаркеры СА 125, НЕ 4 как предикторные факторы прогноза у больных с пограничными опухолями яичников
Диагностика пограничных опухолей яичников, называемых еще карциномами с низкой степенью злокачественности, является одной из актуальных проблем современной онкогинекологии. Среди злокачественных опухолей яичников их доля составляет 15–23 % [2, 7]. Несмотря на тот факт, что данные новообразования, в отличие от рака яичников (РЯ), отличаются менее агрессивным течением, их своевременное выявление определяет более благоприятный прогноз. Обычно эти новообразования выявляются на ранней стадии у женщин репродуктивного возраста, что позволяет провести органосохраняющее лечение и сохранить репродуктивную функцию пациенток.
На дооперационном этапе клиническая и инструментальная (УЗИ, МРТ, КТ) диагностика пограничных опухолей, как и рака яичников, затруднена из-за отсутствия патогномоничных симптомов. По этой причине диагноз пограничной опухоли может быть достоверно установлен только по итогам послеоперационного морфологического исследования. В связи с этим большинство операций по поводу новообразований с низким потенциалом злокачественности выполняется в неспециализированных учреждениях, где нет возможности для экспресс-диагностики, от результата которой зависит адекватный объем оперативного вмешательства [1, 2].
С начала 2000-х годов отечественными и зарубежными исследователями для мониторинга эффективности лечения, выявления ранних рецидивов опухолей и выделения пациенток группы повышенного онкологического риска стали применяться методы молекулярно-биологической диагностики с использованием онкомаркеров [3, 4]. Одним из них является опухольассоциированный антиген СА 125, представляющий собой высокомолекулярный гликопротеин, активно секретируемый железистыми клетками эпителия яичников, кишечника и некоторых других клеток. Высокая концентрация данного гликопротеина в крови чаще всего свидетельствует об онкологической патологии яичников. Выявлена прямая корреляция уровня СА 125 в зависимости от возраста пациенток, стадии и гистологического строения опухоли. Так, у здоровых женщин этот показатель составляет 8,9 ± 2,2 Ед/ мл, у больных РЯ I–II стадий – 88 ± 22,1 Ед/мл, при РЯ III–IV стадий уровень СА 125 возрастает до 409 ± 30,1 Ед/мл, при пограничных опухолях – до 68,7 ± 19,7 ед/мл.
При этом содержание онкомаркера было повышено в 90,9 % случаях при серозных пограничных опухолях и в 61,0 % при муцинозных пограничных опухолях [2, 8, 9]. У больных, радикально оперированных по поводу РЯ, уровень СА 125 снижается до 5–15 Ед/мл (эффект удаления опухоли) [3, 4].
Перспективным является также применение нового онкомаркера – эпидидимального белка НЕ 4, принадлежащего к семейству ингибиторов протеиназ [8, 9]. По данным рандомизированных исследований, определение СА 125 в качестве единственного маркера рака яичников обеспечивает чувствительность диагностики, равную 78,3 %, специфичность – 59,4 %, тогда как дополнительное тестирование HE 4 позволяет значительно повысить диагностическую значимость исследования: чувствительность возрастает до 95,1 %, специфичность – до 86,5 % [6, 8, 9]. Применение такого комплексного подхода было осуществлено и для диагностики пограничных опухолей яичников. При этом средние показатели уровня онкомаркера НЕ 4 составили 69 пкмоль/л при колебаниях от 35–202 пмоль/л в зависимости от стадии и гистологического типа опухоли, медиана СА 125 – 53 Ед/мл при колебаниях от 8 до 1225 Ед/мл [8]. Однако данных, позволяющих оценить прогностическое значение комплекса тестов HE 4 и CA 125 для выявления пограничных опухолей, пока недостаточно.
Целью исследования являлось выявление зависимости уровня онкомаркеров СА 125 и НЕ 4 в сыворотке крови у больных пограничными опухолями яичников от стадии заболевания, гистологического типа пограничной опухоли, а также проводимого лечения.
Материал и методы
Исследование основано на ретроспективном анализе историй болезни 30 женщин, больных пограничными опухолями яичников, получавших лечение с января 2012 г. по сентябрь 2013 г. в он-когинекологическом отделении Новосибирского областного онкологического диспансера. Возраст больных колебался от 23 до 62 лет. Из них 50 % составили женщины фертильного возраста – от 23 до 36 лет (n=15). Группой контроля являлись 70 пациенток с диагнозом рак яичника, в возрасте от 35 до 78 лет. Среди них возрастная группа от 30 до 40 лет составила 14 % (n=10). Большая часть наблюдений – 56 % (n=39) – пришлась на пациенток в возрасте 40–60 лет. Женщины старше 60 лет составляли 30 % (n=21). Кроме того, уровень СА 125 и НЕ 4 оценивался у 30 здоровых женщин, проходивших профилактические осмотры.
Из 30 пациенток с пограничными опухолями яичников 9 (30 %) женщин первоначально получили хирургическое лечение в учреждениях гинекологического профиля в нерадикальном объеме, что было обусловлено стертой клинической картиной заболевания и недооценкой факторов онкологи- ческого риска. Двум пациенткам оперативное лечение выполнено по экстренным показаниям, что в последующем потребовало релапаротомии с проведением радикального объема операции.
Стадирование проводилось согласно классификации FIGO 2009 г., в большинстве случаев выявлены Iа и Ib стадии заболевания – 19 (63,3 %) пациенток; IIа, IIб, IIс стадии диагностированы в 8 (26,6 %), III и IIIа стадии – в 3 (10,1 %) случаях. Для морфологической характеристики пограничных опухолей использовалась «Международная гистологическая классификация опухолей женской половой сферы ВОЗ (1996)». Серозные пограничные опухоли (ПОЯ) выявлены в 27 (89,3 %), муцинозные – в 3 (11 %) случаях, что несколько меньше данных зарубежных авторов [6, 8].
Первая стадия рака яичников была выявлена у 10 (14 %), II стадия – у 4 (6 %), III стадия – у 40 (58 %), IV стадия – у 15 (22 %) женщин. Серозный РЯ наблюдался у 65 (93 %), муцинозный РЯ – у 5 (7 %) пациенток. При этом высокодифференцированная аденокарцинома диагностирована в 21 (32 %), умереннодифференцированная – в 28 (44 %), низкодифференцированная – в 7 (10 %), папиллярный рак – в 9 (14 %) случаях. Морфологическая верификация получена по данным гистологического исследования операционных препаратов.
Всем пациенткам проводилось общеклиническое обследование, УЗИ органов малого таза c вагинальным датчиком, УЗИ брюшной полости, обследование ЖКТ. Сравнивались показатели концентрации онкомаркеров СА 125 и НЕ 4 в сыворотке крови до начала и в процессе лечения, а также после его окончания. Определение онкомаркеров проводилось иммунологическими методами в лаборатории «ИНВИТРО».
Пациенткам с Ia стадией пограничных опухолей яичников с благоприятными факторами прогноза (отсутствие нарушения целостности капсулы опухоли до операции, размеры опухоли менее 10 см, высокая дифференцировка опухоли G1, возраст больных моложе 40 лет) проводилась только органосохраняющая операция, в объеме односторонней аднексэктомии, с биопсией контралатерального яичника и мультифокальной биопсией брюшины, резекцией большого сальника. При ПОЯ Ia стадии с неблагоприятными факторами прогноза (нарушение целостности капсулы опухоли до операции, размеры опухоли более 10 см, массивные сращения и спайки опухоли с окружающими тканями, низкая дифференцировка опухоли G3, возраст больных старше 40 лет) в послеоперационном периоде проводилось 3 курса химиотерапии карбоплатином в монорежиме. При ПОЯ Ib стадии выполнялось комбинированное лечение: операция в объеме гистерэктомии с придатками с резекцией большого сальника дополнялась курсами химиотерапии, количество которых варьировало в зависимости от стадии заболевания согласно «Стандартам по оказанию медицинской помощи онкологическим больным».
Эффективность проводимого лечения оценивалась по данным УЗИ, МРТ и гинекологического осмотра. За время наблюдения данных за рецидив заболевания не выявлено.
Статистическая обработка полученных данных проводилась с использованием программы «Sta-tistica 6.0» с использованием общепринятых параметрических и непараметрических статистических методов. Вычислялась средняя величина (M), среднеквадратичное отклонение (δ), стандартная ошибка средней. При сравнении двух независимых групп по количественному признаку использовался t-критерий Стьюдента для независимых ошибок. Критический уровень достоверности принимали равным 0,05(p≤0,05).
Результаты исследования
В среднем уровень онкомаркера СА 125 в сыворотке здоровых женщин составил 8 Ед/мл (6–29 Ед/мл), НЕ 4 – 49 пмоль/л (36–98 пмоль/л), что соответствует данным других авторов [2, 5, 6, 8, 9]. Значения уровня онкомаркера СА 125 в сыворотке крови у пациенток с пограничными опухолями яичников I стадии составили 10,3 ± ± 1,9 ЕД/мл (n=19), II стадии –15,2 ± 3,2 Ед/мл (n=8), что сопоставимо с показателями уровня онкомаркера у больных РЯ I стадии – 12,5 ± 2,5 Ед/ мл (n=10) и II стадии –18 ± 2,4 Ед/мл (n=4). Тогда как у больных РЯ III стадии отмечается значительный рост показателей СА 125 – 564 ± 78 Ед/мл (n=40), что практически в 2 раза превышает аналогичные значения у пациенток с пограничными опухолями яичников III стадии – 275 ± 95 ЕД/мл (n=3) (рис. 1, 2).
Аналогичные изменения выявлены при анализе уровня онкомаркера НЕ 4 (рис. 3). У пациенток с пограничными опухолями и раком яичников I–II стадий его значения до лечения не различаются: ПОЯ I стадии – 38 ± 2,3 пмоль/л, РЯ I стадии – 41 ± ± 4,1 пмоль/л, ПОЯ II стадии – 42 ± 4,4 пмоль/л, РЯ II стадии – 43 ± 4,9 пмоль/л. Начиная с III стадии заболевания, наблюдается превышение значений уровня онкомаркера НЕ 4 у больных раком яичников, по сравнению с группой пациенток с пограничными опухолями – 310 ± 31,4 пмоль/л и 228 ± ± 54 пмоль/л соответственно (p<0,05).
После лечения при РЯ I–II стадий не отмечено статистически значимого уменьшения значений НЕ 4, что, вероятно, связано с гетерогенностью опухолей, хотя прослеживается тенденция к их снижению. Однако при ПОЯ и РЯ III–IV стадий наблюдалось значимое снижение концентрации онкомаркера НЕ 4 (p<0,05). При этом уровень опухолевых маркеров при раке яичников в 1,5–2 раза (p<0,05) превышает аналогичные показатели у больных с пограничными опухолями яичника. Вероятнее всего, это обусловлено изначально более высокими значениями уровня онкомаркеров у больных раком яичников (рис. 1, 2).
Следует отметить, что уровень онкомаркеров зависит не только от стадии, но и от гистотипа опухоли. В нашем исследовании выявлено снижение среднего уровня маркера СА 125 у женщин с серозными ПОЯ в репродуктивном возрасте (n=15) – 95 ± 5,4 ЕД/мл по сравнению с группой пациенток с муцинозными пограничными опухолями (n=3) – 65,3 ± 3,4 Ед/мл, что согласуется с данными литературы [2, 5, 6, 8, 9]. Обратная тенденция выявлена для онкомаркера НЕ 4, его среднестатистические значения у пациенток в репродук-
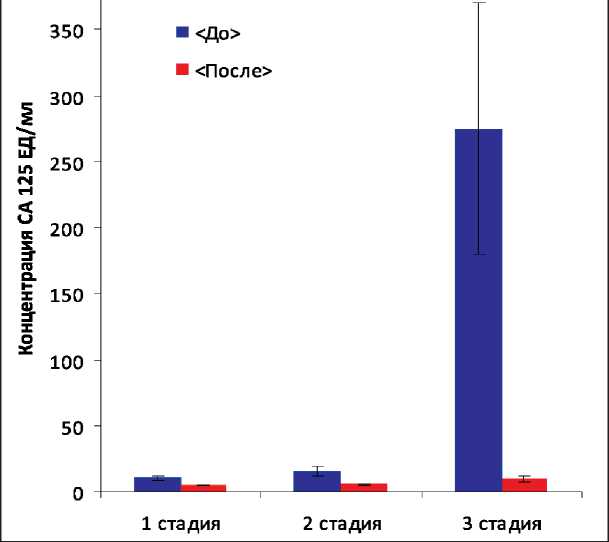
Рис. 1. Уровень онкомаркера СА 125 в сыворотке крови больных с пограничными опухолями яичников до и после лечения (p<0,05)
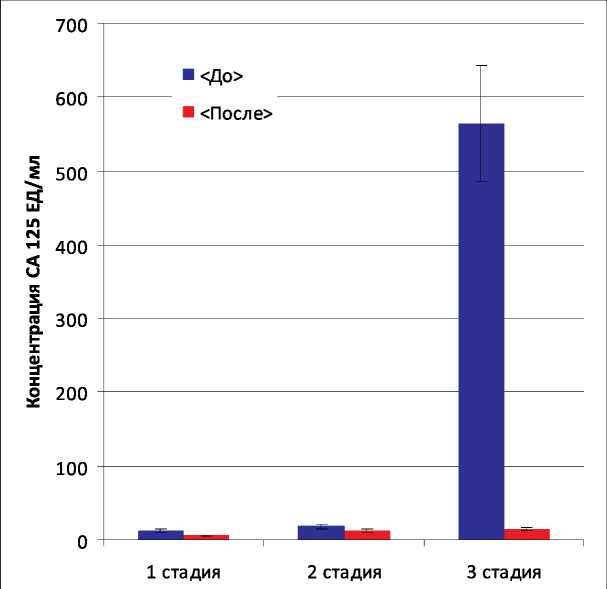
Рис. 2. Уровень онкомаркера СА 125 в сыворотке крови больных раком яичников до и после лечения (p<0,05)
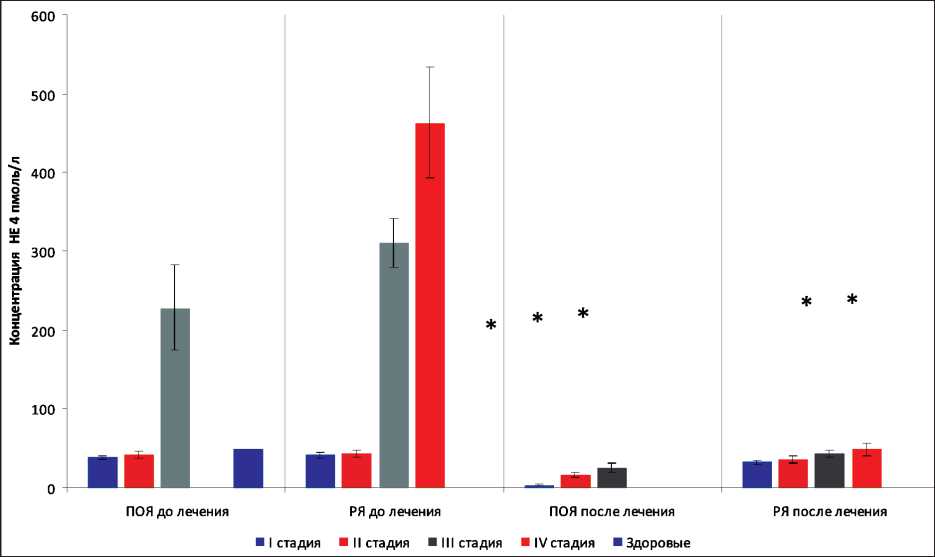
Рис. 3. Уровень онкомаркера Не 4 в сыворотке крови больных с ПОЯ и РЯ до и после лечения (p<0,05)
тивном возрасте составляют 76,5 ± 3,2 пмоль/л, что ниже, чем у больных с муцинозными ПОЯ, – 85,5 ± 3,6 пмоль/л.
Заключение
Результаты проведенного исследования позволяют утверждать, что показатели уровня онкомаркеров СА 125 и НЕ 4 при пограничных опухолях до лечения значительно превышают таковые у здоровых женщин. При пограничных опухолях яичников I–II стадий значения онкомаркеров СА 125 и НЕ 4 сопоставимы с аналогичными показателями при раке яичников. Однако при III стадии заболевания наблюдается рост значений уровня онкомаркеров СА 125 и НЕ 4, которые при раке яичников в не- сколько раз превышают значения у пациенток с пограничными опухолями яичников.
Список литературы Онкомаркеры СА 125, НЕ 4 как предикторные факторы прогноза у больных с пограничными опухолями яичников
- Бохман Я.В. Лекции по онкогинекологии. М., 2007. 167 с.
- Новикова Е.Г., Батталова Г.Ю. Пограничные опухоли яичников. М., 2007. 151 с.
- Сергеева Н.С., Маршрутина Н.В. Общие представления о серологических биомаркерах и их месте в онкологии//Практическая онкология. 2011. Т. 12, № 4. С. 147-154.
- Тюляндин С.А., Моисеенко В.М. Практическая онкология: избранные лекции. СПб., 2004. 784 с.
- Чернышова А.Л., Чуруксаева О.Н. Роль опухолевого маркера СА-125 в выявлении рецидива рака яичников и определении тактики лечения//Сибирский онкологический журнал. 2010. № 3. С. 34-37.
- Bast R.C. Jr., Skates S., Lokshin A., Moore R.G. Differential diagnosis of pelvic mass: improved algorithms and novel biomarkers//Int. J. Gynecol. Cancer 2012. Vol. 22. P. 5-8. doi: 10.1097/IGC.0b013e318251c97d.
- Tropé С.G., Kaern J., Davidson B. Boderline ovarian tumours//Best Pract. Res. Clin. Obstet. Gynaecol. 2012. Vol. 26 (3). P. 325-336 DOI: 10.1016/j.bpobgyn.2011.12.006
- Kalapotharakos G., Asciutto C., Henic E., Casslen B., Borgfeldt C. High preoperative blood ievels of HE 4 predicts poor prognosis in patients with ovarian cancer//J. Ovarian Res. 2012. Vol. 5 (1). P. 20 DOI: 10.1186/1757-2215-5-20
- Moore R.G., McMeekin D.S., Brown A.K., DiSilvestro P., Miller M.C., Allard W.Jeffery, Gajewski W., Kurman R., C.Bast Jr. R., Skates S.J. A novel multiple marker bioassay utilizing HE 4 and CA 125 for the prediction of ovarian cancer in patients with a pelvic mass//Gynecol. Oncol. 2009. Vol. 112 (1). P. 40-46 DOI: 10.1016/j.ygyno.2008.08.031


