Операндо исследование реакций сочетания в присутствии "безлигандных" палладиевых катализаторов
Автор: Ларина Е.В., Курохтина А.А., Ярош Е.В., Лагода Н.А., Шмидт А.Ф.
Журнал: Вестник Бурятского государственного университета. Химия. Физика @vestnik-bsu-chemistry-physics
Рубрика: Химия
Статья в выпуске: 4, 2016 года.
Бесплатный доступ
Совместное применение УФ-спектроскопии и хромато-масс-спектрометрии было использовано для in situ контроля количества окисленного палладия в ходе реакции Хека с ангидридом бензойной кислоты, а также реакции прямого арилирования индола по С-Н-связи в присутствии каталитических систем на основе солей палладия (II). Показано, что в ходе реакции Хека бóльшая часть палладия (до 90%) находится в каталитически неактивной форме [PdBr4]2-, в то время как в реакции прямого арилирования индола количество окисленного палладия в виде каталитически неактивного комплекса [PdI4]2- не превышает 25% от количества загружаемого в реакцию палладия.
Реакция хека, прямое арилирование, катализ, палладий, каталитически неактивная форма [pdbr4]2-
Короткий адрес: https://sciup.org/148317764
IDR: 148317764 | УДК: 547: | DOI: 10.18101/2306-2363-2016-4-26-36
Текст научной статьи Операндо исследование реакций сочетания в присутствии "безлигандных" палладиевых катализаторов
Открытие в начале 70-х годов прошлого века реакции Мицороки-Хека, больше известной под названием реакции Хека, положило начало развитию нового направления в металлокомплексном катализе и тонком органическом синтезе, представленного целым семейством реакций сочетания, в которых формируются новые связи углерод-углерод и углерод-гетероатом [1]. Одной из многочисленных модификаций реакции Хека стало использование в качестве арилирующего агента ангидридов ароматических кислот, предложенное впервые в 1998 г. [2]. Привлекательность этого подхода обусловлена отсутствием необходимости использования основания, являющегося обязательным компонентом каталитической системы при осуществлении «классического» варианта реакции с использованием арилгалогенидов в качестве арилирую-щих реагентов. Тем не менее, такой вариант реакции на сегодняшний день остается крайне мало изученным по сравнению с классической реакцией с участием арилгалогенидов. Так, исследованию природы интермедиатов этого процесса фактически посвящено всего две работы, в одной из которых рассматривались лишь модельные реакции [3], а в другой проводилось исследование реального каталитического процесса [4], однако, применение в качестве основного метода анализа ЯМР-спектроскопии на ядрах фосфора позволяло исследовать только каталитические системы, содержащие фосфорорганические лиганды. При этом т.н. «безлигандные» каталитические системы без использования специально добавляемых органических лигандов не уступают, а нередко значительно превосходят по активности фосфинсодержащие каталитические системы, требующие к тому же специальных условий осуществления реакции (инертная атмосфера, осушка растворителей и реагентов). В связи с этим исследования превращений катализатора в ходе реакции Хека с ангидридами ароматических кислот в присутствии «безлигандных» каталитических систем необходимы для получения сведений о состоянии катализатора в ходе реакции.
Логическим развитием методологии образования новых углерод-угдеродных связей путем сочетания арилгалогенидов с различными нуклеофилами стало открытие не менее перспективных, но при этом более простых (не требующих предварительного введения дополнительных функциональных групп в молекулу нуклеофила) реакций так называемого прямого арили-рования ароматических и гетероароматических соединений по С-Н-связи [5]. Несмотря на то, что исследования реакций этого семейства не столь продолжительны (фактически ведутся последние 8-10 лет), к настоящему моменту уже можно говорить о значительных успехах в области разработки эффективных каталитических систем для их осуществления (обзор) [6]. Однако, фундаментальным исследованиям механизма функционирования таких систем в литературе уделено крайне недостаточное внимание. В частности, на сегодняшний день не представлено каких-либо работ, посвященных целенаправленному исследованию процессов превращения катализатора в ходе протекания реакций прямого арилирования (в качестве исключения можно лишь упомянуть работы [7, 8], в которых при использовании гетерогенных предшественников катализатора оценивалось количество палладия, перешедшего с их поверхности в раствор, и/или методами электронной микроскопии оценивалось состояние катализатора до и после реакции). Таким образом, становится очевидной необходимость исследования состояния палладия в ходе этих реакций для формулировки гипотез их механизма.
Ранее с помощью применения in situ спектроскопических методов было показано, что в присутствии не содержащих добавок органических лигандов каталитических систем на основе палладия в реакции Хека с арилиодидами и арилбромидами наблюдается переход бóльшей части палладия в форму неактивного в катализе ацидокомплекса [PdX 4 ]2- (где Х — галоген) [9-11].
Целью настоящей работы являлось исследование возможности образования аналогичных комплексов палладия в растворе при проведении реакции сочетания ангидрида бензойной кислоты со стиролом, а также реакции прямого арилирования индола иодбензолом в присутствии безлигандных каталитических систем.
Экспериментальная часть
Реакцию Хека проводили в стеклянном реакторе, снабженном резиновой мембраной и магнитной мешалкой, помещая в него стирол (5 ммоль), PdCl 2 (0,08 ммоль), ангидрид бензойной кислоты (5 ммоль), NBu 4 Br или NaBr (1,6 ммоль), нафталин (1 ммоль) в качестве внутреннего стандарта и 5 мл N- метилпирролидона (NMP). Реакции проводились при 140ºС в условиях интенсивного перемешивания. Каждый эксперимент проводили 2 раза для проверки воспроизводимости.
Реакцию прямого арилирования проводили в стеклянном реакторе, снабженном резиновой мембраной и магнитной мешалкой, помещая в него индол (5 ммоль), PdCl 2 (0,08 ммоль), иодбензол (5 ммоль), NaOAc (6,5 ммоль) в качестве основания, нафталин (1 ммоль) в качестве внутреннего стандарта и 5 мл смеси N,N- диметилформамида (DMF) с водой в соотношении 4:1. Реакции проводились при 140ºС в условиях интенсивного перемешивания. Каждый эксперимент проводили 2 раза для проверки воспроизводимости.
Хромато-масс-спектрометрический анализ проводили на приборе Shimadzu QP-2010 Ultra с ионизацией электронным ударом (энергия ионизации 70 эВ), колонка GsBP-5MS (0,25 мкм х 0,25 мм х 30 м), газ-носитель гелий. Полученные масс-спектры сравнивались с библиотечными (библиотеки сравнения Wiley, NIST, NIST05). Количественный анализ проводился методом внутреннего стандарта (внутренний стандарт нафталин).
УФ-спектры исследуемых растворов регистрировали на приборе СФ-2000 в области 190-600 нм с использованием кварцевых кювет с толщиной поглощающего слоя 0,01 см.
В реакции Хека измерение концентрации комплекса [PdBr 4 ]2- проводили, используя интенсивность поглощения при 350 нм. Калибровочный график для этой длины волны был предварительно построен на основе спектров стандартных растворов [PdBr 4 ]2-, полученных путем последовательного разбавления раствора, содержащего 0,16 ммоль PdBr 2 и 3,2 ммоль NBu 4 Br в 10 мл NMP. При этом так же путем построения калибровочных графиков учитывалось поглощение при 350 нм от образующихся продуктов реакции стильбена и халкона, количества которых в ходе реакции оценивались с помощью метода хромато-масс-спектрометрии.
В реакции прямого арилирования измерение концентрации комплекса [PdI 4 ]2- проводили, используя интенсивность поглощения при 450 нм. Калибровочный график для этой длины волны был предварительно построен на основе спектров стандартных растворов [PdI 4 ]2-, полученных путем последовательного разбавления раствора, содержащего 0,16 ммоль PdI 2 и 3,2 ммоль NaI в 10 мл смеси ДМФА-вода (4:1).
Обсуждение результатов
Реакция Хека (арилирование стирола ангидридом бензойной кислоты)
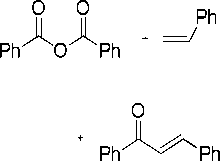
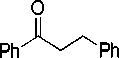
Реакция сочетания ангидрида бензойной кислоты со стиролом проводилась в присутствии безлигандной каталитической системы на основе хлорида палладия с использованием добавки бромистого тетрабутиламмония или бромида натрия. При этом наблюдалось образование не только типичных «хековских» продуктов — стильбена и 1,1,-дифенилэтилена, но и продуктов, содержащих карбонильную группу — халкона (1,3-дифенил-2-пропен-1-она) и дигидрохалкона (1,3-дифенил-пропан-1-она), а также побочного продукта — бензойной кислоты (рис. 1).
PdCI2] NBu4Br (NaBr)
NMP, 140°C
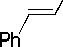
40-60%
Ph
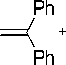
2-3%
PhCOOH +
CO
5-15% 6-10%
Рис. 1. Схема реакции сочетания стирола с ангидридом бензойной кислоты в присутствии каталитической системы PdCl 2 -NBu 4 Br (NaBr)
С учетом ранее полученных результатов в реакции Хека с арилгалогени-дами [9-11], в присутствии добавок NBu 4 Br или NaBr в реакции с ангидридом можно было также ожидать образования комплексов [PdBr 4 ]2- (рис. 1). УФ-спектр раствора [PdBr 4 ]2- в NMP характеризуется максимумом поглощения при 350 нм. Анализ спектров поглощения веществ-участников реакции (ангидрида бензойной кислоты, стирола, стильбена, 1,1,-дифенилэтилена, халко-на, дигидрохалкона, бензойной кислоты и нафталина) показал, что при этой длине волны также наблюдается поглощение от стильбена и халкона (рис. 2). Нами были построены калибровочные графики для зависимости оптической плотности при 350 нм для различных концентраций халкона, стильбена и [PdBr 4 ]2-. При этом диапазон концентраций для их построения был выбран, исходя из образующихся в выбранных условиях реакции количеств этих продуктов (рис. 1). С учетом того, что количества стильбена и халкона можно легко измерить методом хромато-масс-спектрометрии, измерение оптической плотности в УФ-спектре реакционного раствора при 350 нм позволяет осуществить контроль количества образующегося в ходе реакции арилирования стирола ангидридом бензойной кислоты комплекса [PdBr 4 ]2- непосредственно в ходе реальной каталитической реакции.
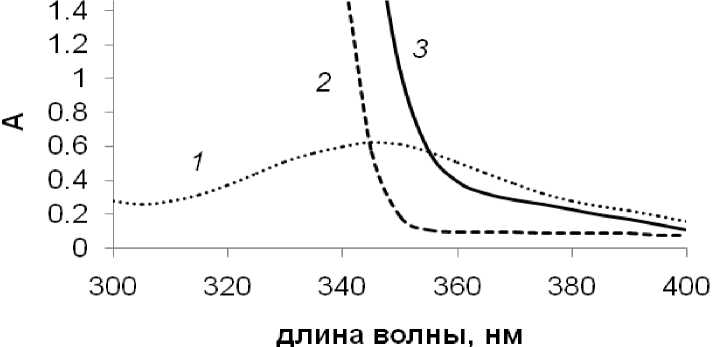
Рис. 2. УФ-спектры растворов [PdBr 4 ]2- (1), стильбена (2) и халкона (3). Концентрации [PdBr 4 ]2-, стильбена и халкона соответствуют их выходам 40, 50 и 5 %, соответственно в условиях реакции
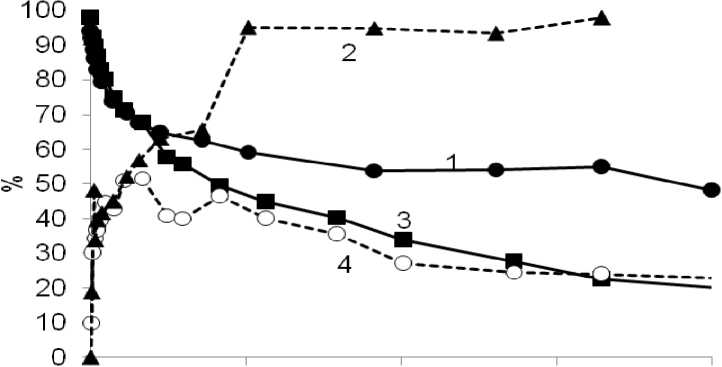
Разработанная методика была применена для операндо исследования образования [PdBr 4 ]2- в условиях реального каталитического процесса. УФ-спектры реакционной смеси, в различные моменты времени реакции, представлены на рис. 3. Отбираемые в ходе реакции пробы реакционного раствора дополнительно подвергались хромато-масс-спектрометрическому анализу для определения количеств стильбена и халкона. С учетом этих данных, нами были рассчитаны зависимости количества образующегося в ходе реакции комплекса [PdBr 4 ]2- от времени. Вне зависимости от природы соединения-источника бромид-ионов, в начале каталитической реакции наблюдался рост концентрации [PdBr 4 ]2-, совпадающий по времени с периодом максимальной каталитической активности (рис. 4). При этом начальные скорости расходования стирола (как и накопления [PdBr 4 ]2-) в экспериментах с применением NBu 4 Br и NaBr практически совпадали, однако, на более поздних этапах протекания реакции наблюдались существенные отличия. При использовании добавки бромистого тетрабутиламмония вскоре наблюдалось некоторое падение скорости расходования стирола, при этом концентрация [PdBr 4 ]2- в растворе снижалась (кривые 3, 4, рис. 4). В условиях использования добавки бромида натрия количество [PdBr 4 ]2- в растворе оказывалось бóльшим по сравнению с использованием NBu 4 Br, концентрация [PdBr 4 ]2- продолжала расти, при этом каталитическая реакция практически останавливалась (рис. 4). Влияние природы катиона используемой в реакционной системе соли на каталитическую активность в реакции ангидрида бензойной кислоты со стиролом согласуется с опубликованными ранее данными [12].
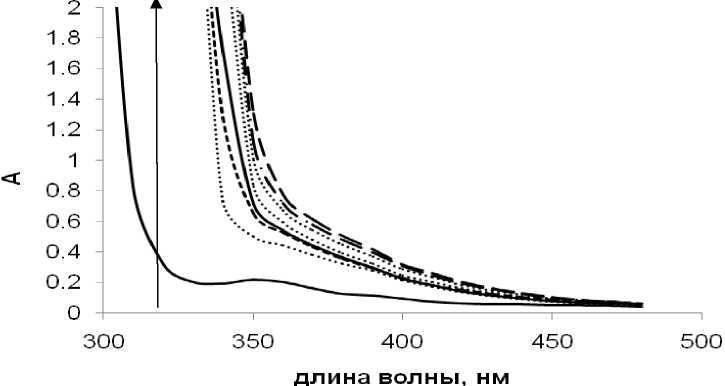
Рис. 3. УФ-мониторинг реакции арилирования стирола ангидридом бензойной кислоты в присутствии каталитической системы PdCl 2 -NBu 4 Br (стрелкой показаны изменения спектров во времени)
О 100 200 300 400
время, мин
Рис. 4. Зависимость количества стирола (сплошные линии) и [PdBr 4 ]2-(пунктирные линии) (проценты от максимально возможной в условиях реакции концентрации) от времени в реакции стирола с ангидридом бензойной кислоты при использовании NаBr (1, 2) и NBu 4 Br (3, 4) (20 эквивалентов по отношению к PdCl 2 )
Из представленных на рис. 4 данных операндо спектроскопического исследования очевидно, что изменение природы добавляемых в систему соединений-источников бромид-ионов слабо влияет как на начальную скорость каталитической реакции, так и на начальную скорость процесса накопления [PdBr 4 ]2-. При этом характер кинетических кривых этих процессов указывает на то, что комплекс [PdBr 4 ]2-, как и в случае реакции Хека с арилгалогенида-ми, не участвует в основном каталитическом цикле реакции, поскольку в условиях присутствия в растворе значительного количества указанного комплекса каталитическая активность в системе заметно снижается. Это согласуется с общепринятыми представлениями о превращениях катализатора в реакции Хека, согласно которым катализ протекает на комплексах восстановленного палладия [13]. Таким образом, в реакции арилирования стирола ангидридом бензойной кислоты, как и в реакции Хека с арилгалогенидами, образование комплекса [PdBr 4 ]2- является маршрутом дезактивации катализатора. Тем не менее, с учетом одновременного падения его концентрации и скорости каталитической реакции при использовании каталитической системы с добавкой NBu 4 Br, можно предположить, что этот маршрут дезактивации не является единственным. В случае протекания катализа на растворенных комплексах палладия (являющегося наиболее вероятным в реакции Хека с арил-галогенидами [14-16]) таким процессом может быть агломерация растворенных молекулярных комплексов палладия с образованием наноразмерных и более крупных частиц металла. Если же катализ протекает на поверхности частиц металлического палладия, дезактивация может быть обусловлена блокированием поверхности катализатора продуктами реакции.
Реакция прямого арилирования индола иодбензолом по С-Н-связи
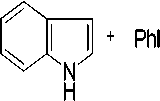
Реакция арилирования индола иодбензолом проводилась в присутствии безлигандной каталитической системы на основе хлорида палладия (рис. 5).
PdCI2. NaOAc
DMF:H2O=4:1,140°C
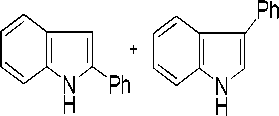
0.5-4%
Рис. 5. Схема реакции арилирования индола иодбензолом в присутствии каталитической системы на основе PdCl 2
Уже с первых минут реакционный раствор приобретал характерный для иодидных комплексов палладия (II) красный цвет. Действительно, на основании литературных данных в реакции Хека с иодбензолом при использовании безлигандных каталитических систем [10], в реакционной смеси можно было ожидать появления комплексов [PdI4]2-. Анализ УФ-спектров реакционной смеси показал наличие максимумов поглощения при 450 и 560 нм, являющихся характерными для последнего (рис. 6). При этом, в УФ-спектрах поглощения других веществ — участников реакции, включая индол и фенилин- долы (рис. 6), в длинноволновой области отсутствовали максимумы поглощения (наблюдался лишь небольшой рост фонового поглощения), что позволяло напрямую использовать данные, полученные при обработке УФ-спектров реакционной смеси, для расчета концентрации образующегося в реакции [PdI4]2-(рис. 7).
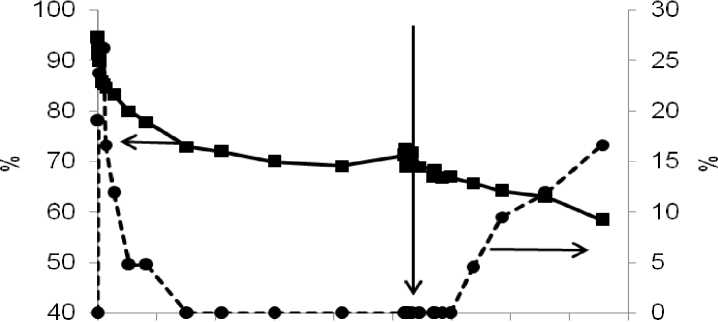
Операндо исследование протекания реакции арилирования индола иод-бензолом показало, что начальный период характеризовался быстрым ростом концентрации [PdI 4 ]2- до 25% от теоретически возможного максимального количества. Увеличение концентрации происходило на фоне максимальной каталитической активности в реакции прямого арилирования индола (рис. 8). Тем не менее, начиная примерно с 5-й минуты реакции, количество [PdI 4 ]2- в реакционном растворе снижалось практически до нуля, совпадая с падением скорости каталитической реакции. Однако, следует отметить, что исчезновение [PdI 4 ]2- совпадало по времени с практически полной конверсией иодбен-зола за счет протекания побочных процессов его восстановления до бензола и восстановительного гомосочетания до дифенила. Таким образом, для проверки гипотезы непосредственного участия комплекса [PdI 4 ]2- в катализе необходимо было исключить влияние уменьшения концентрации иодбензола. Для этого в реакционную смесь после момента полного расходования иодбензола вводили еще одну его порцию (момент введения обозначен вертикальной стрелкой на рис. 8). После введения сразу начиналась реакция арилирования индола, однако, в УФ-спектрах реакционной смеси довольно длительное время не было зафиксировано образования [PdI 4 ]2-, и лишь после этого был зафиксирован рост его концентрации в реакционном растворе. В этом случае скорость накопления [PdI 4 ]2- была значительно медленней, чем в начале реакции, что позволило экспериментально наблюдать каталитическую активность в отсутствии [PdI 4 ]2-. Таким образом, полученные данные указывают на то, что комплекс [PdI 4 ]2- не принимает непосредственного участия в арилирова-нии индола иодбензолом.
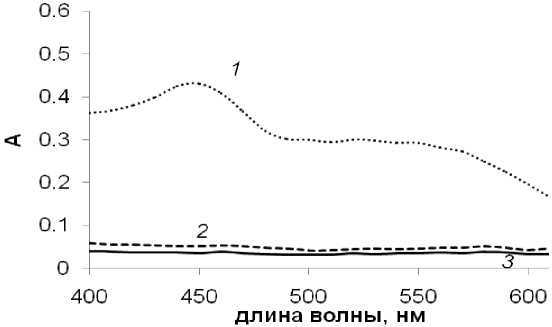
Рис. 6. УФ-спектры растворов [PdI 4 ]2- (1), индола (2) и 2-фенилиндола (3). Концентрации [PdI 4 ]2-, индола и 2-фенилиндола соответствуют выходам 50, 50 и 15 %, соответственно
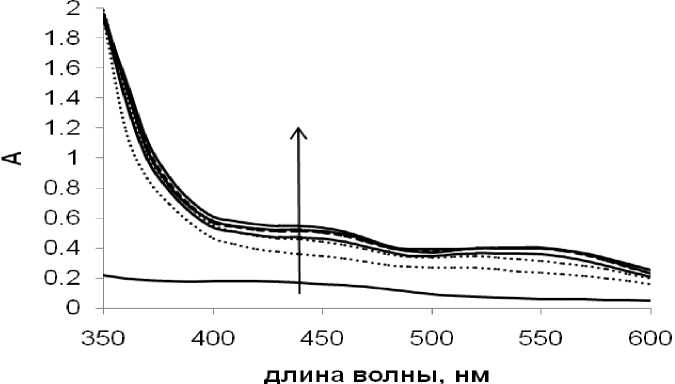
Рис. 7. УФ-мониторинг реакции арилирования индола иодбензолом в присутствии каталитической системы на основе PdCl 2 (стрелкой показаны изменения спектров во времени)
О 50 100 150 200 250 300 350 400 450
время, мин
Рис. 8. Зависимости количеств индола (сплошные линии) и [PdI 4 ]2-(пунктирные линии) (проценты от максимально возможной в условиях реакции концентрации) от времени в реакции арилирования индола иодбензолом в присутствии каталитической системы на основе PdCl 2
Заключение
Путем УФ-спектроскопического операндо исследования с одновременным измерением параметров каталитической активности установлено, что при проведении реакции Хека с ангидридом бензойной кислоты в присутствии безлигандной каталитической системы с добавкой соединения-источника бромид ионов в реакционной смеси значительная доля палладия (до 90%) переходит в каталитически неактивную форму [PdBr4]2-, что сказывается на активности каталитической системы. В свою очередь в реакции арилирования индола по С-Н-связи иодбензолом до 25% загружаемого в систему катализатора в момент максимальной каталитической активности находится в каталитически неактивной форме [PdI4]2-. Полученные данные позволяют предложить пути повышения эффективности катализатора, в частности, путем применения добавок соединений-восстановителей.
Работа выполнена при поддержке грантов РНФ № 14-13-00062 (раздел «Реакция Хека (арилирование стирола ангидридом бензойной кислоты)») и РФФИ № 16-29-10731 (раздел «Реакция прямого арилирования индола иодбензолом по С-Н-связи»).
Список литературы Операндо исследование реакций сочетания в присутствии "безлигандных" палладиевых катализаторов
- Seechurn C. J., Kitching M. O., Colacot T. J., Snieckus V. Palladium-catalyzed cross-coupling: a historical contextual perspective to the 2010 Nobel Prize // Angew. Chem. Int. Ed. - 2012. - V. 51, № 21. - P. 5062 - 5085.
- Stephan M. S., Teunissen A. J. J. M., Verzijl G. K. M., de Vries J. G. Heck reactions without salt formation: aromatic carboxylic anhydrides as arylating agents // Angew. Chem. - 1998. - V. 37, № 5.- P. 662-664.
- Jutand A., Negri S., de Vries J. G. Rate and mechanism of the oxidative addition of benzoic anhydride to palladium(0) complexes in DMF // Eur. J. Inorg. Chem. - 2002. - V. 2002, № 7. - P. 1711-1717.
- Шмидт А. Ф., Смирнов В. В. Исследование механизма реакции арилирования алкенов ангидридами ароматических кислот методом ЯМР // Кинетика и катализ. - 2002. - Т. 43, № 2. - С. 215-218.
- Cano R., Schmidt A. F., McGlacken G. P. Direct arylation and heterogeneous catalysis; ever the twain shall meet // Chem. Sci. - 2015. - V. 6. - P. 5338-5346.


