ОПЕРАТИВНОЕ ИЗГОТОВЛЕНИЕ МИКРОЧИПОВ ДЛЯ ПЦР-АНАЛИЗА ИЗ ПОЛИМЕРНЫХ МАТЕРИАЛОВ В ЛАБОРАТОРНЫХ УСЛОВИЯХ
Автор: Н. А. Есикова, Н. Н. Гермаш, А. А. Евстрапов
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Приборостроение физико-химической биологии
Статья в выпуске: 4 т.30, 2020 года.
Бесплатный доступ
Методами термоформования и герметизации специальными пленками для ПЦР изготовлены микрочипы из поликарбоната и полипропилена. Работоспособность микрочипов продемонстрирована путем проведения ПЦР-РВ на тест-объекте. Полученные микрочипы из поликарбоната и полипропилена выдерживают хранение при отрицательных температурах (–40 °C).
Микрочип, термопласт, поликарбонат, полипропилен, полимеразная цепная реакция в реальном времени, оптическое детектирование
Короткий адрес: https://sciup.org/142224609
IDR: 142224609 | УДК: 67.02+543.07 | DOI: 10.18358/np-30-4-i2126
Текст научной статьи ОПЕРАТИВНОЕ ИЗГОТОВЛЕНИЕ МИКРОЧИПОВ ДЛЯ ПЦР-АНАЛИЗА ИЗ ПОЛИМЕРНЫХ МАТЕРИАЛОВ В ЛАБОРАТОРНЫХ УСЛОВИЯХ
ВВЕДЕНИЕ 2], поскольку для нее не требуется сложного обо-
Анализы, основанные на проведении полимеразной цепной реакции в реальном времени (ПЦР-РВ), находят применение в медицине, криминалистике, контроле качества продуктов питания и др. Переход на микрочиповый формат позволяет автоматизировать анализ и уменьшить влияние человеческого фактора на его результаты. Целью данной работы являлось исследование возможности оперативного изготовления микрочипов для проведения ПЦР-РВ анализа из твердых пластиков предпочтительно с использованием материалов отечественного производства.
Для изготовления микрочипа нужно сформировать в материале открытые структуры и герметизировать их. Формирование реакционных камер микронных размеров в твердом пластике может быть проведено методами термоформования и лазерной микрообработки. Основным недостатком первого метода является потребность в мастер-форме и зависимость разрешения получаемых оттисков от ее качества. Лазерная микрообработка — прямой метод получения структуры в пластиках и металлах. Разрешение зависит от характеристик используемого лазера, материала, режима обработки и составляет от ~1 мкм и более. Однако для получения множества одинаковых реплик лазерными методами необходимы регулярный контроль и настройка оптической системы, корректировка режимов. Отметим, что данный метод может успешно применяться при получении металлической мастер-формы для последующего термоформования различных пластиков.
Для герметизации термоформованных микрочипов часто применяется термическая сварка [1, рудования и получаемые структуры могут быть полностью из одного материала. Однако в случае плоских камер большой площади данный метод либо приводит к существенной деформации структур, либо прочность соединения недостаточна и существует возможность разъединения деталей (например, при ударном воздействии).
В последние годы появились работы, в которых герметизация чипов/картриджей производилась благодаря использованию полимерных пленок с адгезионным слоем. Например, в [3] рассмотрена применимость пленок с активируемым давлением адгезивом ARcare 92712, ARcare 90445, ARcare 90106 из полиэстера с акрилатным адгезивом различной толщины и ARseal 90880 из полипропилена с силиконовым адгезивом. Авторы [4] исследовали герметизацию чипов из разных материалов, предназначенных для генерации капель и проведения ПЦР, пленкой ThermalSealRTS ™ (Exel-Scientific). Особенностью применения данного метода для ПЦР-микрочипов является постоянный контакт реакционной смеси с адгезионным слоем пленки при многократном нагреве до 90–95 °С.
Так же представляется интересным рассмотрение метода ультразвуковой сварки [5]. Однако для его применения требуется дорогостоящее оборудование, позволяющее производить тонкую настройку под различные материалы и топологии, и соответствующая оснастка.
Поэтому для достижения цели поставлены следующие задачи: 1) термоформование топологии камер в поликарбонате и полипропиленене мас-тер-формы, изготовленной методом лазерного микроформования; 2) герметизация полученных
|
микрочипов коммерческими пленками для проведения ПЦР, представляющими из себя полимерную пленку с тонким адгезивным слоем (соединение должно обеспечивать силу связывания, выдерживающую возникающее в камерах при термоциклировании давление, и не ингибировать реакцию); 3) исследование светопропускания и фоновой флуоресценции микрочипов, поскольку предполагается детектирование ПЦР-РВ оптическими методами; 4) изучение свойств поверхности камер микрочипов (методом лежачей капли), поскольку они влияют на образование пузырьков воздуха при термоциклировании; 5) апробация микрочипов при проведении в них ПЦР-РВ. ИЗГОТОВЛЕНИЕ МИКРОЧИПОВ Для создания микрочипов выбрано два вида пластиков: полипропилен (ПП) и поликарбонат (ПК). Они обладают высокой термостойкостью, хорошим светопропусканием в видимой части спектра. ПП более устойчив к кислотам и раство- |
рителям, чем ПК, и обладает меньшей сорбцией воды (0.01–0.1 % против 0.23 % для ПК [6]). Исследованы марки отечественных производителей: ПК Novattro (SafPlast, Россия) и ПП PP 4445S (ТУ 20.16.51-136-05766801-2015 (ПАО Нижнекамскнефтехим, Россия)). Топология микрочипа (рис. 1), представляющая из себя 3 камеры с подводящими каналами, была получена методом термопрессования в гидравлическом прессе MM-100 (MTDI, Корея) на одной мастер-форме из нержавеющей стали, изготовленной методом лазерной микрообработки. Формование камер микрочипов проводилось следующим образом: а) пластины ПК толщиной 1 мм и размером 25 × 38 мм выдерживались при температуре 190 °С под давлением 30 кг/см2 в течение 1000 с; б) гранулы ПП весом 1.5 или 2 г выдерживались сначала 5 мин при температуре 190 °С, после чего на 400 с подавалось давление 60 кг/см2. После формования производился отжиг деталей в течение 2 ч при 200 °С. Результаты измерений геометрических параметров представлены в табл. 1. |
Табл. 1. Оценка размеров полученных микрочипов
|
Материал |
Число измерений (микрочипов) |
Толщина микрочипов, мкм |
Глубина камеры I, мкм |
Глубина камеры II, мкм |
Глубина камеры III, мкм |
|
ПП (1.5 г) ПП (1.5 г) после |
41 |
688 ±68 |
305 ±7 |
291 ±7 |
302 ±7 |
|
отжига |
6 |
734 ±42 |
302 ±8 |
290 ±9 |
297 ±5 |
|
ПП (2 г) ПП (2 г) после |
8 |
958 ±63 |
310 ±8 |
299 ±8 |
306 ±5 |
|
отжига |
8 |
968 ±65 |
310 ±8 |
296 ±9 |
306 ±5 |
|
ПК |
36 |
1000 ±20 |
308 ±25 |
291 ±20 |
312 ±26 |
|
ПК после отжига |
10 |
1014 ±13 |
308 ±4 |
287 ±16 |
306 ±7 |
|
12 I II III 6 |
Рис. 1. Изображение топологии микрочипа с нумерацией реакционных камер. Размеры на рис. даны в мм |
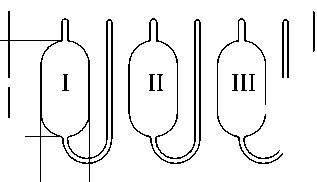
Глубина камер оценивалась как разница толщин микрочипа и дна. После отжига происходило их незначительное увеличение. Центральная камера микрочипов из обоих пластиков менее глубокая, чем боковые, что объясняется разной удаленностью камер от краев чипа (т.е. разными давлением и температурным распределением). В связи с большой площадью камер глубина вносит существенный вклад в вариацию объема. Поэтому детали из ПП с разницей в глубине камер на одном микрочипе до 14 мкм предпочтительней для дальнейшего использования, чем детали из ПК с разницей глубин до 21 мкм (табл. 1).
Детали, получаемые из 1.5 г ПП, при нагреве деформировались, поэтому с целью придания конструкции большей жесткости вес исходного материала для формования был увеличен до 2 г.
Для герметизации микрочипов протестированы варианты коммерческих пленок для ПЦР: "Ther-malSealRT TM" (Excel Scientific), "Adhesive PCR Seal" (Sarstedt), "PCR firm Adhesive" (Eppendorf) и "Пленки для ПЦР плашек полимерные" Р-500 (ООО "ПКФ Современные технологии"). Изначально качество герметизации оценивалось визуально по целостности структуры (например, адгезив пленки "ThermalSealRT TM" заполняет структуру при надавливании) и по наличию расклеенных зон вокруг камер после нагрева до 90 °С. По результатам оценок были выбраны 3 вида микрочипов: из ПК, герметизированный пленками Р-500 и "PCR firm Adhesive" фирмы Eppendorf (далее ПК + Р-500 и ПК + Epp) и из ПП с пленкой Р-500 (далее ПП + Р-500).
Также герметичность микрочипов проверялась при заполнении дегазированной дистиллированной водой и термоциклировании (40–50 циклов, 60–95 °С) на приборе Swift Max Pro (Esco Micro Pte Ltd, Таиланд). После этого контролировалось изменение массы микрочипа. Оно составило (1.6 ±0.4) % от веса воды для микрочипов (ПК + Р500), (3.0 ±0.4) % для (ПП + Р-500) и (2.4 ±0.4) % для (ПК + Epp) (по 6–9 микрочипам). В процессе термоциклирования произошло растяжение и отслоение пленки (не более 0.5 мм), вызвавшее увеличение объема камер, что может быть связано как с колебанием давления жидкости при нагреве и охлаждении, так и с разностью коэффициентов термического расширения материалов микрочипа.
После герметизации микрочипы были обработаны 70 % этиловым спиртом для стерилизации, промыты дистиллированной водой и высушены при 40 °С.
Поскольку одной из проблем при оптическом детектировании является образование в камерах пузырьков воздуха при термоциклировании, на которое оказывают влияние свойства поверхности материала, то был измерен угол смачивания ПП и ПК. Для ПП он составил 82 ±2° после термоформования, 84 ±2° — после отжига и 87 ±2° — после промывки; для ПК получены значения 76 ±1°, 76 ±3° и 82 ±1° соответственно (n = 6).
Исследована возможность хранения чипов при отрицательных температурах. Для этого микрочипы выдерживались в течение 2 ч при –40 °С, после чего их герметичность проверялась при термоциклировании. Все три варианта чипов (по 3 штуки каждого вида) выдержали испытание.
ОПТИЧЕСКИЕ СВОЙСТВА МИКРОЧИПОВ
Так как микрочипы предназначены для амплификации нуклеиновых кислот с оптическим детектированием, то были изучены светопропускание и флуоресценция полученной конструкции. Микрочипы заполнялись дистиллированной водой, а спектры регистрировались на спектрофотометре (Hitachi U-3410) и спектрофлуориметре (Hitachi F-4010).
На рис. 2 приведены усредненные по 6 образцам зависимости светопропускания для каждого вида микрочипов. Для микрочипов из ПК зависимость близка к линейной в спектральном диапазоне от 430 до 850 нм. Причем светопропускание на 490 нм составляет 70 %, в то время как для ПП это значение достигается лишь на 585 нм. На длинах волн 610 нм и выше светопропускание ПП практически совпадает с ПК. Использование разных пленок не оказывает влияния на светопропускание микрочипов.
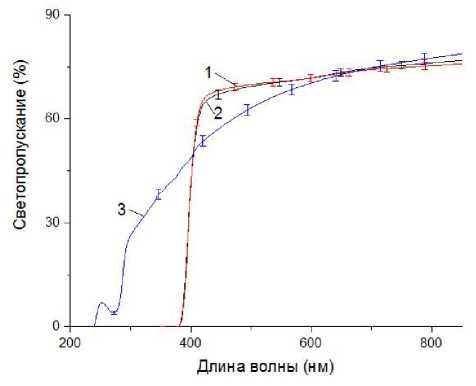
Рис. 2. Усредненные спектральные зависимости све-топропускания микрочипов и со средним отклонением ( n = 6).
1 — ПК + Р-500; 2 — ПК + Epp; 3 — ПП + Р-500
Табл. 2. Интенсивность фоновой флуоресценции микрочипов (в отн. ед.)
|
Тип микрочипа |
Возбуждение 490 нм, флуоресценция 520 нм (FAM) |
Возбуждение 520 нм, флуоресценция 550 нм (R6G) |
Возбуждение 580 нм, флуоресценция 610 нм (ROX) |
Возбуждение 645 нм, флуоресценция 670 нм (Cy5) |
|
ПК + Epp |
12.3 ±2.4 |
14.0 ±2.9 |
18.5 ±3.8 |
19.0 ±4.0 |
|
ПК + Р-500 |
8.3 ±0.5 |
9.6 ±0.6 |
13.3 ±0.8 |
14.2 ±0.9 |
|
ПП + Р-500 |
10.5 ±2.2 |
12.3 ±1.3 |
17.2 ±1.7 |
18.5 ±1.8 |
Как известно, полимеры обладают собственной флуоресценцией, что может влиять на результаты измерения. В табл. 2 приведены значения фоновой флуоресценции (в отн. ед.) чипов, усредненные по 6 образцам, для длин волн возбуждения/эмиссии красителей FAM, R6G, ROX, Cy5. Ширина щели сканирования 5 нм, скорость 120 нм/мин.
Наблюдается влияние используемой для герметизации пленки на сигнал: у микрочипов (ПК + Epp) флуоресценция выше, чем у (ПК + Р500). Флуоресценция ПП микрочипов выше, чем у ПК с той же пленкой. Поскольку исследование проведено в относительных единицах, то для сравнения измерена интенсивность флуоресценции раствора FITC концентрацией 10–5 М в камерах микрочипа (ПП + Р-500). Она составила 2686.5 отн. ед., что на 2 порядка выше фоновой флуоресценции микрочипов.
РЕЗУЛЬТАТЫ ПРОВЕДЕНИЯ ПЦР
Проверка работоспособности изготовленных микрочипов осуществлена при проведении ПЦР-РВ ДНК, выделенных вручную из E.coli . Для этого использовались наборы реагентов "М-сорб-ООМ" для выделения ДНК и РНК из клинических образцов и объектов окружающей среды и "ПЦР-Микс", праймеры и метки. Все реагенты предоставлены ООО "Синтол" (Москва).
Измерения проводились на специально созданном макете, обеспечивающем режим термоциклирования для проведения ПЦР-РВ (возбуждение на длине волны 490 нм и регистрация на 520 нм). Камеры микрочипов заполнялись реакционной смесью с добавлением выделенных нуклеиновых кислот. Микрочип размещался на нагревательном элементе пленкой вниз. Для сравнения проведена амплификация той же смеси с пробой в пробирках на АНК-48 (ИАП РАН, СПб.).
Полученные зависимости нормировались от 0 до 1. Линейные участки плато до 24-го цикла и роста сигнала от 27-го до 30-го циклов аппрок- симировались прямой. Значение порогового цикла составило: 26.1 ±0.4 для микрочипов (ПК + Epp), 26.4 ±0.6 — для (ПК + Р-500), 27.0 ±0.4 — для (ПП + Р-500) и 26.6 ±0.1 — для пробирок в АНК-48. После термоциклирования пленка микрочипа (ПК + Epp) была существенно деформирована во всех камерах, что не оказало влияния на результат.
ЗАКЛЮЧЕНИЕ
Апробирован метод оперативного изготовления микрочипов для проведения ПЦР-РВ. Камеры с подводящими каналами получены методом термоформования поликарбоната Novattro (SafPlast, Россия) и из полипропилена PP 4445S (ТУ 20.16.51-136-05766801-2015, ПАО Нижнекамскнефтехим, Россия). Установлено что в связи с разной удаленностью камер от краев мастер-формы, их глубина на одном и том же чипе варьируется. Для ПП разброс глубин как на одном микрочипе, так и между микрочипами оказался меньше, чем из ПК.
Для герметизации микрочипов исследованы коммерческие пленки для ПЦР и выбраны две, обеспечивающие сохранность топологии и герметичность при термическом режиме: "PCR firm Adhesive" (Eppendorf) и "Пленки для ПЦР плашек полимерные" Р-500 (ООО "ПКФ Современные технологии"). Получено 3 вида микрочипов: (ПК + Epp), (ПК + Р-500) и (ПП + Р-500) и проверено влияние отрицательных температур на герметичность соединения пластика с пленкой. Все 3 вида микрочипов выдержали термоциклирование после 2 ч нахождения при –40 °С.
Исследовано влияние отжига пластин после формования и промывки микрочипов 70 % этиловым спиртом на угол смачиваемости пластиков. Существенного влияния не обнаружено, изменение угла не превышает 6°.
Оптические свойства (светопропускание и интенсивность фоновой флуоресценции) полученных микрочипов позволяют работать с красителями, нашедшими широкое распространение при оптическом детектировании ПЦР (FAM, ROX, R6G, Cy5). Пленка "PCR firm Adhesive" (Eppendorf) вносит небольшой вклад в флуоресценцию микрочипа, однако величина сигнала для микрочипов (ПК + Epp) не превышает аналогичную для (ПП + Р-500). Минимальные значения получены для микрочипов (ПК + Р-500).
Результаты проведения ПЦР-РВ на примере нуклеиновых кислот, выделенных из E.coli вручную, продемонстрировали работоспособность полученных микрочипов. Значения пороговых циклов для всех трех видов микрочипов близки друг к другу и к значениям, полученным на АНК-48.


