Описательная, аналитическая и молекулярная эпидемиология рака поджелудочной железы
Автор: Шаньгина О.В., Максимович Д.М., Заридзе Д.Г.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 3 т.21, 2022 года.
Бесплатный доступ
Цель исследования - представить современные данные о роли факторов образа жизни и наследственности в этиологии рака поджелудочной железы (РПЖ). Материал и методы. Проанализированы результаты эпидемиологических исследований, посвященных роли факторов образа жизни и наследственности в этиологии РПЖ. Поиск соответствующих источников производился в системах medline и elibrary. Результаты. Рак поджелудочной железы занимает 9-е место в структуре онкологической смертности в мире. Он имеет крайне неблагоприятный прогноз, 5-летняя выживаемость больных РПЖ не превышает 9 %. Самые высокие показатели заболеваемости и смертности от РПЖ зарегистрированы в странах Восточной Европы, включая Россию. Заболеваемость РПЖ в 2019 г. составила 9,3 на 100 тыс. населения у мужчин и 5,7 у женщин. В России, как и во всем мире, наблюдается рост заболеваемости и смертности от РПЖ. Доказанными факторами риска являются курение, потребление алкоголя, избыточный вес, ожирение и диабет, панкреатит в анамнезе. На риск развития РПЖ влияет микробиом полости рта и толстой кишки. Установлено, что 5-10 % случаев РПЖ являются наследственными. Идентифицированы наследственные синдромы. Риск развития РПЖ у пациентов с такими синдромами колеблется от 2 (синдром наследственного рака молочной железы и яичников) до 132 (синдром Пейтца-Егерса). Выявлены участки генома, содержащие варианты полиморфизма одиночных нуклеотидов (sNps), которые чаще встречаются у больных РПЖ, чем у здоровых людей. К часто встречающимся соматическим мутациям относится мутация драйверных генов (driver-gene) РПЖ, к которым относятся онкоген KRAS и гены-супрессоры опухолей TP53, CDKN2A и SMAD4 . Идентифицированы и так называемые пассажирские мутации, которые при РПЖ встречаются реже ( AIB1/NCOA, ERBB2/HER2/EGFR2, AKT2, BRAF, CCND1, RB1) . Однако комбинированный эффект полиморфизма этих генов может быть существенным и сравнимым с влиянием драйверного гена. Заключение. На сегодняшний день существенным недостатком нашего понимания процесса канцерогенеза является отсутствие информации о том, какие именно канцерогенные факторы приводят к тем или иным конкретным мутациям, т. е. образованию мутационных сигнатур. Для разрешения этой проблемы в 2017 г. стартовал международный научный проект gRaNd cHalleNge “mutograph”, в котором участвуют сотрудники отдела анализа эпидемиологии опухолей ФГБУ «НМИЦ онкологии им. Н.Н.Блохина».
Рак поджелудочной железы, эпидемиология, этиология, факторы риска
Короткий адрес: https://sciup.org/140295083
IDR: 140295083 | УДК: 616.37-006.6-036.22 | DOI: 10.21294/1814-4861-2022-21-3-90-103
Текст научной статьи Описательная, аналитическая и молекулярная эпидемиология рака поджелудочной железы
Рак поджелудочной железы (РПЖ) занимает 9-е место в структуре онкологической смертности в мире [1]. В 2020 г. в мире зарегистрировано свыше 495 тыс. случаев РПЖ, а умерло – 466 тыс. [1]. По прогнозам, к 2030 г. смертность от РПЖ займет 2-е ранговое место в смертности от онкологических причин [2]. Рак поджелудочной железы имеет крайне неблагоприятный прогноз. 5-летняя выживаемость больных РПЖ, по данным США, не превышает 9 % и мало изменилась за последние десятилетия [3]. Основная причина плохого прогноза РПЖ связана с поздним выявлением заболевания: в 29 % случаев РПЖ диагностируется с метастазами в регионарных лимфатических узлах, а в 53 % случаев – с отдаленными метастазами [4]. Довольно часто РПЖ диагностируется посмертно. В результате в некоторых статистических отчетах число умерших от РПЖ превышает число заболевших.
По данным Международного агентства по изучению рака [1], самые высокие показатели заболеваемости РПЖ у мужчин зарегистрированы в странах Восточной Европы: в Венгрии (13,7)
(здесь и далее скорректированные по мировому стандартному населению показатель на 100 тыс. населения), Словакии (12,0), Латвии (11,9), Молдове (11,3), Чехии (11,2), Эстонии (11,5), а также в Уругвае (12.8) и в Японии (11,7). У женщин заболеваемость РПЖ наиболее высока в Венгрии (9,2), Уругвае (8,9), Японии (8,2), Австрии (8,0), Чехии (8,0). Аналогичное распределение наблюдается и по уровню смертности. Мужчины умирают от РПЖ значительно чаще, чем женщины [1, 5]. Причины более низкой заболеваемости РПЖ у женщин до конца не изучены, поскольку мужчины курят в 5 раз чаще (25,0 %), чем женщины (5,4 %), возможно, этим и объясняются гендерные различия [6].
За последние три десятилетия количество заболевших и умерших от РПЖ в мире выросло более чем в 2 раза [5]. Этот рост связан, в первую очередь, со старением населения, т. е. с увеличением доли пожилых людей в общей численности населения. Однако этот рост может быть связан и с распространением в мире таких факторов риска РПЖ, как ожирение и диабет [7]. Географические различия в заболеваемости РПЖ, скорее всего, можно объ- яснить различием в воздействии известных или предполагаемых факторов риска [5]. Например, региональные различия в распространенности курения, доказанного фактора риска РПЖ, могут частично объяснить эти географические особенности. Другие факторы риска РПЖ, такие как ожирение и диабет, более распространены в странах с высоким уровнем жизни по сравнению со странами с низким уровнем жизни, что также может влиять на географические различия в заболеваемости РПЖ.
Россия, по данным МАИР, относится к регионам с высокой заболеваемостью и смертностью от РПЖ [8]. Заболеваемость РПЖ в 2019 г. составила 9,31 у мужчин и 5,68 у женщин. Однако в ряде регионов показатели заболеваемости РПЖ выше общероссийских. На рис. 1 представлены регионы России с самыми высокими и самыми низкими показателями заболеваемости РПЖ среди мужчин в 2019 г. Самая высокая заболеваемость (более 10,0) отмечена в Ненецком автономном округе (22,95), Еврейской автономной области (16,4) и Орловской области (16,16), а самые низкие показатели заболеваемости РПЖ зарегистрированы в Республике Алтай (3,65). Среди женщин (рис. 2) высокая заболеваемость отмечается в Ненецком автономном округе (11,55), Мурманской области (9,64) и на Камчатке (9,13), самые низкие показатели – в Республике Чувашия (2,89) [8].
По показателям смертности Россия также относится к регионам с высокой смертностью от РПЖ [1]. Смертность от РПЖ в 2019 г. составила 9,26 у мужчин и 5,27 у женщин. В России, как и в других странах, смертность от РПЖ коррелирует с заболеваемостью, т.е. она высока в регионах с высокой заболеваемостью и низка там, где заболеваемость низкая (рис. 3, 4). Так, самая высокая смертность от РПЖ у мужчин в Еврейской автономной области составила 20,88, в Ненецком автономном округе – 17,27, низкая – в Чеченской Республике (2,15). Показатели смертности от РПЖ у женщин в России также значительно варьируют: лидирует Ненецкий автономный округ (9,94), далее следуют Сахалинская область (8,64), Амурская область (8,6), самая низкая смертность – в Республике Ингушетия (0,96) [8].
Показатели заболеваемости и смертности от РПЖ практически не отличаются друг от друга. 5-летняя выживаемость больных РПЖ в России не превышает 1 %. В некоторые годы смертность выше заболеваемости, что указывает на недоучет при жизни больных РПЖ [9]. В России наблюдается рост заболеваемости и смертности от РПЖ как у мужчин, так и у женщин. На графиках (рис. 5) представлена динамика заболеваемости и смертности от РПЖ в России среди мужчин и женщин. С 1990 г. заболеваемость и смертность от РПЖ у мужчин выросла примерно на 50 %. Наиболее
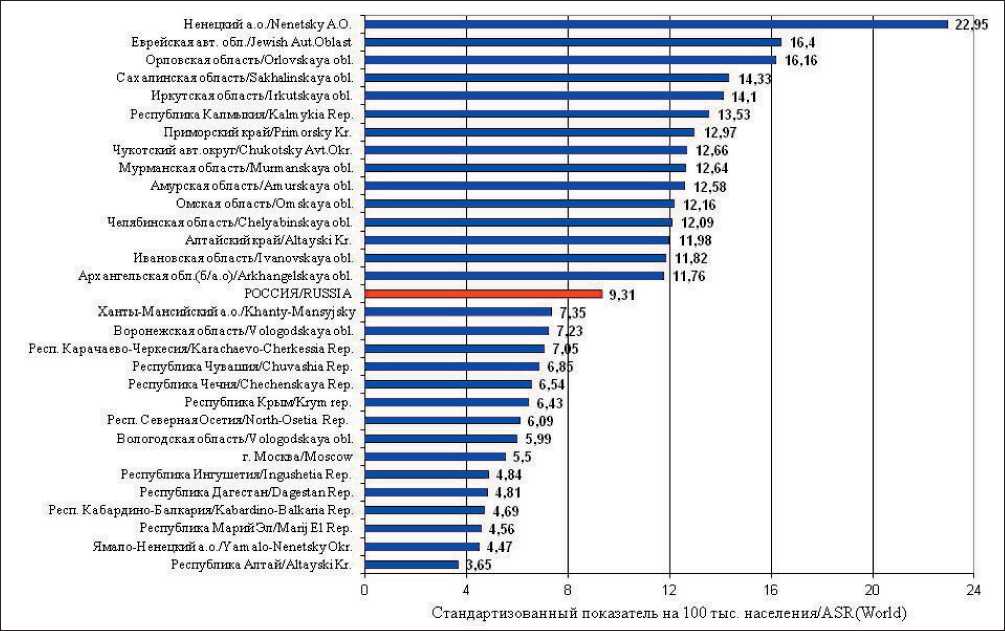
Рис. 1. Регионы России с наибольшей и наименьшей заболеваемостью раком поджелудочной железы, мужчины, 2019 г. (скорректированный по стандартному мировому населению показатель на 100 000 населения).
Fig. 1. Regions of Russia with the highest and lowest incidence of pancreatic cancer in men in 2019 (standardized rate per 100,000 population)
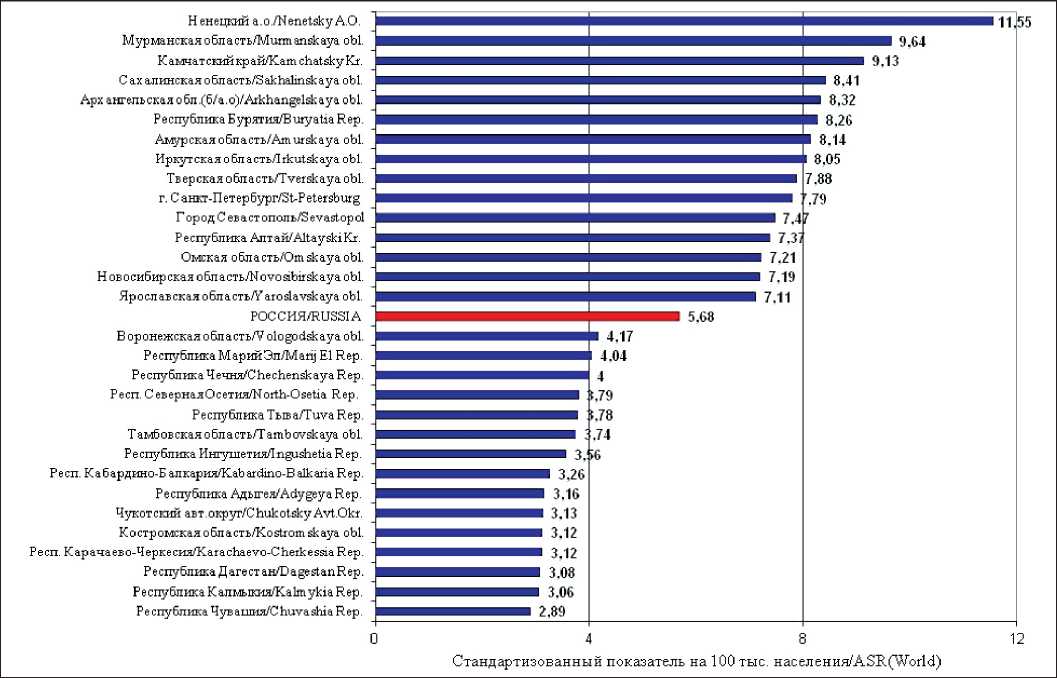
Рис. 2. Регионы России с наибольшей и наименьшей заболеваемостью раком поджелудочной железы, женщины, 2019 г. (скорректированный по стандартному мировому населению показатель на 100 000 населения)
Fig. 2. Regions of Russia with the highest and lowest incidence of pancreatic cancer in women in 2019 (standardized rate per 100,000 population)
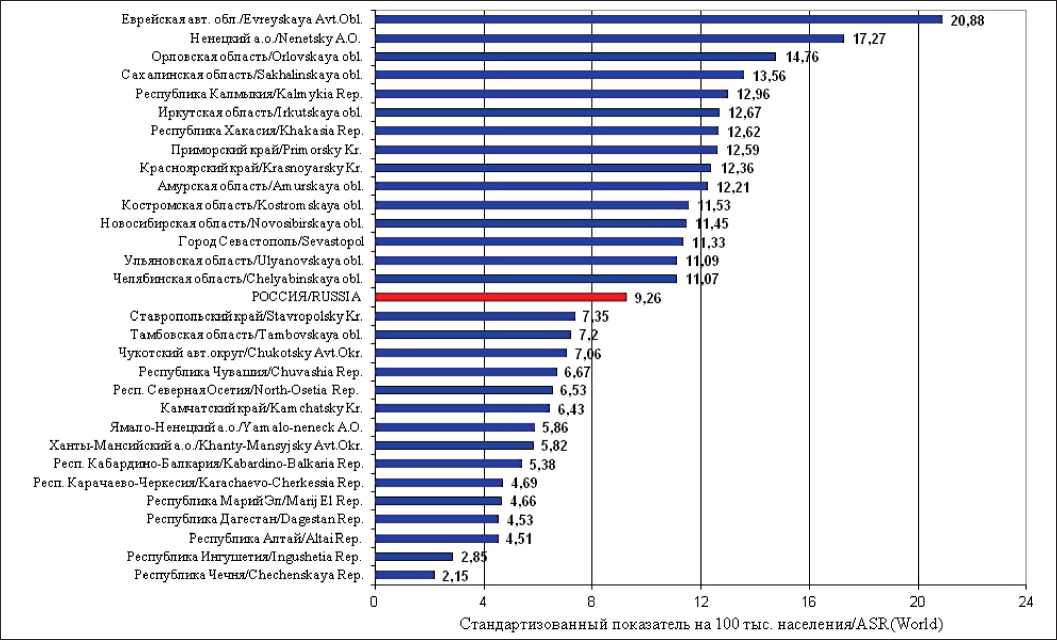
Рис. 3. Регионы России с наибольшей и наименьшей смертностью от рака поджелудочной железы, мужчины, 2019 г. (скорректированный по стандартному мировому населению показатель на 100 000 населения) Fig. 3. Regions of Russia with the highest and lowest mortality from pancreatic cancer in men in 2019 (standardized rate per 100,000 population)
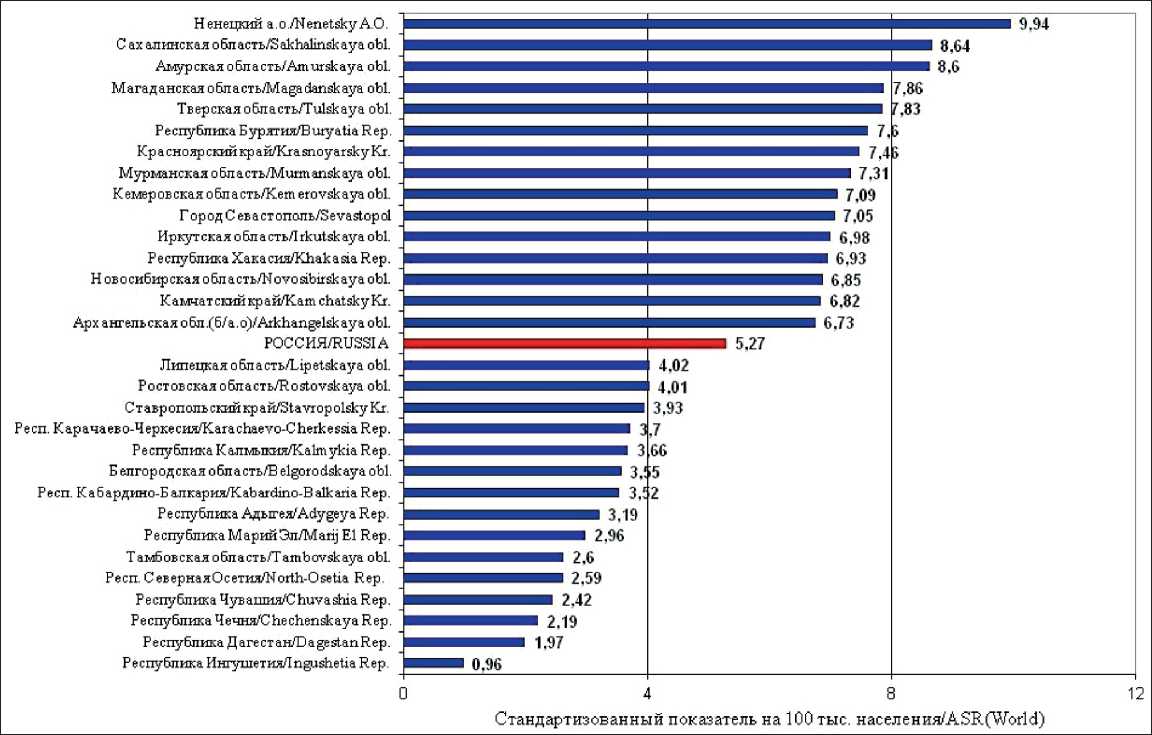
Рис. 4. Регионы России с наибольшей и наименьшей смертностью от рака поджелудочной железы, женщины, 2019 г. (скорректированный по стандартному мировому населению показатель на 100 000 населения)
Fig. 4. Regions of Russia with the highest and lowest mortality from pancreatic cancer in women in 2019 (standardized rate per 100,000 population)
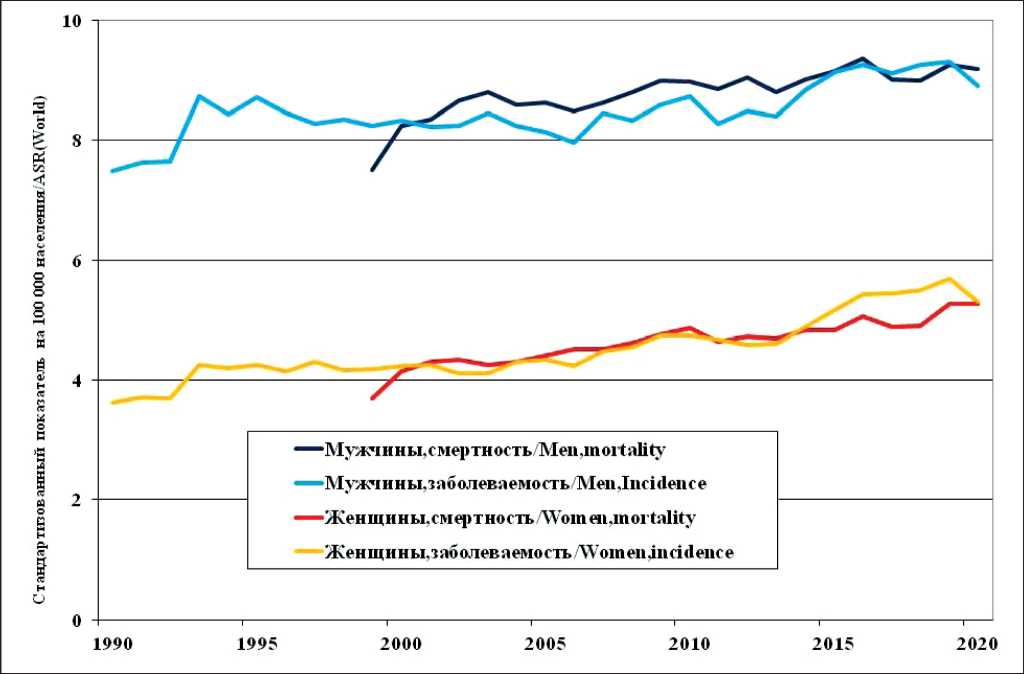
Рис. 5. Динамика заболеваемости и смертности раком поджелудочной железы в России (скорректированный по стандартному мировому населению показатель на 100 000 населения) Fig. 5. Trends in pancreatic cancer incidence and mortality in Russia (standardized rate per 100,000 population)
выраженный рост заболеваемости и смертности от РПЖ наблюдается у женщин: заболеваемость, и смертность от РПЖ выросла в 2 раза. По-видимому, это гендерное различие в динамике показателей связано с более широким распространением факторов риска РПЖ среди женщин. Например, распространенность ожирения значительно выше среди российских женщин по сравнению с мужчинами [10].
РПЖ, как правило, является болезнью пожилых людей, поскольку 90 % вновь диагностированных пациентов старше 55 лет [5]. Анализ смертности по возрастным группам показал рост смертности в старших возрастных группах (60–64, 65–69, 70–74, 75–79) как у мужчин, так и у женщин. В более молодых возрастных группах (35–39, 40–44, 45–49, 50–54, 55–60) тенденции роста не наблюдаются.
Факторы риска РПЖ
Курение
Курение является основной доказанной причиной РПЖ [11]. Причинная связь между курением и риском развития РПЖ выявлена как в ретроспективных, так и в проспективных исследованиях. Атрибутивный риск РПЖ, связанный с курением, составляет 20–25 % [12]. Обзор последних работ показал, что риск развития РПЖ у курильщиков в 1,5–2 раза выше по сравнению с некурящими. По результатам крупного метаанализа, который объединил данные 20 когорных исследований, риск РПЖ у курящих составил 1,56 (95 % доверительный интервал (95 % ДИ) 1,34–1,83), у бросивших курить лиц – 1,15 (95 % ДИ 1,06–1,26) по сравнению с теми, кто никогда не курил [13]. Этот эффект курения не зависел от употребления алкоголя, индекса массы тела и наличия диабета. Кроме того, в этом исследовании была выявлена дозо-зависимая связь между интенсивностью курения, количеством сигарет, выкуренных в течение жизни, длительностью курения и смертностью от РПЖ.
Другой метаанализ 78 эпидемиологических исследований показал, что относительный риск (ОР) РПЖ повышен в 1,8 раза у курящих (95 % ДИ 1,7–1,9) и в 1,2 раза (95 % ДИ 1,1–1,2) у бросивших курить лиц по сравнению с некурящими [14]. Показатель ОР повышался с ростом количества выкуриваемых сигарет в день (для куривших 30 сигарет в день ОР 2,2; 95 % ДИ 1,9–2,4) и длительности курения (для куривших более 30 лет ОР 1,8; 95 % ДИ 1,6–2,0). Риск РПЖ снижался через несколько лет после отказа от курения, однако для достижения уровня некурящих потребовалось до 20 лет.
Алкоголь
Чрезмерное употребление алкоголя повышает риск РПЖ, в то время как влияние средних и низких доз алкоголя на риск РПЖ до сих пор неясно. Основываясь на многих исследованиях, ученые пришли к выводу, что риск РПЖ увеличивается при чрезмерном потреблении алкоголя (более 3 доз (25 мл) спиртных напитков в день), тогда как связи с умеренным и низким потреблением алкоголя обнаружено не было [15]. Повышение риска РПЖ было выявлено у лиц, пьющих крепкие спиртные напитки. Пиво и вино на риск РПЖ не влияют. Курение усиливает эффект чрезмерного потребления алкоголя на риск РПЖ. Недавно опубликованное исследование показало [16], что чрезмерное потребление алкоголя у курильщиков повышало риск РПЖ в 4 раза (ОР 4,04, 95 % ДИ 1,58–10,37), тогда как у лиц, которые никогда не курили, риск был в 2 раза ниже (ОР 2,01, 95 % ДИ: 0,50–8,18) [16].
Избыточный вес и ожирение
Ожирение является одним из признанных факторов риска РПЖ. Рабочая группа Международного агентства по изучению рака (МАИР) пришла к заключению, что «полнота тела», которая включает избыточный вес (индекс массы тела (ИМТ) 25,0–29,9 кг/м2) и ожирение (ИМТ≥30 кг/м2), повышает риск РПЖ [17]. Основанием для такого вывода послужили многочисленные работы, посвященные этой проблеме. Так, в исследовании, в которое вошли 8769 случаев РПЖ и 7055 контрольных лиц, показан повышенный риск РПЖ в группе с самым высоким квартилем ИМТ по сравнению с группой с самым низким квартилем (ОР 1,43, 95 % ДИ 1,20–1,71) [18]. Установлено, что риск РПЖ повышается на 10 % с увеличением ИМТ на каждые 5 кг/м2 (ОР 1,10, 95 % ДИ 1,07–1,14). Кроме того, наличие избыточного веса и ожирения в детском и юношеском возрасте повышало заболеваемость и смертность от РПЖ в более позднем возрасте [19].
Питание
Всемирный фонд исследований рака/Американ-ский институт исследований рака (WCRF/AICR) в своем отчете о РПЖ за 2012 г. отметил, что доказательства, подтверждающие связь между факторами питания и РПЖ, ограничены [20]. Несколько исследований показали, что потребление «красного» мяса и обработанного мяса (колбасы, ветчины) повышает риск РПЖ [21, 22]. В 2017 г. проведен метаанализ, который объединил 28 исследований, как когортные проспективные исследования, так и ретроспективные, методом случай-контроль. Метаанализ когортных исследований выявил положительную связь между заболеваемостью РПЖ и высоким потреблением красного (100 г/день) или обработанного мяса (50 г/день) (р<0,01) у мужчин. Результаты анализа объединенных данных исследований «случай-контроль» показали, что потребление «красного» мяса и обработанного мяса статистически достоверно связано с риском РПЖ для обоих полов (р=0,02 и р<0,01 соответственно) [22]. Обработанное мясо часто содержит нитраты, из которых в организме в результате реакции с аминами образуются канцерогенные нитрозо(а)амины, которые действуют как мощные мутагены [23].
Потребление овощей и фруктов, особенно цитрусовых, оказывает защитное действие, снижая риск на 38 % (95 % ДИ 0,54 – 0,73) и 29 % (95 % ДИ 0,59–0,84) соответственно [24]. Интересно, что в крупном британском когортном исследовании, опубликованном в 2016 г., смертность от РПЖ была ниже среди тех, кто ограничивал количество пищи в целом (примерно на 30–45 %), а также среди вегетарианцев и веганов (примерно на 50 %) по сравнению с обычными потребителями [25]. Известно, что пища с высоким содержанием клетчатки, потребление рыбы или средиземноморская диета обладают протективным эффектом от ряда онкологических заболеваний, однако в исследованиях, изучавших их влияние на РПЖ, этой связи не найдено [26].
Физическая активность
Исследования, изучающие связь между физическими нагрузками и РПЖ, дали противоречивые результаты. Метаанализ 26 исследований установил, что физическая активность в свободное время была связана с пониженным риском РПЖ (ОР 0,89, 95 % ДИ 0,82–0,96). Обратная связь была выявлена только в ретроспективных исследованиях «случай-контроль», но не в проспективных когортных исследованиях [27]. Проспективное когортное исследование, проведенное в США, не выявило связи между физической активностью и РПЖ, китайские исследователи выявили снижение риска РПЖ, связанного с физическими нагрузками среди мужчин (ОР 0,71, 95 % ДИ 0,50–1,00), но не среди женщин (ОР 1,06, 95 % ДИ 0,81–1,38) [28]. В целом, роль физических нагрузок в предотвращении возникновения РПЖ является неубедительной. Тем не менее физическая активность, в дополнение к здоровой диете, важна для предотвращения ожирения, которое является известным фактором риска РПЖ.
Сахарный диабет
В многочисленных исследованиях была показана положительная связь между диабетом I и II типа и РПЖ. В недавно опубликованном эпидемиологическом исследовании показано, что у пациентов с наличием в анамнезе сахарного диабета риск РПЖ повышен на 75 % [29]. Однако выводы исследователей по поводу причинно-следственной связи между РПЖ и диабетом разделились: сахарный диабет может как являться причиной развития РПЖ, так и быть следствием РПЖ и являться ранним маркером развития РПЖ. Анализ, объединяющий данные 15 исследований методом «случай-контроль», показал, что у пациентов, которым был диагностирован сахарный диабет менее 2 лет до диагноза РПЖ, риск РПЖ был повышен на
90 % (ОР 1,90, 95 % ДИ 1,72–2,09). В то время как у пациентов, которые страдали сахарным диабетом более 20 лет, риск РПЖ был повышен на 30 % (ОР 1,30, 95 % ДИ 1,03–1,63) [30]. Диабет и рак РПЖ имеют много общих факторов риска, таких как неправильное питание, отсутствие физической активности, курение и ожирение, которые затрудняют интерпретацию результатов исследований.
Панкреатит
Известно, что у больных, которые длительное время страдали хроническим панкреатитом, РПЖ развивается в 2,7–16 раз чаще, чем у людей с неотя-гощенным анамнезом. Однако только у 4 % пациентов с хроническим панкреатитом развивается РПЖ. Метаанализ, объединяющий данные 13 исследований, показал, что хронический панкреатит связан с повышенным риском РПЖ, диагностированным в течение 2 лет после диагноза хронического панкреатита (ОР 16,16, 95 % ДИ 12,59–20,73). Риск уменьшался с увеличением времени между постановкой диагноза хронического панкреатита и развитием РПЖ [31]. По данным A. Syed et al., панкреатит возник у 81,3 % пациентов за 3 мес до постановки диагноза РПЖ и у 98,9 % за 3 года [32]. Таким образом, исследователи пришли к выводу, что хронический панкреатит, как и сахарный диабет, может являться как фактором риска РПЖ, так и быть следствием РПЖ из-за возможной обструкции протоков опухолью и в данном случае может выступать в роли раннего маркера РПЖ.
Основными причинами хронического панкреатита являются чрезмерное употребление алкоголя, камни в желчном пузыре и аутоиммунные заболевания. Метаболические факторы, такие как ожирение и сахарный диабет, также играют важную роль в развитии как хронического панкреатита, так и РПЖ.
Микробиом и гигиена полости рта
Исследователи, изучавшие связь между состоянием полости рта (заболевания пародонта и потеря зубов) и риском РПЖ, пришли к выводу, что состояние полости рта влияет на риск РПЖ. Так, результаты недавнего исследования, которое включало примерно 40 000 афроамериканских женщин, выявили, что потеря зубов, пародонтоз или и то и другое повышают риск развития РПЖ [33].
Микробиом полости рта содержит более 700 различных видов бактерий и целый ряд других микроорганизмов (грибы и вирусы) [34]. Микробиом, выделенный из поджелудочной железы, аналогичен микробиому полости рта. Обнаружено, что Porphyromonas gingivalis, периодонтопатогенная бактерия, выживает внутри опухолевых клеток РПЖ, а высокие уровни сывороточных антител к этим бактериям были связаны с повышенным риском РПЖ. Микроорганизмы полости рта могут колонизировать поджелудочную железу через желудочно-кишечный тракт, особенно в случае панкреатита. Наличие бактерий способно оказывать влияние и на клиническое течение заболевания, поскольку бактерии, подобные видам Fusobacterium, в тканях опухоли коррелируют с плохим прогнозом РПЖ, а внутриопухолевые бактерии могут метаболизировать противоопухолевый препарат гемцитабин, тем самым снижая терапевтический эффект. Кроме того, предполагается, что особенности орального микробиома могут служить неинвазивным биомаркером РПЖ.
Кишечный микробиом также играет роль в развитии РПЖ [35]. E. Riquelme et al. при сравнении микробиома опухоли и кишечника обнаружили, что 25 % микробиома опухоли составляет микробиом кишечника, что указывает на способность микробиома кишечника специфически колонизировать опухоли поджелудочной железы [36]. S. Pushalkar et al. показали способность кишечных бактерий мигрировать в поджелудочную железу, что предполагает возможность прямого взаимодействия между кишечными бактериями и микроокружением поджелудочной железы [37].
Наследственность
По последним данным, 21,2 % случаев РПЖ являются наследственными [38]. У лиц, в семейном анамнезе которых имеется, по крайней мере, два родственника первой степени (мать, отец, брат, сестра) с РПЖ, риск РПЖ повышен почти в 2 раза [39].
Наследование генов с высокопенетрантными мутациями является причиной развития наследственных онкологических синдромов и, соответственно, повышенного риска злокачественных опухолей. В результате изучения семейных форм РПЖ были идентифицированы наследственные синдромы и связанные с ними гены, при которых повышен риск РПЖ. К ним относятся синдром наследственного рака молочной железы и яичников (мутация генов BRCA1 и BRCA2 ), герминогенная мутация PALB2 , семейная атипичная множественная меланома (мутация гена CDKN2A) , синдром Пейтца–Егерса (мутация гена STK11), наследственный панкреатит (ген PRSS1), синдром Ли–Фраумени (мутации TP53), семейный аденоматозный полипоз (APC), атаксии-телеангиоектазии (АТМ), синдром Линча (в основном мутации в генах MLH1, MSH2, MSH6 и PMS2 ). Риск развития РПЖ у пациентов с такими синдромами колеблется от 2 (синдром наследственного рака молочной железы и яичников) до 132 (синдром Пейтца–Егерса) [40].
Герминогенные мутации некоторых генов (PALLD, BRCA1, BRCA2, PALB2, FANCC, FANCG ATM, CDKN2A и CHEK2) выявлены у 15–20 % пациентов с наследственной формой РПЖ. У остальных 80–85 % пациентов наследственный РПЖ определялся наличием 2 и более родственников первой степени родства или 3 и более родственни- ков независимо от степени родства по одной линии семьи [38, 41]. Риск семейного РПЖ при наличии РПЖ по крайней мере у одного родственника первой степени родства возрастает в 2,3 раза, при наличии РПЖ у 2 родственников первой степени родства – в 6 раз, у 3 родственников – в 32 раза.
Генетические наследуемые мутации встречаются не только у пациентов с семейными формами РПЖ, но и у пациентов со спорадическим РПЖ. Так, в исследовании 306 пациентов с РПЖ у 14 выявлены мутации в BRCA1 или BRCA2, в то время как только у 2 из них в анамнезе был семейный рак [42]. Мутации генов CDKN2A, BRCA2, MLH1, TP53 и STK11 могут быть как герминогенными, так и соматическими, и, согласно гипотезе «двух ударов» Кнудсона (two-hit hypothesis), эти гены, вероятно, являются наиболее значимыми в развитии РПЖ [43]. Скорее всего, РПЖ является заболеванием с комбинацией наследственных и соматических мутаций.
Однонуклеотидный полиморфизм последовательностей
(single nucleotide polymorphism-SNP)
Для идентификации распространенных гер-миногенных вариантов низкого риска, а именно однонуклеотидных полиморфизмов (SNP), проводятся полногеномные исследования (Genome Wide Association Study (GWAS)) наследственного генома, которые без предварительной гипотезы с помощью микрочипов способны картировать многочисленный набор генов у большого числа пациентов. Риск развития рака, связанный с этим типом полиморфизма, невысок (не более 1,5), и доля РПЖ, связанная с определенным вариантом полиморфизма, зависит от частоты встречаемости этого варианта среди населения. Полногеномные исследования РПЖ были выполнены Консорциумом по изучению рака поджелудочной железы (PanScan) и Консорциумом по борьбе с раком поджелудочной железы (PanC4) с целью идентификации маркеров предрасположенности.
Первое полногеномное исследование РПЖ (PanScan I) было двухэтапным, включавшим 1896 случаев РПЖ и 1939 контролей, а также 2457 случаев и 2654 контроля на стадии репликации [44]. В результате идентифицирован SNP высокого риска (rs505922) на хромосоме 9q34.2 (ОР 1,20; 95 % ДИ 1,12–1,28), который был расположен в первом интроне гена у обладателей группы крови АВО. Исследователи установили, что Т/Т генотип SNP rs505922 (0 группа крови) является протективным фактором от РПЖ. Wolpin et al. (2010) на базе данных PanScan I показали, что у лиц с группами крови A был повышенный риск РПЖ по сравнению с лицами нулевой группы крови (ОР 1,38, 95 % ДИ 1,18–1,62), AB (ОР 1,47, 95 % ДИ 1,07–2,02) и B (ОР 1,53, 95 % ДИ 1,21–1,92) [45]. Несмотря на то, что ассоциация этого локуса с РПЖ была неоднократно воспроизведена в последующих исследованиях в европейских и азиатских популяциях, механизм влияния группы крови на риск ПРЖ остается неясен.
Согласно Каталогу GWAS, 32 локуса повышают риск развития РПЖ у европейского населения [46]. Кроме того, были выполнены два полногеномных исследования среди японского и китайского населения, результаты которых установили еще 8 локусов предрасположенности к РПЖ среди азиатской популяции.
Результаты полногеномных исследований расширили понимание процесса канцерогенеза РПЖ. Например, некоторые из установленных SNP, повышающих риск РПЖ, находятся в генах, участвующих в развитии и дифференцировке экзокринной поджелудочной железы. Так, 1q32. 1/NR5A2 (rs3790844, ОР 0,77, р=2,5×10-10) и 13q12.2/PDX1 (rs9581943, ОР 1,15 р=2,4×10-9) являются регуляторами транскрипции, играющими главную роль в развитии поджелудочной железы и экспрессии ацинарных генов, ген 13q22.1/KLF5 (rs9543325, ОР 1,26, р=3,27×10-11) регулирует клеточный цикл и трансформацию клетки, а ген 12q24.31/HNF1A (rs1182933, ОР 1,12, р=1,1×10-6 и rs7310409, ОР 1,11, р=6,3×10-7) регулирует клеточный цикл и апоптоз клеток и является геном-супрессором в канцерогенезе РПЖ [47].
Последний метаанализ данных, включающий 36 360 больных РПЖ и 54 752 контрольных лица, выявил статистически достоверную связь между TP53 rs9895829 (ОР 1,23, 95 % ДИ 1,14–1,33), VDR rs2228570 (ОР 1,98, 95 % ДИ 1,50–2,61) и CTLA-4 rs231775 (ОР 0,33, 95 % ДИ 0,22–0,49) и РПЖ [48].
Эпигенетические изменения при РПЖ
Установлено, что полиморфизм SNPs, выявленных в полногеномных исследованиях, часто не затрагивает изменения непосредственно в генах, а встречается в интронах или межгенных областях генома и влияет на эпигенетическую активность. На риск РПЖ влияют три отдельных взаимоуси-ливающих эпигенетических изменения: метилирование ДНК; дерегуляция уровня микроРНК; посттрансляционная модификации гистонов и ремоделирование хроматина.
Гиперметилирование приводит к повышению активности онкогенов или потере функции в генах-супрессорах опухоли и генах репарации ДНК. S.D. Henriksen et al. (2017) идентифицирована панель гиперметилированных генов (BMP3, RASSF1A, BNC1, MESTv2, TFPI2, APC, SFRP1 и SFRP2), которые значительно чаще встречаются при РПЖ по сравнению с доброкачественными опухолями и панкреатитом (p<0,001). В исследовании было установлено, что гиперметилированные внеклеточные ДНК в плазме крови обнаруживаются на всех стадиях РПЖ, однако пациенты с IV стадией отличаются значимо повышенным количеством гиперметилированных генов во внеклеточной ДНК по сравнению с I–III стадиями. Среднее количество гиперметилированных генов у больных с I, II и III стадией заболевания было практически одинаковым (ОР 7,09, 95 % ДИ 5,51–8,66; ОР 7,00, 95 % ДИ 5,93–8,07 и ОР 6,77, 95 % ДИ 5,08–8,46, соответственно), в то время как у больных с IV стадией РПЖ количество гиперметилированных генов возрастало (ОР 10,24; 95 % ДИ 8,88–11,60) [49].
За последние десятилетия проведено большое количество исследований, посвященных роли малых, не кодирующих белок молекул РНК (микроРНК) в канцерогенезе РПЖ. Семейство генов микроРНК составляет 3 % от всего генома человека, но регулирует экспрессию 20–30 % всех генов, которые играют роль в регуляции онкогенеза, апоптозе клеток, их пролиферации, инвазии, эпителиально-мезенхимальном переходе, метастазировании и химиорезистентности. Исследователи определили 95 микроРНК, экспрессия которых изменяется при РПЖ. Так, определение профиля экспрессии микроРНК установило, что уровни miRNA-10b, miRNA-21, miRNA-30c, miRNA-181a и miRNA-17-5p были значительно выше у больных РПЖ по сравнению с группой контрольных лиц. В то же время низкий уровень miRNA-155 и miRNA-196a и miRNA-let7a был значительно ниже у пациентов РПЖ по сравнению с контрольной группой [50].
Модификация гистонов с помощью ферментов изменяет структуру хроматина и его функции, а также влияет на контроль за репликацией ДНК, ее репарацией и транскрипцией. Потеря триметилирования лизина в позиции 9 на гистоне 3 (H3K9) увеличивает вероятность метастазирования РПЖ, а триметилирование лизина 27 (H3K27me3) было связано с плохим прогнозом у пациентов с РПЖ. Триметилирование лизина в позиции 4 гистона 3 (H3K4me3) ассоциировано с прогрессированием РПЖ [51]. Повышенная активность гистондеацетилаз часто встречается при РПЖ и может привести к снижению модификаций ацетилирования гистонов, что, в свою очередь, приводит к репрессии генов-супрессоров p27 и p53. Кроме того, ферменты, модифицирующие гистоны, действуют только на одну или несколько гистоновых меток, что делает их идеальными мишенями для таргет-ной терапии.
Соматические мутации при РПЖ
Накопление мутаций ключевых генов приводит к злокачественной трансформации эпителия поджелудочной железы. С генетической точки зрения РПЖ представляет собой полигенное заболевание, при котором ряд генов изменяется с помощью различных механизмов, включая точечные мутации, хромосомные аберрации и эпигенетические ме- ханизмы. Наиболее часто мутируют четыре гена, также называемые «генетические горные вершины РПЖ»: онкоген KRAS и гены-супрессоры опухолей TP53, CDKN2A и SMAD4 [51]. Мутации этих генов отмечены еще на этапах предопухолевых поражений поджелудочной железы, к которым относятся внутриэпителиальные неоплазии (PanIN), внутрипротоковые сосочковые муцинозные неоплазии (IPMN) и муцинозные кистозные опухоли. Большинство РПЖ развивается из PanIN, микроскопического внутриэпителиального повреждения, которое обнаруживается в поджелудочной железе при инвазивном раке в 80 % случаев и классифицируется в зависимости от степени дисплазии от низкой (PanIN 1) до высокой степени (PanIN 3).
В зависимости от частоты соматические мутации при РПЖ можно подразделить на часто и редко встречающиеся. К часто встречающимся мутациям относится мутация драйверных генов (driver-gene) РПЖ. Наиболее часто мутирующим геном при РПЖ (>90 % случаев) является KRAS, онкоген, локализованный на коротком плече 12-й хромосомы (12p12.1). Он стимулирует некоторые внутриклеточные сигнальные пути, такие как MAPK и PI3K, контролирующие пролиферацию, метаболизм, миграцию и апоптоз клеток. Примечательно, что до сих пор попытки ингибировать активность мутантного KRAS-онкопротеина были безуспешными, что, возможно, и является одной из важных причин высокой смертности при РПЖ. Совсем недавно появились новые данные о KRAS (G12C)-селективных ингибиторах, что, возможно, улучшит перспективу лечения этих опухолей. Мутации KRAS являются инициирующим генетическим событием для РПЖ, т. к. они обнаруживаются на самых ранних этапах предопухолевых поражений, таких как PanIN и IPMN, с низкой степенью дисплазии [52].
CDKN2A является геном-супрессором опухоли, расположенным на хромосоме 9 (9p21), и его инактивация отмечается в 95 % случаев РПЖ. P16, белок, кодируемый этим геном, регулирует цикл клетки путем активации белка ретинобластомы. Изменение этого сигнального пути способствует неконтролируемому росту клеток и прогрессированию опухоли. Мутации CDKN2A представляют собой более позднее, следующее за мутацией KRAS, событие в онкогенезе РПЖ [52].
Ген-супрессор опухолевого роста TP53 находится на хромосоме 17р13.1 и мутирует от 50–60 до 80 % случаев РПЖ [52]. Этот ген кодирует Р53, важнейший белок, который контролирует рост клеток, обмен веществ, старение, репарацию ДНК и апоптоз в ответ на различные типы клеточных и внеклеточных процессов, таких как гипоксия и повреждение ДНК. Подобно мутациям KRAS, изменения TP53 в настоящее время считаются «неубиваемыми» с терапевтической точки зрения, что является еще одним объяснением высокой смертности при РПЖ. Мутации TP53 можно классифицировать как позднее событие в канцерогенезе РПЖ: они были обнаружены в PanIN и IPMN с выраженной дисплазией или только в инфильтрирующем компоненте РПЖ.
Изменения гена-супрессора опухоли SMAD4, расположенного на хромосоме 18q21, встречаются в 30–60 % случаях РПЖ [52]. Этот ген инактивируется гомозиготной делецией или внутригенными мутациями, сопровождающимися потерей второго аллеля. Белок, кодируемый SMAD4, является эффектором сигнального пути трансформирующего фактора роста-β (TGF-β). Мутации SMAD4 и последующие нарушения этого пути приводят к пролиферативному эффекту и активации процесса эпителиально-мезенхимального перехода. При этом опухолевые клетки теряют свои эпителиальные свойства и приобретают «мезенхимальный» фенотип, который необходим для сосудистой инвазии и общего метастазирования. Показано, что мутации SMAD4 увеличивают способность клеток РПЖ к колонизации в отдаленных органах. Мутации этого гена встречаются при метастатическом, и обычно отсутствуют при локализованном РПЖ. Мутации SMAD4 также можно отнести к поздним событиям в онкогенезе РПЖ. Таким образом, по мере прогрессирования предопухолевого повреждения поджелудочной железы происходит постепенное накопление мутаций: от KRAS и p16/ CDKN2A на стадиях PanIN 1 и 2 до мутаций TP53 и SMAD4 , которые появляются на стадии PanIN 3 и при инвазивном раке.
Гены в опухолевых клетках РПЖ, мутация которых встречается с меньшей частотой, их называют «генетическими холмами РПЖ» в генетическом ландшафте РПЖ, идентифицируются как «пассажирские» мутации [53]. К ним относятся мутации в генах AIB1/NCOA, ERBB2/HER2/EGFR2, AKT2, BRAF, CCND1, RB1 и др. В то же время комбинированный эффект полиморфизма этих генов может быть существенным и сравнимым с влиянием драйвер-генов.
РПЖ является генетически гетерогенным заболеванием. В среднем, в каждой опухоли поджелудочной железы выявляется 63 генных изменения, что усложняет разработку панели маркеров для ранней диагностики и выработку единой тактики лечения.
Мутационные сигнатуры
Существенным недостатком нашего понимания процесса канцерогенеза является отсутствие информации о том, какие именно канцерогенные факторы приводят к тем или иным конкретным мутациям, т. е. образованию мутационных сигнатур. Под этим термином имеется в виду комплекс мутаций, причину которой мы знаем, т. е. мы знаем, что она произошла в результате воздействия конкретного канцерогенного вещества или фактора. Для изучения мутационных сигнатур злокачественных опухолей, идентификации онкогенных мутаций для ранней диагностики и классификации опухолей в соответствии с паттернами генетических изменений был осуществлен проект «Полногеномный анализ злокачественных опухолей» (проект Pan-Cancer Analysis of Whole Genomes (PCAWG)). Участниками проекта было проанализировано около 5 млн мутаций 7 042 генома из каталога мутаций с 30 самыми распространенными видами рака [54]. Этот анализ позволил выявить более 20 мутационных сигнатур.
Для РПЖ было идентифицировано 6 мутационных сигнатур – 1В, 2, 3, 5, 6 и 13. Сигнатура 1В встречается в большинстве видов рака и коррелирует с возрастом пациентов, т. е. с большой долей вероятности, появление этой сигнатуры – следствие старения организма. Сигнатура 2 может быть результатом аномальной активности ферментов, которые модифицируют ДНК – семейства APOBEC. Однако причина экстремальной активации этого мутационного процесса при РПЖ неизвестна. Сигнатура 13 часто встречается в образцах, в которых присутствует сигнатура 2, и, по-видимому, также связана с активностью ферментов семейства APOBEC. Сигнатура 3 является результатом дефектов репарации ДНК из-за мутаций в генах-супресорах BRCA 1 и 2. Наличие сигнатуры 3 было тесно связано с мутациями BRCA1 и BRCA2 при РПЖ. Этиология сигнатуры 5 до сих пор неизвестна. И наконец, сигнатура 6 ассоциирована с нарушениями в поддержании стабильности ДНК и ее дефектного восстановления. Кроме того, отдельные регионы генома содержат множество мутаций, и это явление, которое исследователи назвали категис (kataegis), присутствует почти во всех видах рака, в т. ч. при РПЖ. Дополненные данные о мутационных сигнатурах опубликованы в Каталоге соматических мутаций при раке, COSMIC, доступном по адресу:
Таким образом, благодаря новым биоинженерным технологиям ученые приблизились к пониманию канцерогенеза РПЖ. Однако, несмотря на прорыв в генной биоинженерии, проблемы возникновения РПЖ и его резистентность к лечению остаются открытыми. Для разрешения в т. ч. и этих
Список литературы Описательная, аналитическая и молекулярная эпидемиология рака поджелудочной железы
- Cancer Today: Data visualization tool for exploring the global cancer burden in 2020 [Internet]. 2020 International Agency for Research on Cancer, Lyon France. [cited 2021 June 26]. URL: http:.gco.iarc.fr/ today/home.
- RahibL., SmithB.D., AizenbergR., RosenzweigA.B., Fleshman J.M., Matrisian L.M. Projecting cancer incidence and deaths to 2030: the unexpected burden of thyroid, liver, and pancreas cancers in the United States. Cancer Res. 2014; 74(11): 2913-21. doi: 10.1158/0008-5472. CAN-14-0155.
- SiegelR.L., MillerK.D., Jemal A. Cancer statistics, 2020. CA Cancer J Clin. 2020; 70(1): 7-30. doi: 10.3322/caac.21590.
- National Cancer Institute SEER Stat Fact Sheets: Pancreas Cancer [Internet] [cited 2007 Feb 21]. URL: https://seer.cancer.gov/statfacts/html/ pancreas.html.
- GBD 2017Pancreatic Cancer Collaborators. The global, regional, and national burden of pancreatic cancer and its attributable risk factors in 195 countries and territories, 1990-2017: a systematic analysis for the Global Burden ofDisease Study 2017. Lancet Gastroenterol Hepatol. 2019; 4(12): 934-47. doi: 10.1016/S2468-1253(19)30347-4.
- Capasso M., Franceschi M., Rodriguez-Castro K.I., Crafa P., Cambiè G., Miraglia C., Barchi A., Nouvenne A., Leandro G., Meschi T., De' Angelis G.L., Di Mario F. Epidemiology and risk factors of pancreatic cancer. Acta Biomed. 2018; 89(9): 141-6. doi: 10.23750/abm. v89i9-S.7923.
- Windarti N., Hlaing S.W., Kakinaka M. Obesity Kuznets curve: international evidence. Public Health. 2019;169: 26-35. doi: 10.1016/j. puhe.2019.01.004.
- Злокачественные новообразования в России в 2019 году (заболеваемость и смертность). Под ред. А.Д. Каприна, В.В. Старинского, А.О. Шахзадовой. М., 2019, 250 с. [Malignant neoplasms in Russia in 2019 (morbidity and mortality). Eds. A.D. Kaprin, V.V. Starinskiy, A.O. Shakhzadova. Moscow, 2019, 250 p. (in Russian)].
- Заридзе Д.Г., Каприн А.Д., Стилиди И.С. Динамика заболеваемости и смертности от злокачественных новообразований в России. Вопросы онкологии. 2018; 64(5): 578-91. [Zaridze D.G., Kaprin A.D., Stilidi I.S. Dynamics of morbidity and mortality from malignant neoplasms in Russia. Problems in Oncology. 2018; 64(5): 578-91. (In Russian)]. doi: 10.37469/0507-3758-2018-64-5-578-591.
- БалановаЮ.А., Шальнова С.А., Деев А.Д., ИмаеваА.Э., Концевая А.В., Муромцева Г.А., Капустина А.В., Евстифеева С.Е., Драпки-на О.М., Бойцов С.А., ГомырановаН.В., ЖернаковаЮ.В., Константинов В.В., МамедовМ.Н., МетельскаяВ.А., Оганов Р.Г., СувороваЕ.И., ХудяковМ.Б., Ощепкова Е.В., Баранова Е.И. Ожирение в российской популяции - распространенность и ассоциации с факторами риска хронических неинфекционных заболеваний. Российский кардиологический журнал. 2018; 23(6): 123-30. [Balanova Yu.A., Shal 'nova S.A., Deev A.D., Imaeva A.E., Kontsevaya A.V., Muromtseva G.A., Kapusti-na A.V., Evstifeeva S.E., Drapkina O.M., Boitsov S.A., Gomyranova N.V., Zhernakova Yu.V., Konstantinov V.V., MamedovM.N., Metel'skaya V.A., Oganov R.G., Suvorova E.I., Khudyakov M.B., Oshchepkova E.V., Barano-va E.I. Obesity in Russian population — prevalence and association with the non-communicable diseases risk factors. Russ J Cardiol. 2018; 23(6): 123-30. (in Russian)]. doi: 10.15829/1560-4071-2018-6-123-130.
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Tobacco smoke and involuntary smoking. IARC Monogr Eval Carcinog Risks Hum. 2004; 83: 1-1438.
- Raimondi S., Maisonneuve P., Lowenfels A.B. Epidemiology of pancreatic cancer: an overview. Nat Rev Gastroenterol Hepatol. 2009; 6(12): 699-708. doi: 10.1038/nrgastro.2009.177.
- Ben Q.W., Liu J., Sun Y.W., Wang L.F., Zou D.W., Yuan Y.Z. Cigarette Smoking and Mortality in Patients With Pancreatic Cancer: A Systematic Review and Meta-analysis. Pancreas. 2019; 48(8): 985-95. doi: 10.1097/MPA.0000000000001383.
- Lugo A., Peveri G., Bosetti C., Bagnardi V., Crippa A., Orsini N., Rota M., Gallus S. Strong excess risk of pancreatic cancer for low frequency and duration of cigarette smoking: A comprehensive review and meta-analysis. Eur J Cancer. 2018; 104: 117-26. doi: 10.1016/j. ejca.2018.09.007.
- Vanella G., Archibugi L., Stigliano S., Capurso G. Alcohol and gastrointestinal cancers. Curr Opin Gastroenterol. 2019; 35(2): 107-13. doi: 10.1097/M0G.0000000000000502.
- Rahman F., Cotterchio M., Cleary S.P., Gallinger S. Association between alcohol consumption and pancreatic cancer risk: a case-control study. PLoS One. 2015; 10(4). doi: 10.1371/journal.pone.0124489.
- Lauby-Secretan B., Scoccianti C., Loomis D., Grosse Y., Bianchi-ni F., Straif K.; International Agency for Research on Cancer Handbook Working Group. Body Fatness and Cancer--Viewpoint of the IARC Working Group. N Engl J Med. 2016; 375(8): 794-8. doi: 10.1056/ NEJMsr1606602.
- Lu Y., Gentiluomo M., Lorenzo-Bermejo J., Morelli L., Obazee O., Campa D., Canzian F. Mendelian randomisation study of the effects of known and putative risk factors on pancreatic cancer. J Med Genet. 2020; 57(12): 820-8. doi: 10.1136/jmedgenet-2019-106200.
- Zohar L., Rottenberg Y., Twig G., Katz L., Leiba A., Derazne E., Tzur D., Eizenstein S., Keinan-Boker L., Afek A., Kark J.D. Adolescent overweight and obesity and the risk for pancreatic cancer among men and women: a nationwide study of 1.79 million Israeli adolescents. Cancer. 2019; 125(1): 118-26. doi: 10.1002/cncr.31764.
- Diet, Nutrition, Physical Activity and Cancer: a Global Perspective. [Internet]. World Cancer Research Fund & American Institute for Cancer Research, Third Expert Report. [cited 2021 July 27]. URL: https://www. wcrf.org/dietandcancer/pancreatic-cancer/.
- Larsson S.C., WolkA. Red and processed meat consumption and risk of pancreatic cancer: meta-analysis of prospective studies. Br J Cancer. 2012; 106(3): 603-7. doi: 10.1038/bjc.2011.585.
- Zhao Z., Yin Z., Pu Z., Zhao Q. Association Between Consumption of Red and Processed Meat and Pancreatic Cancer Risk: A Systematic Review and Meta-analysis. Clin Gastroenterol Hepatol. 2017; 15(4): 486-93. doi: 10.1016/j.cgh.2016.09.143.
- Beaney A.J., Banim P.J.R., Luben R., Lentjes M.A.H., Khaw K.T., Hart A.R. Higher meat intake is positively associated with higher risk of developing pancreatic cancer in an age-dependent manner and are modified by plasma antioxidants: a prospective cohort study (EPIC-Norfolk) using data from food diaries. Pancreas. 2017; 46(5): 672-8. doi: 10.1097/ MPA.0000000000000819.
- Paluszkiewicz P., Smolinska K., D^binska I., Turski W.A. Main dietary compounds and pancreatic cancer risk. The quantitative analysis of case-control and cohort studies. Cancer Epidemiol. 2012; 36(1): 60-7. doi: 10.1016/j.canep.2011.05.004.
- Appleby P.N., Crowe F.L., Bradbury K.E., Travis R.C., Key T.J. Mortality in vegetarians and comparable nonvegetarians in the United Kingdom. Am J Clin Nutr. 2016; 103(1): 218-30. doi: 10.3945/ ajcn.115.119461.
- Schulpen M., Peeters P.H., van den Brandt P.A. Mediterranean diet adherence and risk of pancreatic cancer: A pooled analysis of two Dutch cohorts. Int J Cancer. 2019; 144(7): 1550-60. doi: 10.1002/ijc.31872.
- Farris M.S., Mosli M.H., McFadden A.A., Friedenreich C.M., Brenner D.R. The Association between Leisure Time Physical Activity and Pancreatic Cancer Risk in Adults: A Systematic Review and Metaanalysis. Cancer Epidemiol. Biomarkers Prev. 2015; 24(10): 1462-73. doi: 10.1158/1055-9965.EPI-15-0301.
- Wu L, Zheng W, Xiang Y.B., Gao Y.T., Li H.L., Cai H, ShuX.O. Physical Activity and Pancreatic Cancer Risk among Urban Chinese: Results from Two Prospective Cohort Studies. Cancer Epidemiol. Biomarkers Prev. 2018; 27(4): 479-87. doi: 10.1158/1055-9965.EPI-17-0895.
- Goto A., Yamaji T., Sawada N., Momozawa Y., Kamatani Y., KuboM., Shimazu T., InoueM., NodaM., Tsugane S., IwasakiM. Diabetes and cancer risk: A Mendelian randomization study. Int J Cancer. 2020; 146(3): 712-9. doi: 10.1002/ijc.32310.
- 30.Bosetti C., Rosato V., LiD., SilvermanD., Petersen G.M., BracciP.M., Neale R.E.,Muscat J.,Anderson K., Gallinger S., Olson S.H., Miller A.B., Bas Bueno-de-Mesquita H., Scelo G., Janout V., Holcatova I., Lagiou P., Serraino D., Lucenteforte E., Fabianova E., Baghurst P.A., Zatonski W., Foretova L., Fontham E., Bamlet W.R., Holly E.A., Negri E., Hassan M., Prizment A., Cotterchio M., Cleary S., Kurtz R.C., Maisonneuve P., Tricho-poulos D., Polesel J., Duell E.J., Boffetta P., La Vecchia C., Ghadirian P. Diabetes, antidiabetic medications, and pancreatic cancer risk: An analysis from the International Pancreatic Cancer Case-Control Consortium. Ann. Oncol. 2014; 25(10): 2065-72. doi: 10.1093/annonc/mdu276.
- Kirkegard J., MortensenF.V., Cronin-FentonD. Chronic Pancreatitis and Pancreatic Cancer Risk: A Systematic Review and Meta-analysis. Am J Gastroenterol. 2017; 112(9): 1366-72. doi: 10.1038/ajg.2017.218.
- Syed A., Babich O., ThakkarP., PatelA., Abdul-BakiH., Farah K., Morrissey S., MitreM., DhawanM., Kochhar G., Kulkarni A., Thakkar S. Defining Pancreatitis as a Risk Factor for Pancreatic Cancer: The Role, Incidence, and Timeline of Development. Pancreas. 2019; 48(8): 1098-1101. doi: 10.1097/MPA.0000000000001367.
- GerlovinH., MichaudD.S., Cozier Y.C., Palmer J.R. Oral Health in Relation to Pancreatic Cancer Risk in African American Women. Cancer Epidemiol. Biomarkers Prev. 2019; 28(4): 675-9. doi: 10.1158/1055-9965. EPI-18-1053.
- Zhang W., Zhang K., Zhang P., Zheng J., Min C., Li X. Research Progress of Pancreas-Related Microorganisms and Pancreatic Cancer. Front Oncol. 2021; 10. doi: 10.3389/fonc.2020.604531.
- ThomasR.M., Jobin C. Microbiota in pancreatic health and disease: the next frontier in microbiome research. Nat Rev Gastroenterol Hepatol. 2020; 17(1): 53-64. doi: 10.1038/s41575-019-0242-7.
- RiquelmeE., Zhang Y., ZhangL., MontielM., ZoltanM., Dong W., Quesada P., Sahin I., Chandra V., San Lucas A., Scheet P., Xu H., Hanash S.M., Feng L., Burks J.K., Do K.A., Peterson C.B., Nejman D., Tzeng C.D., Kim M.P., Sears C.L., Ajami N., Petrosino J., Wood L.D., Maitra A., Straussman R., KatzM., White J.R., Jenq R., Wargo J., McAllister F. Tumor Microbiome Diversity and Composition Influence Pancreatic Cancer Outcomes. Cell. 2019; 178(4): 795-806. doi: 10.1016/j. cell.2019.07.008.
- Pushalkar S., Hundeyin M., Daley D., Zambirinis C.P., Kurz E., Mishra A., MohanN., AykutB., UsykM., TorresL.E., Werba G., Zhang .K, Guo ., Li Q., Akkad N., Lall S., Wadowski B., Gutierrez J., Kochen Rossi J.A., Herzog J.W., Diskin B., Torres-Hernandez A., Leinwand J., Wang W., TaunkP.S., Savadkar S., JanalM., SaxenaA., LiX., CohenD., SartorR.B., Saxena D., Miller G. The Pancreatic Cancer Microbiome Promotes Onco-genesis by Induction of Innate and Adaptive Immune Suppression. Cancer Discov. 2018; 8(4): 403-16. doi: 10.1158/2159-8290.CD-17-1134.
- Chen F., Childs E.J., Mocci E., Bracci P., Gallinger S., Li D., NealeR.E., Olson S.H., Scelo G., Bamlet W.R., Blackford A.L., BorgesM., BrennanP., ChaffeeK.G., DuggalP., HassanM.J., HollyE. A., HungR.J., Goggins M.G., Kurtz R.C., Oberg A.L., Orlow I., Yu H., Petersen G.M., Risch H.A., Klein A.P. Analysis of Heritability and Genetic Architecture of Pancreatic Cancer: A PanC4 Study. Cancer Epidemiol Biomarkers Prev. 2019; 28(7): 1238-45. doi: 10.1158/1055-9965.EPI-18-1235.
- Greer J.B., Whitcomb D.C., Brand R.E. Genetic predisposition to pancreatic cancer: a brief review. Am J Gastroenterol. 2007; 102(11): 2564-9. doi: 10.1111/j.1572-0241.2007.01475.x.
- Syngal S., BrandR.E., Church J.M., GiardielloF.M., HampelH.L., Burt R.W.; American College of Gastroenterology. ACG clinical guideline: Genetic testing and management of hereditary gastrointestinal cancer syndromes. Am J Gastroenterol. 2015; 110(2): 223-62. doi: 10.1038/ ajg.2014.435.
- Stoffel E.M., McKernin S.E., Khorana A.A. Evaluating Susceptibility to Pancreatic Cancer: ASCO Clinical Practice Provisional Clinical Opinion Summary. J Oncol Pract. 2019; 15(2): 108-11. doi: 10.1200/ JOP.18.00629.
- Holter S., Borgida A., Dodd A., Grant R., Semotiuk K., Hedley D., Dhani N., Narod S., Akbari M., Moore M., Gallinger S. Germline BRCA Mutations in a Large Clinic-Based Cohort of Patients With Pancreatic Adenocarcinoma. J Clin Oncol. 2015; 33(28): 3124-9. doi: 10.1200/ JCO.2014.59.7401.
- Sikdar N., Saha G., Dutta A., Ghosh S., Shrikhande S.V., Banerjee S. Genetic Alterations of Periampullary and Pancreatic Ductal Adenocarcinoma: An Overview. Curr Genomics. 2018; 19(6): 444-63. doi: 10.2174 /1389202919666180221160753.
- AmundadottirL., Kraft P., Stolzenberg-SolomonR.Z., Fuchs C.S., Petersen G.M., Arslan A.A., Bueno-de-MesquitaH.B., GrossM., HelzlsouerK., JacobsE.J., LaCroix A., Zheng W., AlbanesD., Bamlet W., Berg C.D., Ber-rinoF., Bingham S., Buring J.E., BracciP.M., CanzianF., Clavel-Chape-lon F., Clipp S., Cotterchio M., de Andrade M., Duell E.J., Fox J.W. Jr, GallingerS., Gaziano J.M., GiovannucciE.L., GogginsM., GonzálezC.A., Hallmans G., Hankinson S.E., Hassan M., Holly E.A., Hunter D.J., Hutchinson A., Jackson R., Jacobs K.B., Jenab M., Kaaks R., Klein A.P., Kooperberg C., Kurtz R.C., Li D., Lynch S.M., Mandelson M., McWil-liams R.R., Mendelsohn J.B., Michaud D.S., Olson S.H., Overvad K., Patel A.V., Peeters P.H., Rajkovic A., Riboli E., Risch H.A., Shu X.O., Thomas G., Tobias G.S., Trichopoulos D., Van Den Eeden S.K., Virtamo J., Wactawski-Wende J., Wolpin B.M., Yu H., Yu K., Zeleniuch-Jacquotte A., Chanock S.J., Hartge P., Hoover R.N. Genome-wide association study identifies variants in the ABO locus associated with susceptibility to pancreatic cancer. Nat Genet. 2009; 41(9): 986-90. doi: 10.1038/ng.429.
- Wolpin B.M., Rizzato C., Kraft P., Kooperberg C., Petersen G.M., Wang Z., Arslan A.A., Beane-Freeman L., Bracci P.M., Buring J., Canzian F., Duell E.J., Gallinger S., Giles G.G., Goodman G.E., Goodman P.J., Jacobs E.J., KamineniA., KleinA.P., KolonelL.N., KulkeM.H., Li D., Malats N., Olson S.H., Risch H.A., Sesso H.D., Visvanathan K., White E., Zheng W., Abnet C.C., Albanes D., Andreotti G., Austin M.A., Barfield R., Basso D., Berndt S.I., Boutron-Ruault M.C., Brotzman M., BüchlerM. W., Bueno-de-MesquitaH.B., BugertP., BurdetteL., CampaD., Caporaso N.E., Capurso G., Chung C., Cotterchio M., Costello E., Elena J., Funel N., Gaziano J.M., Giese N.A., Giovannucci E.L., Goggins M., Gorman M.J., Gross M., Haiman C.A., Hassan M., Helzlsouer K.J., Henderson B.E., HollyE.A., HuN., HunterD.J., Innocenti F., JenabM., KaaksR., Key T.J., Khaw K.T., Klein E.A., Kogevinas M., Krogh V., Kupcinskas J., Kurtz R.C., LaCroix A., Landi M.T., Landi S., Le Marchand L., Mambri-ni A., Mannisto S., Milne R.L., Nakamura Y., Oberg A.L., Owzar K., Patel A. V., PeetersP.H., Peters U., PezzilliR., PiepoliA., PortaM., RealF.X., Riboli E., Rothman N., Scarpa A., Shu X.O., Silverman D.T., Soucek P., Sund M., Talar-Wojnarowska R., Taylor P.R., Theodoropoulos G.E., Thornquist M., Tj0nneland A., Tobias G.S., Trichopoulos D., Vodicka P., Wactawski-Wende J., Wentzensen N., Wu C., Yu H., Yu K., Zeleniuch-Jacquotte A., Hoover R., Hartge P., Fuchs C., Chanock S.J., Stolzenberg-SolomonR.S., AmundadottirL.T. Genome-wide association study identifies multiple susceptibility loci for pancreatic cancer. Nat Genet. 2014; 46(9): 994-1000. doi: 10.1038/ng.3052.
- Buniello A., MacArthur J.A.L., CerezoM., HarrisL. W., Hayhurst J., Malangone C., McMahon A., Morales J., Mountjoy E., Sollis E., Suveges D., Vrousgou O., WhetzelP.L., AmodeR., Guillen J.A., Riat H.S., Trevanion S.J., Hall P., Junkins H., Flicek P., Burdett T., Hindorff L.A., Cunningham F., ParkinsonH. The NHGRI-EBI GWAS Catalog of published genome-wide association studies, targeted arrays and summary statistics 2019. Nucleic Acids Res. 2019; 47(1): 1005-12. doi: 10.1093/nar/gky1120.
- Chen F., Roberts N.J., Klein A.P. Inherited Pancreatic Cancer. Chin Clin Oncol. 2017; 6(6): 58. doi: 10.21037/cco.2017.12.04.
- Ye Z.M., Li L.J., Luo M.B., Qing H.Y., Zheng J.H., Zhang C., Lu Y.X., Tang Y.M. A systematic review and network meta-analysis of single nucleotide polymorphisms associated with pancreatic cancer risk. Aging (Albany NY). 2020; 12(24): 25256-74. doi: 10.18632/aging.104128.
- Henriksen S.D., Madsen P.H., Larsen A.C., Johansen M.B., Pedersen I.S., Krarup H., Thorlacius-Ussing O. Promoter hypermethyla-tion in plasma-derived cell-free DNA as a prognostic marker for pancreatic adenocarcinoma staging. Int J Cancer. 2017; 141(12): 2489-97. doi: 10.1002/ijc.31024.
- Lai X., Wang M., McElyea S. D., Sherman S, House M., Korc M. A microRNA signature in circulating exosomes is superior to exosomal glypican-1 levels for diagnosing pancreatic cancer. Cancer Letters. 2017; 393: 86-93. doi: 10.1016/j.canlet.2017.02.019.
- Lu C, Paschall A. V., Shi H, SavageN, Waller J.L., Sabbatini M.E., Oberlies N.H., Pearce C., Liu K. The MLL1-H3K4me3 axis-mediated PD-L1 expression and pancreatic cancer immune evasion. J. Natl. Cancer Inst. 2017; 109(6). doi: 10.1093/jnci/djw283.
- Riva G., Pea A., Pilati C., Fiadone G., Lawlor R.T., Scarpa A., Luchini C. Histo-molecular oncogenesis of pancreatic cancer: From precancerous lesions to invasive ductal adenocarcinoma. World J Gastrointest Oncol. 2018; 10(10): 317-27. doi: 10.4251/wjgo.v10.i10.317.
- Pea A., Cheng L., Luchini C. Dissecting the molecular landscape of pancreatic cancer: Towards a precision medicine approach. Exp Rev Prec Med Drug Develop. 2019; 4: 113-9. doi: 10.1080/23808993.2019.160413.
- AlexandrovL.B., Nik-Zainal S., Wedge D.C., Aparicio S.A., Beh-jati S., Biankin A.V., Bignell G.R., Bolli N., Borg A., B0rresen-Dale A.L., Boyault S., BurkhardtB., Butler A.P., Caldas C., DaviesH.R., Desmedt C., Eils R., Eyfjörd J.E., Foekens J.A., GreavesM., Hosoda F., Hutter B., Ilicic T., Imbeaud S., Imielinski M., Jäger N., Jones D.T., Jones D., Knappskog S., KoolM., Lakhani S.R., Lopez-Otin C., Martin S., Munshi N. C., NakamuraH., Northcott P.A., Pajic M., Papaemmanuil E., Paradiso A., Pearson J.V., Puente X.S., Raine K., Ramakrishna M., Richardson A.L., Richter J., Rosenstiel P., Schlesner M., Schumacher T.N., Span P.N., Teague J.W., Totoki Y., Tutt A.N., Valdés-Mas R., van Buuren M.M., van 't Veer L., Vincent-Salomon A., Waddell N., Yates L.R.; Australian Pancreatic Cancer Genome Initiative; ICGC Breast Cancer Consortium; ICGC MMML-Seq Consortium; ICGC PedBrain, Zucman-Rossi J., Futreal P.A., McDer-mott U., Lichter P., Meyerson M., Grimmond S.M., Siebert R., Campo E., Shibata T., Pfister S.M., CampbellP.J., StrattonM.R. Signatures of mutational processes in human cancer. Nature. 2013; 500(7463): 415-21. doi: 10.1038/nature12477.
- Goggins M., Overbeek K.A., Brand R., Syngal S., Del Chiaro M., Bartsch D.K., Bassi C., Carrato A., Farrell J., Fishman E.K., Fockens P., Gress T.M., vanHooft J.E., HrubanR.H., KastrinosF., Klein A., Lennon AM, Lucas A., Park W., Rustgi A., Simeone D., Stoffel E., Vasen H.F.A., Cahen D.L., Canto M.I., Bruno M.; International Cancer of the Pancreas Screening (CAPS) consortium. Management of patients with increased risk for familial pancreatic cancer: updated recommendations from the International Cancer of the Pancreas Screening (CAPS) Consortium. Gut. 2020; 69(1): 7-17. doi: 10.1136/gutjnl-2019-319352.


