Определение чувствительности возбудителей сальмонеллеза Salmonella enteritidis и Salmonella typhimurium к антибактериальным препаратам с помощью метода проточной цитометрии
Автор: Замай Татьяна Николаевна, Савицкая Анна Геннадьевна, Замай Анна Сергеевна, Дубынина Анна Владимировна, Коловская Ольга Сергеевна, Решетнева Ирина Тимофеевна, Кузнецова Светлана Алексеевна, Замай Галина Сергеевна, Титова Надежда Митрофановна, Петрова Людмила Львовна, Труфанова Людмила Васильевна, Перьянова Ольга Владимировна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Влияние экологии на внутренние болезни
Статья в выпуске: 5-2 т.14, 2012 года.
Бесплатный доступ
Статья посвящена сравнению методов определения чувствительности сальмонелл Salmonella Enteritidis и Salmonella Typhimurium к антибактериальным препаратам – азитромицину, флемоксину, эритромицину и бетулину. С помощью классического бактериологического метода и метода проточной цитометрии с применением аптамеров показано, что сальмонеллы проявляют чувствительность ко всем препаратам, однако метод проточной цитометрии обладает важным преимуществом – быстротой определения и меньшими трудозатратами в сравнении с бактериологическим методом.
Чувствительность к антибиотикам, антибактериальные препараты
Короткий адрес: https://sciup.org/148201522
IDR: 148201522 | УДК: 616-036.22
Текст научной статьи Определение чувствительности возбудителей сальмонеллеза Salmonella enteritidis и Salmonella typhimurium к антибактериальным препаратам с помощью метода проточной цитометрии
отражающая общемировые тенденции. Из всех возбудителей кишечных инфекций наибольшую опасность представляют различные серотипы сальмонелл вследствие того, что они вызывают генерализацию инфекционного процесса, часто заканчивающегося эндартериитом, циррозом печени, менингитом, остеомиелитом, пневмонией и др. [11]. В настоящее время усиливается циркуляция полирезистентных штаммов сальмонелл [2, 3]. Поэтому, несмотря на то, что наиболее распространенным среди сальмонелл является серовар Salmonella Enteritidis , играющий основную роль в инфекционной патологии человека, большую опасность представляет серовар Salmonella Typhimurium , поскольку он проявляет устойчивость к некоторым антибиотикам, в частности, к амикацину. Заболевания, вызванные полирезистентными штаммами сальмонелл, отличаются более длительным инкубационным периодом и тяжелым течением заболевания, поскольку множественная лекарственная устойчивость бактерий является основной причиной, снижающей эффективность антибактериальной терапии. Разработка новых технологий определения лекарственной устойчивости бактерий к действию антибиотиков – одно из наиболее актуальных и востребованных направлений современной медицины. В настоящее время стала возможной диагностика различных бактериальных инфекций [7], в том числе и сальмонеллеза
[9, 10, 12] с помощью одноцепочечных ДНК аптамеров. Интерес к аптамерам растет, поскольку они, являясь функциональными аналогами естественных антител, способны заменить их в диагностических тест-системах различных модификаций [8]. Аптамеры можно использовать как основу для диагностических средств, поскольку они высоко специфичны, резистентны к денатурации и деградации, легко поддаются химической модификации, иммобилизации на биочипах, что создает предпосылки для формирования высокоструктурированного «рецепторного» слоя [6].
Наряду с острой необходимостью определения лекарственной устойчивости сальмонелл возникает проблема создания новых антимикробных лекарственных средств, поскольку вследствие нерационального использования антибактериальных препаратов. В последнее время возрастает интерес к натуральным веществам, обладающим высокой биодоступностью и ярко выраженными антиоксидантными и антимикробными свойствами [5]. Использование композитов натуральных биологически активных веществ еще более предпочтительно за счет синергетического терапевтического эффекта.
Цель работы: описание возможности применения ДНК аптамеров для определения чувствительности Salmonella Enteritidis и Salmonella Typhimurium к различным антибактериальным препаратам и композитам биологически активных веществ.
Материалы и методы. Селекция аптамеров к сальмонеллам проводилась с помощью технологии cell-SELEX путем чередования позитивной и негативной селекции описанной нами ранее [1, 10]. Исследование аффинности аптамеров к сальмонеллам проводили на проточном цитометре FC 500 (Beckman Coulter Inc., USA). Долю бактерий, связанных с аптамерами, определяли по флуоресценции аптамеров в зеленой области спектра [10]. Композиты бетулина с полимером полиэтиленгликолем (ПЭГ) и диацетат бетулина с арабиногалактаном были получены с помощью механохимической активации. Композиты бетулина были получены в Институте химии и химических технологий СО РАН по способу, описанному ранее [4]. Для изучения чувствительности бактерий к антибиотикам и бетулину использовали суточные культуры Salmonella Enteritidis и Salmonella Typhimurium, которые доводили питательным бульоном до концентрации примерно 1000 клеток/мл. В опытные пробы Salmonella Enteritidis и Salmonella Typhimurium добавляли антибиотики (цефотаксим, азитромицин, флемоксин), а также композит бетулин-ПЭГ. Все пробы инкубировали в СО2-инкубаторе течение 24-ти часов при температуре 37°С, после чего определяли мутность проб по McFarland. Чувствительность бактерий к антибиотикам и композитам бетулина определяли с помощью классического бактериологического метода и метода, основанного на связывании бактерий с аптамерами. Для определения числа колониеобразующих единиц в пробах после воздействия антибиотиков и бетулина на чашки Петри высевали по 100 мкл суспензии из контрольных (Salmonella Enteritidis и Salmonella Typhimurium) и опытных (Salmonella Enteritidis и Salmonella Typhimurium с антибиотиками и бетулином) проб в трех повторностях. Подсчет колоний в каждой чашке Петри осуществляли через 24 часа культивирования бактерий при 37°С.
Результаты и обсуждение. Одним из методов определения лекарственной устойчивости является метод лунок в агаре. Первоначальное сравнение антибактериального эффекта композитов бетулина с исходными бетулинами их компонентами проводили этим методом. В застывшей агаризованной среде, засеянной S.Typhimurium стерильным пробочным сверлом (диаметр 6-8 мм) делали лунки на расстоянии 1,5-2 см от края чашки. В лунки вносили растворы компонентов композитов и композиты бетулинов. Выяснилось, что наиболее выраженным бактериостатическим эффектом обладал композит бетулина с ПЭГ 10%:90% (лунка 5, рис. 1), при этом сам бетулин обладал слабо выраженным антибактериальным эффектом (лунка 4, рис. 1), а ПЭГ не влиял на рост бактерий (лунка 6, рис. 1).
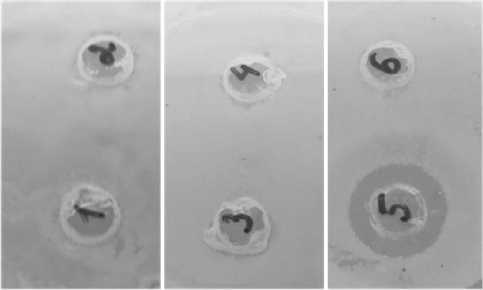
Рис. 1. Определение антибактериальной активности арабиногалактана, композита диацетата бетулина с арабиногалактаном, бетулина и композита бетулина с ПЭГ. Лунка 1 – фосфатный буфер, лунка 2 –арабиногалактан, лунка 3 – композита диацетата бетулина с арабиногалактаном (10%: 90%), лунка 4 – бетулин, лунка 5 – композит бетулина с ПЭГ (10%:90%)
Слабый бактериостатический эффект бетулина при данном методе исследований может объясняться его плохой растворимостью в водных растворах, и, как следствие, слабым проникновением в толщу агара. Влияние композита диацетата бетулина с арабиногалактаном (10%:
90%) (лунка 3, рис. 1) на рост бактерий было также незначительным, сам арабиногалактан (лунка 2, рис. 1) также не проявил антибактериальной активности, возможно вследствие свой разветвленной структуры, препятствующей прохождению в агар. Таким образом, метод лунок оказался непригодным для крупных разветвленных молекул и слаборастворимых веществ, поскольку не позволяет достоверно оценить их антимикробные свойства.
Другим индикатором для определения чувствительности бактерий к антибиотикам стала оценка мутности проб, зависящая от скорости роста бактерий. Проведенный анализ показал, что рост бактерий в контрольных пробах был значительно выше, чем в опытных образцах. После 24-часовой инкубации при 37°С контрольные пробы были мутными, все опытные пробы оставались прозрачными. Исходя из данных полученных в исследованиях по методу определения мутности проб, оба штамма S.Typhimurium и S.Enteritidis были чувствительными ко всем используемым нами антибактериальным препаратам.
Более точный классический бактериологический метод использовали для получения уточненных данных. Культивирование контрольных и обработанных антибактериальными препаратами образцов сальмонелл на питательной среде в чашках Петри показало, что азитромицин, в отличие от других антибиотиков, не полностью подавлял рост бактерий S.Typhimurium и S.Enteritidis (табл. 1). По-видимому, это было связано не с проявлением устойчивости бактерий к азитромицину, а с механизмом его воздействия на бактерии (азитромицин, в отличие от других использованных антибиотиков, обладает не бактерицидным, а бактериостатическим действием). Поэтому метод культивирования на питательной среде не очень пригоден для бактериостатических препаратов.
Таблица 1. Оценка чувствительности классическим бактериологическим методом бактерий S.Typhimurium и S.Enteritidis к антибиотикам, бетулину и его композиту с ПЭГ.
|
Тип пробы |
Количество колоний S.Enteritidis в мл, КОЕ/мл |
Количество колоний S.Typhimurium в мл, КОЕ/мл |
|
контроль |
5,0∙108 |
6,37∙108 КОЕ/мл |
|
флемоксин |
0 (стерильно) |
0 (стерильно) |
|
азитромицин |
0,008∙106 КОЕ/мл |
0,011∙106 КОЕ/мл |
|
цефотаксим |
0 (стерильно) |
0 (стерильно) |
|
бетулин |
4,41∙108 КОЕ/мл |
3,99∙108 КОЕ/мл |
|
бетулин: ПЭГ (10%:90%) |
4,42∙108 КОЕ/мл |
2,23∙108 КОЕ/мл |
Определение чувствительности бактерий к антибактериальным препаратам с помощью классического бактериологического метода, т.е. способности бактерий к росту после обработки этими препаратами, несмотря на высокую точность и воспроизводимость результатов, имеет недостатки – оно достаточно трудоемко и требует длительного культивирования и может давать ложные результаты в случае бактериостатических препаратов. Поэтому в экстренных случаях, когда нужно принять срочное решение о терапии, необходимы способы, позволяющие быстро и точно определить эффект от применения антибиотиков. Очевидно, что эту проблему можно решить с помощью маркеров, которые будут связываться только с живыми бактериями, но не способны связываться с неживыми. В ходе селекции были получены аптамеры с высокой аффинностью и специфичностью только к живым Salmonella Enteritidis и Salmonella Typhi-murium, позволяющие идентифицировать разные серова-ры (Salmonella Enteritidis и Salmonella Typhi-murium) одного вида сальмонелл – Salmonella Enterica, различающихся по своей устойчивости к антибиотикам. Для индикации антибактериальной устойчивости использовали аптамеры SE-20, ST-12, которые связывались только с живыми Salmonella Enteritidis и Salmonella Typhimurium, соответственно. Исследования, проведенные методом проточной цитометрии с использованием аптамеров к живым Salmonella Enteritidis и Salmonella Typhimurium, показали, что сальмонеллы после обработки антибактериальными препаратами не связываются с аптамерами (рис. 2).
Таким образом, данные о жизнеспособности бактерий, полученные при помощи классического бактериологического метода соответствовали результатам, полученных методом проточной цитометрии с использованием аптамеров. В то же время использование аптамеров для определения чувствительности к антибактериальным препаратам обладало двумя важными преимуществами – быстротой определения и меньшими трудозатратами, возможностью оценки не только бактерицидного, но и бактериостатического эффекта.
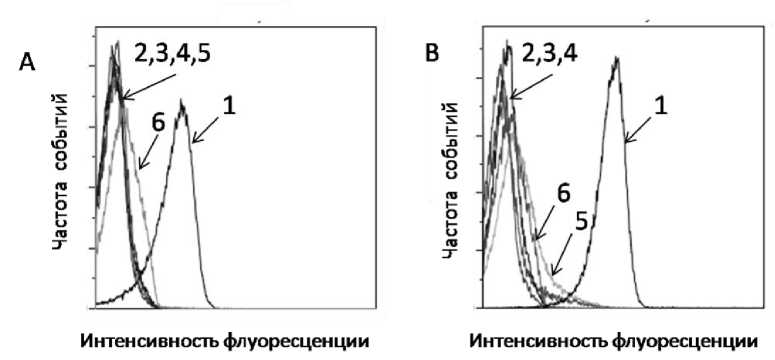
Рис. 2. Оценка жизнеспособности с помощью аптамеров, способных связываться только с живыми бактериями:
S.Enteritidis (A): 1 – флуоресценция аптамера SE-20_60 связанного с живыми S.Enteritidis ; 2 – флуоресценция аптамера SE-20_60 связанного с S.Enteritidis после 15 мин воздействия температуры 95 ° С; 3 - флуоресценция аптамера SE-20_60 связанного с живыми S.Enteritidis после суточной инкубации с флемоксином; 4 – флуоресценция аптамера SE-20_60 связанного с живыми S.Enteritidis после суточной инкубации с цефотаксимом; 5 – флуоресценция аптамера SE-20_60 связанного с живыми S.Enteritidis после суточной инкубации с азитромицином; 6 – флуоресценция аптамера SE-20_60 связанного с живыми S.Enteritidis после суточной инкубации с композитом бетулина c ПЭГ.
S.Typhimurium (B): 1 – флуоресценция аптамера ST-12_60 связанного с живыми S.Typhimurium; 2 – флуоресценция аптамера ST-12_60 связанного с S.Typhimurium после 15 мин воздействия температуры 95 ° С; 3 - флуоресценция аптамера ST-12_60 связанного с живыми S.Typhimurium после суточной инкубации с азитромицином; 4 – флуоресценция аптамера ST-12_60 связанного с живыми S.Typhimurium после суточной инкубации с цефотаксимом; 5 – флуоресценция аптамера ST-12_60 связанного с живыми S.Typhimurium после суточной инкубации с флемоксином; 6 – флуоресценция аптамера ST-12_60 связанного с живыми S.Typhimurium после суточной инкубации с композитом бетулина c ПЭГ.
Выводы: метод определения на основе аптамеров позволяет получать точные данные о жизнеспособности бактерий в присутствии антибактериальных и бактериостатических препаратов, соответственно, судить о степени их устойчивости к ним микроорганизмов. Композиты бетулина с ПЭГ могут быть использованы в дополнение к классической антибатериальной терапии, что позволит уменьшать дозы препаратов и добиваться лучших терапевтических результатов за счет их синергетического эффекта.
Работа выполнена при финансовой поддержке Министерства образования и науки Российской Федерации в рамках федеральной целевой программы «Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2007-2012 годы» (Государственный контракт № 16.512.11.2107), программы Президиума РАН «Фундаментальные науки – медицине 45», РФФИ (11-03-12114-офи-м).
Список литературы Определение чувствительности возбудителей сальмонеллеза Salmonella enteritidis и Salmonella typhimurium к антибактериальным препаратам с помощью метода проточной цитометрии
- Замай, Т.Н. Новый перспективный способ идентификации возбудителя сальмонеллеза/Т.Н. Замай, А.Б. Салмина, О.С. Замай и др.//Вестник новых медицинских технологий. 2011. №4. С. 36-39.
- Иванов, А.С. Современные представления об антибиотикорезистентности и антибактериальной терапии сальмонеллезов//Клиническая микробиология и антимикробная химиотерапия. 2009. Т.11, №4. C. 305-326.
- Козлова, Н.С. Антибиотикорезистентность сальмонелл, выделенных в Санкт-Петербурге и Ленинградской области в 1992-2000 гг./Н.С. Козлова, Д.П. Гладилин, Л.А. Липатова и др.//Клиническая микробиология и антимикробная химиотерапия. 2001. Т.1. С. 20.
- Кузнецова, С.А. Способ получения бетулина: Пат. РФ 2264411/С.А. Кузнецова, Б.Н. Кузнецов, А.Г. Михайлов, В.А. Левданский//2005. 4 с.
- Кузнецова, С.А. Изучение состава гексанового экстракта бересты и его токсико-фармакологических свойств/С.А. Кузнецова, Б.Н. Кузнецов, О.Ф. Веселова//Химия растительного сырья. 2008. №1. С. 45-49.
- Сho, E.J. Applications of aptamers as sensors/E.J. Сho, J.W. Lee, A.D. Ellington//Annual Review of Analytical Chemistry. 2009. №1. P. 241-264.
- Hamula, C.L.A. Selection of Aptamers against Live Bacterial Cells/C.L.A. Hamula, H. Zhang, L.L. Guan et al.//Anal. Chem. 2008. №20. P. 7812-7819.
- Iliuk, A.B. Aptamer in bioanalytical applications/A.B. Iliuk, L. Hu, W.A. Tao//Anal Chem. 2011. №12. P. 4440-4452.
- Joshi, R. Selection, characterization, and application of DNA aptamers for the capture and detection of Salmonella enterica serovars/R. Joshi, H. Janagama, H.P. Dwivedi et al.//Molecular and Cellular Probes. 2009. №23. P. 20-28.
- Labib, M. Aptamer-based Viability Impedimetric Sensor for Bacteria/M. Labib, A.S. Zamay, O.S. Kolovskaya et al.//Analytical chemistry. 2012 (Letter) DOI: DOI: 10.1021/ac302217u
- Pegues, D.A. Salmonella species, including Salmonella typhi. In Principles and Practice of Infectious Diseases/D.A. Pegues, M.E. Ohl, S.I. Miller//Eds G.L. Mandell, Bennet, J.E., Dolin, R. -6th Ed. New York: Churchill Livingstone, 2005. P. 2636-2654.
- Wang, F. Aptamers That Preferentially Bind Type IVB Pili and Inhibit Human Monocytic-Cell Invasion by Salmonella enterica Serovar Typhi/F. Wang, M.-S. Zhang, J.-M.Hu//Antimicrob Agents Chemother. 2005. №10. P. 4052-4060.


