Определение хлора в нерудных материалах методом ионометрии
Автор: Матвейко Николай Петрович
Журнал: Вестник Витебского государственного технологического университета @vestnik-vstu
Рубрика: Химическая технология и экология
Статья в выпуске: 1 (18), 2010 года.
Бесплатный доступ
На основании исследований влияния состава фонового электролита разработана методика определения хлорид-ионов методом прямой потенциометрии. Показано, что определение хлорид-ионов в нерудных материалах возможно на фоновом электролите, содержащем 0,001 моль/дм3 H2SO4 с относительной погрешностью, не превышающей 13%.
Методика определения хлорид-ионов, метод прямой потенциометрии, методы определения, потенциометрия, фоновые электролиты, хлор, хлорид-ионы, определение хлора, ионометрический метод, нерудные материалы
Короткий адрес: https://sciup.org/142184621
IDR: 142184621
Текст научной статьи Определение хлора в нерудных материалах методом ионометрии
Приведены результаты определения хлора в нерудных материалах ионометрическим методом. Определены условия выполнения анализа нерудных материалов, позволяющие получать результаты с относительной погрешностью, не превышающей 13%.
Хлор широко распространен в природе и входит в больших или меньших количествах в состав многих природных минералов. Хлор оказывает значительное влияние на физико-химические свойства минералов (взаимодействие с водой и другими веществами, электропроводность и т.д.). В больших количествах он может представлять опасность для человека и окружающей среды. Поэтому необходим контроль содержания хлора в нерудных минералах [1].
В настоящее время содержание хлора нормируется в графите, каолине, тальке, талькомагнезите, меле, сырье глинистом.
Для определения хлора в указанных минералах применяется преимущественно метод меркуриметрического титрования водной вытяжки [2-5], или метод, основанный на титровании водной вытяжки раствором нитрата серебра в присутствии хромата калия [6]. Эти методы имеют высокую относительную погрешность и не всегда дают достоверные результаты. Кроме того, они требуют использования значительного перечня химических реактивов и являются достаточно трудоемкими. В этой связи разработка новых, экспрессных, не требующих дефицитных и дорогостоящих реактивов, нетрудоемких методик определения хлора в нерудных материалах представляет определенный теоретический и практический интерес.
Наиболее перспективным методом определения хлора в водных растворах является прямая потенциометрия (ионометрия). Метод прост, не требует дорогостоящих приборов и реактивов, имеет низкую относительную погрешность, является экспрессным и легко может быть автоматизирован [7].
Цель работы – разработка методики ионометрического определения хлора в нерудных материалах.
Исследования проводили с применением иономера марки И-160, хлоридсеребряного электрода сравнения, ионселективного мембранного кристаллического индикаторного электрода марки ЭМК-Сl-01, имеющего диапазон измерения концентраций ионов хлора от 1·10-4 до 1·10-2 моль/л.
Растворы готовили на дистиллированной воде из реактивов марки «ЧДА». В качестве фонового электролита использовали растворы серной кислоты различной концентрации (моль/л): 0,1; 0,01; 0,001; 0,0001. Для выбора состава фонового электролита строили зависимости потенциала индикаторного электрода (E) от логарифма концентрации хлорид-ионов в растворе (–lgCCl). Исследования проводили при концентрации хлорид-ионов 1·10-4; 4·10-4; 5·10-4; 8·10-4; 1·10-3; 2·10-3; 4·10-3; 8·10-3; 1·10-2 моль/дм3. Калибровочные графики строили по усредненным результатам трех измерений потенциала. Относительная погрешность единичного измерения не превышала 1%.
Подготовку пробы мела для анализа проводили следующим образом. Навеску массой 50 г помещали в стакан вместимостью 500 см3, приливали 200 см3 воды и кипятили в течение 10 минут, периодически помешивая стеклянной палочкой. Затем раствор отстаивали и отфильтровали через двойной фильтр "белая лента" в мерную колбу вместимостью 500 см3. Осадок в стакане промывали горячей водой сначала декантацией 3 раза, затем перенесли на фильтр и промыли. После охлаждения раствор доводили до метки дистиллированной водой.
Пробу глины готовили следующим образом. Навеску массой 100 г помещали в коническую колбу вместимостью 1000 см3, приливали свежекипяченую воду, закрывали пробкой и взбалтывали в течение 15 минут. Отстаивали 24 часа, затем отфильтровывали через воронку Бюхнера с двойным фильтром "синяя лента" в колбу Бунзена.
Для проведения анализа отбирали аликвоты по 10,0 см3 водных вытяжек мела и глины в мерные колбы вместимостью 50 см3, доводили объемы до метки раствором серной кислотой таким образом, чтобы ее концентрация составляла 0,001 моль/л, и проводили измерение потенциалов индикаторного электрода. За результат принимали среднее арифметическое значение трех измерений.
На рисунке в качестве примера представлены зависимости E – -lgCCl, полученные для стандартных растворов в 0,1 и 0,001 моль/л растворах серной кислоты, содержащих ионы хлора.
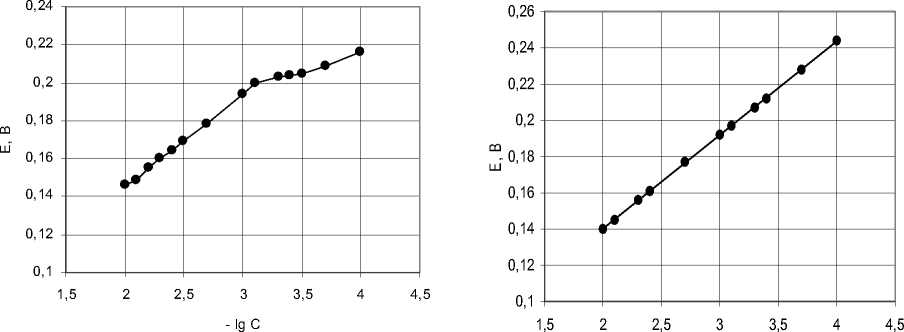
- lg C а б
Рисунок ─ Калибровочный график в фоновом электролите, содержащем H 2 SO 4 (моль/л): а) 0,1; б) 0,001
Из рисунка а) видно, что зависимость потенциала индикаторного электрода от логарифма концентрации хлорид-ионов в 0,1 моль/л растворе серной кислоты можно условно разбить на два прямолинейных участка, отличающихся наклоном. Это значит, что в таком фоновом электролите определение хлорид-ионов в интервале концентраций 1·10-4 – 1·10-2моль/л затруднительно.
Аналогичная зависимость E – -lgC Cl наблюдается при использовании в качестве фонового электролита 0,01 моль/л раствора серной кислоты.
В фоновом электролите, содержащем 0,0001 моль/л серной кислоты, зависимость E – -lgC Cl не может быть изображена прямой линией, причем наблюдается большой разброс точек. Кроме того, в таком электролите требуется значительно большее время для установления постоянного значения потенциала индикаторного электрода, чем в растворах серной кислоты большей концентрации.
Оптимальным фоновым электролитом является 0,001 М раствор серной кислоты – графическая зависимость E – -lgC Cl в таком электролите, как видно из рисунка б), выражается прямой линией во всем интервале исследованных концентраций. Поэтому все дальнейшие исследования проводили с использованием указанного фонового электролита.
Для расчета основных аналитических характеристик методики ионометрического определения ионов хлора в 0,001 М растворе серной кислоты использовали метод «введено-найдено». С этой целью исследованы стандартные растворы, содержащие 3·10-3 и 3·10-4 моль/дм3 ионов хлора. Результаты представлены в таблице.
Таблица – Основные аналитические характеристики методики ионометрического определения ионов хлора
|
Введенное количество хлорид-ионов, моль/дм3 ( ) |
Найденное количество хлорид-ионов, моль/дм3 (x i ) |
x |
= x i – |
2= (x i – )2 |
2 σ |
S |
, |
|
|
3,0·10-3 |
2,7·10-3 2,9·10-3 2,7·10-3 3,0·10-3 2,6·10-3 |
о со с\Г |
0,3·10-3 0,1·10-3 0,3·10-3 0 0,4·10-3 |
0,09·10-6 0,01·10-6 0,09·10-6 0 0,16·10-6 |
о о о |
о со CXI о |
CsT со г? схГ |
10 3,3 10 0 13 |
|
3,0·10-4 |
3,0·10-4 3,0·10-4 3,4·10-4 2,9·10-4 3,0·10-4 |
о со о со |
0 0 0,4·10-4 0,1·10-4 0 |
0 0 0,16·10-8 0,01·10-8 0 |
о о |
о о' |
ю ° ь со ^ о со |
0 0 13 3,3 0 |
Видно, что ионометрическое определение содержания ионов хлора с использованием в качестве фонового электролита 0,001 М раствора серной кислоты и индикаторного ионселективного мембранного кристаллического электрода марки ЭМК-Сl-012.5.3. позволяет получать результаты с относительной погрешностью, не превышающей 13%, и стандартным отклонением менее 0,3·10-3.
С целью апробации методики ионометрического определения ионов хлора проведен анализ проб мела школьного и глины огнеупорной. По измеренным значениям потенциала индикаторного электрода, используя градуировочный график, установлено, что содержание хлорид-ионов составляет (моль/дм3): в меле школьном – 7,36·10-4; в глине огнеупорной – 3,16·10-3. Такие количества хлорид-инов не превышают допустимых концентраций, нормируемых в ТНПА (0,05 и 0,01 моль/дм3 соответственно) [5,6].
По результатам исследований можно сделать следующие выводы.
-
1. Определение ионов хлора в нерудных материалах можно проводить ионометрическим методом с применением ионселективного мембранного кристаллического индикаторного электрода марки ЭМК-Сl-01 на фоне 0,001 М раствора серной кислоты в интервале концентраций от 1·10-4 до 1·10-2 моль/л.
-
2. Разработанная методика позволяет определять ионы хлора с относительной погрешностью, не превышающей 13%, и стандартным отклонением менее 0,3·10-3.
Список литературы Определение хлора в нерудных материалах методом ионометрии
- Фрумина, Н. С. Хлор/Н. С. Фрумина, Н. Ф. Лисиенко, М. А. Чернова. -Москва: Наука, 1983. -200 с.
- ГОСТ 17818.18-90. Графит. Метод определения хлорид-ионов в водной вытяжке. -Взамен ГОСТ 10273-79; введ. 1991-07-01.-Москва: Издательство стандартов, 1990. -4 с.
- ГОСТ 19609.10-89. Каолин обогащенный. Метод определения хлорид-ионов в водной вытяжке. -Взамен ГОСТ 19609.10-79; Введ. 1991-01-01.-Москва: Изд-во стандартов, 1989. -3 с.
- ГОСТ 19728.13-2001. Тальк и талькомагнезит. Метод определения хлорид-ионов в водной вытяжке. -Взамен ГОСТ 19728.13-88; введ. 2003-01-01.-Москва: Изд-во стандартов, 2001. -8 с.
- ГОСТ 21138.3-85. Мел. Метод определения массовой доли хлорид-ионов в водной вытяжке. -Взамен ГОСТ 21138.3-75; введ 1987-01-01. -Москва: Изд-во стандартов, 1985. -4 с.
- ГОСТ 21216.7-93. Сырье глинистое. Метод определения хлорид-ионов в водной вытяжке. Взамен ГОСТ 2216.7-81; введ. 1996-01-01.-Москва: Издательство стандартов, 1993. -6 с.
- Демина, Л. А. Ионометрия в неорганическом анализе/Л. А. Демина [и др.]. -Москва: Химия, 1991. -192 с.


