Определение инфаркт-связанной артерии у пациентов с инфарктом миокарда без подъёма сегмента ST
Автор: Халилов Ш. дЖ.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 1 т.14, 2024 года.
Бесплатный доступ
У пациентов с инфарктом миокарда без подъёма ST (ИМбпST) идентифицировать инфаркт-связанную артерию трудно.Цель: выявление инфаркт-связанной артерии (ИСА) у пациентов с ИМбпST методом сердечно-сосудистого магнитного резонанса (СМР) и сравнение с коронарной ангиографией.Объект и методы. Обследованы 86 пациентов с ИМбпST обоего пола. Всем пациентам при поступлении была выполнена стандартная ЭКГ в 12 отведениях. Для выявления ИСА использованы коронарная ангиография и СМР. В сыворотке крови определены показатели липидного профиля, концентрация тропонина Т, активность креатинкиназы-МВ. Средний возраст пациентов составил 62,8±5,8 года, индекс массы тела - 28,0±3,53 кг/м2. Мужчины составили 73,3%. Многососудистое поражение отмечалось в 38,4% случаев. Отягощенная наследственность по ИБС встречалась у 39,5% пациентов. Гипертензию, сахарный диабет и гиперлипидемию отмечали 66,3%, 18,6% и 37,2% пациентов соответственно. ЭКГ-изменения выявлены у 83,7% пациентов.Результаты. По данным коронарографии ИСА была определена у 62,8% и не выявлена у 37,2% пациентов, по локализации самой распространенной была левая нисходящая артерия (42,6%). По данным СМР инфаркт-связанная артерия выявлена у 80,2% пациентов. Вероятность идентификации ИСА с помощью СМР составила OR=2,405 (95% ДИ 1,209-4,784, рЗаключение. Основные результаты: 1) инфаркт-связанная артерия при коронарной ангиографии не была выявлена у 37,2% пациентов с ИМбпST, а при сердечно-сосудистом магнитном резонансе - у 19,8% пациентов; 2) значимая вероятность идентифицировать инфаркт-связанную артерию имела место при сердечно-сосудистом магнитном резонансе (OR = 2,405, 95% ДИ 1,209-4,784, р> ˂ 0,05). Инфаркт-связанная артерия у пациентов с поражением трёх сосудов чаще выявлялась с помощью СМР (64,7%). Из 32 пациентов, у которых не удалось выявить ИСА с помощью коронарной ангиографии, 13 пациентов имели многососудистое атеросклеротическое поражение. У этих пациентов была область гиперусиленного миокарда.Заключение. Основные результаты: 1) инфаркт-связанная артерия при коронарной ангиографии не была выявлена у 37,2% пациентов с ИМбпST, а при сердечно-сосудистом магнитном резонансе - у 19,8% пациентов; 2) значимая вероятность идентифицировать инфаркт-связанную артерию имела место при сердечно-сосудистом магнитном резонансе (OR = 2,405, 95% ДИ 1,209-4,784, р ˂ 0,05). Результаты исследования могут быть актуальны для пациентов ИМбпST с критериями высокого риска.
Инфаркт миокарда без подъема st, инфаркт-связанная артерия, коронарная ангиография, сердечно-сосудистый магнитный резонанс, многососудистое поражение
Короткий адрес: https://sciup.org/143182252
IDR: 143182252 | УДК: 616.72-001.52-089.844 | DOI: 10.20340/vmi-rvz.2024.1.CLIN.4
Текст научной статьи Определение инфаркт-связанной артерии у пациентов с инфарктом миокарда без подъёма сегмента ST
Инфаркт миокарда без подъёма сегмента ST (ИМбпST) является частью спектра острого коронарного синдрома и представляет собой тип частичной закупорки одной из коронарных артерий, вызывающий снижение притока богатой кислородом крови к сердечной мышце, а также является важным острым проявлением ишемической болезни сердца (ИБС) и основной причиной смерти [1]. Доля пациентов с ИМбпST в госпитализации составляет 60–70% [2]. Частота ИМбпST по сравнению с инфарктом миокарда с подъёмом сегмента ST продолжает увеличиваться, что имеет серьёзные последствия, поскольку смертельных случаев среди пациентов ИМбпST после выписки из больницы больше, чем с подъёмом сегмента ST [3–6].
Согласно исследованиям, около четверти ИМбпST вызвано полной окклюзией инфаркт-связанной артерии, что соответствует данным ИМпST при коронарной ангиографии [7]. У пациентов с ИМбпST по сравнению с пациентами с подъёмом сегмента ST идентификация инфаркт-связанной артерии (ИСА) может быть сложной задачей, поскольку у пациентов с большей вероятностью будет или многососудистое поражение, или незначительная ИБС. Правильная идентификация ИСА при остром ИМ имеет очевидное значение для стратегий коронарной реваскуляризации. Многие считают, что сердечно-сосудистый магнитный резонанс (СМР) является эталонным стандартом in vivo для визуализации ИМ, учитывая его способность генерировать изображения с высоким разрешением инфарктного и жизнеспособного миокарда. Помимо этого, СМР, являясь мощным неинвазивным методом, позволяет получить данные о жизнеспособном миокарде, перфузии миокарда и сердечной функции за одно обследование [8]. Отмечается, что при остром ИМ для оценки глубины повреждения миокарда и риска развития осложнений проведение СМР по сравнению с общепринятой клинической оценкой является предпочтительным [9].
Тем не менее, имеются противоречивые данные. Одной из потенциальных причин противоречивых данных могут быть проблемы с определением ИCА, а не предполагаемые преимущества различных стратегий реваскуляризации [10]. Даже если ИСА выявляется с помощью коронарной ангиографии, возможно, что эта субъективная оценка иногда может быть ошибочной.
Таким образом, у пациентов с ИМбпST идентифицировать инфаркт-связанную артерию трудно. Переоценка каждой стратегии с помощью надежного метода определения истинной ИСА может дать более точные ответы на вопрос, какая стратегия реваскуляризации является наилучшей.
Цель исследования заключалась в выявлении ин-фаркт-связанной артерии у пациентов с ИМбпST методом сердечно-сосудистого магнитного резонанса и сравнение с рентген коронарной ангиографией.
Объект и методы исследования
В проспективное исследование были включены 86 пациентов с ИМбпST обоего пола, в возрасте от 50 до 69 лет. На момент обследования все пациенты находились клинически и гемодинамически в стабильном состоянии. Критериями включения были: соответствие критериям ИМ без подъёма сегмента ST, отсутствие противопоказаний к инвазивной коронарной ангиографии, соответствие пациентов критериям ИМ без подъёма сегмента ST, отсутствие в анамнезе ИМ или операции аортокоронарного шунтирования. Критерии исключения: гемодинамически нестабильные пациенты, наличие блокады ножек пучка Гиса на исходной ЭКГ, гипертрофия левого желудочка, желудочковая электрокардиостимуляция, повышение сегмента ST, пациенты, нуждающиеся в немедленной реваскуляризации коронарных артерий, пациенты со скоростью клубочковой фильтрации менее <30 мл/мин на 1,73 м2, противопоказания к сердечному магнитному резонансу, пациенты с миокардитом. Исследование проводилось в соответствии с принципами Хельсинкской декларации.
Всем пациентам при поступлении была выполнена стандартная ЭКГ в 12 отведениях. При идентификации ИСА методом коронарной ангиографии, участок перфузии миокарда, который обеспечивал ИСА, картировался на стандартной 17-сегментной модели. Участок перфузии ИСА был локализован до половины миокарда левого желудочка путём выбора ≤8 сегментов на 17-сегментной модели, которые с наибольшей вероятностью включали территорию перфузии ИСА [11]. Коронарография выполнена с помощью ангиографической рентгеновской уста- новки Philips Integris 3000 (Нидерланды). СМР проводилась на аппарате 1,5 Тл (Siemens Avanto, Германия). Визуализацию выполняли с использованием стандартных протоколов. Изображения были получены в нескольких ракурсах по короткой оси (каждые 10 мм по всему левому желудочку) и в трёх ракурсах по длинной оси с использованием стационарной последовательности свободной прецессии (толщина среза – 6 мм; промежуток между срезами – 4 мм; временное разрешение – 35–40 мс; угол поворота – 60°; разрешение в плоскости – 1,7×1,4 мм). Изображения с замедленным улучшением были получены с использованием сегментированной последовательности градиентного эхо-сигнала с инверсией-восстановлением (толщина среза – 6 мм; межслоевой зазор – 4 мм; угол поворота – 25°; разрешение в плоскости – 1,8×1,4 мм) через 10–15 минут после внутривенного болюсного введения 0,15 ммоль/кг массы тела из гадолиниевого контраста (гадолиний-диэтилентриамин-пентауксусная кислота или гадоверсетамид). Киноизображения оценивались на предмет нарушений движения региональных стенок, Т2-взвешенные изображения и LGE (Late gadolinium enhancement – позднее усиление гадолинием) – изображения для визуального наличия отёка и рубца соответственно, а изображения перфузии в состоянии покоя и стресса – на наличие ишемии [9]. Лабораторные тесты: измерение показателей липидного профиля (общий холестерин – ОХ, липопротеины низкой плотности – ЛПНП, липопротеины высокой плотности – ЛПВП, триглицериды – ТРГ, коэффициент атерогенности – КА) выполнено на анализаторе Cholestech LDX (США), в котором используется ферментативный метод в сочетании с твёрдофазной технологией. Концентрацию высокочувствительного тропонина Т определяли электрохемилюминесцентным методом с помощью тест-системы ТNT-HS Roche Diagnostics (Германия) на анализаторе Cobas 6000 (е 601, Roche, Швейцария). Фермент креатинкиназа-МВ определяли методом ИФА на анализаторе Cobas 6000 (е 601, Roche, Швейцария). Материалом для исследования была сывороточная кровь.
Полученные данные выражали как среднее ± стандартное отклонение. Сравнения непрерывных данных между группами были сделаны с использованием однофакторного или двухфакторного теста ANOVA, в зависимости от ситуации. Для межгруппового сравнения дискретных данных использовался критерий χ 2, отношение шансов (OR – odds ratio). Значение р<0,05 считалось значимым. При проведении статистического анализа использована программа STATISTICA 16.
Результаты
Средний возраст пациентов составил 62,8±5,8 года. Индекс массы тела (ИМТ) в среднем составил 28,0±3,53 кг/м2. Исходные характеристики пациентов представлены в табл. 1.
Из табл. 1 следует, что большинство пациентов были мужского пола (73,3%). Многососудистое поражение отмечалось в 38,4% случаев. Отягощённая наследственность по ИБС встречалась у 39,5% пациентов. Такие факторы риска ИМбпST, как гипертензия, сахарный диабет и гиперлипидемия отмечали 66,3%, 18,6% и 37,2% пациентов соответственно. ЭКГ-изменения выявлены у 83,7% пациентов, в частности, депрессия сегмента ST – у 24,4% пациентов, инверсия зубца T – у 31,4%, сочетание депрессии ST и инверсии зубца Т – у 27,9% пациентов. При этом, депрессия сегмента ST отмечалась у всех женщин.
По данным коронарографии ИСА была определена у 54 (62,8%) и не выявлена у 32 (37,2%) пациентов. При этом, самой распространённой была левая нисходящая артерия (рис. 1).
Таблица 1. Исходные характеристики пациентов
Table 1. Initial characteristics of patients
Показатели Пациенты с ИМбпST (n=86)
N %
Пол:
|
мужчины, n (%) |
63 |
73,3 |
|
женщины, n (%) |
23 |
26,7 |
|
Многососудистое поражение, n (%) |
33 |
38,4 |
|
Сахарный диабет, n (%) |
16 |
18,6 |
|
Гипертензия, n (%) |
57 |
66,3 |
|
Активный курильщик, n (%) |
44 |
51,2 |
|
Гиперлипидемия, n (%) |
32 |
37,2 |
|
Семейный анамнез по ИБС, n (%) |
34 |
39,5 |
|
ЭКГ в 12 отведениях: |
||
|
Депрессия ST, n (%) |
21 |
24,4 |
|
Инверсия зубца T, n (%) |
27 |
31,4 |
|
Сочетание депрессии ST и инверсия зубца T, n (%) |
24 |
27,9 |
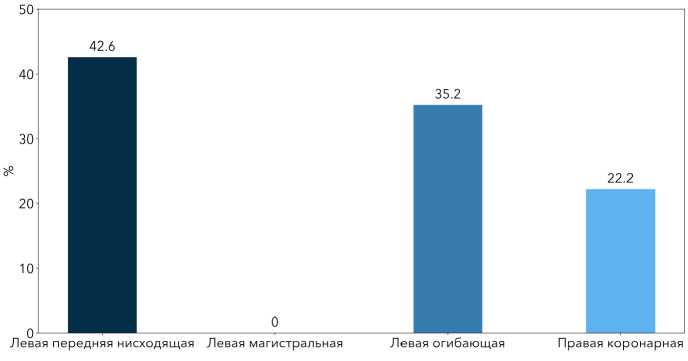
Рисунок 1. Локализация ИСА по данным коронарной ангиографии Figure 1. Localization of the infarct-related artery according to coronary angiography
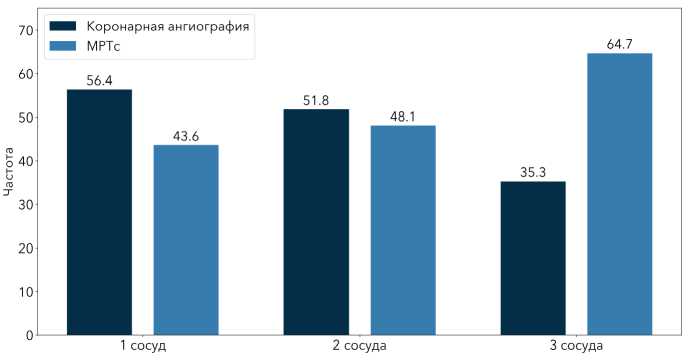
Рисунок 2. Частота выявления инфаркт-связанной артерии с помощью коронарной ангиографии и сердечно-сосудистого магнитного резонанса
Figure 2. The frequency of detection of an infarct-related artery using coronary angiography and cardiovascular magnetic resonance
Как видно из рис. 1, помимо левой передней нисходящей артерии (42,6%, n=23), также распространенной артерией, связанной с ИМ, была левая огибающая (35,2%, n=19). Следовательно, локализация поражения ИСА, выявленная у 54 пациентов с ИМбпST, была следующей: левая передняя нисходящая артерия, левая сгибающая и правая коронарная артерия (22,2%, n=12).
Следует отметить, что группа пациентов с выявленной ИСА несколько отличалась от группы пациентов с невыявленной ИСА (табл. 2).
Как видно из данных табл. 2, по возрасту группа пациентов с невыявленной ИСА была моложе, но различие не было значимым (р=0,279). Эта группа пациентов в сравнении с группой с выявленной ИСА имела сравнительно низкий исходный уровень тропонинов (р=0,325). Активность креатинкиназы у пациентов с невыявленной ИСА также была ниже, но значительно не отличалась от активности в группе пациентов с выявленной ИСА. Не наблюдалось существенного различия между группами в отношении показателей липидного спектра.
Отметим, что из 32 пациентов с неидентифици-рованной ИСА коронарной ангиографией 25 пациентов имели многососудистое поражение.
По данным СМР инфаркт-связанная артерия была выявлена у 69 (80,2%) пациентов. Помимо 54 пациентов, у которых ИСА была идентифицирована с помощью коронарной ангиографии, при СМР у 15 наблюдалось гиперконтрастирование, соответствующее ИМ. Вероятность идентификации ИСА с помощью СМР составила OR=2,405 (95% ДИ 1,209– 4,784, р<0,05). Как видно, ИСА чаще выявляли с помощью СМР, разница в сравнении с коронарной ангиографией составила 21,7% (р=0,012).
Инфаркт-связанная артерия у пациентов с поражением трёх сосудов чаще выявлялась с помощью СМР (рис. 2).
Из 32 пациентов, у которых не удалось выявить ИСА с помощью коронарной ангиографии, 13 пациентов имели многососудистое атеросклеротическое поражение. У этих пациентов была область гиперусиленного миокарда, которая соответствовала картине ИБС, соответствующей ИМ на СМР. У остальных 19 пациентов при коронарографии обструктивные поражения не выявлены.
Таблица 2. Характеристики пациентов с выявленной и не выявленной ИСА по данным коронарной ангиографии Table 2. Characteristics of patients with identified and undiagnosed infarct-related artery according to coronary angiography
|
Характеристики |
Группа пациентов с выявленной ИСА (n=54) |
Группа пациентов с невыявленной ИСА (n=32) |
t |
Р |
|
Средний возраст, лет |
63,1±3,27 |
58,8±2,21 |
1,09 |
0.279 |
|
Исходный тропонин Т, нг/мл |
0,79±0,15 |
0,60±0,12 |
0,99 |
0,325 |
|
Креатинкиназа-МВ, нг/мл |
14,9±0,16 |
11,8±1,77 |
1,74 |
0,085 |
|
ОХС, мг/дл |
185,8±21,2 |
178,8±33,5 |
0,18 |
0,860 |
|
Триглицериды, мг/дл |
159,6±40,2 |
234,8±32,4 |
1,46 |
0,149 |
|
ЛПНП, мг/дл |
102,6±34,2 |
93,8±22,4 |
0,22 |
0,830 |
|
ЛПВП, мг/дл |
46,1±5,11 |
40,3±6,0 |
0,74 |
0,464 |
|
КА |
3,14±1,02 |
3,55±0,98 |
0,29 |
0,773 |
Примечание: ОХС – общий холестерин; ЛПНП – липопротеины низкой плотности; ЛПВП – липопротеины высокой плотности; КА – коэффициент атерогенности; t – критерий Стьюдента.
Обсуждение
Острый ИМ обычно возникает в результате разрыва или эрозии бляшки в коронарной артерии, широко известной как инфаркт-связанная артерия. До 14% пациентов с подозрением на ИМбпST диагностируется как ИМ с необструктивными коронарными артериями при инвазивной коронарной ангиографии [12].
У пациентов с ИМбпST идентификация ИСА может быть сложной задачей, поскольку у пациентов с большей вероятностью будет или многососудистая, или незначительная ИБС [10]. Часто из-за многососудистого поражения существует неопределенность в отношении инфаркт-связанной артерии [12].
Пациенты с ИМбпST отличаются гетерогенностью как в отношении клинических проявлений, так и ангиографических данных. Наше исследование показало, что идентификация ИСА у пациентов с ИМбпST с помощью коронарной ангиорафии составила 62,8%, не удалось выявить в 37,2% случаев, с помощью МРТ сердца – в 80,2% и в 19,8% случаев соответственно. Полученные нами результаты сопоставимы с данными J.F. Heitner и соавт. [10], которые считают, что идентификация ИСА с помощью коронарографии может быть затруднена у пациентов с ИМбпST.
Morawska I. и соавт. [13] считают, что нужно соблюдать предельную осторожность в отсрочке проведения коронарографии у пациентов с ИМбпST с метаболическими нарушениями и семейным анамнезом ИБС, которые представляют повышенный риск полной окклюзии. По мнению авторов, у пациентов с высоким риском окклюзии ИСА немедленная, но не ранняя, инвазивная стратегия является разумным вариантом для спасения миокарда и улучшения прогноза [13].
Согласно современным рекомендациям [14], всем пациентам с ИМбпST показана ранняя инвазивная стратегия в течение 24 ч. Немедленная инвазивная ангиография рекомендуется пациентам с нестабильным ИМбпST в соответствии с гемодинамическим статусом, аритмиями, острой сердечной недостаточностью или постоянной болью в груди [14, 15]. Heitner J.F. и соавт. [10] отмечают, что у пациентов, которым в конечном счёте проводится реваскуляризация коронарных артерий, нередко проводят реваскуляризацию только с инфаркт-несвязанных артерий, которые определяются с помощью СМР.
В идентификации ИСА может помочь ЭКГ в 12 отведениях, которая является диагностическим инструментом первой линии при обследовании пациентов с подозрением на острый коронарный синдром [16]. При проведении ЭКГ мы получили депрессию сегмента ST в 24,4% случаев, инверсию зубца T – в 31,4% случаев, сочетание депрессии ST и инверсии зубца Т – в 27,9% случаев. Локализация ишемизированной области при ИМбпST сложная, поскольку отведения с углублениями сегмента ST не указывают точно на ишемизированную область. Обычно утверждается, что депрессии сегмента ST, а также инверсии зубца Т не могут быть использованы для локализации ишемизированной области [17]. К сожалению, пациенты с ИМбпST не имеют ЭКГ-маркеров.
Преимуществом СМР является его способность оценивать региональную и глобальную функцию миокарда, наличие и характер рубцов, ишемию миокарда и дифференцировать коронарную и некоронарную этиологию в рамках одного исследования [1, 18]. Вазодилататорная стресс-перфузионная СМР точно выявляет обструктивную ИБС в популяции со стабильной болью в груди, а стратегия под контролем СМР снижает вероятность неадекватной инвазивной коронарографии [19]. CMР точно обнаруживает обструктивную ИБС и острый коронарный синдром при подозрении на ИМбпST. Необструктивная ИБС является распространённым заболеванием, при этом CMР всё ещё выявляет инфаркт почти у четверти пациентов [1]. Раннее включение CMР в диагностическую стратегию может безопасно избежать инвазивную коронарную ангиографию у значительного числа пациентов с ИМбпST [1]. Результаты исследования Y.J.M. van Cauteren [1] подтверждают потенциал ранней СМР у пациентов с подозрением на ИМбпST и позволяют выбрать тех, кому больше всего помогает дополнительная инвазивная коронгарная ангиография. По данным исследования J.F. Heitner и соавт. [10] у четверти пациентов, у которых ИСА могла быть идентифицирована с помощью коронарной ангиографии, СМР не согласовывался с коронарной ангиографией и указывал на другой ИСА (14%) или новый неишемический диагноз (13%). Большинство пациентов с различными ИСА по данным СМР (80%) были с многососудистым поражением сосудов.
Заключение
Основными результатами исследования являются: 1) инфаркт-связанная артерия при коронарной ангиографии не была выявлена у 37,2% пациентов с ИМбпST, а при сердечно-сосудистом магнитном резонансе – у 19,8% пациентов; 2) значимая вероятность идентифицировать инфаркт-связанную артерию имела место при сердечно-сосудистом магнитном резонансе (OR=2,405, 95% ДИ 1,209–4,784, р<0,05). Результаты нашего исследования могут быть актуальны для пациентов с ИМбпST с критериями высокого риска.


