Определение кальцитонина и РЭА в пунктате узла щитовидной железы для диагностики медуллярного рака щитовидной железы
Автор: Северская Н.В., Чеботарева И.В., Желонкина Н.В., Белякова А.С., Исаев П.А., Полькин В.В., Ильин А.А., Иванов С.А., Каприн А.Д.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 5 т.22, 2023 года.
Бесплатный доступ
Актуальность. Медуллярный рак щитовидной железы (МРЩЖ) экспрессирует кальцитонин (КТ) и раково-эмбриональный антиген (РЭА). Определение КТ в смыве из иглы после тонкоигольной аспирационной биопсии (ТАБ-КТ) улучшает цитологическую диагностику МРЩЖ. Однако отсутствие рекомендованного порогового значения ТАБ-КТ затрудняет его клиническое использование. Определение РЭА в смыве из иглы (ТАБ-РЭА) при МРЩЖ не изучалось. Цель исследования - оценить информативность и предложить пороговое значение ТАБ-КТ и ТАБ-РЭА для диагностики МРЩЖ. материал и методы. Ретроспективный анализ 164 образцов смывов из иглы, полученных у 92 пациентов с узлами щитовидной железы, которым проводилась ТАБ с последующим цитологическим исследованием и определением ТАБ-КТ. Гистологически верифицировано 17 МРЩЖ и 41 не-МРЩЖ. 106 узлов, определенных цитологически как не-МРЩЖ, не оперированы. В 29 образцах дополнительно исследовали ТАБ-РЭА. Пороговое значение определяли с помощью ROC-анализа.
Кальцитонин, рэа, медуллярный рак щитовидной железы, узел щитовидной железы, смыв из иглы, тонкоигольная аспирационная биопсия
Короткий адрес: https://sciup.org/140303543
IDR: 140303543 | УДК: 616.441-006.6:577.175.446]-076 | DOI: 10.21294/1814-4861-2023-22-5-60-70
Текст научной статьи Определение кальцитонина и РЭА в пунктате узла щитовидной железы для диагностики медуллярного рака щитовидной железы
Медуллярный рак щитовидной железы (МРЩЖ) происходит из парафолликулярных С-клеток и экспрессирует кальцитонин (КТ), который является высокочувствительным и специфичным маркером заболевания и используется для диагностики, оценки эффективности проведенного лечения и наблюдения [1, 2]. Определение КТ в сыворотке крови рекомендовано для скрининга МРЩЖ среди пациентов с узловыми образованиями щитовидной железы (ЩЖ) [3]. Обнаружение повышенного уровня КТ в сыворотке является показанием для дальнейшего обследования, в том числе проведения тонкоигольной аспирационной биопсии (ТАБ) с последующим цитологическим исследованием [4]. Однако информативность цитологического ис- следования при МРЩЖ невысока и варьирует от 10 до 86 %, составляя в среднем 54 % [5]. С другой стороны, умеренное повышение сывороточного КТ (<100 пг/мл) не всегда указывает на МРЩЖ и может наблюдаться при других состояниях [6]. В сомнительных случаях, когда подозревается МРЩЖ, а клинические данные противоречивы, КТ определяют в смыве из иглы после тонкоигольной аспирационной биопсии (ТАБ-КТ). Определение ТАБ-КТ повышает информативность цитологического исследования в диагностике МРЩЖ [5]. Однако существуют проблемы, связанные с интерпретацией результата ТАБ-КТ, препятствующие широкому внедрению метода в клиническую практику. Во-первых, это отсутствие единого по- рогового значения ТАБ-КТ, и его рекомендовано установить в каждой лаборатории [7]. Во-вторых, у некоторых больных без МРЩЖ может определяться высокий уровень ТАБ-КТ, предположительно за счет прохождения пункционной иглы через очаги С-клеточной гиперплазии [8, 9], которые могут присутствовать у пациентов с хроническим тиреоидитом, узловым зобом, папиллярным раком, гиперпаратиреозом [10].
Неспецифическое повышение ТАБ-КТ у больных с умеренно повышенным сывороточным КТ (<100 пг/мл) и отрицательным цитологическим заключением представляет дилемму и требует экспертной оценки [4]. В таких случаях могут быть предложены проведение иммуно-цитохимического исследования [9], наблюдение с повторным исследованием сывороточного КТ и ТАБ-КТ, определение ТАБ-КТ из окружающей ткани ЩЖ, исследование раково-эмбрионального антигена в сыворотке [4, 6]. В некоторых случаях проводится операция с диагностической целью [8].
Раково-эмбриональный антиген (РЭА) является вторым опухолевым маркером, который используют у больных МРЩЖ [1]. Уровень РЭА в сыворотке крови повышен у 70 % больных МРЩЖ до операции, коррелирует со степенью распространенности и агрессивностью МРЩЖ [11]. Однако учитывая то, что повышение сывороточного РЭА не является специфичным для МРЩЖ и его уровень может повышаться при других раках, чаще колоректальном, определение РЭА при МРЩЖ чаще используют после тиреоидэктомии, для диагностики прогрессирования заболевания [1, 4]. Имеются единичные сообщения об определении РЭА в смыве после пункционной биопсии (ТАБ-РЭА) у больных МРЩЖ [12].
Цель исследования – оценить информативность и предложить пороговое значение ТАБ-КТ и ТАБ-РЭА для диагностики МРЩЖ.
Материал и методы
Ретроспективный анализ 164 пунктатов узлов ЩЖ, полученных у 92 пациентов с узловыми образованиями щитовидной железы, которым проводилась тонкоигольная аспирационная биопсия с последующим цитологическим исследованием и определением ТАБ-КТ. В 29 пунктатах дополнительно исследовали ТАБ-РЭА.
Пункционная аспирационная биопсия узлов ЩЖ проводилась под контролем УЗИ. После приготовления цитологического мазка пункционная игла промывалась в 1 мл физраствора, в котором затем измеряли концентрацию КТ и РЭА. Определяли КТ и РЭА с помощью электрохемилюминесцентного иммуноанализа на платформе Cobas e (Roche Diagnostics, Germany). Диапазон измерения КТ 0,5 – 2000 пг/мл, РЭА 0,2 – 1000 нг/мл. Значение КТ>2000 пг/мл и РЭА>1000 нг/мл учитывали как равное 2000 пг/мл и 1000 нг/мл соответственно.
Референсный диапазон КТ в сыворотке у женщин и мужчин – менее 9,8 пг/мл и 14,3 пг/мл соответственно; РЭА в сыворотке – менее 4,7 нг/мл.
Цитологическое исследование проведено во всех 164 случаях. Оперировано 36 больных с гистологической верификацией 58 узловых образований.
Результаты ТАБ-КТ и ТАБ-РЭА сопоставлены с цитологией и данными послеоперационного гистологического заключения, если оно проводилось. В случае расхождения цитологического и гистологического результатов гистологическое заключение считалось приоритетным.
Статистический анализ проведен с помощью программ SPSS Statistics 17.0 и Microcal Origin. Описательная статистика оценивала характер распределения в выборке и была представлена в виде медианы и перцентилей. Сравнение групп проводили с использованием критерия Манна–Уитни (Mann–Whitney U-test). Различия между группами считали значимыми при p<0,05. Пороговое значение ТАБ-КТ и ТАБ-РЭА определяли при помощи ROC-анализа с учетом оптимальной чувствительности и специфичности. Диагностическая значимость тестов оценивалась по показателям чувствительности, специфичности, точности и прогностической ценности положительного и отрицательного результата.
Результаты
По данным гистологического исследования МРЩЖ верифицирован в 17 образцах (10,4 %), папиллярный рак – в 13, Гюртле-клеточный рак – в 2, фолликулярный рак – в 1, фолликулярная аденома – в 10, в том числе у 2 из оксифильных клеток, узловой зоб – в 15 случаях. Остальные 106 (64,6 %) образований гистологически не верифицированы, и диагноз основан на цитологическом заключении: узловой зоб – 99, фолликулярная опухоль – 6, папиллярный рак – 1 (табл. 1).
Чувствительность цитологического исследования в диагностике МРЩЖ составила 71 % (12/17). Из 5 случаев МРЩЖ, не выявленных при цитологическом исследовании, 2 интерпретированы как фолликулярная опухоль, 1 – как узловой зоб и в 2 случаях получен неинформативный материал (Bethesda I, 2017).
Концентрация ТАБ-КТ в узлах МРЩЖ во всех случаях, кроме одного, была >2000 пг/мл, в одном – 638 пг/мл (рис. 1). В узлах без МРЩЖ (не-МРЩЖ) уровень ТАБ-КТ варьировал от 0,5 до 2000 пг/мл (табл. 1), но в большинстве случаев (81 %) не превышал 10 пг/мл и в 90 % был <100 пг/мл. В 5 % (7/147) узлов не-МРЩЖ уровень ТАБ-КТ был > 500 пг/мл, в 2 % (3/147) – >1000 пг/мл.
При анализе ROC-кривой, с включением только гистологически подтвержденных случаев (n=58), при пороговом значении 438 пг/мл чувствительность ТАБ-КТ – 100 %, специфичность – 98 %, при
Таблица 1/Table 1
|
Диагноз/Diagnosis |
Кальцитонин в смыве, пг/мл/FNA-CT, pg/ml |
|||||
|
Ме |
Min |
25 % |
75 % |
95 % |
Max |
|
|
МРЩЖ/MTC (n=17) |
2000,0 |
638,1 |
2000,0 |
2000,0 |
2000,0 |
2000,0 |
|
не-МРЩЖ (гистологически подтверждены, n=41)/ non-MTC (histologically confirmed, n=41):
|
1,2 |
0,5 |
0,8 |
2,8 |
192,8 |
938,3 |
|
не-МРЩЖ (гистологически не подтверждены, n=106)/ non-MTC (no histological confirmation, n=106): - УЗ/ХТ/NG/AIT (n=99); |
1,1 |
0,5 |
0,5 |
3,9 |
541,7 |
2000,0 |
- ФО/FN (n=6);
ТАБ-КТ в узловых образованиях МРЩЖ и не-МРЩЖ
FNA-CT concentration in MTC and non-MTC nodules
- ПРЩЖ/PTC (n=1)
Примечание: МРЩЖ – медуллярный рак щитовидной железы; ПРЩЖ – папиллярный рак щитовидной железы; ФРЩЖ – фолликулярный рак щитовидной железы; ГРЩЖ – Гюртле-клеточный рак щитовидной железы; ФА – фолликулярная аденома; ФО – фолликулярная опухоль; УЗ – узловой зоб; ХТ – хронический тиреоидит. Различия между группой МРЩЖ и не-МРЩЖ значимые (p<0,0001, Mann–Whitney test); таблица составлена авторами.
Note: MTC – medullary thyroid cancer; PTC – papillary thyroid cancer; FTC – follicular thyroid cancer; HTC – Hurthle cell thyroid cancer; FA – follicular adenoma; FN – follicular neoplasia; NG – nodular goiter; AIT – autoimmune thyroiditis. Differences between MTC and non-MTC statistically significant (p<0.0001, Mann–Whitney test); created by the authors.
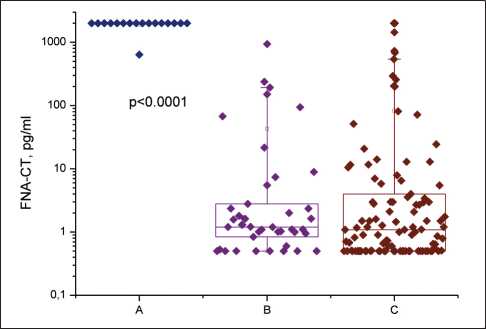
Рис. 1. Концентрация ТАБ-КТ (пг/мл) в узлах, верифицированных гистологически как МРЩЖ (А); МРЩЖ исключен (В); цитологически нет данных за МРЩЖ, но без гистологического подтверждения (С). Точки показывают значение ТАБ-КТ (пг/мл); прямоугольники – 25 и 75 перцентиль; усы – 5 и 95 перцентиль. Различия между группами А и В (p<0,0001, Mann–Whitney test), А и С (p<0,0001, Mann–Whitney test), В и С (p=0,32, Mann–Whitney test). Примечание: рисунок выполнен авторами
Fig. 1. FNA-CT concentration (pg/ml) in thyroid nodules histologically verified as MTC (A); non-MTC (B); no cytological evidence for MTC, but no histological confirmation (C). Dots indicate FNA-CT value (pg/ml), rectangles – 25th and 75th percentiles$ whiskers – 5th and 95th percentiles. Differences between groups A and B (p<0.0001; Mann–Whitney test); A and C (p<0.0001, Mann–Whitney test), B and C (p=0.32, Mann– Whitney test). Note: created by the authors
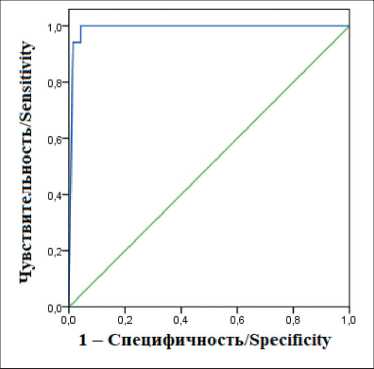
Рис. 2. ROC-анализ значений КТ в смыве из иглы для диагностики МРЩЖ. Площадь под кривой (AUC)=0,99. Примечание: рисунок выполнен авторами
Fig. 2. ROC-analysis of FNA-CT values for the diagnosis of MTC. AUC=0.99. Note: created by the authors
пороге 1469 пг/мл чувствительность и специфичность – 94 % и 100 % соответственно (площадь под кривой AUC=0,99).
При включении в ROC-анализ также неопе-рированных пациентов (n=164) при пороговом значении 590 пг/мл чувствительность ТАБ-КТ составила 100 %, специфичность – 96 %, при пороге 1721 пг/мл чувствительность и специфичность – 94 и 99 % соответственно (рис. 2). Доля ложноположительных результатов при пороге ТАБ-КТ 590 пг/мл и 1721 пг/мл составила 3,7 % (6/164) и 1,2 % (2/164) соответственно.
Среди всех узлов не-МРЩЖ 11 образований пунктировано у больных с сопутствующим МРЩЖ (в окружающей тиреоидной ткани). Медиана [Q1; Q3] ТАБ-КТ в этой подгруппе составила 2,8 [1,7; 37,9] пг/мл, что значимо выше, чем у пациентов без МРЩЖ, – 1,1 [0,5; 3,0] пг/мл (р=0,008, Mann–Whitney U-test). В 3 узлах с ТАБ-КТ от 25 до 94 пг/мл уровень сывороточного КТ был >2000 пг/мл, что
Таблица 2/Table 2
Характеристика неоперированных пациентов без МРЩЖ с высоким уровнем ТАБ-КТ Characteristics of non-operated non-MTC patients with high FNA-CT levels
|
Пациент, пол/возраст/ Patient,sex/age |
Обследование в динамике/ Checkup number |
ТАБ–КТ, пг/мл/ FNA–CT, pg/ml |
Цитология/ Cytology |
КТ сыворотки, пг/мл/ Serum CT, pg/ml |
РЭА сыворотки/ Serum CEA, ng/ml |
Наблюдение/ Follow up |
|
К., ж/61/ |
1. |
>2000 |
УЗ/NG |
14,1 |
10 мес/ |
|
|
1,7 |
||||||
|
K., f/61 |
2. |
УЗ/NG |
12,1 |
10 month |
||
|
3. |
81 |
УЗ/NG |
12,3 |
— |
||
|
П., м/41/ |
1. |
>2000 |
УЗ/NG УЗ+ХТ/ |
24,6 |
— |
7 мес/ |
|
P., m/41 |
2. |
0,5 |
28,7 |
2,7 |
7 month |
|
|
NG+AIT |
||||||
|
С., м/54/ |
1. |
НИ/ND |
13,7 |
26 мес/ |
||
|
684,5 |
2,9 |
|||||
|
S., m/54 |
2. |
УЗ/NG |
11,6 |
26 month |
||
|
36,7 |
4,1 |
|||||
|
3. |
УЗ/NG |
16,5 |
||||
|
П., м/65/ |
НИ/ND |
1 мес/ |
||||
|
1. |
– |
УЗ+ХТ/ |
21,1 |
– |
||
|
P., m/65 |
2. |
541,7 |
30,7 |
0,9 |
1 month |
|
|
NG+AIT |
||||||
|
Н., ж/59/ |
1. |
— |
УЗ/NG |
9,5 |
— |
3 мес/ |
|
N., f/59 |
2. |
731,5 |
УЗ/NG |
6,9 |
— |
3 month |
|
М., м/42/ |
||||||
|
M., m/42 |
1. |
1442 |
ФО/FN |
29,8 |
– |
– |
Примечание: НИ – неинформативный результат; УЗ – узловой зоб; ФО – фолликулярная опухоль;ХТ – хронический тиреоидит; таблица составлена авторами.
Note: ND – non diagnostic smear; NG – nodular goiter; FN – follicular neoplasia; AIT – autoimmune thyroiditis; created by the authors.
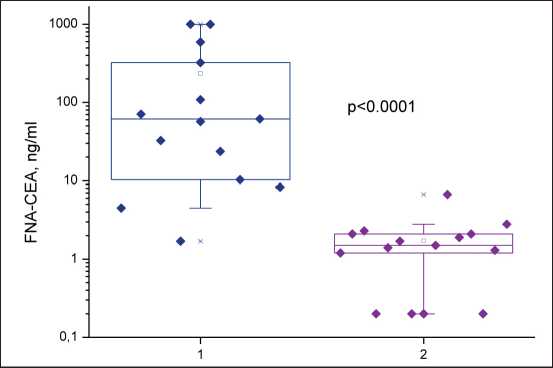
Рис. 3. Концентрация ТАБ-РЭА в узлах МРЩЖ (слева) и не-МРЩЖ (справа). Точки показывают значение ТАБ-РЭА (нг/мл); прямоугольники – 25 и 75 перцентиль; усы – 5 и 95 перцентиль. Примечание: рисунок выполнен авторами Fig. 3. FNA-CEA concentration in MTC (left) non-MTC (right) nodules. Dots indicate FNA-CEA value (ng/mL), rectangles – 25th and 75th percentiles, whiskers – 5th and 95th percentiles. Note: created by the authors
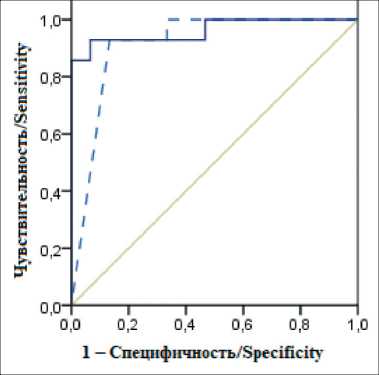
Рис. 4. ROC-анализ значений ТАБ-РЭА для диагностики МРЩЖ у пациентов с ТАБ-КТ>50 пг/мл. Кривая ТАБ-РЭА – сплошная линия; ТАБ-КТ – пунктирная. Площадь под кривой
AUC (ТАБ-РЭА)=0,96; AUC (ТАБ-КТ)=0,91. Примечание: рисунок выполнен авторами
Fig. 4. ROC-analysis of FNA-CEA values for the diagnosis of MTC in patients with FNA-CT>50 pg/ml. The FNA-CEA curve is a solid line; the FNA-CT curve is a dotted line. AUC (FNA-
CEA)=0.96, AUC (FNA-CT)=0.91. Note: created by the authors
позволяет предположить, что умеренно повышенный ТАБ-КТ может быть связан с контаминацией сывороточным КТ. Тем не менее исключение этих 11 результатов из ROC-анализа не привело к изменению рассчитанного порогового значения, чувствительности и специфичности, вероятно, из-за малого количества случаев.
У всех неоперированных пациентов с ТАБ-КТ >500 пг/мл уровень сывороточного КТ не превышал 30 пг/мл, и при цитологическом исследовании отсутствовали признаки МРЩЖ. У 2 пациентов с ТАБ-КТ >2000 пг/мл при повторной биопсии с определением ТАБ-КТ уровень последнего снизился до 81 и 0,5 пг/мл. У одного пациента при повторной биопсии ТАБ-КТ снизился с 684,5 пг/мл до 36,7 пг/мл. Один пациент с ТАБ-КТ 1442 пг/мл и цитологической картиной, подозрительной на фолликулярную опухоль, повторно не явился на обследование. Остальные пациенты находятся под наблюдением без признаков МРЩЖ (табл. 2).
Для оценки диагностической значимости ТАБ-РЭА были отобраны пунктаты с содержанием ТАБ-
Таблица 3/Table 3
Результаты ТАБ-КТ и ТАБ-РЭА, цитологического заключения в узловых образованиях различной природы
Results of FNA-CT, FNA-CEA, and cytological findings in nodules of various nature
|
№ |
КТ в смыве, пг/мл/ FNA-CT, pg/ml |
РЭА в смыве, нг/мл/ FNA-CEA, ng/ml |
КТ в сыворотке, пг/мл/ Serum CT, pg/ml |
Цитология/ Cytology |
Гистология/Histology |
|
1 |
>2000 |
57,1 |
175,1 |
МРЩЖ/MTC |
МРЩЖ/MTC |
|
2 |
>2000 |
>1000 |
857,2 |
НИ/ND |
МРЩЖ/MTC |
|
3 |
>2000 |
1,7 |
128 |
МРЩЖ/MTC |
МРЩЖ/MTC |
|
4 |
>2000 |
23,6 |
45,8 |
ФО/FN |
МРЩЖ/MTC |
|
5 |
>2000 |
32,5 |
619,4 |
МРЩЖ/MTC |
МРЩЖ/MTC |
|
6 |
>2000 |
10,3 |
8058 |
МРЩЖ/MTC |
МРЩЖ/MTC |
|
7 |
>2000 |
108,4 |
334,9 |
НИ/ND |
МРЩЖ/MTC |
|
8 |
>2000 |
70,8 |
25,1 |
МРЩЖ/MTC |
МРЩЖ/MTC |
|
9 |
>2000 |
61,5 |
9124 |
УЗ/NG |
МРЩЖ/MTC |
|
10 |
>2000 |
4,5 |
291,2 |
МРЩЖ/MTC |
МРЩЖ/MTC |
|
11 |
>2000 |
323,1 |
64,7 |
МРЩЖ/MTC |
МРЩЖ/MTC |
|
12 |
>2000 |
8,3 |
31,3 |
МРЩЖ/MTC |
МРЩЖ/MTC |
|
13 |
>2000 |
592,2 |
101,1 |
МРЩЖ/MTC |
МРЩЖ/MTC |
|
14 |
638,1 |
>1000 |
308,6 |
МРЩЖ/MTC |
МРЩЖ/MTC |
|
15 |
237,7 |
0,2 |
32,2 |
НИ/ND |
ФА/FA |
|
16 |
150,6 |
0,2 |
17,6 |
РЩЖ/TC |
УЗ, ХТ/NG, AIT |
|
17 |
94,1 |
1,5 |
8058 |
ФО/FN |
ФА/FA |
|
18 |
67,6 |
1,7 |
15,6 |
ФО/FN |
ФА оксиф/FA oxiphillic |
|
19 |
>2000 |
6,7 |
14,1 |
УЗ/NG |
Не оперирован/No surgery |
|
20 |
>2000 |
1,4 |
25,1 |
ХТ/AIT |
Не оперирован/No surgery |
|
21 |
1442,2 |
1,9 |
29,8 |
ФО/FN |
Не оперирован/No surgery |
|
22 |
731,5 |
0,2 |
6,9 |
УЗ/NG |
Не оперирован/No surgery |
|
23 |
684,5 |
2,1 |
11,6 |
УЗ/NG |
Не оперирован/No surgery |
|
24 |
541,7 |
2,3 |
30,7 |
УЗ/NG |
Не оперирован/No surgery |
|
25 |
257,2 |
0,2 |
16,9 |
УЗ/NG |
Не оперирован/No surgery |
|
26 |
200,1 |
2,1 |
20,5 |
УЗ/NG |
Не оперирован/No surgery |
|
27 |
71,7 |
1,3 |
6,2 |
УЗ/NG |
Не оперирован/No surgery |
|
28 |
54,4 |
1,2 |
9124 |
УЗ/NG |
Не оперирован/No surgery |
|
29 |
51,4 |
2,8 |
9124 |
УЗ/NG |
Не оперирован/No surgery |
Примечание: МРЩЖ – медуллярный рак щитовидной железы; РЩЖ – рак щитовидной железы; ФА – фолликулярная аденома; ФО – фолликулярная опухоль; УЗ – узловой зоб; ХТ – хронический тиреоидит; НИ – неинформативный результат (Bethesda I, 2017); таблица составлена авторами.
Note: MTC – medullary thyroid cancer; TC – thyroid cancer; FA – follicular adenoma; FN – follicular neoplasia; NG – nodular goiter; AIT – autoimmune thyroiditis; ND – non diagnostic smear (Bethesda I, 2017); created by the authors.
КТ>50 пг/мл (n=29). Из них при гистологическом исследовании 14 образований верифицировано как МРЩЖ, в 4 МРЩЖ исключен, 11 не оперированы (табл. 3).
Концентрация ТАБ-РЭА при МРЩЖ значимо отличалась от таковой из узлов другой природы (р <0,0001, Mann–Whitney U-test). Медиана [Q1;Q3] ТАБ-РЭА при МРЩЖ составила 59,3 [9,8; 390,0] нг/мл, при не-МРЩЖ – 1,5 [0,2; 2,1] нг/мл (рис. 3).
По данным ROC-анализа при пороговом значении ТАБ-РЭА 3,7 нг/мл чувствительность составила 93 %, специфичность – 93 %, при пороговом значении 7,5 нг/мл – 86 и 100 % соответственно. Площадь под кривой (AUC) для ТАБ-РЭА – 0,96, для ТАБ-КТ в этой же подгруппе – 0,91 (рис. 4).
Если рассматривать ТАБ-РЭА как уточняющий тест при повышенном ТАБ-КТ и отрицательной цитологии, решено использовать порог ТАБ-РЭА 7,5 нг/мл, как обеспечивающий максимальную специфичность. При сравнении ТАБ-КТ и ТАБ-РЭА в данной подгруппе частота ложноположительных результатов ТАБ-КТ при пороге 590 пг/мл и 1721 пг/мл составила 17,2 % (5/29) и 6,9 % (2/29) соответственно. Дополнительное определение ТАБ-РЭА исключило все ложноположительные результаты ТАБ-КТ, но не выявило МРЩЖ у 2 пациентов с низким ТАБ-РЭА (ложноотрицательные – 6,9 %). Среди образцов с ТАБ-КТ >590 пг/мл и отрицательной цитологией (n=9) ТАБ-РЭА при пороге 7,5 нг/мл позволил дифференцировать МРЩЖ от других заболеваний (табл. 3).
Сводные данные по информативности цитологии, ТАБ-КТ и ТАБ-РЭА в диагностике МРЩЖ представлены в табл. 4.
Таблица 4/Table 4
Диагностическая значимость цитологии, ТАБ-КТ и ТАБ-РЭА в диагностике МРЩЖ diagnostic value of cytology, FNA-CT and FNA-CEA in the diagnosis of MTC
|
Метод (количество узлов)/ Method (thyroid nodules) |
Порог/ Cut–off |
Чувствительность/ Sensitivity |
Специфичность/ Specificity |
Точность/ Accuracy |
ПЦПР/ PPV |
ПЦОР/ NPV |
|
Цитология/ Cytology (n=164) |
– |
71 % |
99 % |
96 % |
92 % |
97 % |
|
ТАБ–КТ/ FNA–CT (n=164) |
590 пг/мл/ng/ml 1721 пг/мл/ng/ml |
100 % 94 % |
96 % 99 % |
96 % 98 % |
74 % 89 % |
100 % 99 % |
|
ТАБ–РЭА/ FNA–CEA (n=29) |
7,5 нг/мл/ng/ml |
86 % |
100 % |
93 % |
100 % |
88 % |
Примечание: ПЦПР – прогностическая значимость положительного результата; ПЦОР – прогностическая значимость отрицательного результата; таблица составлена авторами.
Note: PPV – positive prognostic value, NPV – negative prognostic value; created by the authors.
Предлагаемые пороговые значения ТАБ-КТ
Proposed FNA-CT thresholds
Таблица 5/Table 5
|
Автор, год/ Author, year |
Количество узлов ЩЖ/МРЩЖ/опери-ровано/ Number of thyroid nodes/MTC/operated |
Порог ТАБ-КТ, пг/мл (чувствительность/ специфичность)/ FNA-CT cut-off, pg/ml (sensitivity specificity) |
Раствор для смыва/ Washout solution |
Метод определения КТ/ CT assay |
Расчет порога/ Cut-off estimation |
|
В 3 раза > макс. значения |
|||||
|
Boi [14], 2007 |
18/10/14 |
36 (100 %/100 %) |
0,5 мл буфера/ CT-free buffer |
Immulite |
ТАБ-КТ при не-МРЩЖ/ 3 times > max FNA-CT |
|
in non-MTC cases |
|||||
|
Diazzi [8], 2013 |
60/10/60 |
17 (100 %/80 %) 1000 (36 %/100 %) |
1 ml 0,9 % NaCl/ |
Dia Sorin |
Сравнение нескольких порогов/ Multiple cut-off comparison |
|
ROC-анализ для КТ сыворотки |
|||||
|
Trimboli [13], |
86/34/86 |
39,6 (100 %/100 %) |
1 ml 0,9 % |
Immulite |
+ макс. CV*/ |
|
2014 |
NaCl/ |
ROC analisis for serum CT+max |
|||
|
CV* |
|||||
|
De Crea [15], 2014 |
62/18/62 |
10,4 (89 %/100 %) |
0,5 ml 0,9 % NaCl |
Dia Sorin |
ROC-анализ для ТАБ-КТ/ ROC analisis for FNA-CT |
|
Kihara [9], |
180/39/180 |
21 (100 %/100 %) |
0,5 мл 0,9 % |
Roche |
ROC-анализ для ТАБ-КТ/ |
|
2018 |
NaCl |
Diagnostics |
ROC analisis for FNA-CT |
||
|
Liu [16], 2021 |
87/69/69 |
36 (98,6 %/100 %) |
1 ml 0,9 % NaCl |
Mindray |
Рекомендованный Boi [14]/ According to Boi [14] |
|
Our data |
164/17/58 |
590 (100 %/96 %) |
1 ml 0,9 % |
Roche |
ROC-анализ для ТАБ-КТ/ |
|
1721 (94 %/99 %) |
NaCl |
Diagnostics |
ROC analisis for FNA-CT |
Примечание: * – межлабораторный коэффициент вариации для кальцитонина (15,6 %); таблица составлена авторами.
Note: * – interlaboratory coefficient of variation for calcitonin (15,6 %); created by the authors.
Обсуждение
Выявление высокого уровня ТАБ-КТ в узле ЩЖ является полезным дополнением к цитологическому исследованию для диагностики МРЩЖ [5, 13]. Однако отсуствие единого порогового значения, а также наличие ложноположительных результатов из-за С-клеточной гиперплазии затрудняют интерпретацию данного теста и выбор тактики ведения пациентов с высоким ТАБ-КТ и отрицательной цитологией.
Предлагались разные пороговые значения для ТАБ-КТ. По данным C. Diazzi et al. [8], достоверно судить о МРЩЖ можно при ТАБ-КТ >1000 пг/мл, в диапазоне 36–1000 пг/мл может быть и МРЩЖ и С-клеточная гиперплазия, ТАБ-КТ <17 пг/мл исключает МРЩЖ в узле. Предлагались также другие пороговые значения – от 10,4 до 39,6 пг/мл (табл. 5).
Выбор порогового значения зависел от выборки и метода расчета. Некоторые исследователи включили в анализ только гистологически подтвержденные случаи [8, 13], другие включали также образцы неоперированных пациентов [14]. В некоторых работах помимо узлов ЩЖ учитывали также пунктаты из лимфатических узлов [13–15], при включении которых пороговое значение ожидаемо будет ниже, так как меньше ложноположительных результатов за счет отсутствия С-клеточной гиперплазии в лимфоузлах. Чаще выбор порогового значения основывался на ROC-анализе. Но ROC-анализ проводился как по сывороточному КТ [13], так и по ТАБ-КТ [9, 15]. F. Boi et al. [14] установили пороговое значение как 3-кратное превышение максимального значения ТАБ-КТ в группе не-МРЩЖ. Отличались также методы определения ТАБ-КТ и объем раствора, в котором промывалась игла (табл. 5).
Стоит отметить, что количество узловых образований, в которых определяли ТАБ-КТ, было также невелико. Максимальная серия (180 узлов) представлена M. Kihara et al. [9], которые предложили порог ТАБ-КТ 21 пг/мл, но они отмечают, что у больных МРЩЖ при пункции сопутствующих узлов иной природы (не-МРЩЖ) уровень ТАБ-КТ выше, что может быть связано с интерференцией с сывороточным КТ и прохождением иглы через очаги С-клеточной гиперплазии. В 6 таких случаях из 7 уровень ТАБ-КТ был >21 пг/мл, в 2 – >600 пг/мл.
Мы провели исследование ТАБ-КТ в 164 пун-ктатах узлов различной природы. В большинстве образцов МРЩЖ (94 %) ТАБ-КТ превышал 2000 пг/мл. В узлах не-МРЩЖ ТАБ-КТ чаще (81 %) был <10 пг/мл. Однако в 5 % не-МРЩЖ уровень ТАБ-КТ был >500 пг/мл и в 2 % был >1000 пг/мл. С другой стороны, в одном образце МРЩЖ ТАБ-КТ был равен 638 пг/мл, что затрудняет интерпретацию высоких значений ТАБ-КТ. Используя ROC-анализ, мы установили 2 пороговых значения с максимальной чувствительностью (100 %) – 590 пг/мл и с максимальной специфичностью (99 %) – 1721 пг/мл. Частота ложноположительных результатов при пороге ТАБ-КТ 590 пг/мл и 1721 пг/мл составила 3,7 и 1,2 % соответственно. Наши данные отличаются от ранее проведенных иследований более высоким значением порога ТАБ-КТ, что может быть связано как с особенностями выборки (только узлы ЩЖ), так и с методом определения ТАБ-КТ. M. Kihara et al. [9] использовали аналогичный метод Roche Diagnostics для определения ТАБ-КТ и при рекомендованном пороге 21 пг/мл отмечали, что в узлах не-МРЩЖ ТАБ-КТ может быть >600 пг/мл, но эти данные, видимо, не включены в расчет порога. В нашем исследовании было также 11 образцов не-МРЩЖ, полученных у больных МРЩЖ, и уровень ТАБ-КТ в них был выше, видимо, за счет контаминации сывроточным КТ, однако это не повлияло на рассчитанное значение порога.
Тактика ведения больных с высоким ТАБ-КТ и отрицательным цитологическим заключением представляет дилемму. С одной стороны, чувствительность цитологического исследования при диагностике МРЩЖ невысока и составляет, по данным метаанализа [5], в среднем 54 % [95 % ДИ 0,35;
0,74], и ТАБ-КТ является более чувствительным методом [5, 13]. С другой стороны, прохождение иглы во время пункции через очаг С-клеточной гиперплазии снижает специфичность ТАБ-КТ за счет ложноположительных результатов. Поэтому при получении высокого ТАБ-КТ и отрицательной цитологии решение о тактике принимается индивидуально, с учетом дополнительных факторов, таких как уровень сывороточного КТ и его динамика, наследственный анамнез, уровень РЭА в сыворотке [6], и результатов иммуноцитохимического исследования при наличии адекватного количества клеток в мазке [9]. C. Diazzi et al. [8] предлагали оперировать пациентов с ТАБ-КТ >1000 пг/мл. Однако в нашем исследовании у 2 пациентов с ТАБ-КТ >2000 пг/мл и отрицательной цитологией при повторной пункции ТАБ-КТ снизился до 81 и 0,5 пг/мл, что свидетельствует в пользу того, что такие пациенты скорее нуждаются в динамическом наблюдении и, возможно, повторной ТАБ-КТ, по крайней мере, при умеренно повышенном уровне сыворотчного КТ и отсутствии других данных за МРЩЖ.
Для снижения ложноположительных результатов ТАБ-КТ мы решили исследовать возможности ТАБ-РЭА. РЭА является вторым опухолевым маркером МРЩЖ, который обычно определяют в сыворотке больных МРЩЖ после тиреоидэктомии для диагностики прогрессирования [1]. Предлагалось также исследовать сывороточный РЭА до операции для оценки распространенности МРЩЖ и планирования лимфодиссекции [11, 17]. Определение ТАБ-РЭА ранее предложено P. Trimboli et al. [12]. У пациента с кистозной формой МРЩЖ уровень ТАБ-РЭА превышал 1000 нг/мл при умеренно повышенном сывороточном РЭА 6,4 нг/мл.
Мы провели исследование ТАБ-РЭА в 29 образцах с высоким и умеренно повышенным уровнем ТАБ-КТ с целью изучения возможности ТАБ-РЭА уменьшить количество ложноположительных результатов ТАБ-КТ. Используя ROC-анализ, мы установили пороговое значение ТАБ-РЭА 7,5 нг/мл (чувствительность – 86 %, специфичность – 100 %). Дополнительное определение ТАБ-РЭА исключило все ложноположительные результаты ТАБ-КТ. Среди образцов с ТАБ-КТ >590 пг/мл и отрицательной цитологией ТАБ-РЭА позволил дифференцировать МРЩЖ от других заболеваний с чувствительностью и специфичностью, равными 100 %.
Данное исследование имеет ограничение. Не все образцы, в том числе с высоким ТАБ-КТ, подтверждены гистологически, и окончательный диагноз в 106 случаях базировался на цитологическом заключении и наблюдении. Не проведено иммуногистохимическое исследование оперированных случаев не-МРЩЖ с высоким ТАБ-КТ, что позволяет лишь предположить наличие С-клеточной гиперплазии. ТАБ-РЭА определен лишь в 14 образцах МРЩЖ и 15 – без МРЩЖ, что позволяет сделать лишь предварительные выводы о пользе данного маркера в смыве для диагностики МРЩЖ. Цитологическое заключение в ряде случаев получено после исследования сывороточного КТ и ТАБ-КТ, что могло повлиять на результативность цитологического исследования в диагностике МРЩЖ.
Заключение
Определение ТАБ-КТ и ТАБ-РЭА в узле ЩЖ является полезным дополнением к цитологическому исследованию для диагностики МРЩЖ. Максимальная вероятность МРЩЖ в узле ЩЖ
Список литературы Определение кальцитонина и РЭА в пунктате узла щитовидной железы для диагностики медуллярного рака щитовидной железы
- Wells S.A. Jr., Asa S.L., Dralle H., Elisei R., Evans D.B., Gagel R.F., Lee N., Machens A., Moley J.F., Pacini F., Raue F., Frank-Raue K., Robinson B., Rosenthal M.S., Santoro M., Schlumberger M., Shah M., Waguespack S.G.; American Thyroid Association Guidelines Task Force on Medullary Thyroid Carcinoma. Revised American Thyroid Association guidelines for the management of medullary thyroid carcinoma. Thyroid. 2015; 25(6): 567–610. doi: 10.1089/thy.2014.0335.
- Costante G., Meringolo D. Calcitonin as a biomarker of C cell disease: recent achievements and current challenges. Endocrine. 2020; 67(2): 273–80. doi: 10.1007/s12020-019-02183-6.
- Elisei R. Routine serum calcitonin measurement in the evaluation of thyroid nodules. Best Pract Res Clin Endocrinol Metab. 2008; 22(6): 941–53. doi: 10.1016/j.beem.2008.09.008.
- Северская Н.В., Чойнзонов Е.Л., Решетов И.В., Иванов С.А., Поляков А.П., Кропотов М.А., Мудунов А.М., Полькин В.В., Исаев П.А., Ильин А.А., Бельцевич Д.Г., Ванушко В.Э., Румянцев П.О., Мельниченко Г.А., Алымов Ю.В., Романов И.С., Игнатова А.В., Бородавина Е.В., Крылов В.В., Шуринов А.Ю., Раджабова З.А., Кульбакин Д.Е., Невольских А.А., Геворков А.Р., Хмелевский Е.В., Кутукова С.И., Гузь А.О., Слепцов И.В., Черников Р.А., Степанова А.М., Фалалеева Н.А., Подвязников С.О., Рубцова Н.А., Рудык А.Н., Мусин Ш.И., Гулидов И.А., Владимирова Л.Ю., Семиглазова Т.Ю., Агабабян Т.А., Костромина Е.В. Проект клинических рекомендаций по диагностике и лечению медуллярного рака щитовидной железы у взрослых пациентов. Эндокринная хирургия. 2022; 16(3): 5–23. [Severskaya N.V., Choinzonov E.L., Reshe-tov I.V., Ivanov S.A., Polyakov A.P., Kropotov M.A., Mudunov A.M., Polkin V.V., Isaev P.A., Ilyin A.A., Beltsevich D.G., Vanushko V.E., Rumyantsev P.O., Melnichenko G.A., Alymov Yu.V., Romanov I.S., Ignatova A.V., Borodavina E.V., Krylov V.V., Shurinov A.Yu., Radjabova Z.A., Kulbakin D.E., Nevolskikh A.A., Gevorkov A.R., Khmelevsky E.V., Kutukova S.I., Guz A.O., Sleptsov I.V., Chernikov R.A., Stepanova A.M., Falaleeva N.A., Podvyaznikov S.O., Rubtsova N.A., Rudyk A.N., Musin S.I., Gulidov I.A., Vladimirova L.Yu., Semiglazova T.Yu., Aghababyan T.A., Kostromina E.V. Draft of clinical guidelines for the diagnosis and treatment of medullary thyroid cancer in adult patients. Endocrine Surgery. 2022; 16(3): 5–23. (in Russian)]. doi: 10.14341/serg12794.
- Trimboli P., Giannelli J., Marques B., Piccardo A., Crescenzi A., Deandrea M. Head-to-head comparison of FNA cytology vs. calcitonin measurement in FNA washout fluids (FNA-CT) to diagnose medullary thyroid carcinoma. A systematic review and meta-analysis. Endocrine. 2022; 75(1): 33–9. doi: 10.1007/s12020-021-02892-x.
- Северская Н.В., Ильин А.А., Чеботарева И.В., Желонкина Н.В., Исаев П.А., Полькин В.В., Иванов С.А., Каприн А.Д. Исследование кальцитонина у пациентов с узловыми образованиями щитовидной железы для скрининга медуллярного рака: «серая зона». Опухоли головы и шеи. 2022; 12(2): 79–88. [Severskaya N.V., Ilyin A.A., Chebotareva I.V., Zhelonkina N.V., Isaev P.A., Polkin V.V., Ivanova S.A., Kaprin A.D. Calcitonin testing in patients with thyroid nodules for screening medullary thyroid carcinoma: a “gray zone”. Head and Neck Tumors. 2022; 12(2): 79–88. (in Russian)]. doi: 10.17650/2222-1468-2022-12-2-79-88.
- Gharib H., Papini E., Garber J.R., Duick D.S., Harrell R.M., Hegedüs L., Paschke R., Valcavi R., Vitti P.; AACE/ACE/AME Task Force on Thyroid Nodules. American Association of Clinical Endocrinologists, American College of Endocrinology, and Associazione Medici Endocrinologi Medical Guidelines for Clinical Practice for the Diagnosis and Management of Thyroid Nodules--2016 Update. Endocr Pract. 2016; 22(5): 622–39. doi: 10.4158/EP161208.GL.
- Diazzi C., Madeo B., Taliani E., Zirilli L., Romano S., Granata A.R., De Santis M.C., Simoni M., Cioni K., Carani C., Rochira V. The diagnostic value of calcitonin measurement in wash-out fluid from fine-needle aspiration of thyroid nodules in the diagnosis of medullary thyroid cancer. Endocr Pract. 2013; 19(5): 769–79. doi: 10.4158/EP12420.OR.
- Kihara M., Hirokawa M., Kudo T., Hayashi T., Yamamoto M., Masuoka H., Higashiyama T., Fukushima M., Ito Y., Miya A., Miyauchi A. Calcitonin measurement in fine-needle aspirate washout fluid by electrochemiluminescence immunoassay for thyroid tumors. Thyroid Res. 2018; 11: 15. doi: 10.1186/s13044-018-0059-4.
- Baloch Z.W., LiVolsi V.A. C-Cells and their Associated Lesions and Conditions: A Pathologists Perspective. Turk Patoloji Derg. 2015; 31(s1): 60–79. doi: 10.5146/tjpath.2015.01315.
- Machens A., Ukkat J., Hauptmann S., Dralle H. Abnormal carcinoembryonic antigen levels and medullary thyroid cancer progression: a multivariate analysis. Arch Surg. 2007; 142(3): 289–93. doi: 10.1001/archsurg.142.3.289.
- Trimboli P., Guidobaldi L., Locuratolo N., Piro F.R., Giordano M., Giovanella L. Serum markers measured in FNA fluids of medullary thyroid carcinoma occurring as a cyst. Int J Biol Markers. 2016; 31(2): 224–7. doi: 10.5301/jbm.5000205.
- Trimboli P., Cremonini N., Ceriani L., Saggiorato E., Guidobaldi L., Romanelli F., Ventura C., Laurenti O., Messuti I., Solaroli E., Madaio R., Bongiovanni M., Orlandi F., Crescenzi A., Valabrega S., Giovanella L. Calcitonin measurement in aspiration needle washout fluids has higher sensitivity than cytology in detecting medullary thyroid cancer: a retrospective multicentre study. Clin Endocrinol (Oxf). 2014; 80(1): 135–40. doi: 10.1111/cen.12234.
- Boi F., Maurelli I., Pinna G., Atzeni F., Piga M., Lai M.L., Mariotti S. Calcitonin measurement in wash-out fluid from fine needle aspiration of neck masses in patients with primary and metastatic medullary thyroid carcinoma. J Clin Endocrinol Metab. 2007; 92(6): 2115–8. doi: 10.1210/jc.2007-0326.
- de Crea C., Raffaelli M., Maccora D., Carrozza C., Canu G., Fadda G., Bellantone R., Lombardi C.P. Calcitonin measurement in fine-needle aspirate washouts vs. cytologic examination for diagnosis of primary or metastatic medullary thyroid carcinoma. Acta Otorhinolaryngol Ital. 2014; 34(6): 399–405.
- Liu Z., Zhou W., Han R., Zhou W., Zhang J., Li H., Wan Z., Jin Y., Shen L., Zhou Y., Wang S., Chen X., Ye L. Cytology versus calcitonin assay in fine-needle aspiration biopsy wash-out fluid (FNAB-CT) in diagnosis of medullary thyroid microcarcinoma. Endocrine. 2021; 74: 340–8. doi: 10.1007/s12020-021-02759-1.
- Turkdogan S., Forest V.I., Hier M.P., Tamilia M., Florea A., Payne R.J. Carcinoembryonic antigen levels correlated with advanced disease in medullary thyroid cancer. J Otolaryngol Head Neck Surg. 2018; 47(1): 55. doi: 10.1186/s40463-018-0303-x.


