Определение потенциала генетической изменчивости Triticum aestivum L., индуцированной с помощью химического мутагена фосфемида
Автор: Боме Н.А., Салех С., Утебаев М.У., Королев К.П., Вайсфельд Л.И.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Генетическая изменчивость
Статья в выпуске: 1 т.59, 2024 года.
Бесплатный доступ
Климатические изменения и растущий спрос на продукты питания делают необходимым поиск эффективных методов улучшения сельскохозяйственных растений. Из имеющихся селекционно-генетических инструментов, позволяющих создавать исходный материал с хозяйственно ценными признаками, перспективно применение индуцированного (искусственного) мутагенеза. В настоящей работе впервые установлен биологический потенциал химического мутагена фосфемида на яровой мягкой пшенице. Выявлено, что обработка семян водным раствором мутагена в оптимальных концентрациях эффективна для увеличения генетической изменчивости и отбора селекционно ценных форм. Нашей целью было увеличение генетического разнообразия яровой мягкой пшеницы ( Triticum aestivum L.) с использованием химического мутагена фосфемида, а также определение биологического потенциала мутантных образцов (М5, М6) по изменчивости различных категорий признаков в условиях Северного Зауралья. В качестве объектов исследования использовали 29 образцов яровой мягкой пшеницы, отобранных из мутантных популяций двух сортов Cara и Скэнт 3, гибрида (Cara × Скэнт 3), а также три контрольных сорта - Тюменская 25, Тюменская 29, Новосибирская 31. Мутантные образцы были получены с помощью химического мутагена фосфемида после обработки семян водным раствором в концентрациях 0,002 и 0,01 % в течение 3 ч. Идентификацию мутаций и проверку их стабильности провели во втором (М2) и третьем (М3) поколениях. В статье приведены результаты исследования мутантов пятого (М5) и шестого (М6) поколений в контрастных метеорологических условиях вегетационных периодов 2021-2022 годов. Посев, наблюдения, учеты, описание морфологических признаков и биологических свойств растений проводили на экспериментальном участке биостанции Тюменского государственного университета «Озеро Кучак» (Тюменская обл., Нижнетавдинский р-н). Электрофорез глиадинов был выполнен на зерновках урожая 2021 года (М5). На основе электрофоретического анализа зерна исходных и мутантных образцов составлены генетические формулы глиадина, определена частота аллелей глиадинкодирующих локусов ( Gli ) и показано, что применение химического мутагена фосфемида позволяет увеличить генетическое разнообразие яровой мягкой пшеницы. В полевых испытаниях выявлены значительные различия между генотипами по ряду количественных признаков (высота растений, линейные размеры и площадь флагового листа, число продуктивных колосьев на 1 м2, длина колоса, число и масса зерен в колосе). Основываясь на результатах корреляционного анализа, установлено, что сила связи между урожайностью и другими признаками зависит от метеорологических условий сезона вегетации. Под воздействием водного и теплового стресса увеличивалась зависимость зерновой продуктивности от числа растений ( r = 0,71, p 2, сохранившихся к уборке, высоты растений ( r = 0,82, p 0,05), числа зерен в колосе ( r = 0,73, p 2, у стандартных сортов 355,0-424,5 г/м2. Таким образом, потенциал адаптации яровой мягкой пшеницы в экстремальных условиях Северного Зауралья может быть увеличен за счет использования генетической изменчивости мутантных популяций. Доказан биологический эффект химического мутагена фосфемида для индуцирования полезных мутаций T. aestivum . Для увеличения генетического разнообразия эффективно комплексное использование мутационной и рекомбинационной изменчивости.
Triticum aestivum, яровая мягкая пшеница, генотип, мутантные формы, глиадинкодирующие локусы, стресс, устойчивость, количественные признаки, корреляция
Короткий адрес: https://sciup.org/142241617
IDR: 142241617 | УДК: 633.111.1:575.224.46.044 | DOI: 10.15389/agrobiology.2024.1.92rus
Текст научной статьи Определение потенциала генетической изменчивости Triticum aestivum L., индуцированной с помощью химического мутагена фосфемида
Климатические изменения, приводящие к засухам, засолению почв, преобладанию высоких температур, появлению новых болезней и вредителей, рассматриваются как серьезная угроза мировому растениеводству (1).
Растущий спрос на увеличение производства сельскохозяйственных культур с целью удовлетворения потребности в продуктах питания сделал необходимым поиск эффективных методов для улучшения растений.
Современное понимание селекционно-генетического улучшения растений предусматривает интеграцию традиционных и молекулярных методов. Из имеющихся селекционно-генетических инструментов, позволяющих создавать исходный материал культурных растений с хозяйственно ценными признаками, перспективно применение индуцированного (искусственного) мутагенеза. Методом мутационной селекции получено 3402 мутантных сорта различных сельскохозяйственных культур, зарегистрированных в базе данных Международного агентства по атомной энергии (ФАО/МАГАТЭ, , из них 265 сортов пшеницы (2).
Результативность молекулярно-генетического анализа зависит от свойств мутантной популяции, которые определяют частоту мутаций, их разнообразие и качество. Учитывая, что рекомбинационная изменчивость может усиливаться в меняющихся условиях среды (что характерно для резко континентального климата Западной Сибири), следует ожидать повышения вероятности возникновения форм растений с трансгрессивным выражением признаков в поколениях.
Чтобы использовать эти генетические ресурсы в селекционных программах, необходимо оценить степень их генетической и фенотипической изменчивости (3), что повысит эффективность процесса селекции (4). Морфологическая оценка растений остается одним из важных методов, несмотря на то, что морфологические признаки контролируются разными генами (5) и находятся под влиянием факторов окружающей среды (6).
Продолжается поиск химических веществ, обладающих мутагенными свойствами и позволяющих эффективно менять наследственную природу культурных растений (7, 8).
В настоящей работе впервые установлен биологический потенциал химического мутагена фосфемида на яровой мягкой пшенице. Выявлено, что обработка семян водным раствором мутагена в оптимальных концентрациях эффективна для увеличения генетической изменчивости и отбора селекционно ценных форм
Нашей целью было увеличение генетического разнообразия яровой мягкой пшеницы ( Triticum aestivum L.) с использованием химического мутагена фосфемида и определение биологического потенциала мутантных образцов (М 5 , М 6 ) по изменчивости различных категорий признаков в условиях Северного Зауралья.
Методика . Исходный материал яровой мягкой пшеницы Triticum aestivum L. был подобран по результатам предварительного изучения образцов из мировой коллекции Всероссийского института генетических ресурсов растений им. Н.И. Вавилова (ВИР) в Тюменской области в 2006-2010 годах.
Сорт Скэнт 3 (var. lutescens; оригинаторы — НИИ сельского хозяйства Северного Зауралья, Казахский НИИ земледелия и селекции) был создан методом индивидуального отбора из популяции F3 [F1 (Шторм ½ Саратовская 29) ½ Саратовская 29]; зарегистрирован по Тюменской области с 2003 года. Сорт Cara (к-64381, var. eritrospermum, Мексика) взят из мировой коллекции ВИР. По данным GRIS (Genetic Resources Information System for Wheat and Triticale, , сорт является носителем гена устойчивости Lr13. Гибрид F4 (Cara ½ Скэнт 3) отобран на основе диаллельного анализа признаков 5 родительских и 10 гибридных форм, полученных в Институте биологии Тюменского государственного университета.
Семена яровой пшеницы обрабатывали водным раствором фосфе-мида (0,002 %; 0,01 %) в течение 3 ч, в контроле семена выдерживали в дистиллированной воде. Фосфемид (phosphemidum), или ди-(этиленимид)-пиримидил-2-амидофосфорная кислота, — белый или желтоватый кристаллический порошок, растворимый в воде и спирте (препарат был синтезирован в Московском государственном университете им. М.В. Ломоносова).
Оценивали фенотипические изменения по морфологическим признакам колоса, стебля, листьев (окраска, опушение, форма, размеры) и по биологическим свойствам (позднеспелые, раннеспелые, растения озимого типа, карлики). Отбор во втором мутантном поколении (М 2 ), а также проверку на стабильность в третьем (М 3 ) и последующих поколениях проводили по признакам крупный, пирамидальный, спельтоидный колос, окраска соломины ярко-желтая и антоциановая, прочная соломина, широкий флаговый лист, высокорослые, позднеспелые, раннеспелые.
Нативный электрофорез запасного белка глиадина проводили на зерновках урожая 2021 года (М 5 ) по общепринятой методике (9) (Аналитический центр по определению качества почвы и растениеводческой продукции ТОО НПЦ ЗХ им. А.И. Бараева). Использовали вертикальные камеры для электрофореза VE-20 («Хеликон», Россия), химические реактивы категории extra pure («Sigma-Aldrich», США). Глиадины идентифицировали по каталогу аллелей глиадинкодирующих локусов (10). Обозначение локусов глиадина в соответствии с каталогом генов пшеницы было следующим: Gli-A1 , Gli-B1 , Gli-D1 , Gli-A2 , Gli-B2 и Gli-D2 (11).
В 2021-2022 годах провели полевое испытание 29 мутантных образцов пятого и шестого поколений (М 5 , М 6 ), хранящихся в Институте биологии Тюменского государственного университета. Образцы сравнивали с исходными сортами и гибридом, а также с сортами, выращиваемыми в Тюменской области, — Тюменская 25, Тюменская 29 и Новосибирская 31.
Посев, наблюдения, учеты, описание морфологических признаков и биологических свойств на экспериментальном участке биостанции Тюменского государственного университета «Озеро Кучак» (Тюменская обл., Нижнетавдинский р-н, 57°20 ‘ 57.3 ‘‘ N 66°03 ‘ 21.8 ‘‘ Е) были выполнены в соответствии с методическими указаниями (12, 13). Учетная площадь делянки — 1 м2, повторность опыта 4-кратная, размещение делянок рендомизирован-ное, число высеянных семян на 1 м2 — 650 шт. (из расчета 6,5 млн всхожих семян/га), междурядье — 20 см. Посев проводили во II декаде мая, уборку — вручную в фазу полной спелости зерна. Почва участка — дерново-подзолистая супесчаная с содержанием гумуса 3,67 %, рH 6,6.
Высоту растений измеряли от поверхности почвы, включая верхний лист или колос в зависимости от фенологической фазы. Содержание хлорофилла в клетках флаговых листьев определяли при помощи оптического счетчика SPAD 502 («Minolta Camera Co., Ltd.», Япония) на 10 растениях в солнечную погоду, в период между 1100 и 1400. Расчет площади листовой пластинки проводили по формуле (14):
A = LWb i , где L — длина листовой пластинки, см, W — максимальная ширина листовой пластинки, см; b i — 0,835.
После уборки подсчитывали растения и продуктивные колосья на 1 м2, определяли урожайность, а также число и массу зерна в колосе у 10 растений в каждой повторности.
Мониторинг условий окружающей среды осуществлялся с помощью профессиональной локальной метеостанции IMetos IMT300 («Pessl Instruments», Австрия), расположенной на экспериментальном участке, а также с использованием данных по среднесуточной температуре воздуха и осадкам справочно-информационного портала «Погода и климат» .
Статистическую обработку экспериментальных данных выполняли по апробированным методикам (12, 15) с использованием табличного процессора Microsoft Excel и программного обеспечения STATISTICA 6.0 («StatSoft, Inc.», США). Рассчитывали средние значения ( M ), стандартные ошибки средних (±SEM), коэффициенты вариации ( Cv , %), оценивали достоверности различий между средними значениями вариантов с использованием t -критерия Стьюдента; выполняли корреляционный анализ.
Результаты. Предварительные цитогенетические исследования по воздействию мутагена фосфемида на растения выполнили на модельном объекте Crepis capillaris L ., имеющем три пары четко различимых хромосом. Раствором фосфемида обрабатывали сухие семена, на проростках анализировали типы и число перестроек хромосом (16, 17). Важно было определить, как долго может сохраняться мутагенный эффект препарата. Мы установили, что при однократном применении мутагена фосфемида на семенах C. capillaris L. перестройки хромосом и частота проростков с митозами обнаруживаются в течение 3 мес. Следовательно, можно предположить, что при хранении обработанных семян мутаген фосфемид не разлагается и его эффект практически не снижается (16, 17).
На основании полученных результатов в исследовании на сортах и гибридной форме T. aestivum применяли однократную обработку семян с последующим использованием в лабораторном и полевом опытах. При подборе объекта исследования исходили из того факта, что указанный мутаген ранее не применялся, и одной из задач было определение его эффективности по частоте и спектру мутаций. В связи с этим мы отбирали такие образцы, которые бы отличались по ботанической и географической принадлежности и предположительно могли бы различаться реакцией на действие фосфемида. В поколении М 2 был идентифицирован широкий спектр мутаций с измененными растениями (12 типов) с частотой 30,3 % у гибрида и 15,3-28,5 % у исходных сортов. По числу мутаций, стабильно проявляющих признак в потомстве, преимущество имела концентрация раствора фосфе-мида 0,01 %.
1. Мутантные образцы яровой мягкой пшеницы ( Triticum aestivum L.), полученные с помощью химического мутагена фосфемида ( экспериментальный участок биостанции Тюменского государственного университета «Озеро Ку-чак», Тюменская обл., Нижнетавдинский р-н, 2021-2022 годы)
|
¹ |
образца Обозначение |
1 ¹ |
образца Обозначение |
|
1 |
P1k (Cara), контроль |
17 |
P 2 (0,002 %) Cкэнт 3 |
|
2 |
F 4к (Cara ½ Cкэнт 3), контроль |
18 |
P 2 (0,002 %) Cкэнт 3 |
|
3 |
P2k (Cкэнт 3), контроль |
19 |
P 2 (0,002 %) Cкэнт 3 |
|
4 |
F 4 (0,01 %) Cara ½ Cкэнт 3 |
20 |
P 2 (0,002 %) Cкэнт 3 |
|
5 |
F 4 (0,01 %) Cara ½ Cкэнт 3 |
21 |
F 4 (0,002 %) Cara ½ Cкэнт 3 |
|
6 |
P 1 (0,002 %) Cara |
22 |
P 2 (0,002 %) Cкэнт 3 |
|
7 |
P 1 (0,002 %) Cara |
23 |
P 2 (0,002 %) Cкэнт 3 |
|
8 |
P 1 (0,002 %) Cara |
24 |
P 2 (0,002 %) Cкэнт 3 |
|
9 |
P 1 (0,002 %) Cara |
25 |
P 2 (0,002 %) Cкэнт 3 |
|
10 |
F 4 (0,01 %) Cara ½ Cкэнт 3 |
26 |
P 1 (0,01 %) Cara |
|
11 |
F 4 (0,01 %) Cara ½ Cкэнт 3 |
27 |
P 1 (0,01 %) Cara |
|
12 |
F 4 (0,01 %) Cara ½ Cкэнт 3 |
28 |
P 1 (0,01 %) Cara |
|
13 |
F 4 (0,01 %) Cara ½ Cкэнт 3 |
29 |
P 1 (0,01 %) Cara |
|
14 |
P 2 (0,002 %) Cкэнт 3 |
30 |
P 2 (0,01 %) Cкэнт 3 |
|
15 |
P 2 (0,002 %) Cкэнт 3 |
31 |
P 2 (0,01 %) Cкэнт 3 |
|
16 |
P 2 (0,002 %) Cкэнт 3 |
32 |
F 4 (0,002 %) Cara ½ Cкэнт 3 |
Примечание. F 4 — гибрид четвертого поколения, P 1 — исходный сорт Cara, P 2 — исходный сорт Скэнт
3. В скобках указана концентрация фосфемида.
Мутантные образцы яровой мягкой пшеницы, исследованные в работе, представлены в таблице 1.
В результате электрофоретического анализа зерна исходных и мутантных образцов были составлены генетические формулы глиадина мягкой пшеницы. Установлено, что часто мутанты имели идентичные спектры и, соответственно, формулу глиадина (табл. 2).
2. Генетические формулы глиадина мутантных образцов яровой мягкой пшеницы ( Triticum aestivum L.), полученных с помощью химического мутагена фосфемида
|
¹ образца |
Глиадинкодирующие локусы ( Gli ) |
|||||
|
A1 |
B1 |
D1 |
A2 1 |
B2 |
D2 |
|
|
1, 2 (контроль) |
c |
l |
d |
n |
p |
b |
|
3 (контроль) |
a |
e |
b |
f |
t |
a |
|
8, 10, 11, 12, 13 |
c |
l |
d |
n |
p |
b |
|
6, 7 |
h |
l |
b |
m |
f |
q |
|
17, 18, 19, 20 |
o |
f |
a |
l |
p |
n |
|
23, 24, 25, 26, 27, 28, 29, 16 |
f |
b |
a |
l |
b |
i |
|
5, 21, 22, 32 |
c |
e |
b |
n |
p |
q |
|
14, 30 |
g |
e |
f |
c |
n |
b |
|
4 |
o |
e |
b |
n |
i |
e |
|
9 |
f |
e |
a |
b |
b |
b |
|
15 |
c |
e |
a |
l |
n |
i |
|
31 |
k |
e |
a |
k |
u |
q |
Примечани е. Номера соответствуют названиям образцов, приведенным в таблице 1.
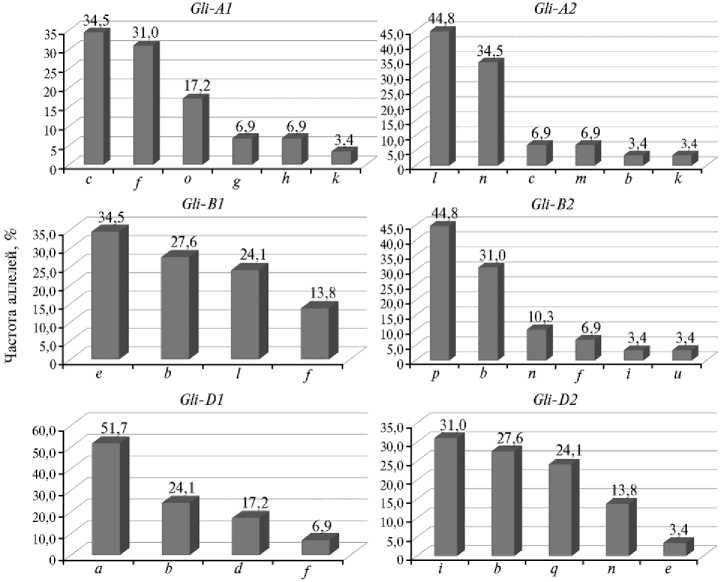
Рис. 1. Частота аллелей глиадинкодирующих локусов (%) у мутантных образцов яровой мягкой пшеницы ( Triticum aestivum L.), полученных с помощью химического мутагена фосфемида.
По всем локусам присутствовали аллели, имеющие максимальную частоту встречаемости. Так, по 1-й гомеологической группе (локусы Gli-А1, Gli-B1, Gli-D1) чаще встречались аллели Gli-А1c и Gli-В1е (34,5 %), Gli-D1а (51,7 %). По 6-й гомеологической группе (локусы Gli-А2, Gli-B2, Gli-D2) преобладали аллели Gli-А2l и Gli-В2p (44,8 %) и аллель Gli-D2i (31,0 %). В целом, в результате электрофореза глиадина выявили 4 аллеля по локусам Gli-В1 и Gli-D1, 5 аллелей по локусу Gli-D2 и 6 аллелей по локусам Gli-A1, изошли изменения в геноме, и
8 8 8 Stl St2
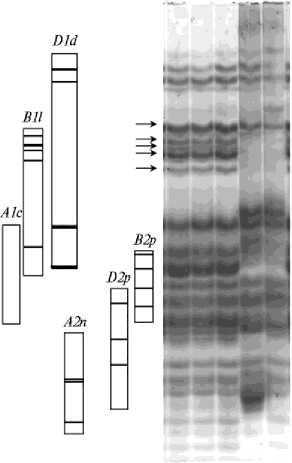
Рис. 2. Электрофореграмма и идентифицированные блоки глиадина у мутантной формы яровой мягкой пшеницы ( Triticum aestivum L.), полученной с помощью химического мутагена фосфе-мида: 8 — образец № 8 P 1 (0,002 %) Cara, St1 — сорт-стандарт Безостая 1, St2 — сорт-стандарт Мироновская 808. Стрелками обозначены основные компоненты, маркирующие пшенично-ржаную транслокацию.
Gli-A2 и Gli-B2 (рис. 1).
Анализ глиадиновых формул показал высокую частоту встречаемости аллеля Gli-А1c (10 из 29 образцов). Стоит отметить, что этот аллель кодирует синтез блока глиадина, который весьма близок по количеству и подвижности компонентов с блоком глиадинов, контролируемых аллелем Gli-А1а (Скэнт 3) (10), отличие заключается лишь в подвижности одного белкового компонента в у-зоне электрофоретического спектра. Перестройки генетического аппарата под действием мутагена возможны и проявляются в исчезновении или появлении одного-двух белковых компонентов в глиа-диновом спектре (18). Вполне вероятно, что за счет действия мутагена про-это отразилось на глиадиновом спектре.
По локусу Gli-B1 аллель Gli-B1е имел максимальную частоту встречаемости (см. рис. 1). Стоит отметить, что этот аллель широко распространен во многих российских (19, 20) и казахстанских (21) сортах пшеницы и, вероятно, связан с хозяйственно ценными признаками.
Интерес представляет аллель Gli-B1l , контролирующий блок компонентов и служащий маркером пшенично-ржаной транслокации 1RS.1BL, который встречался с частотой 24,1 % (рис. 2). Этот аллель связан с устойчивостью растений к ряду заболеваний, а именно к мучнистой росе ( Pm8 ), желтой ржавчине ( Yr9 ), стеблевой ржавчине ( Sr31 ), бурой ржавчине ( Lr26 ) (22, 23).
Преобладающим аллелем по локусу Gli-D1 был Gli-D1а с частотой 51,7 %. По локусу Gli-А2 у мутантных форм идентифицировали аллели l и n с частотой встречаемости соответственно 44,8 и 34,5 %. Распространение аллеля n среди мутантных форм, вероятно, связано с сортом Cara, который несет его в своем генотипе.
В целом следует отметить, что в результате воздействия химического мутагена на исходные сорта и гибридную форму удалось расширить генетическое разнообразие по локусам глиадина. Это в дальнейшем может быть использовано при создании сортов с высокими показателями продуктивности и качества зерна, устойчивых к биотическим и абиотическим факторам среды.
Полевое испытание мутантных образцов яровой мягкой пшеницы пятого и шестого поколений (М 5 , М 6 ), выделенных по результатам скрининга и дальнейшего отбора, проводили в контрастных условиях вегетационных периодов 2021-2022 годов (табл. 3).
Погодные условия вегетационного периода 2021 года обеспечили возможность отбора мутантных форм, способных противостоять водному и тепловому стрессу и формировать полноценное зерно. Рекордно аномальное превышение среднесуточной температуры воздуха относительно нормы (+6,3 °С) отмечали в мае в условиях атмосферной и почвенной засухи, когда количество выпавших осадков не превышало 10,2 % по сравнению с нормой.
При относительно благоприятном температурном режиме в июне и июле сумма осадков составила соответственно 39,1 % и 57,6 % к норме. В августе зерно созревало при повышенных среднесуточных температурах воздуха и дефиците осадков (33,3 % от нормы).
Для роста и развития растений в 2022 году лимитирующим фактором также был недостаток влаги, но вредоносность засушливых периодов оказалась снижена за счет незначительно отличающихся от нормы среднесуточных температур воздуха. Анализ среднесуточной температуры воздуха за вегетационный период выявил отклонение от нормы в июне (ниже на 1,3 °С), июле (выше на 0,9 °С), августе (выше на 2,3 °С). Количество осадков только в мае значительно превышало среднее многолетнее значение, в остальные месяцы показатель относительно нормы изменялся от 101,5 (июнь) до 76,2 % (август).
-
3. Характеристика вегетационных периодов 2021-2022 годов по среднесуточной температуре воздуха и количеству осадков (экспериментальный участок биостанции Тюменского государственного университета «Озеро Кучак», Тюменская обл., Нижнетавдинский р-н)
-
4. Морфофизиологические признаки у мутантных образцов яровой мягкой пшеницы ( Triticum aestivum L.), полученных с помощью химического мутагена фосфемида, в контрастных условиях выращивания (экспериментальный участок биостанции Тюменского государственного университета «Озеро Ку-чак», Тюменская обл., Нижнетавдинский р-н)
|
Месяц |
Среднесуточная температура воздуха, ° C |
Сумма осадков, мм |
||||
|
n |
2021 год |
2022 год |
n |
2021 год 2022 год |
||
|
Май |
11,3 |
17,6 |
12,1 |
45,3 |
4,6 |
93,9 |
|
Июнь |
17,1 |
18,0 |
15,8 |
58,5 |
22,9 |
59,4 |
|
Июль |
18,8 |
18,6 |
19,7 |
86,0 |
49,6 |
65,5 |
|
Август |
15,8 |
19,5 |
18,1 |
60,0 |
20,0 |
56,0 |
|
M, ° C |
15,8 |
18,4 |
16,4 |
|||
|
∑, мм |
249,8 |
97,1 |
274,8 |
|||
Примечани е. n — средние многолетние значения (1968-2021 годы), условная норма.
Были выявлены значительные вариации количественных признаков под воздействием факторов окружающей среды (табл. 4).
|
Признак |
2021 год |
2022 год |
Индекс сравнения, % |
||
|
M± SEM |
Cv , % |
M± SEM |
Cv , % |
||
|
Высота растений, см |
55,3±2,13 |
22,87 |
76,4±2,36* |
18,38 |
38,2 |
|
Длина флаг-листа, см |
10,8±0,21 |
11,20 |
17,4±0,28* |
9,38 |
61,1 |
|
Ширина флаг-листа, мм |
8,5±0,30 |
20,69 |
12,1±0,23* |
11,18 |
42,4 |
|
Площадь флаг-листа, см2 |
6,4±0,30 |
28,06 |
14,3±0,38* |
15,92 |
23,4 |
|
Содержание хлорофилла, ед. Spad |
49,2±2,02 |
6,71 |
45,1±0,64 |
8,38 |
9,1 |
|
Число продуктивных стеблей на 1 м2 |
249,0±8,27 |
23,79 |
358,0±10,93* |
20,89 |
43,8 |
|
Длина колоса, см |
6,1±0,46 |
16,64 |
8,1±0,17* |
12,50 |
32,8 |
|
Число зерен в колосе, шт. |
15,0±3,00 |
41,83 |
30,2±1,18* |
22,92 |
101,3 |
|
Масса зерен с колоса, г |
0,42±0,08 |
49,23 |
1,0±0,04* |
28,88 |
147,6 |
|
Урожайность, г/м2 |
138,1±4,88 |
20,96 |
279,4±7,75* |
25,04 |
102,3 |
Примечани е. Размеры выборок см. в разделе «Методика».
* Различия при сравнении по годам статистически значимы соответственно при p < 0,01.
Период вегетации 2022 года был более благоприятным по сравнению с 2021 годом для проявления ряда признаков. В фазу колошения растения имели преимущество по высоте и развитию флагового листа (длина, ширина, площадь). Было получено больше растений и продуктивных стеблей к уборке, что свидетельствовало о повышенной выживаемости растений и обеспечивало увеличение урожайности.
Выявлено влияние засухи на физиологическое развитие растений яровой пшеницы. На водный и тепловой стресс в 2021 году растения отвечали увеличением количества хлорофилла в клетках флаг-листа. В исследовании M. Yildirim с соавт. (24) сообщается, что измерение содержания хлорофилла в листьях в фазу молочной спелости зерна можно использовать при отборе растений пшеницы с высоким потенциалом урожайности как в относительно оптимальных условиях, так и при тепловом стрессе.
Степень изменчивости признаков в большинстве случаев повышалась под воздействием стресс-факторов, что подтверждалось коэффициентом вариации. Различия по годам исследования наиболее значительно проявились по массе зерна и числу зерен в колосе, а также по урожайности. Минимальное снижение под воздействием стресса отмечали по содержанию хлорофилла в клетках флагового листа и его площади.
Корреляция между урожайностью изученных мутантных образцов и важными количественными признаками зависела от генотипа и факторов окружающей среды (рис. 3).
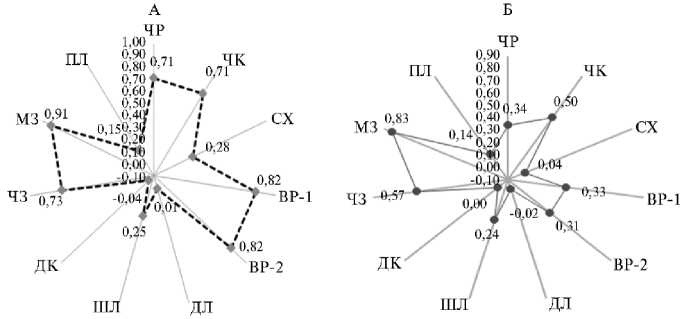
Рис. 3. Корреляция урожайности с количественными признаками в 2021 (А) и 2022 (Б) годах у мутантных образцов яровой мягкой пшеницы ( Triticum aestivum L.), полученных с помощью химического мутагена фосфемида: ЧР — число растений на 1 м2, ЧК — число колосьев на 1 м2, СХ — содержание хлорофилла, ед. Spad, ВР-1 — высота растений, см (учеты 20.06.2021 года, 29.06.2022 года), ВР-2 — высота растений, см (учеты 10.07.2021 года, 17.07.2022 года), ДЛ — длина листа, см, ШЛ — ширина листа, см, ПЛ — площадь одного листа, см2, ДК — длина колоса, см, ЧЗ — число зерен в одном колосе, шт., МЗ — масса зерна в одном колосе, г (экспериментальный участок биостанции Тюменского государственного университета «Озеро Кучак», Тюменская обл., Нижнетавдинский р-н) .
В засушливом 2021 году обнаружили значительную взаимосвязь урожайности с высотой растений при двух промерах (фенологические фазы выход в трубку и колошение) ( r = 0,82, p < 0,05), числом растений ( r = 0,71, p < 0,05) и продуктивных колосьев с 1 м2 ( r = 0,71, p < 0,05), числом ( r = 0,73, p < 0,05) и массой ( r = 0,91, p < 0,05) зерен в колосе. Выявлена прямая связь урожайности с содержанием хлорофилла в клетках флагового листа ( r = 0,28, p > 0,05) и его шириной ( r = 0,25, p > 0,05).
В 2022 году корреляция между урожайностью и массой зерна с колоса ( r = 0,83, p < 0,05) оставалась высокой, связь средней силы обнаружили с числом продуктивных колосьев на 1 м2 ( r = 0,50, p < 0,05) и числом зерен в колосе ( r = 0,57, p < 0,05). Влияние других признаков (кроме ширины и площади флагового листа) на формирование зерновой продуктивности уменьшилось.
По комплексу селекционно ценных признаков из мутантных популяций были отобраны пять образцов, существенно превосходящих исходные формы и соответствовавших уровню сортов, выращиваемых в Тюменской области (Тюменская 25, Тюменская 29, Новосибирская 31) (рис. 4, табл. 5).
-
5. Характеристика лучших мутантных образцов яровой мягкой пшеницы ( Triticum aestivum L.), полученных с помощью химического мутагена фосфемида, при сравнении с сортами-стандартами по результатам полевого испытания в контрастных условиях вегетационных периодов двух лет ( M ±SEM, экспериментальный участок биостанции Тюменского государственного университета «Озеро Кучак», Нижнетавдинский р-н Тюменской обл.)
П
Образец ¹ 4 F 4 (0,01 %)
Cara ½ Cкэнт 3
Образец ¹ 5 F 4 (0,01 %)
Cara ½ Cкэнт 3
Образец ¹ 17 P 2 (0,002 %) Cкэнт 3
Образец ¹ 20 P 2 (0,002 %) Cкэнт 3
Образец ¹ 32
F 4 (0,002 %)
Cara ½ Cкэнт 3
Тюменская 25
Тюменская 29
Новосибирская 31
2021 2022
2021 2022
2021 2022
2021 2022
2021 2022
2021 2022
2021 2022
2021 2022
|
1 |
46,4±1,36a |
62,2±2,24b |
51,6±1,57a |
66,5±1,80a |
60,8±1,03a |
91,7±1,86a |
62,1±1,33b |
81,9±1,60 |
53,3±0,64a |
68,4±1,17 |
72,3+0,86 |
92,5±1,53 |
70,7+0,73 |
90,5±1,16 |
67,3+1,50 |
91,0±1,88 |
|
2 |
13,6±0,43 |
16,3±1,16a |
12,2±0,54 |
17,8±0,51b |
10,7±0,69 |
17,7±0,66b |
10,9±0,62a |
18,5±0,86 |
10,4±0,57a |
18,9±1,08 |
13,2±0,53 |
17,4±0,87 |
12,3±0.56 |
19,5±1,02 |
13,0±0.56 |
19,4±0,68 |
|
3 |
6,4±0,32a |
12,2±0,58 |
7,4±0,51b |
11,8±0,40c |
8,6±0,37b |
14,4±0,68c |
8,2±0,37b |
14,6±0,80c |
8,8±0,40b |
13,6±0,93 |
11,2±0,51 |
12,8±0,51 |
10,3±0,32 |
11,6±0,40 |
10,4±0,45 |
11,2±0.45 |
|
4 |
7,27 |
16,51 |
7,53 |
17,54 |
7,68 |
21,28 |
7,46 |
22,55 |
7,64 |
21,46 |
12,34 |
18,60 |
10,58 |
18,89 |
11,29 |
18,14 |
|
5 |
46,8±0,71b |
46,6±1,16c |
47,2±0,78b |
45,9±2,90c |
49,1±1,18b |
45,3±2,50c |
49,5±0,83b |
44,4±1,00c |
54,8±0,67 |
45,6±1,53b |
53,2±1,62 |
51,1±0,96 |
55,5±1,64 |
42,3±0,64 |
51,7±1,41 |
44,0±0,62 |
|
6 |
246±8,2 |
408±13,6b |
229±7,6с |
417±10,8a |
242±7,5с |
322±11,1c |
236±6,7 |
386±8,1 |
278±9,7b |
436±8,9a |
259±12,0 |
306±9,3 |
246±5,5 |
272±9,8 |
229±7,8 |
317±10,1 |
|
7 |
8,3±0,47a |
9,4±0,49 |
9,2±0,83a |
9,6±0,82 |
5,7±0,36 |
8,3±0,21 |
5,6±0,37 |
8,8±0,77a |
7,4±0,73a |
9,1±0,54a |
6,2±0,72 |
8,4±0,62 |
6,4±0,71 |
8,3±0,36 |
6,4±0,59 |
7,4±0,31 |
|
8 |
24,0±6,38c |
39,0±3,45 |
21,0±2,97b |
45,0±2,27c |
19,0±4,04b |
38,0±3,95 |
16,0±4,26b |
30,0±2,74b |
13,0±3,24a |
26,0±3,03c |
18,0±3,25 |
41,0±2,30 |
23,0±4,32 |
37,0±3,17 |
26,0±5,49 |
39,0±3,26 |
|
9 |
0,47±0,13a |
1,3±0,15b |
0,54±0,08a |
1,02±0,10a |
0,65±0,14b |
1,23±0,17a |
0,66±0,17b |
1,05±0,09a |
0,31±0,08a |
0,95±0,12a |
0,63±0,12 |
1,42+0,13 |
0,79±0,15 |
1,31+0,10 |
0,76±0,16 |
1,12+0,18 |
|
10 |
115,6±2,90a |
518,2±3,66a |
123,7±3,08a |
425,3±4,85b |
157,3±4,12a |
396,1±5,63b |
155,8±4,01с |
405,3±5,70b |
86,2±4,83a |
414,2±6,05 |
163,3±4,56 |
424,5±4,07 |
194,3±5,63 |
356,3±3,68 |
174,0±6,71 |
355,0±4,86 |
П р и м е ч ани е. П — признак: 1 — высота растений, см, 2 — длина флаг-листа, см, 3 — ширина флаг-листа, мм, 4 — площадь флаг-листа, см2, 5 — содержание хлорофилла, ед. Spad,
-
6 — число продуктивных стеблей/м2, 7 — длина колоса, см, 8 — число зерен в колосе, шт., 9 — масса зерен с колоса, г, 10 — урожайность, г/м2. Размеры выборок см. в разделе «Методика».
-
a, b, с Различия статистически значимы (р < 0,05) при сравнении соответственно с тремя стандартами, с двумя стандартами и с одним стандартом.

Рис. 4. Зерно мутантных образцов яровой мягкой пшеницы ( Triticum aestivum L.), полученных с помощью химического мутагена фосфемида: а — образец ¹ 4 F 4 (0,01 %) Cara ½ Cкэнт 3, б — образец ¹ 5 F 4 (0,01 %) Cara ½ Cкэнт 3, в — образец ¹ 17 P 2 (0,002 %) Cкэнт 3, г — образец ¹ 20 P 2 (0,002 %) Cкэнт 3, д — образец ¹ 32 F 4 (0,002 %) Cara ½ Cкэнт 3 (экспериментальный участок биостанции Тюменского государственного университета «Озеро Кучак», Тюменской обл., Нижнетавдинский р-н, 2022 год).
Три образца были отобраны из популяции гибрида Cara ½ Cкэнт 3 после обработки семян фосфемидом в двух концентрациях (0,01 % и 0,002 %), два образца созданы на основе сорта Cкэнт 3 (концентрация 0,002 %). Потенциал зерновой продуктивности сильнее проявился в более благоприятных условиях вегетации растений в 2022 году (396,1-518,2 г/м2); у сортов-стандартов урожайность составила 355,0-424,5 г/м2.
Сравнение мутантных образцов с сортами-стандартами по морфофизиологическим признакам выявило некоторые особенности в реакции на стресс-факторы окружающей среды.
По высоте растения-мутанты, полученные на основе гибрида, существенно уступали в оба года исследований мутантам, отобранным из сорта Cкэнт 3, и стандартам. Максимальное значение длины флагового листа в 2021 году отмечали у образца ¹ 5 F 4 (0,01 %) Cara ½ Cкэнт 3, в 2022 году — у образца ¹ 32 F 4 (0,002 %) Cara ½ Cкэнт 3. У стандартов по длине и ширине флаг-листа выделились сорта Тюменская 25 (2021 год) и Новосибирская 31 (2022 год). Закономерность, выявленная в целом по всему изученному материалу и проявившаяся в увеличении содержания хлорофилла во флаговом листе, подтвердилась данными, полученными для лучших мутантных образцов.
Недостаток влаги на фоне повышенных температур воздуха приводил к снижению выживаемости растений в течение вегетационного периода, числа продуктивных стеблей на 1 м2, числа и массы зерен в колосе. Следует отметить, что максимальное и минимальное число продуктивных колосьев у мутантных образцов и сортов-стандартов в 2021 году имело относительно небольшие различия, соответственно 229-278 и 229-259 шт/м2. В 2022 году этот признак изменялся у мутантов в пределах 322-436 шт/м2, у стандартов — 272-317 шт/м2. При меньшем числе растений и продуктивных стеблей на момент уборки районированные сорта по сравнению с новыми образцами имели преимущество по числу зерен в колосе и их массе.
По нашим данным, недостаток влаги в сочетании с повышенными температурами воздуха оказывал лимитирующее влияние на рост растений в высоту и развитие ассимиляционной поверхности, что мы наблюдали в 2021 году. Другие исследователи также сообщают об ограничении роста пшеницы в период засухи, что отражается на показателях высоты растений, площади листьев, на сухой массе и других функциях роста (25, 26).
Установлено, что засухоустойчивые генотипы сохраняют высокое содержание хлорофилла в листьях, необходимое для фотосинтеза (27). Кроме того, хлорофилл рассматривается как индикатор фотосинтетической активности, биосинтеза ассимилятов (28), что позволяет использовать его содержание для отбора засухоустойчивых форм пшеницы (29).
Наши данные указывают на увеличение содержания хлорофилла в клетках флагового листа под воздействием водного и температурного стресса в среднем по коллекции мутантных образцов до 49,2±2,0 ед. Spad против 45,1±0,64 ед. Spad в относительно благоприятных погодных условиях. Так, различия по содержанию хлорофилла в листьях в 2021 году по сравнению с 2022 годом оказались наиболее выражены у трех перспективных для дальнейшего использования в селекционном процессе образцов: ¹ 17 P 2 (0,002 %) Cкэнт 3 — 8,3 %; ¹ 20 P 2 (0,002 %) Cкэнт 3 — 11,5 %; ¹ 32 F 4 (0,002 %) Cara ½ Cкэнт 3 — 20,2 % (см. табл. 5). Можно предположить, что образец ¹ 32 F 4 (0,002 %) Cara ½ Cкэнт 3 является толерантным генотипом, поскольку он содержит наибольшее количество хлорофилла 54.8±0,67 ед. Spad по сравнению с другими генотипами. В листьях образца ¹ 4 F 4 (0,01 %) Cara ½ Cкэнт 3 количество хлорофилла было практически одинаковым по годам — 46,8±0,71 и 46,6±1,16 ед. Spad соответственно в 2021 и 2022 годах.
Оптимальная температура для процесса фотосинтеза в растениях пшеницы составляет около 25 °C (30). Показано, что превышение температуры воздуха на 1 °С в период налива зерна снижает урожайность на 3-4 % (31). Как сообщают S.S. Bhullar с соавт. (32), если тепловой стресс возникает в период после цветения (период налива зерна), это отрицательно влияет на процесс фотосинтеза, ингибирует синтез крахмала, что приводит к снижению массы зерна и урожайности. По нашим усредненным данным, у изученных образцов в условиях стресса в колосе формировалось в 2 раза меньше зерновок, их масса снижалась в 2,5 раза, урожайность — в 2 раза. Высокие температуры воздуха (30 °С и более) в период цветения и опыления оказались критическими для формирования зерна в колосе. В ряде случаев в колосе образовались только единичные зерновки. В связи с тем, что отбор засухоустойчивых форм только по урожайности не всегда эффективен (33), рекомендуется для относительно быстрой и объективной оценки генотипов использовать морфологические и физиологические признаки, играющие важную роль в адаптации растений (34). Комплексный подход позволил нам отобрать ценные генотипы яровой мягкой пшеницы, начиная с ранних мутантных поколений (35). Теоретические основы химического мутагенеза, предложенные И.А. Рапопортом (36), продолжают оставаться актуальными для повышения эффективности мутационной селекции растений.
Следует отметить, что у отобранных по ряду признаков мутантов (М 5 , М 6 ) имелись идентичные аллели. Так, образцы ¹ 4 F 4 (0,01 %) Cara ½ Cкэнт 3, ¹ 5 F 4 (0,01 %) Cara ½ Cкэнт 3, ¹ 32 F 4 (0,002 %) Cara ½ Cкэнт 3 несли одинаковые аллели по локусам глиадина B1, D1 и A2 . Аллель Gli-A1о был общим для образцов ¹ 4 F 4 (0,01 %) Cara ½ Cкэнт 3, ¹ 17 P 2 (0,002 %) Cкэнт 3, ¹ 20 P 2 (0,002 %) Cкэнт 3, а Gli-B2p — для мутантов ¹ 5 F 4 (0,01 %) Cara ½ Cкэнт 3, ¹ 32 F 4 (0,002 %) Cara ½ Cкэнт 3, ¹ 17 P 2 (0,002 %) Cкэнт 3, ¹ 20 P 2 (0,002 %) Cкэнт 3. Также заметим, что для аллелей Gli-B1e и Gli-B1f , которые встречались у выделившихся мутантов, число и относительная электрофоретическая подвижность глиади-нов были схожими, за исключением одного компонента. Поэтому допустимо предположить, что и влияние, которое аллели Gli-B1e и Gli-B1f могут иметь на морфологические признаки, окажется подобным.
Таким образом, потенциал адаптации яровой мягкой пшеницы в экстремальных условиях Северного Зауралья может быть увеличен за счет использования генетической изменчивости мутантных популяций. Доказан биологический эффект химического мутагена фосфемида для индуцирования полезных мутаций Triticum aestivum L. Для увеличения генетического разнообразия эффективно комплексное использование мутационной и рекомбинационной изменчивости. Под воздействием водного и температурного стресса у ряда мутантных образцов отмечено увеличение содержания хлорофилла в клетках флагового листа при сравнении с показателями в благоприятных погодных условиях. Выявленные различия могут быть использованы как индикатор отбора форм, устойчивых к неблагоприятным факторам окружающей среды. Мутантные образцы, характеризующиеся разнообразными фенотипическими и генотипическими вариациями, могут быть полезны для улучшения хозяйственно ценных признаков пшеницы. По результатам полевого испытания мутантов поколений М5, М6 лучшие из них представляют интерес для селекционно-генетических программ.
Авторы благодарят рецензентов за их вклад в экспертную оценку этой работы.
Список литературы Определение потенциала генетической изменчивости Triticum aestivum L., индуцированной с помощью химического мутагена фосфемида
- Eastwood R.J., Tambam B.B., Aboagye L.M., Akparov Z.I., Aladele S.E., Allen R., Amri A., Anglin N.L., Araya R., Arrieta-Espinoza G., et al. Adapting agriculture to climate change: a synopsis of coordinated national crop wild relative seed collecting programs across five conti-nents. Plants, 2022, 11(14): 1840 (doi: 10.3390/plants11141840).
- Mutant variety database. Режим доступа: https://nucleus.iaea.org/sites/mvd/SitePages/Home.aspx. Без даты.
- Genetic resources in plants — their exploitation and conservation /O.H. Frankel, E. Bennett, in associations with R.D. Brock, A.H. Bunting, J.R. Harlan, E. Schreiner. Oxford and Edinburgh, 1970.
- Barrett B.A., Kidwell K.K., Fox P. Comparison of AFLP and pedigree-based genetic diversity assessment methods using wheat cultivars from the Pacific Northwest. Crop Science, 1998, 38(5): 1271-1278 (doi: 10.2135/cropsci1998.0011183X003800050026x).
- Van Beuningen L.T., Busch R.H. Genetic diversity among North American spring wheat cultivars: III. Cluster analysis based on quantitative morphological traits. Crop Science, 1997, 37(3): 981-988 (doi: 10.2135/cropsci1997.0011183X003700030046x).
- Smith J.S.C. Genetic variability within U.S hybrid maize: multivariate analysis of isozyme data. Crop Science, 1984, 24(6): 1041-1046 (doi: 10.2135/cropsci1984.0011183X002400060009x).
- Моргун В.В., Катеринчук А.М., Чугункова Т.В. Использование новых стереоизомеров нитрозоалкилмочевины в селекции озимой пшеницы. Известия Самарского научного центра Российской академии наук, 2013, 15(3/5): 1666-1669.
- Ренгартен Г.А. Использование химического мутагенеза в селекции растений в Pоссии и за рубежом. Вестник Курской государственной сельскохозяйственной академии, 2022, 4: 42-46.
- Metakovsky E.V. Gliadin allele identification in common wheat. 1. Methodological aspects of the analysis of gliadin pattern by one-dimensional polyacrylamide — gel electrophoresis. Journal of Genetics and Breeding, 1991, 45(4): 317-324.
- Metakovsky E.V., Novoselskaya A.Yu. Gliadin allele identification in common wheat. II. Cata-logue of gliadin alleles in common wheat. Journal of Genetics and Breeding, 1991, 45(4): 325-344.
- McIntosh R.A., Yamazaki Y., Dubcovsky J., Rogers W.J., Morris C.F., Somers D.J., Appels R., Devos K.M. Catalogue of gene symbols for wheat, 2008. Режим доступа: http://wheat.pw.us-da.gov/GG2/Triticum/wgc/2008/. Без даты.
- Доспехов Б.А. Методика полевого опыта (с основами статистической обработки результатов исследований). М., 2014.
- Градчанинова О.Д., Филатенко А.А., Руденко М.И. Методические указания по изучению мировой коллекции пшеницы. Л., 1987.
- Miralles D.J., Slafer G.A. A simple model for nondestructive estimates of leaf area in wheat. Cereal Research Communications, 1991, 4: 439-444.
- Лакин Г.Ф. Биометрия. М., 1990.
- Вайсфельд Л.И. Динамика перестроек хромосом при действии химического мутагена фос-фемида. Мат. Межд. науч. конф. «Селекційно-генетична наука і освіта (Парієві читання)». Умань, 2021: 40-43.
- Вайсфельд Л.И., Боме Н.А., Татаринов Ф.А. Новый подход к цитогенетической оценке химического мутагена. Мат. Межд. науч.-практ. конф. «Селекция и генетика: инновации и перспективы». Горки, 2022: 173-180.
- Созинов А.А., Метаковский А.А., Поморцев Е.В. Проблемы использования блоков компонентов проламина в качестве генетических маркеров у пшеницы и ячменя. Сельскохозяйственная биология, 1989, 1: 3-12.
- Novoselskaya-Dragovich A.Y., Krupnov V.A., Saifulin R.A., Pukhalskiy V.A. Dynamics of genetic variation at gliadin-coding loci in Saratov cultivars of common wheat Triticum aestivum L. over eight decades of scientific breeding. Russian Journal of Genetics, 2003, 39(10): 1130-1137 (doi: 10.1023/A:1026170709964).
- Nikolaev A.A., Pukhal'sky V.A., Upelniek V.P. Genetic diversity of local spring bread wheats (Triticum aestivum L.) of West and East Siberia in gliadin genes. Russian Journal of Genetics, 2009, 45(2): 189-197 (doi: 10.1134/S1022795409020094).
- Utebayev M., Dashkevich S., Bome N., Bulatova K., Shavrukov Y.Genetic diversity of gliadin alleles in bread wheat (Triticum aestivum L.) from Northern Kazakhstan. PeerJ, 2019, 7: e7082. (doi: 10.7717/peerj.7082).
- Singh N.K., Shepherd K.W., McIntosh R.A. Linkage mapping of genes for resistance to leaf, steam and stripe rust and ω-secalins on the short arm of rye chromosome 1R. Theoretical and Applied Genetics, 1990, 80: 609-616 (doi: 10.1007/BF00224219).
- Mcintosh R.A., Yamazaki Y., Dubcovsky J., Rogers J., Morris C., Appels R., Xia X.C. Catalogue of gene symbols for wheat (12th International wheat genetics symposium). Yokohama, Japan, USDA, 2013.
- Yildirim M., Koç M., Akıncı K., Barutçular K. Variations in morphological and physiological features in wheat diallelic crosses under timely and late planting conditions. Field Crop Research, 2013, 140: 9-17 (doi: 10.1016/j.fcr.2012.10.001).
- Hasan M.A., Ahmed J.U., Bahadur M.M., Haque M.M., Sikder S. Effect of late planting heat stress on membrane thermostability, proline content and heat susceptibility index of different wheat cultivars. Journal of the National Science Foundation Sri Lanka, 2007, 35: 109-117 (doi: 10.4038/jnsfsr.v35i2.3675).
- Kiliç H., Yağbasanlar T. The effect of drought stress on grain yield, yield components and some quality traits of durum wheat (Triticum turgidum) cultivars. Notulae Botanicae Horti Agrobotanici Cluj-Napoca, 2010, 38(1): 164-170.
- Bijanzadeh E., Emam Y. Effect of defoliation and drought stress on yield components and chlo-rophyll content of wheat. Pakistan Journal Biological Sciences, 2010, 13(14): 699-705 (doi: 10.3923/pjbs.2010.699.705).
- Manivannan P., Jaleel C.A., Sankar B., Kishorekumar A., Somasundaram R., Lakshmanan G.A., Panneerselvam R. Growth, biochemical modifications and proline metabolism in Helianthus an-nuus L. as induced by drought stress. Colloids and Surfaces B: Biointerfaces, 2007, 59(2): 141-149 (doi: 10.1016/j.colsurfb.2007.05.002).
- Schonfeld M.A., Johnson R.C., Carver B.F., Mornhinweg D.W. Water relations in winter wheat as drought resistance indicators. Crop Scienсe, 1988, 28(3): 526-531 (doi: 10.2135/crop-sci1988.0011183X002800030021x).
- Nagai T., Makino A. Differences between rice and wheat in temperature responses of photosyn-thesis and plant growth. Plant and Cell Physiology, 2009, 50(4): 744-755 (doi: 10.1093/pcp/pcp029).
- Wardlaw I.F., Dawson I.A., Munibi P., Fewster R. The tolerance of wheat to high temperatures during reproductive growth. I. Survey procedures and general response patterns. Australian Journal of Agricultural Research, 1989, 40(1): 1-13 (doi: 10.1071/AR9890001).
- Bhullar S.S., Jenner C.F. Differential responses to high temperatures of starch and nitrogen ac-cumulation in the grain of four cultivars of wheat. Australian Journal of Plant Physiology, 1985, 12(4): 363-375 (doi: 10.1071/PP9850363).
- Sofi P.A., Ara A., Gull M., Rehman K. Canopy temperature depression as an effective physiological trait for drought screening. In: Drought-detection and solutions /G. Ondrasek (ed.). IntechOpen, 2019: 77-92 (doi: 10.5772/intechopen.85966).
- Sohail M., Hussain I., Qamar M., Tanveer S.K., Abbas S.H., Ali Z., Imtiaz M. Evaluation of spring wheat genotypes for climatic adaptability using canopy temperature as physiological indicator. Paki-stan Journal Biological Sciences, 2020, 33(1): 89-96 (doi: 10.17582/journal.pjar/2020/33.1.89.96).
- Боме Н.А., Вайсфельд Л.И., Бабаев Е.В., Боме А.Я., Колоколова Н.Н. Агробиологические признаки яровой мягкой пшеницы (Triticum aestivum L.) при обработке семян химическим мутагеном фосфемидом. Сельскохозяйственная биология, 2017, 52(3): 570-579 (doi: 10.15389/agrobiology.2017.3.570rus).
- Вайсфельд Л.И., Боме Н.А. Теоретические аспекты химических мутагенов и фенотипических активаторов роста растений, разработанные И.А. Рапопортом (обзор литературных источников). Биосфера, 2022, 14(3): 245-253 (doi: 10.24855/biosfera.v14i3.689).


