Определение скорости потока по доплеровскому сдвигу в оптической когерентной томографии
Автор: Петров Д.А., Проскурин С.Г.
Журнал: Juvenis scientia @jscientia
Рубрика: Физико-математические науки
Статья в выпуске: 1, 2015 года.
Бесплатный доступ
Описан способ измерения скорости потока в оптической когерентной томографии, при котором значение скорости оценивается по доплеровскому сдвигу интерференционного сигнала, возникающему в связи с движением частиц потока через световой пучок. Также представлен алгоритм пост-обработки получаемых изображений, который позволяет повысить точность представленной методики. Экспериментально полученные с помощью данного способа значения скорости соответствуют действительным с большой точностью.
Оптическая когерентная томография, спекл-шум, обработка изображений, скорость потока
Короткий адрес: https://sciup.org/14110035
IDR: 14110035
Текст научной статьи Определение скорости потока по доплеровскому сдвигу в оптической когерентной томографии
Существующие методы медицинской визуализации, включая ультразвуковую диагностику, магнитно-резонансную томографию, рентгеновские методы диагностики позволяют получить информацию о глубоко лежащих структурах, но при этом обладают небольшим пространственным разрешением, что делает невозможным исследование небольших объектов, размер которых не превышает десятки микрометров.
Оптическая когерентная томография (ОКТ) – неинвазивная методика исследования внутренней структуры объектов с помощью оптического излучения, в основе которой лежат ме- постоянно улучшалась, в сторону увеличения глубины зондирования, пространственного разрешения и скорости сканирования [1].
Оптическая когерентная томография нашла свое применение в различных областях медицины, в частности в офтальмологии, дерматологии, стоматологии, а также в кардиологии, где ее применение позволяет диагностировать различные заболевания коронарных артерий [2].
Основой ОКТ установки чаще всего является интерферометр Майкельсона (рис. 1). Оптическое излучение, идущее от
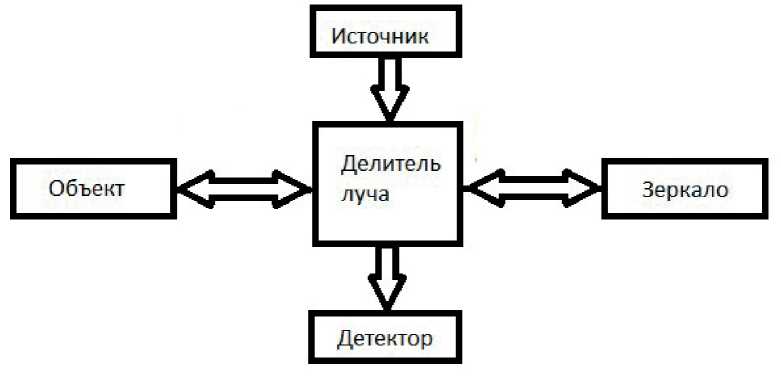
Рисунок 1 Схема ОКТ установки
тоды низкокогерентной интерферометрии. ОКТ предоставляет высокую пространственную разрешающую способность (несколько микрометров), но с глубиной зондирования ограниченной несколькими миллиметрами, что связано с сильным рассеиванием оптического излучения в биологических тканях. Первые результаты применения ОКТ для исследований in vivo получены в 1993, и с тех пор техническая база метода источника, разделяется на две части, одна из которых направляется в опорное плечо интерферометра, в котором располагается движущееся зеркало, а вторая в объектное плечо, где находится исследуемый объект.
После отражения от оптических неоднородностей в объектном плече и от зеркала в опорном пучки снова сводятся вместе и направляются на детектор. При этом интенсивность сигнала на выходе интерферометра определяется как:
I ( z ) = 1 0 + 2-J 1 1 12 I V ( z ) | cos(2 ns (kzz )
проводить с помощью продольной Vl и поперечной Vt составляющих полного вектора скорости:
где I0 – постоянная величина, определяемая ОКТ системой, I1 и I2 интенсивности пучков объектной и опорной волны, | V ( z ) | – степень временной когерентности излучения, а k – среднее значение волнового числа [3].
В некоторых случаях для диагностирования заболеваний необходима информация о кровоснабжении ткани. Существующие методы измерения скорости потока в биологических объектах на основе ультразвуковой диагностики не позволяют исследовать небольшие сосуды, информация о которых зачастую является очень важной для постановки правильного диагноза. Пространственное разрешение ОКТ систем позволяет локализовать крайне маленькие сосуды, размер которых составляет несколько микрон, а также получить информацию о скорости кровотока в этих сосудах при исследовании доплеровского сдвига интерференционного сигнала. Техника получения информации о скорости потока в ОКТ получила название доплеровская оптическая когерентная томография (ДОКТ).
ДОКТ является функциональным дополнением ОКТ, и проводится на той же установке, что и обычные ОКТ исследования. Преимуществом ДОКТ перед другими методами потоковой визуализации на основе применения оптического излучения является то, что они являются либо инвазивными (флуоресцентная ангиография), либо не позволяют получить достаточно хорошее разрешение по глубине (лазерная доплеровская флуометрия, лазерная спекл флуография) [4].
Доплеровский сдвиг интерференционного сигнала определяется как:
f = 2 v c°s £ ,
V a = arctg (—)
Vl
Частицы потока, двигающиеся через зондирующий пучок, вызывают флуктуации интерференционного сигнала, при этом спектр мощности может быть описан как:
A,
P ( f ) = -ex exp
C
—
f f 0 I
C
Z A exp i2 4 ) n n П
где Ar и An – амплитуды опорного и объектного плеча, f0 – сдвиг частоты, tn – время, через которое частица пересекает зондирующий пучок, а σ – стандартный разброс частот, который зависит от скорости в поперечном направлении :
a =
V t
V2 m о
+ fo ^l л о
+ a
где σ – константа. σ и f0 , может быть определена при анализе измеренного сигнала а Δ λ – ширина спектра источника. Используя данную зависимость можно получить продольную Vl и поперечную скорости потока:
vt = V2 t ^ o
a — f 0Г
I ^ 0
—
a 0
J
l
Vl f о 2
Спектрограмма получаемого сигнала зачастую подвергается разного рода шумовым воздействиям, которые могут уменьшить точность методики (рис. 3). Источниками этих шу-
где V – скорость потока, α – угол между направлением сканирования и направлением потока (угол Доплера), λ – длина волны излучения (рис. 2).
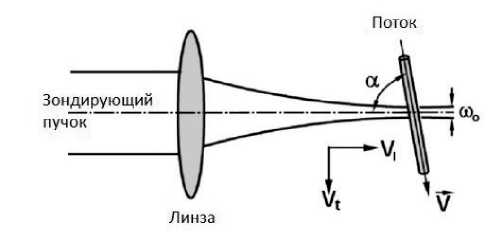
Рис. 2. Общий принцип сканирования потока жидкости
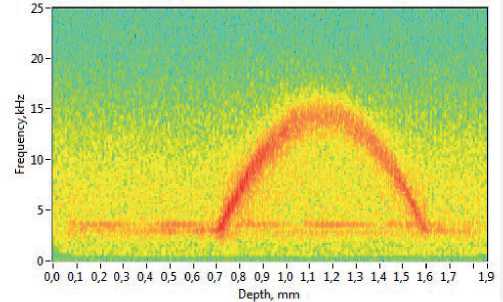
Рис. 3. Спектрограмма сигнала без фильтрации
В современных ДОКТ системах точное определение Доплеровского угла зачастую является довольно сложной задачей, и его неправильное измерение приводит к погрешности до 50% при исследованиях как in vitro, так и in vivo. Имеющиеся на данный момент методики определения Доплеровского угла имеют свои недостатки, например применение призмы Волластона в объектном плече интерферометра оказалось довольно эффективным для точного измерения угла в некоторых отдельных случаях, но для исследования большинства реальных биологических систем методика является неприменимой, так как равенство оптических путей в обоих каналах оказалось практически недостижимым. Соответственно, способ измерения Доплеровского угла, который позволяет определить его до проведения исследования или эффективно оценить его значение после него, является важным шагом в развитии ДОКТ [5]. Измерение его значения предлагается мов являются различные несовершенства технической аппаратуры, движения пациента и т.д.
Эффективным способом увеличения отношения сигнал/шум является усреднение. Часто используется либо усреднение по соседним А-сканам, либо усреднение по B-сканам. Во втором случае производится несколько сканирований одного участка объекта, что увеличивает время выполнений процедуры. При увеличении количества усредняемых элементов отношение С/Ш первоначально линейно возрастает, а после 20 элементов входит в режим насыщения с постоянным коэффициентом увеличения соотношения С/Ш. Усреднение большого количества сканов сильно замедляет исследование, поэтому в клинических исследованиях число усреднений составляет 5-10. Усреднение позволяет существенно увеличить контраст получаемого изображения (рис. 4).
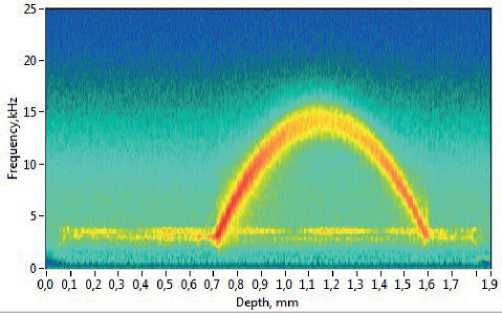
Рис. 4. Спектрограмма после усреднения по 10 B-сканам
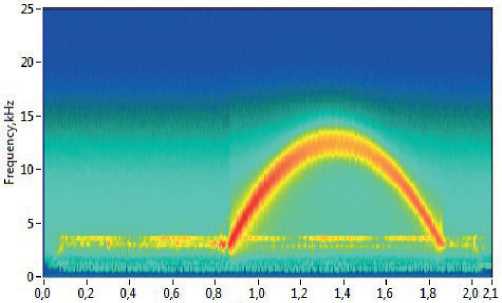
После проведения усреднения для удаления остаточных шумов проводится дополнительная спектральная фильтрация, включающая спектральное вычитание, пороговую обработку, медианную фильтрацию. Комплекс этих процедур позволяет существенно увеличить точность методики (Рис. 5).
Depth, mm
Рис. 5. Спектрограмма после пост-обработки
Для проверки представленной методики был произведен ряд экспериментов при различных углах сканирования и скоростях потока (Таблица 1). Исследование проведено с помощью специальной установки, в которой жидкость с оптическими характеристиками, соответствующими таковым у крови, перекачивалась по сосуду с помощью специального насоса. Погрешность полученных значений скорости и Доплеровского угла не превышает 3%
Таблица 1
Сравнение результатов эксперимента и установленных значений
|
Установленные значения |
Измеренные значения |
||
|
Угол (градусы) |
Скорость (мм/с) |
Угол (градусы) |
Скорость (мм/с) |
|
90 |
38.2 |
89.72 |
38.8 |
|
26.5 |
89.54 |
27.4 |
|
|
19.4 |
89.39 |
20.3 |
|
|
83 |
38.2 |
82.84 |
39.0 |
|
26.5 |
82.59 |
27.3 |
|
|
19.4 |
82.40 |
20.1 |
|
Согласно результатам эксперимента, представленная методика позволяет эффективно оценить значение Доплеровского угла и полного вектора скорости. Возможность применения данной методики в клинических условиях остается открытым вопросом, что и будет являться следующим этапом исследований.
Список литературы Определение скорости потока по доплеровскому сдвигу в оптической когерентной томографии
- A. F. Fercher, C. K. Hitzenberger, W. Drexler, G. Kamp, and H. Sattmann, « In Vivo Optical Coherence Tomography,» Am. J. Ophthalmol, vol. 116, no. 1, pp. 113-114. 1993.
- Bezerra, Hiram G.; Costa, Marco A.; Guagliumi, Giulio; Rollins, Andrew M.; Simon, Daniel I. (November 2009). «Intracoronary Optical Coherence Tomography: A Comprehensive Review». JACC: Cardiovascular Interventions 2 (11): 1035-1046. PMID 19926041 DOI: 10.1016/j.jcin.2009.06.019
- Гуров И.П. Оптическая когерентная томография: принципы, проблемы и перспективы. В кн.: Проблемы когерентной и нелинейной оптики/Под ред. И.П. Гурова и С.А. Козлова. СПб.: СПбГУ ИТМО, 2004. С. 6-30.
- Arthur, Donna Louise Doppler Optical Coherence Tomography for Microcirculation Studies: Manchester, UK: The University of Manchester; 2014.
- Галеб К.И.С., Абдулкарим С. Н., Проскурин С. Г. Связь вектора скорости с уширением допплеровских спектров//Фундаментальные исследования, Издательский Дом «Академия Естествознания» № 1-4/2015 С. 725-729


