Определение содержания фитоэкдистероидов в лекарственном средстве «Спорт-Актив» методом ВЭЖХ
Автор: Компанцева Е.В., Компанцев Д.В., Биляч Я.И., Леонова В.Н.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Биологические ресурсы: флора
Статья в выпуске: 1-4 т.13, 2011 года.
Бесплатный доступ
Разработана методика определения фитоэкдистероидов в лекарственном средстве «Спорт-актив, гранулы». Найдены условия и разработана ВЭЖХ-методика количественного определения ФЭС с применением в качестве внутреннего стандарта парацетамола. Это дает возможность оценки качества гранул, содержащих экстракт левзеи, при одновременном присутствии других компонентов гранул. Установлено, что данная методика специфичная, воспроизводимая и не отягощена систематической ошибкой.
Экстракт левзеи сафлоровидной, фитоэкдизоны, гранулы "спорт-актив"
Короткий адрес: https://sciup.org/148199752
IDR: 148199752 | УДК: 615.322+453.3.074:543.544.5.068.7
Текст научной статьи Определение содержания фитоэкдистероидов в лекарственном средстве «Спорт-Актив» методом ВЭЖХ
Леонова Виктория Нодарьевна, кандидат фармацевтических наук, преподаватель кафедры фармацевтической химии процессы. Кроме того, включение глюкозамина сульфата в состав комбинированного ЛС также оправдано, так как физические нагрузки могут привести к функциональным перегрузкам, травмам и заболеваниям опорно-двигательного аппарата, в решении данной задачи хондропротекторные ЛС занимают ведущее место.
Цель работы: разработка методики количественного определения одного из главных компонентов ЛС «Спорт-актив» – фитоэкдистерои-дов (ФЭС) экстракта левзеи.
Для количественного определения ФЭС экстракта левзеи в ФС 42-1995-99 используется метод высокоэффективной жидкостной хроматографии (ВЭЖХ) и внешний стандарт – экдисте-рон. Но наиболее эффективным является вариант ВЭЖХ в сочетании с методом внутреннего стандарта (ВС), позволяющий существенно повысить точность количественного определения индивидуальных соединений при анализе сложных по составу образцов [1]. В качестве ВС предлагается использовать парацетамол (ФС 42-0268-07), содержащий фенильный хромофор с максимумом полосы поглощения в области 238 нм, что практически совпадает с максимумом полосы поглощения хромофора (С = С – С = О) в структуре ФЭС (242 нм). В условиях, предлагаемых по ФС 42-1995-99, на хроматограмме раствора содержащего стандартный образец (СО) экдистерона и парацетамола фиксировали 2 пика, при этом коэффициент разделения пиков составил 0,11. Также оказались неудовлетворительными такие показатели, как эффективность (не более 103 теоретических тарелок), время удерживания парацетамола (2 мин) и коэффициент асимметрии пика (3-4). Таким образом, предлагаемая система по ФС 42-1995-99 оказалась непригодной для определения суммы ФЭС с использованием внутреннего стандарта.
Материал и методика. Для определения ФЭС в экстракте левзеи нами предложена следующая методика: 5,0 мл экстракта левзеи жидкого помещали в колбу вместимостью 25 мл, добавляли 10 мл спирта этилового 60%, тщательно перемешивали в течение 10-15 мин, фильтровали через бумажный фильтр, пропускали через концентрирующий патрон «Диапак 130-С 16-Т» со скоростью 0,5-1,0 мл/мин. Сумму ФЭС селективно элюировали с сорбента 10 мл спирта этилового 60%. Элюат собирали в мерную колбу емкостью 25 мл, вносили 2 мл раствора парацетамола в элюенте (С≈0,675мг/мл) и доводили до метки спиртом этиловым 60%. 3 мкл полученного раствора испытуемого образца подвергали хроматографированию. ВЭЖХ-анализ каждого образца проводили 3 раза.
Условия проведения анализа суммы ФЭС в жидком экстракте левзеи с использованием внутреннего стандарта: внутренний стандарт: парацетамол (n-ацетаминофенол); колонка: 80 х 2 мм сорбент «Диасорб 130-С16-Т»; размер частиц сорбента: 6 мкм; длина волны 242 нм; состав подвижной фазы: вода-этанол-бутанол (72,4: 26,8: 0,8); скорость потока элюента: 50 мкл/мин; объем вводимой пробы: 3 мкл; режим: изокра тическое элюирование; общее время анализа: 15 мин. Регистрацию и математическую обработку результатов ВЭЖХ-анализа осуществляли с помощью универсальной компьютерной системы сбора и обработки хроматографической информации «Полихром для Window».
Приготовление раствора парацетамола . Около 0,675 г (точная навеска) парацетамола – стандартного образца ФС 42-0268-07, помещали в мерную колбу вместимостью 100 мл, прибавляли 50 мл подвижной фазы и перемешивали в течение 15 мин. Затем доводили объем раствора подвижной фазой до метки и перемешивали. 10 мл полученного раствора переносили в мерную колбу вместимостью 100 мл, доводили тем же растворителем до метки и перемешивали. Раствор хранят в темном месте в колбе с притертой пробкой. Срок годности 1 мес.
Приготовление СО экдистерона : около 0,15 г (точная навеска) экдистерона – стандартного образца (ВФС 42-1713-87) помещали в мерную колбу вместимостью 25 мл, прибавляли 20 мл спирта этилового 95% и перемешивали. Затем доводили объем раствора спирта этилового 95% до метки и перемешивали. 7 мл полученного раствора переносили в мерную колбу вместимостью 25 мл, доводили тем же растворителем до метки и перемешивали. Раствор хранили в темном месте в колбе с притертой пробкой. Срок годности 1 мес.
Далее для исследования линейности готовили растворы с концентрациями 0,1-1,1 мг/мл экдистерона и 0,01-0,11 мг/мл парацетамола. Зависимость площади пика от концентрации носила линейный характер для обоих компонентов в
указанных областях концентраций. Уравнения имели следующий вид: y=2892x–109,5 и y=1303x–32 для экдистерона и парацетамола соответственно. На основании данных, полученных при определении линейности, вычисляли калибровочный коэффициент ( К х/ст ) по формуле:
K
х / ст
ст
a
x
Sxaст
= ст^ x 10
S
x
где S х – площадь хроматографического пика экдистерона, мВ х с; S ст – площадь пика ВС, мВ х с; а х – масса экдистерона в пробе, г; а cт – масса парацетамола в пробе, г.
Содержание ФЭС в экстракте левзеи в % (Х) вычисляли по формуле:
X = ^ S x a cm x V 1 cm x V 2 cm x К 1O0% _
S cm X а X W cm 1 x W ^ 2 0
E S X a cm X K _
S ;
ст
где ∑ S – площадь хроматографического пика ФЭС, мВ х с; S ст – площадь пика парацетамола, мВ х с; а – количество экстракта левзеи взятого на анализ; К – калибровочный коэффициент ФЭС.
Методика количественного определения ФЭС экстракта левзеи в лекарственном средстве «Спорт-актив»: около 5,0 г гранул (точная навеска) помещали в колбу вместимостью 100 мл, прибавляли 50 мл спирта этилового 60%, тщательно перемешивали в течение 10-15 мин, фильтровали через бумажный фильтр. Полученный фильтрат (раствор А) анализировали в опии-санных выше условиях. Содержание ФЭС в модельных смесях и в гранулах в г (Х) в пересчете на одну дозу гранул вычисляли по формуле:
a ■ к■ p
Х ^^kJ cmcrn г 1 cm r 2 cm
V -Л -W . W .
cm a cm 1 cm 2
где ∑ S – сумма площадей хроматографических пиков ФЭС, мВ х с; S ст – площадь пика парацетамола, мВ х с; а – количество модельной смеси, взятой на анализ; а cт – масса СО парацетамола, мг; К – калибровочный коэффициент; Р – масса одной дозы гранул.
Для проверки специфичности методики готовили модельную смесь плацебо. Проверку правильности методики проводили на трехуровневом эксперименте по 9 последовательным определениям точно известной концентрации суммы ФЭС экстракта левзеи, находящейся в пределах аналитической зоны 50-150%. Для этого использовали растворы модельных смесей гранул с содержанием экстракта левзеи соответственно 2,5 мл, 5,0 мл, 7,5 мл. Объемы экстракта левзеи помещали в колбы вместимостью
100 мл, добавляли 2,0000 г кальция глицерофосфата (точная навеска), 2,0000 г калия оротата (точная навеска), 0,7500 г глюкозамина сульфата, 50 мл спирта этилового 60%, тщательно перемешивали в течение 10-15 мин, фильтровали через бумажный фильтр. Полученный фильтрат (раствор А) использовали для анализа. Параллельно готовили модельную смесь гранул без экстракта левзеи (плацебо). Полученный раствор А пропускали через концентрирующий патрон «Диа-пак 130-С 16-Т» со скоростью 0,5-1,0 мл/мин и далее поступали как описано в методике определения ФЭС экстракта левзеи жидкого. Для определения линейности данной методики строили градуировочный график из усредненных значений оптической плотности, полученных при определении правильности методики.
Результаты и их обсуждение. При использовании внешнего стандарта (0,1-1,1 мг/мл экдистерона) и внутреннего стандарта (0,01-0,11 мг/мл парацетамола) поправочный коэффициент составил 5,17±0,14, что позволяет использовать его для расчета содержания суммы ФЭС в экстракте левзеи жидком с использованием внутреннего стандарта – парацетамола.
Хроматограммы определения суммы ФЭС в модельной смеси гранул и плацебо, полученные по вышеизложенной методике, представлены на рис. 1а и 1б. Как следует из рис. 1а в модельной смеси плацебо отсутствуют пики экдистерона и других ингредиентов модельной смеси, что позволяет проводить количественное определение суммы ФЭС в присутствии глюко-замина сульфата, калия оротата, кальция глицерофосфата и вспомогательных веществ при их совместном присутствии, т.е. методика специфична.

а
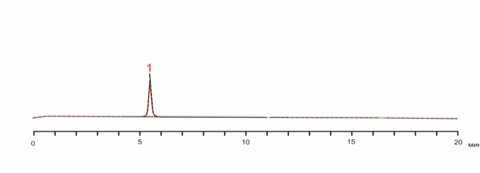
б
Рис. 1. Хроматограмма экдистероидов в составе модельной смеси плацебо (а) и модельной смеси №1 (б): 1 – парацетамол, 2 – экдистерон, 3 – неидентифицированный компонент
Определение правильности методики проводили методом добавок. Предварительно по вышеописанной методике определили сумму ФЭС в экстракте левзеи жидком, которая оказалась равной 1,28% (по ФС 42-1995-99 не менее 1%). Таким образом, в одной дозе гранул, исходя из полученных данных, содержание суммы ФЭС оказалось равным 0,064 г. Результаты определения правильности методики представлены в табл. 1. Как следует из таблицы 1 с помощью метода добавок установлено, что данная методика не отягощена систематической ошибкой. Определение воспроизводимости методики проводили на одной серии гранул (табл. 2).
Таблица 1. Установление правильности результатов определения ФЭС методом ВЭЖХ (Внешний стандарт СО парацетамол S ст , mV*сек =850,35; а = 0,6751)
|
Внесено добавки, г |
Sx, mV*сек |
Найдено добавки экдистерона |
Метрологические характеристики |
||
|
% |
г |
||||
|
50 |
0,032 |
11444,9 |
94,2 |
0,0301 |
Х ср =97,69 S ср =3,94 ∆Хср=3,94 RSD=4,03 ε, % =3,17 tрасч=1,76 t табл =2,36 |
|
0,032 |
11479,2 |
94,3 |
0,0302 |
||
|
0,032 |
11463,1 |
93,5 |
0,0299 |
||
|
100 |
0,064 |
15705,2 |
101,2 |
0,0648 |
|
|
0,064 |
15188,9 |
94,5 |
0,0605 |
||
|
0,064 |
15759,2 |
101,9 |
0,0652 |
||
|
150 |
0,096 |
19770,1 |
102,1 |
0,0980 |
|
|
0,096 |
19786,3 |
102 |
0,0979 |
||
|
0,096 |
19601,3 |
95,5 |
0,0917 |
||
Таблица 2. Результаты количественного определения ФЭС в лекарственном препарате (Внешний стандарт СО парацетамол Sст, mV*сек =850,35; а = 0,6751)
|
Взято, г |
Sx, mV*сек |
Найдено ФЭС,г |
Метрологическ ие характеристики |
|
5,0231 |
8135,0088 |
0,0668 |
Х ср =0,0645 S ср =0,0007 ∆Хср=0,0019 RSD=2,97 ε, % =3,1 |
|
5,0140 |
7532,5573 |
0,0618 |
|
|
5,0012 |
7668,6568 |
0,0630 |
|
|
5,0113 |
7910,4876 |
0,0649 |
|
|
5,0042 |
8008,5768 |
0,0657 |
|
|
5,0041 |
7863,4236 |
0,0646 |
Как следует из таблицы 2, предлагаемая методика характеризуется хорошей воспроизводимостью – RSD не превышает 3% [2]. Хроматографическая система пригодна для анализа с использованием разработанной методики при условии эффективности хроматографической колонки по пику экдистерона не менее 5000 теоретических тарелок, коэффициент асимметрии пиков близок к 1. Нами также установлено, что линейная зависимость наблюдается в интервале концентрации от 0,005 до 0,022 мг/в пробе. Уравнение имеет вид: y=119607х+359,86. Коэффициент корреляции равен 0,998.
Выводы: разработана методика ВЭЖХ-ана-лиза, которая дает возможность оценки качества гранул, содержащих экстракт левзеи, при одновременном присутствии кальция глицерофосфата, калия оротата и глюкозамина сульфата. С помощью валидации установлено, что данная методика специфичная, воспроизводимая и не отягощена систематической ошибкой. Она характеризуется достаточно высокой чувствительностью и рекомендуется для выполнения массовых анализов, а также для технологического контроля при производстве.
Список литературы Определение содержания фитоэкдистероидов в лекарственном средстве «Спорт-Актив» методом ВЭЖХ
- Сапрыкин, Л.В. Динамическое модифицирование в практике ВЭЖХ//Химический анализ. 2005. №1. С. 20-36.
- Эпштейн, Н.А. Оценка пригодности (валидация) ВЭЖХ методик в фармацевтическом анализе (обзор)//Хим.-фармац. журн. 2004. Т.38, № 4. С. 40-56.


