Определение степени агрессивности меланомы кожи после оперативного лечения для персонализации лечения
Автор: Яргунин Сергей А., Шойхет Яков Н., Лазарев Александр Ф.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Вопросы онкохирургии
Статья в выпуске: 2 т.11, 2021 года.
Бесплатный доступ
Целью исследования было разработать, внедрить и оценить возможности применения способа прогнозирования агрессивности первичной меланомы кожи у больных после хирургического удаления опухоли. Установлено, что применение методики прогнозирования агрессивности опухоли позволяет определить степень агрессивности опухолевого процесса, продолжительность жизни пациента и выделить категорию больных неблагоприятного прогноза для индивидуализации лечения. Выявлена зависимость выживаемости пациентов от степени агрессивности опухолевого процесса. Выделена группа пациентов с 0-IIa стадиями (16,4%) со 2 степенью агрессивности опухолевого процесса, имеющих потенциально высокий риск негативного прогноза, что может служить поводом к индивидуализации лечения этой категории больных. Использование способа прогнозирования негативной динамики у пациентов может потенциально расширить показания к назначению дальнейшего лечения, персонализировать терапию.
Меланома кожи, хирургическое лечение, прогнозирование выживаемости, персонализация лечения
Короткий адрес: https://sciup.org/140290743
IDR: 140290743 | DOI: 10.18027/2224-5057-2021-11-1-45-51
Текст научной статьи Определение степени агрессивности меланомы кожи после оперативного лечения для персонализации лечения
Пятилетняя выживаемость пациентов с меланомой кожи (МК) тесно связана со стадией опухоли [1]. В недавнем исследовании Абдель–Рахман сообщил, что разные отдаленные мишени метастазирования приводят к различным прогнозам [2-4]. Кроме того, он обнаружил, что отсутствие хирургического вмешательства является негативным прогностическим фактором отдаленного метастазирования [2]. Основная причина, по которой опухолевые клетки трудно уничтожить, заключается в их способности ускользать от иммунной системы с помощью различных механизмов, а сила противоопухолевого иммунного ответа организма напрямую влияет на прогноз и исход у пациентов с опухолями [5-7]. Для выявления и мониторинга пациентов с МК применялись многочисленные методы, такие как оценка иссеченных опухолей, использование биомаркеров и методы визуализации [8,9]. Известные в настоящее время гистопатологические характеристики, такие как толщина опухоли и ее изъязвление, используются для прогнозирования течения болезни [10]. Все эти данные отражены в AJCC, куда также добавлены количество митозов, распространение в лимфатических узлах и наличие отдаленных метастазов; они используются в качестве детерминант-прогноза [11]. Однако остаются ограничения на использование только системы определения стадии AJCC, и результаты выживания могут широко варьировать у пациентов с одной и той же стадией [11]. Было продемонстрировано, что такие факторы, как раса, пол и возраст, являются важными про- гностическими факторами для меланомы [12,13]. Многофакторный анализ показал, что такие факторы, как возраст на момент постановки диагноза, семейное положение, а также стадия процесса и состояние лимфатических узлов — все они являются факторами риска для выживаемости [14]. Кроме того, прогностическими являются сопутствующая патология, отдаленные метастазы, применение системных методов лечения и лучевой терапии [1,15-19]. Имеются данные, свидетельствующие о тесной взаимосвязи иммунной системы и опухолевым прогнозом [7]. Результаты показали, что высокая экспрессия HDAC6 в значительной степени связана с неблагоприятным прогнозом: она коррелировала с метастазированием меланомы и сокращением выживаемости пациентов с меланомой, и эта связь оставалась значимой при многофакторном анализе [20]. Тем не менее, совокупные данные исследований показывают, что биомаркеры не являются абсолютно прогностическими, и для оптимизации лечебной тактики явно необходимы более эффективные и доступные маркеры. Необходимо изучить потенциальные биомаркеры, терапевтические мишени и физиологические особенности организма для улучшения диагностики и лечения инвазивной МК. Необходимы новые прогностические инструменты для повышения точности прогнозирования выживаемости у пациентов с МК.
Вопросы онкохирургии
РАСЧЕТ СТЕПЕНИ АГРЕССИВНОСТИ МЕЛАНОМЫ КОЖИ
В исследование включено 337 пациентов с первичной меланомой кожи 0–IIIc стадий. Проведен многофакторный анализ, пациенты были разделены на группы. Опытным путем на общей совокупности пациентов, с учетом имеющихся данных по каждому пациенту, а также меланомо-специфичной общей выживаемости, определены факторы, на нее влияющие, а также дана оценка в баллах каждому фактору в зависимости от его характеристики. Распределение выживаемости в исследуемой совокупности не подчинялось нормальному закону (р < 0,001, тест Колмогорова–Смирнова), поэтому в качестве меры средней тенденции для сравнения выживаемости в группах с разной степенью агрессивности опухоли использовались медиана и межквартальный диапазон (табл. 1). Вначале у каждого пациента необходимо было выяснить значимые факторы, влияющие на прогноз меланомы.
Установлена степень влияния каждого фактора в баллах: минимальное влияние — 1 балл, двукратное — 2 балла, трёхкратное — 3 балла и т. д. Были взяты следующие данные: пол (где мужчина оценивался в 2 балла, женщина в 1 балл), возраст (40–59 лет — 1 балл, до 40 лет и после 60лет— 2 балла), рост (160–169 см— 1 балл, до 160 и более 170см— 2 балла), вес (до60кг— 3 балла, 60–89 кг — 2 балла, 90кг и выше — 1 балл), индекс массы тела (ИМТ: ИМТ < N — 3 балла, ИМТ = N (18,5–24,5) — 2 балла, ИМТ > N — 1 балл), сопутствующие заболевания (наличие — 2 балла, отсутствие — 1 балл), характер труда (умственный и физический — 2 балла, смешанный — 1 балл), профессиональные вредности (наличие — 2 балла, отсутствие — 1 балл), продолжительность сна (7–8 часов — 1 балл, до 7 или более 8 часов — 2 балла), стадия заболевания (0–IIa— 1 балл, IIb– IIc— 2 балла, IIIa–IV — 3 балла), применение пластических методов закрытия дефекта (использование — 1 балл, отказ от использования — 2 балла), форма разреза (эллипсовидный— 1 балл, иной способ — 2 балла), наличие лимфоидной инфильтрации в опухоли (нет — 3 балла, слабовыражен-ная — 2 балла, выраженная — 1 балл), форма МК (поверхностно-распространенная — 1 балл, МК типа злокачественного лентиго — 2 балла, узловая — 3 балла), толщина
Таблица 1. Определение степени агрессивности опухолевого с балльной оценкой процесса у пациентов с меланомой кожи
|
Фактор (Р) |
Значения |
Баллы |
|
|
1 |
Пол |
Мужчина |
2 |
|
Женщина |
1 |
||
|
2 |
Возраст |
До 40 лет |
2 |
|
40–59 лет |
1 |
||
|
60 лет и старше |
2 |
||
|
3 |
Рост |
До160см |
2 |
|
160–169 см |
1 |
||
|
170 см и выше |
2 |
||
|
4 |
Вес |
До 60 кг |
3 |
|
60–89 кг |
2 |
||
|
90кг и выше |
1 |
||
|
5 |
ИМТ |
ИМТ < N |
3 |
|
ИМТ = N (18,5–24,5) |
2 |
||
|
ИМТ > N |
1 |
||
|
6 |
Сопутствующие заболевания |
Да |
2 |
|
Нет |
1 |
||
|
7 |
Характер труда |
Умственный |
2 |
|
Смешанный |
1 |
||
|
Физический |
2 |
||
|
8 |
Профессиональные вредности |
Нет |
1 |
|
Да |
2 |
||
|
9 |
Продолжительность сна |
До 7 часов |
2 |
|
7–8 часов |
1 |
||
|
Более 8 часов |
2 |
||
|
10 |
Стадия |
0–IIa |
1 |
|
IIb–IIc |
2 |
||
|
IIIa–IV |
3 |
||
|
Фактор (Р) |
Значения |
Баллы |
|
|
11 |
Применение пластических методов закрытия дефекта |
Использовалась |
1 |
|
Не использовалась |
2 |
||
|
12 |
Форма разреза |
Эллипс |
1 |
|
Иная |
2 |
||
|
13 |
Наличие лимфоидной инфильтрации в опухоли |
Нет |
3 |
|
Слабовыраженная |
2 |
||
|
Выражена |
1 |
||
|
14 |
Форма МК |
Поверхностнораспространенная |
1 |
|
МК злокачественного лентиго |
2 |
||
|
Узловая |
3 |
||
|
15 |
Толщина опухоли (по Бреслоу) |
До 2 мм |
1 |
|
2–4мм |
2 |
||
|
Более 4мм |
3 |
||
|
16 |
Наличие изъявления первичной опухоли |
Нет |
1 |
|
Есть |
3 |
||
|
17 |
ki-67—онкоген |
До 10% |
1 |
|
10–20 % |
2 |
||
|
Более 20% |
3 |
||
|
18 |
BRAF-мутация |
Нет |
1 |
|
Есть |
2 |
||
|
19 |
Наличие прогрессирования заболевания |
Да |
2 |
|
Нет |
1 |
||
|
20 |
Место прогрессирования |
Нет |
1 |
|
Регионарные и транзиторные |
2 |
||
|
Отдаленные |
3 |
||
Вопросы онкохирургии опухоли по Бреслоу (до 2мм — 1 балл, 2–4 мм — 2 балла, более 4мм — 3 балла), наличие изъявления первичной опухоли (наличие — 3 балла, отсутствие — 1 балл), ki-67 — онкоген (уровень до10%— 1 балл, 10–20% — 2 балла, более 20% — 3 балла), BRAF — мутация (отсутствие — 1 балл, наличие — 2 балла), прогрессирование заболевания (присутствует — 2 балла, отсутствует — 1 балл), место прогрессирования (нет — 1 балл, регионарные и транзиторные метастазы — 2 балла, отдаленные метастазы — 3 балла). Данные представлены в табл. 1.
Минимальное возможное число баллов для формулы — 20, максимально возможное число баллов — 48. Пациенты, набравшие S<1,5 ед. были отнесены к категории I-й степени агрессивности опухолевого процесса, S = 1,5–2,0 ед.— ко II-й степени агрессивности опухолевого процесса, S >2 ед.— к III-й степени агрессивности опухолевого процесса. Расчёт степени агрессивности опухоли производился по формуле 1:
S= (P1+P2+ ... Pn) n где S — степень агрессивности (в ед.);
Р— фактор (пол, возраст ит. д.), влияющий на прогноз (в баллах);
n — число анализируемых факторов.
ВЫЖИВАЕМОСТЬ ПАЦИЕНТОВ
С ПЕРВИЧНОЙ МЕЛАНОМОЙ КОЖИ
В ЗАВИСИМОСТИ ОТ СТЕПЕНИ АГРЕССИВНОСТИ ОПУХОЛИ
В исследование включено 337 пациентов с первичной меланомой кожи 0–IIIc стадии после хирургического удаления первичной опухоли. Проведен многофакторный анализ, все пациенты были распределены с учетом факторов агрессивности с балльной оценкой на группы I, II и III степени агрессивности (табл. 2). Всего с I степенью агрессивности выявлено 92 пациента (27,3% от n=337). Из них на долю пациентов с 0–IIа стадиями приходилось 98,9% случаев, пациентов с IIb–IIс стадиями зарегистрировано не было, а на долю пациентов с IIIb–IIIс приходился
Таблица 2. Средняя выживаемость пациентов с меланомой кожи в зависимости степени агрессивности опухоли в баллах
|
Степень агрессивности опухоли (S) |
Ме (Q1–Q3), мес. |
p-level* |
|
|
I |
<1,5 ед. (n=92) |
65,5 (62,3–69) |
<0,001 |
|
II |
1,5–2 ед. (n=225) |
62 (30,5–70) |
|
|
III |
>2 ед. (n=20) |
18,5 (14–25) |
|
* Использован тест Н-тест Краскала–Уоллиса (Kruskal–Wallis test). Распределение выживаемости в исследуемой выборочной совокупности не подчиняется нормальному закону (р < 0,001, тест Колмогорова–Смирнова)
всего 1,1% случаев (табл. 3). Со II степенью агрессивности выявлено 225 пациентов (66,8% от n=337), из них на долю пациентов с 0–IIа стадиями приходилось 16,4% случаев, на долю пациентов с IIb–IIс стадиями — 73,4% случаев, на долю пациентов с IIIB–IIIC стадиями — 10,2% случаев (табл. 3). С III степенью агрессивности выявлено 20 пациентов (5,9% от 337), пациентов с 0–IIа стадиями зарегистрировано не было (0,0%), на долю пациентов с IIb–IIc стадиями приходилось 55,0% случаев, на долю пациентов с IIIb–IIIc стадиями — 45,0% случаев (табл. 3).
Доля пациентов с I степенью агрессивности опухолевого процесса была достоверно выше на 98,9% (98,9% и 0,0% соответственно, р < 0,001) у пациентов с 0–IIa стадиями по сравнению с пациентами с IIb–IIc стадиями и на 97,1% (98,9% и 1,1% соответственно, р < 0,001) выше, чем пациентов с IIIb–IIIc стадиями. Разница между пациентами с 0–IIa/IIb–IIc была недостоверна (р > 0,050, табл. 3).
Доля пациентов со II степенью агрессивности опухолевого процесса была достоверно выше на 57,0% (73,4% и 16,4% соответственно, р < 0,001) у пациентов сIIb–IIc стадиями по сравнению с пациентами с 0–IIa и на 63,2% (73,4% и 10,2%, соответственно, р < 0,001) выше, чем пациентов с IIIb–IIIc стадиями. Разница между пациентами с 0–IIa/ IIIb–IIIc стадиями была недостоверна (р>0,050, табл. 3).
Доля пациентов с III-й степенью агрессивности опухолевого процесса была достоверно выше на 55,0% (55,0% и 0,0% соответственно, р< 0,001) у пациентов с IIb–IIc стадиями по сравнению с пациентами с 0–IIa стадиями, а доля пациентов IIIb–IIIc — на 45,0% (45,0% и 0,0%, соответственно, р < 0,001) выше по сравнению с пациентами с 0–IIa стадиями. Разница между пациентами с IIb–IIc/ IIIb–IIIc стадиями была недостоверна (р>0,050, табл. 3).
Все пациенты с I степенью агрессивности переживали порог в 12 месяцев, до конца 5-летнего периода доживало 98,9% пациентов. Пациенты со II степенью агрессивности процесса в 95,6% доживали до 12-месячного
Таблица 3. Степень агрессивности опухоли в зависимости от стадии заболевания у пациентов с меланомой кожи
|
Стадия меланомы кожи |
Степень агрессивности |
|||||
|
I степень <1,5 ед. |
II степень 1,5–2 ед. |
III степень >2 ед. |
||||
|
Абс. |
% |
Абс. |
% |
Абс. |
% |
|
|
0–IIa (n=128) |
91 |
98,9 |
37 |
16,4 |
0 |
0,0 |
|
IIb–IIc (n=176) |
0 |
0,0 |
165 |
73,4 |
11 |
55,0 |
|
IIIb–IIIc (n=33) |
1 |
1,1 |
23 |
10,2 |
9 |
45,0 |
|
Всего (n=337) |
92 |
100,0 |
225 |
100,0 |
20 |
100,0 |
|
Vs степень агрессивности 0–IIa/IIb–IIc |
<0,001 |
<0,001 |
<0,001 |
|||
|
Vs степень агрессивности 0–IIa/IIIb–IIIc |
<0,001 |
0,376 |
<0,001 |
|||
|
Vs степень агрессивности IIb–IIc/IIIb–IIIc |
- |
<0,001 |
0,291 |
|||
Вопросы онкохирургии
Таблица 4. Скорректированная общая выживаемость пациентов с меланомой кожи в зависимости от степени агрессивности опухоли
|
Степень агрессивности опухоли |
Период наблюдения (месяцев) |
||||||||
|
12 |
36 |
60 |
|||||||
|
Абс. число |
%* |
Абс. число |
%* |
р |
Абс. число |
%* |
р |
р1 |
|
|
I (n = 92) |
92 |
100,0 |
91 |
98,9 |
1,0 |
91 |
98,9 |
1,0 |
1,0 |
|
II (n = 225) |
215 |
95,6 |
170 |
75,6 |
< 0,001 |
143 |
63,6 |
< 0,001 |
< 0,001 |
|
III (n = 20) |
16 |
80,0 |
5 |
25,0 |
0,001 |
4 |
20,0 |
< 0,001 |
1,0 |
|
Итого (n = 337) |
323 |
95,8 |
266 |
78,9 |
< 0,001 |
238 |
70,6 |
< 0,001 |
< 0,001 |
|
Vs I/II |
0,041 |
< 0,001 |
< 0,001 |
||||||
|
Vs I/III |
< 0,001 |
< 0,001 |
< 0,001 |
||||||
|
Vs II/III |
0,004 |
< 0,001 |
< 0,001 |
||||||
Статистически значимые различия: р — с периодом 12 месяцев; р1 — между периодами 36 и 60 месяцев после операции (использован непараметрический критерий Мак-Немара)
периода наблюдения, тогда как к концу 3-летнего периода их количество снижалось до 75,6%, а к концу 5-летнего периода в живых оставалось 63,6% пациентов. С III степенью агрессивности процесса до конца 1 года наблюдения оставались живы 80,0% пациентов, к концу 3-летнего периода — 25,0%, а к концу 5-летнего рубежа — только 20,0% (табл. 4). В период наблюдения до12 месяцев после операции у пациентов с I степенью агрессивности скорректированная общая выживаемость (сОВ) по сравнению с пациентами со II степенью агрессивности опухолевого процесса была выше на 4,4% (100,0% и 95,6%, соответственно, р = 0,041) а по сравнению с пациентами сIII степенью агрессивности опухолевого процесса выше на 20,0% (100,0% и 80,0%, соответственно, р < 0,001). У пациентов со II степенью агрессивности опухолевого процесса по сравнению с пациентами с III степенью агрессивности опухолевого процесса сОВ была выше на 15,6% (95,6% и 80,0%, соответственно, р = 0,004) (табл. 4, рис. 1).
В период наблюдения до 36 месяцев после операции у пациентов с I степенью агрессивности СОВ по сравнению с пациентами со II степенью агрессивности опухолевого процесса была выше на 23,3% (98,9% и 75,6%, соответственно, р < 0,001) и на 73,9% выше, чем у пациентов с III степенью агрессивности опухолевого процесса (98,9% и 25,0%, соответственно, р < 0,001). У пациентов со II степенью агрессивности опухолевого процесса по сравнению с пациентами с III степенью агрессивности опухолевого процесса сОВ была выше на 50,6% (75,6% и 25,0%, соответственно, р < 0,001) (табл. 4, рис. 1).
Тест Хи-квадрат показывает наличие достоверных различий в частотных соотношениях таблицы (χ = 224,8; р < 0,001). H-тест Краскала–Уоллиса также показывает достоверное влияние стадии заболевание на степень агрессивности опухоли (р < 0 < 001)
В период наблюдения до 60 месяцев после операции у пациентов с I степенью агрессивности сОВ по сравнению с пациентами со II степенью агрессивности опухолевого процесса в период наблюдения была выше на 35,3%
(98,9% и 63,6%, соответственно, р < 0,001) и на 78,9% выше, чем у пациентов с III степенью агрессивности течения опухолевого процесса (98,9% и 20,0%, соответственно, р < 0,001). У пациентов со II степенью агрессивности опухолевого процесса по сравнению с пациентами с III степенью агрессивности опухолевого процесса сОВ была выше на 43,6% (63,6% и 20,0%, соответственно, р < 0,001, табл. 4, рис. 1).
Подавляющее количество пациентов, у которых установлена I степень агрессивности были с 0–IIa стадиями МК— 98,9%, с IIb–IIc стадиями пациентов не было, а с IIIb– IIIc стадией было всего 1,1 %, что достоверно на 97,8% (р < 0,001) меньше, чем пациентов с 0–IIa стадиями. Боль-
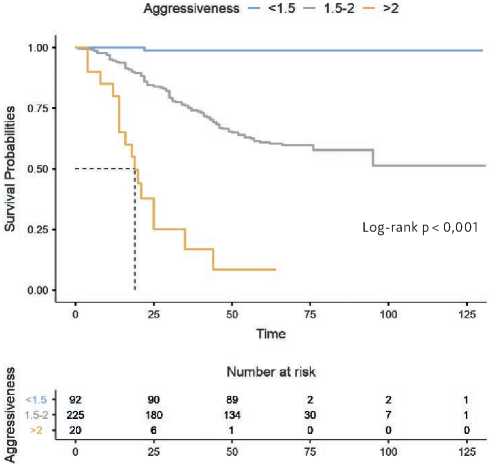
Рисунок 1. Скорректированная общая выживаемость (сОВ) пациентов с первичной меланомой кожи в группах в зависимости от степени агрессивности опухолевого процесса.
Вопросы онкохирургии ше всего пациентов, у которых установлена II степень агрессивности были с IIb–IIc стадиями, что достоверно на 57,0% (р < 0,001) больше, чем пациентов с 0–IIa стадиями и на 63,2% (р < 0,001) больше, чем пациентов с IIIb–IIIc; разница между пациентами 0–IIa и IIIb–IIIc стадиями хотя и была в пользу 0–IIa, но статистически была не достоверной (p = 0,376). С III степенью агрессивности пациентов с IIb–IIc стадиями было 55,0%, а с IIIb–IIIc — 45,0%, что соответствовало статистическому преимуществу натоже количество % над количеством пациентов со 0–IIa стадиями (р < 0,001), которых зарегистрировано не было с III степенью агрессивности. Разница в количестве пациентов с IIb–IIc и IIIb–IIIc стадиями была на 10,0% в пользу последней, но она была статистически не различимой (р = 0,291, табл. 3).
Пациенты с минимальной степенью агрессивности процесса достоверно больше переживали 12 месячный рубеж по сравнению с пациентами со II степенью агрессивности на 4,4% (р = 0,041), с III степенью — на 20,0% (p < 0,001). Пациенты со II степенью агрессивности имели преимущество в сОВ перед пациентами с III степенью агрессивности на 15,8% (р = 0,004). Пациенты с I степенью агрессивности опухолевого процесса достоверно больше переживали 3-летний рубеж по сравнению с пациентами со II степенью агрессивности — на 23,3% (p < 0,001), с III степенью — на 73,9% (p < 0,001). Пациенты со II степенью агрессивности опухолевого процесса имели преимущество в сОВ перед пациентами с III степенью агрессивности на 50,6% (p < 0,001). Медиана выживаемости у пациентов с III степенью агрессивности была достигнута на19 (15–23) месяце, у пациентов с I и II степенями медиана выживаемости не достигнута за период наблюдения.
Пациенты с I степенью агрессивности опухолевого процесса достоверно больше переживали 5-летний период по сравнению с пациентами со II степенью агрессивности на 35,3% (p < 0,001), с III степенью — на 78,9% (p < 0,001). Пациенты со II степенью агрессивности опухолевого процесса имели преимущество в сОВ перед пациентами с III степенью на 43,6% (p < 0,001, табл. 4, рис. 1).
ОБСУЖДЕНИЕ
Несмотря на стадию благоприятного прогноза, 37 (16,4%) пациентов с 0–IIa стадиями по совокупности факторов были отнесены во 2 прогностическую группу (промежуточную), в которой доминировали пациенты с IIb–IIc стадиями неблагоприятного прогноза, которые переживали 5-летний период только в 63,6% случаях — это может служить поводом к назначению адъювантного лечения (табл. 4).
Таким образом, из данных нашего анализа следует, что пациенты с I степенью агрессивности имеют 5-летнюю выживаемость 98,9%, и этот показатель достоверно выше по сравнению с другими степенями (со II степенью на 35,3%, а с III — на 78,9%, p < 0,001). У 16,4% пациентов с 0–IIa стадиями (благоприятного прогноза) была II степень агрессивности опухолевого процесса (промежуточная), в которой доминировали пациенты со стадиями неблагоприятного прогноза (IIb–IIc). А у пациентов со II степенью агрессивности опухолевого процесса 5-летняя сОВ была на 35,3% меньше, чем в группе пациентов с I степенью агрессивности опухолевого процесса, что может служить поводом к назначению этой категории больных адъювантного лечения. На способ был получен патент РФ № 2754100 «Способ определения степени агрессивности течения меланомы кожи» от 26.08.2021, заявка № 2021104031.
ВЫВОДЫ
Применение методики прогнозирования агрессивности опухоли позволяет с высокой точностью определить степень агрессивности опухолевого процесса первичной меланомы кожи 0–IIIс стадий, продолжительность жизни пациентов и выделить категорию больных неблагоприятного прогноза с целью индивидуализации дальнейшего лечения.
Список литературы Определение степени агрессивности меланомы кожи после оперативного лечения для персонализации лечения
- Rockberg J., Amelio J. M., Taylor A. et al. Epidemiology of cutaneous melanoma in Sweden-Stage-specific survival and rate of recurrence. Int J Cancer 2016; 139:2722-9.
- Abdel-Rahman O. Clinical correlates and prognostic value of different metastatic sites in patients with malignant melanoma of the skin: a SEER database analysis. J Dermatolog Treat 2018; 29:176-81.
- Korn E. L., Liu P. Y., Lee S. J. et al. Meta-analysis of phase II cooperative group trials in metastatic stage IV melanoma to determine progression-free and overall survival benchmarks for future phase II trials. J Clin Oncol. 2008 Feb 1; 26 (4):527-34. doi: 10.1200/JCO. 2007.12.7837. PMID: 18235113.
- Balch C. M., Gershenwald J. E., Soong S. J, et al. Final version of 2009 AJCC melanoma staging and classification. J Clin Oncol. 2009; 27: 6199-206. 10.1200/JCO. 2009.23.4799.
- Doyle C. Combination Immunotherapy Superior to Monotherapy in Patients with Melanoma. Am Health Drug Benefits. 2015; 8 (Spec Issue): 41 Epub 2015/09/19.
- Chae Y. K., Arya A., Iams W., et al. Current landscape and future of dual anti-CTLA4 and PD-1/PD-L1 blockade immunotherapy in cancer; lessons learned from clinical trials with melanoma and non-small cell lung cancer (NSCLC). J Immunother Cancer. 2018; 6 (1):39 Epub 2018/05/18. 10.1186/s40425-018-0349-3.
- Albittar A. A., Alhalabi O., Glitza O. Immunotherapy for Melanoma. Adv Exp Med Biol. 2020; 1244:51-68. 10.1007/978-3-030-41008-7_3.
- Riker A. I., Enkemann S. A., Fodstad O. et al. The gene expression profiles of primary and metastatic melanoma yields a transition point of tumor progression and metastasis. BMC Med Genomics. 2008; 1 (1):1-16.
- Mohammadpour A., Derakhshan M., Darabi H., et al. Melanoma: where we are and where we go. J Cell Physiol. 2019; 234 (4):3307-3320.
- Abbas O., Miller D. D., Bhawan J. Cutaneous malignant melanoma. Am J Dermatopathol. 2014; 36 (5): 363-379.
- Weiss S. A., Hanniford D., Hernando E., et al. Revisiting determinants of prognosis in cutaneous melanoma. Cancer-Am Cancer Soc 2015; 121:4108-23.
- Enninga E., Moser J. C., Weaver A. L. et al. Survival of cutaneous melanoma based on sex, age, and stage in the United States. Cancer Med 2017; 6:2203-12.
- Cherobin A. C. F. P., Wainstein A. J. A., Colosimo E. A., et al. Prognostic factors for metastasis in cutaneous melanoma. An Bras Dermatol 2018; 93:19-26.
- Yang J., Pan Z., Zhao F., et al. A nomogram for predicting survival in patients with nodular melanoma: A population-based study. Medicine (Baltimore). 2019 Jun; 98 (24):e16059. doi: 10.1097/MD. 0000000000016059. PMID: 31192966.
- Cavanaugh-Hussey M. W., Mu E. W., Kang S. et al. Older age is associated with a higher incidence of melanoma death but a lower incidence of sentinel lymph node metastasis in the SEER databases (2003-2011). Ann Surg Oncol 2015; 22:2120-6.
- Gimotty P. A., Shore R., Lozon N. L. et al. Miscoding of melanoma thickness in SEER: research and clinical implications. J Invest Dermatol 2016; 136:2168-72.
- Ciarrocchi A., Pietroletti R., Carlei F. et al. Extensive surgery and lymphadenectomy do not improve survival in primary melanoma of the anorectum: results from analysis of a large database (SEER). Colorectal Dis 2017; 19:158-64.
- Jang B-S, Chang J. H., Oh S., et al. Surgery vs. radiotherapy in patients with uveal melanoma: analysis of the SEER database using propensity score matching and weighting. Strahlenther Onkol 2017; 193:931-42.
- Pasquali S., Hadjinicolaou A. V., Chiarion Sileni V. et al. Systemic treatments for metastatic cutaneous melanoma. Cochrane Database Syst Rev 2018; 2: CD011123.
- Hu Z., Rong Y., Li S., et al. Upregulated Histone Deacetylase 6 Associates with Malignant Progression of Melanoma and Predicts the Prognosis of Patients. Cancer Manag Res. 2020 Dec 17; 12:12993-13001. doi: 10.2147/CMAR. S284199. eCollection 2020. PMID: 33364845.


