Определение термодинамических характеристик реакции получения N-метил-D-глюкозимина
Автор: Михайлов Степан Петрович, Бровко Роман Викторович, Мушинский Лев Сергеевич, Сульман Михаил Геннадьевич
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Химические науки
Статья в выпуске: 11 т.6, 2020 года.
Бесплатный доступ
Представленная статья посвящена термодинамическим расчетам обратимой реакции образования N-метил-D-глюкозимина, промежуточного продукта получения N-метил-D-глюкозамина, широко используемого в фармацевтической практике в качестве балластного вещества или противоиона, улучшающего биодоступность основного лекарственного средства. N-метил-D-глюкозимин синтезируется в результате взаимодействия D-глюкозы с метиламином в среде органических растворителей, реакция является обратимой, а выход целевого продукта всецело зависит от условий проведения реакции. Применение термодинамических расчетов позволяет оценить влияния условий проведения химических процессов на выход целевых продуктов, что в свою очередь способствует более глубокому пониманию механизмов протекания химических реакций. При химическом равновесии прямая и обратная реакции протекают с равными скоростями, а концентрации продуктов и реагентов остаются постоянными. При протекании реакции в замкнутой системе, через определенное время наступает состояние равновесия, при этом реакция не протекает с полной трансформацией реагентов. В представленной статье приводятся результаты термодинамических расчетов реакции синтеза N-метил-D-глюкозимина методом Ван-Кравлена-Черемнова. Рассчитаны энергия Гиббса, константы равновесия и конверсия глюкозы при единичной активности реагирующих веществ. Показано что рост температуры реакционной массы с 20 до 160 °С способствует увеличению конверсии глюкозы с 3 до 32%, в связи с чем можно рекомендовать проведение этой реакции при повышенных температурах.
D-глюкоза, n-метил-d-глюкозимин, основание шиффа, термодинамические расчеты, равновесие, энергия гиббса
Короткий адрес: https://sciup.org/14117692
IDR: 14117692 | УДК: 544.47 | DOI: 10.33619/2414-2948/60/04
Текст научной статьи Определение термодинамических характеристик реакции получения N-метил-D-глюкозимина
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 544.47
Применение термодинамических расчетов позволяет оценить влияния условий проведения химических процессов на выход целевых продуктов, что в свою очередь способствует более глубокому пониманию механизмов протекания химических реакций. Термодинамика — это наука о физических и химических системах, находящихся в стационарном, нестационарном состояниях при их взаимодействии с окружающей средой [1– 2]. Взаимодействия могут включать обмен теплотой [3], работой и массы между системой и окружающей средой, определяемый граничными условиями [4]. Типичная работа включает в себя воздействие внешних механических [5], электрических и магнитных полей [6]. Первый закон термодинамики описывает эти взаимодействия, утверждая, что чистое изменение энергии окружающей среды должно уравновешиваться противоположным изменением внутренней энергии системы. В то время как второй закон термодинамики управляет эволюцией состояния внутри системы при заданных взаимодействиях между системой и окружающей средой. Второй закон термодинамики заявляет, что любые внутренние процессы, если они происходят спонтанно, то есть необратимо, должны приводить к положительным значениям энтропии. Комбинация первого и второго законов термодинамики была впервые получена Гиббсом и названа им фундаментальным термодинамическим уравнением, которое вдохновило Максвелла на построение модели ее поверхности [1]. Комбинированный закон термодинамики представляет собой интеграцию внешних и внутренних переменных системы и, очевидно, включает как равновесные, так и неравновесные состояния системы [2], хотя Гиббс сосредоточился на применении комбинированного закона к состояниям равновесия в своей работе [1]. Через серию основополагающих публикаций Гиббс [1] разработал основу для равновесия гетерогенных веществ посредством геометрического представления термодинамических свойств, включая связующие линии, треугольники, определение химических потенциалов, а также критерии равновесия и стабильности.
Получение N-метил-D-глюкозимина является первым этапом синтеза N-метил-D-глюкозамина, который широко используется фармацевтической практике в качестве балластного вещества и противоиона, улучшающего биодоступность основного лекарственного средства. N-метил-D-глюкозимин синтезируется в результате взаимодействия D-глюкозы с метиламином в среде органических растворителей, реакция является обратимой, а выход целевого продукта всецело зависит от условий проведения реакции. В представленной статье приводятся результаты термодинамических расчетов реакции синтеза N-метил-D-глюкозимина методом Ван-Кравлена–Черемнова.
Методы исследования
Расчет Δ G т о обр методом Ван-Кравлена–Черемнова
Эмпирический метод расчета ΔGто обр Ван-Кравлена–Черемнова основан на использовании Формулы 1 [7–8],
Δ G т о обр = Σ А+ Σ BT (1)
где Σ А, Σ В — суммы эмпирических коэффициентов групповых составляющих, на которые разбивается данное соединение.
Эмпирические коэффициенты являются справочными и/или вычисляются методами статистической термодинамики.
Для расчета константы равновесия использовался третий закон термодинамики в приложении к обратимым химическим реакциям (2):
Δ G т о обр =-RT×ln(K a ) (2)
где Δ G т о обр — энергия Гиббса для соответствующей реакции, Дж/(моль×К); R — газовая постоянная, 8,314 Дж/(моль×К); T — температура, K; K a — константа равновесия реакции.
В свою очередь константа равновесия реакции может быть использована для вычисления конверсии целевых веществ или продуктов реакции, в соответствии с Формулой 3.
_ а г лю (а)а м еАм (а)
a а г лю (1-а)(а м еАм -а г лю (а))
где а 0лю
—
активность исходного раствора глюкозы, моль/л; а МеАм
—
активность
исходного раствора метиламина, моль/л.
Результаты и обсуждение
Для реакции синтеза N-метил-D-глюкозимина (4) групповые составляющие уравнения Ван-Кравлена–Черемнова приведены в Таблице.
OH C
H COH
HO C H + CH NH
H COH
H COH
CH OH
CH 3
NH C
H COH
HO CH
H COH
H COH
CH OH
+ H 2 O
D-глюкоза метиламин
N-метил-D-глюкозимин
Таблица.
РЕЗУЛЬТАТЫ ВЫЧИСЛЕНИЯ ГРУППОВЫХ КОЭФФИЦИЕНТОВ СОЕДИНЕНИЙ ПО МЕТОДУ ВАН-КРАВЛЕНА–ЧЕРЕМНОВА
|
Группа |
Групповая составляющая |
Рассматриваемое соединение |
||
|
A, ккал/моль |
В×10-2, ккал/моль |
A, ккал/моль |
В×10-2, ккал/моль |
|
|
H 2 O |
||||
|
H 2 O |
-58,076 |
1,154 |
-58,076 |
1,154 |
|
Глюкоза (С 6 H 12 O 6 ) |
||||
|
–CH 2 – |
-5,283 |
2,443 |
-5,283 |
2,443 |
|
–CH– |
-0,756 |
2,942 |
-3,024 |
11,768 |
|
–C=OH |
-29,16 |
0,663 |
-29,16 |
0,663 |
|
–ОН |
-42,959 |
1,134 |
-42,959 |
1,134 |
|
(первичная) |
||||
|
–ОН |
-44,538 |
1,18 |
-178,152 |
4,72 |
|
(вторичная) |
||||
|
ИТОГО |
-258,578 |
20,728 |
||
|
Метиламин (СН 3 NH 2 ) |
||||
|
–CH 3 |
-10,833 |
2,176 |
-10,833 |
2,176 |
|
–NH 2 |
2,82 |
2,71 |
2,82 |
2,71 |
|
ИТОГО |
-8,013 |
4,886 |
||
|
N-метил-D-глюкозимин (С 7 Н 15 N) |
||||
|
–CH 2 – |
-5,283 |
2,443 |
-5,283 |
2,443 |
|
–CH– | |
-0,756 |
2,942 |
-3,024 |
11,768 |
|
–N=C– | |
46,32 |
-0,89 |
46,32 |
-0,89 |
|
–ОН |
-42,959 |
1,134 |
-42,959 |
1,134 |
|
(первичная) |
||||
|
–ОН |
-44,538 |
1,18 |
-178,152 |
4,72 |
|
(вторичная) |
||||
|
–CH 3 |
-10,833 |
2,176 |
-10,833 |
2,176 |
|
ИТОГО |
-193,931 |
21,351 |
||
С учетом общего вида уравнения Ван-Кравлена–Черемнова (1) и реакции получения N-метил-D-глюкозимина (2), Δ G т о реакции может быть выражено Формулой 5.
о реакции= 2А Сп°Родр — = 2А С И'сХбр- = 14,585—3,109х10 -2 Т
Графическая зависимость Δ G т о реакции от температуры в диапазоне температур 20– 150 °С приведены на Рисунке 1.
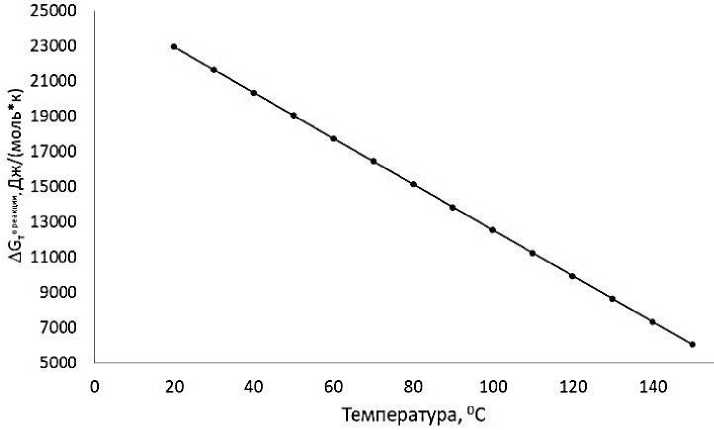
Рисунок 1. Зависимость энергии Гиббса от температуры для реакции получения N-метил-D-глюкозимина.
Необходимо отметить, что энергия Гиббса реакции находится в положительной области, что позволяет судить о смещении равновесия процесса влево. Однако, тенденция уменьшения энергии Гиббса при увеличении температуры с 20 до 160 °С, с 23 кДж/(моль×к) до 6 кДж/(моль×л) показывает на возможность смещения равновесия реакции вправо при более высокой температуре. Рассчитанные по Формуле 2 константы равновесия были сведены график (Рисунок 2) зависимости константы равновесия от температуры. При этом увеличение реакционной температуры от 20 до 160 °С способствует увеличению константы равновесия реакции образования N-метил-D-глюкозимина с 0,001 до 0,18.
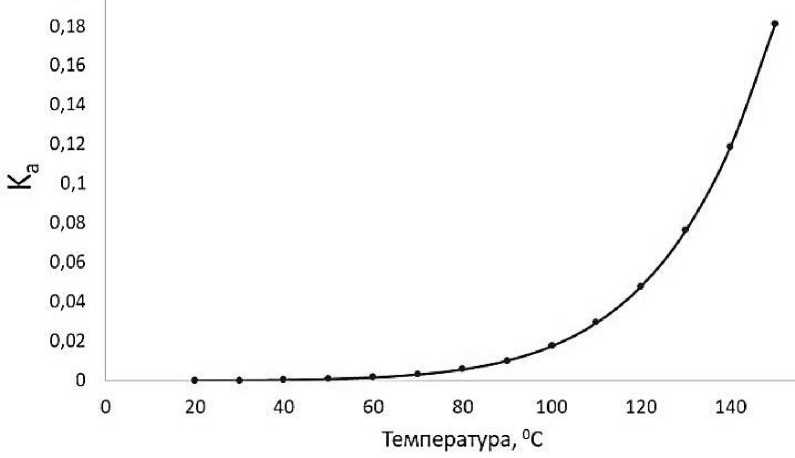
Рисунок 2. Зависимость константы равновесия от температуры для реакции получения N-метил-D-глюкозимина.
В случае единичных значений начальных активностей D-глюкозы и метиламина возможно провести оценку конверсии реагентов (Рисунок 3). При этом рост температуры реакционной массы с 20 до 160 °С способствует увеличению конверсии глюкозы с 3 до 32%, в связи с чем можно рекомендовать проведение этой реакции при повышенных температурах.
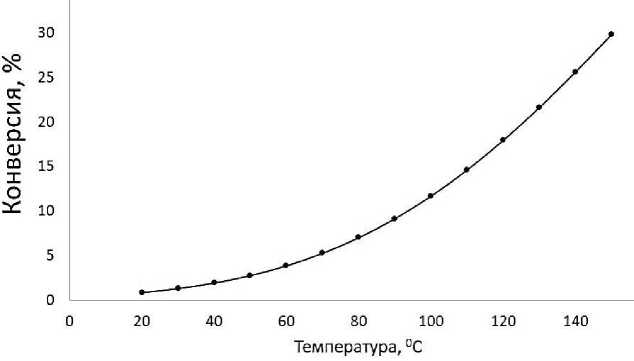
Рисунок 3. Зависимость равновесной конверсии от температуры для реакции получения N-метил-D-глюкозимина при единичных начальных активностях реагирующих веществ.
Заключение
N-метил-D-глюкозимин является промежуточным продуктом получения N-метил-D-глюкозамина, широко используемого химического соединения в фармацевтической практике в качестве балластного вещества или противоиона, улучшающего биодоступность основного лекарственного средства. Проведенные термодинамические расчеты реакции синтеза N-метил-D-глюкозимина методом Ван-Кравлена–Черемнова позволили получить значения энергии Гиббса, константы равновесия и конверсии исходных соединений при единичной активности реагирующих веществ. Показано что рост температуры реакционной массы с 20 до 160 °С способствует увеличению конверсии глюкозы с 3% до 32%, в связи с чем можно рекомендовать проведение этой реакции при повышенных температурах.
Исследование выполнено в рамках проекта РФФИ 18-08-00489.
Список литературы Определение термодинамических характеристик реакции получения N-метил-D-глюкозимина
- Gibbs J. W. The collected works of J. Willard Gibbs (№536.7092). Yale Univ. Press, 1948.
- Hillert M. Phase equilibria, phase diagrams and phase transformations: their thermodynamic basis. Cambridge University Press, 2007. DOI: 10.1017/cbo9780511812781
- Prigogine I. Introduction to Thermodynamics of Irreversible Processes. New York, London: Interscience Publ. Inc., 1961.
- De Groot S. R., De Groot S. R. Thermodynamics of irreversible processes. Amsterdam: North-Holland, 1951. V. 336.
- Müller I., Ruggeri T. Rational extended thermodynamics. Springer Science & Business Media, 2013. V. 37.
- Jou D., Casas-Vázquez J., Lebon G. Extended Irreversible Thermodynamics. New York: Springer, 2010.
- Liu Z. K., Wang Y. Computational thermodynamics of materials. Cambridge University Press, 2016.
- Liu Z. K., Li B., Lin H. Multiscale entropy and its implications to critical phenomena, emergent behaviors, and information // Journal of Phase Equilibria and Diffusion. 2019. V. 40. №4. P. 508-521. DOI: 10.1007/s11669-019-00736-w


