Определение устойчивости фасоли к возбудителю антракноза - Colleotrichum lindemuthianum Br. et Cav
Автор: Пашкевич А.М., Чайковский А.И., Медведь Н.В.
Журнал: Овощи России @vegetables
Рубрика: Защита растений
Статья в выпуске: 4 (54), 2020 года.
Бесплатный доступ
Актуальность. В настоящее время в ассортимент овощных культур прочно вошла фасоль овощная, белок которой усваивается человеческим организмом до 87% и выше. Основным фактором, ограничивающим выращивание фасоли в условиях Беларуси, является отсутствие сортов данной культуры, устойчивых к микологическим заболеваниям, в первую очередь, к антракнозу. Материалы и методы. В исследования были включены 34 образца фасоли овощной мутантного и гибридного происхождения, полученные в секторе бобовых овощных культур РУП «Институт овощеводства НАН Беларуси». Для получения мутагенного эффекта использовали индуцированный мутагенез в виде действия радиоактивного изотопа 60Со и неодимового лазера. Гибридные комбинации получали путем внутривидовой гибридизации мутантных образцов. Для молекулярного тестирования генома ДНК выделяли из листьев растений до цветения, ее очистку проводили по методике фирмы Fermentas, набором Genomic DNA Purification Kit. Концентрацию полученного раствора ДНК определяли спектрофотометрическим методом на приборе CARY 50 SCAN. Для проведения ПЦР использовали амплификатор Thermo Hybaid Rx2. Температуру отжига праймеров определяли с помощью программы «олигокалькулятор». В качестве маркера выступил праймер CV2014, устойчивые генотипы к Colletotrichum lindemuthianum Br. et Cav были на уровне бэндов размером около 450 п.н. Фитопатологическая оценка поражаемости растений основывалась на визуальных и инструментальных способах учёта реакции растений, и интенсивности поражения, в условиях естественного инфекционного фона в фазу технической спелости. Результаты. Выделены семь образцов фасоли, имеющие генетическую устойчивость к антракнозу и проявившие ее в условиях естественного инфекционного фона.
Фасоль, антракноз, инфекционный фон, мутант, гибрид, молекулярно-генетическое маркирование, гены устойчивости, восприимчивость, иммунологическая характеристика
Короткий адрес: https://sciup.org/140250315
IDR: 140250315 | УДК: 635.652/.654:632.938.1 | DOI: 10.18619/2072-9146-2020-4-93-97
Текст научной статьи Определение устойчивости фасоли к возбудителю антракноза - Colleotrichum lindemuthianum Br. et Cav
В связи с растущим спросом на продовольственные и кормовые ресурсы, а также с необходимостью диверсификации современного растениеводства в последние годы большое внимание уделяется бобовым культурам [1], в частности, фасоли.
Фасоль – ценная высокобелковая культура, имеющая многостороннее использование в пищевой промышленности. Наиболее важной в пищевом отношении составной частью как лопаток, так и семян фасоли, являются белки, которые участвуют в важнейших функциях организма и не могут быть заменены другими пищевыми веществами. По количеству содержащихся белков фасоль приближается к мясу и превосходит рыбу. Усвояемость белка фасоли в зависимости от кулинарной обработки доходит до 87% и выше. В состав белков фасоли входят аминокислоты, которые могут полностью покрывать потребность в них организма [2]. Также установлено, что 1 га, засеянный фасолью, производит 123 кг белка по сравнению с 3-4 кг белка от мясного скота на одинаковом количестве земли [3].
Основной фактор, препятствующий выращиванию фасоли на зерно в условиях Беларуси – отсутствие сортов, приспособленных для выращивания в наших почвенно-климатических условиях. Антракноз сильно развивается во влажную погоду, поэтому обильные росы и продолжительные дожди особенно благоприятны для развития болезни. Сроки созревания большинства районированных сортов фасоли в нашей стране приходятся на сентябрь, что является ограничивающим фактором выращивания фасоли. Поэтому актуальным направлением исследований является выявление образцов фасоли, имеющих устойчивость к антракнозу на генетиче- ском уровне и проявляющих ее в условиях естественного инфекционного фона – в полевых условиях.
Неблагоприятные биотические факторы, которые выражаются в виде болезней возделываемых зерновых бобовых культур, могут приводить к потерям урожаев от 25 до 75%, и даже до 100% [4]. Антракноз фасоли встречается всюду и может поражать растения в любом возрасте, наиболее опасен в период всходов и в период образования молодых бобов. Семена, зараженные антракнозом, высеянные в холодную дождливую весну, или не всходят (загнивают), или дают ослабленные, пораженные всходы. На семядолях ант- ракноз проявляется в виде коричневато-красных пятен с более светлым центром. В центре пятна вскоре появляются красноватые подушечки, состоящие из конидиеносцев с удлиненными одноклеточными конидиями и одиночных щетинок. С каплями росы или дождя споры с семядолей смываются на подсемядольное колено, прорастают, и в результате заражения на стебле появляются темно-бурые полосы; корень может подгнивать, вследствие чего всходы гибнут. От этих первичных очагов споры гриба распространяются по всему посеву, главным образом с брызгами дождя, с ветром, насекомыми.
У листьев поражаются преимущественно жилки с нижней поверхности, от чего они коричневеют, прилегающая ткань желтеет, затем высыхает, по длине жилок лист становится продырявленным. Черешки листьев и стебли поражаются в виде темных полос; на бобах вначале проявляются мелкие ржаво-красные пятна, постепенно увеличивающиеся в размерах, иногда пятна сливаются по нескольку вместе; пораженная ткань углубляется в створку боба, принимая вид округлых язв, а в центре язвочек вскоре появляются мясокрасные слизистые скопления спор грибка. При сильном поражении грибница паразита проникает в семена, на которых образуются такие же пятна, как и на бобах, но у темно-окрашенных семян признаки поражения малозаметны; сильно пораженные семена имеют низкую всхожесть [5].
Целью наших исследований являлась комплексная оценка растений мутантных и гибридных популяций фасоли и выде- ление ценных источников по устойчивости к основному грибному заболеванию – антракнозу.
Материалы и методы исследований
Объектом исследования являлся мутантный материал фасоли овощной шестого поколения в количестве 17 образцов и гибридный материал четвертого поколения в том же количестве; всего 34 образца. На опытных делянках высевали по 50 семян каждого образца, в трехкратной повторности. Площадь делянки, задействованной для выращивания одного образца, составляла 4,5 м2. Общая площадь опытных делянок, включая защитные посевы, – 160 м2. С учетом всхожести и выживаемости, количество изучаемых растений на момент сбора анализируемого материала составляло от 112 до 150 шт., в зависимости от образца.
Образцы фасоли высевали на опытном поле овощного севооборота в аг. Самохваловичи Минского района в 2018 году. Почва участка овощного севооборота дерново-подзолистая легкосуглинистая с такими агрохимическими показателями пахотного (0-25 см) слоя, как: гумус – 2,2-2,4%, рН KCl – 6,3-6,7, подвижные формы калия и фосфора соответственно 186-252,5 и 217-321 мг/кг воздушно-сухой почвы.
Изначально для получения мутагенного эффекта использовали индуцированный мутагенез: кобальт-60 (мощность 0,36 Гр/сек, доза 194 Гр) и неодимовый лазер (в режиме модулированной дробности в течение часа; параметры выходных оптических импульсов: длительность импульсов – 15 нс, частота следования – 15Гц, пиковая мощность – 3х105 Вт, длина волны – 532 нм). Гибридные комбинации получали путем внутривидовой гибридизации мутантных образцов.
Для молекулярного тестирования генома ДНК выделяли из листьев растений до цветения. Листья высушивали в термостате при температуре 37оС примерно двое суток. Навеску листового материала 0,2 г растирали в ступке с добавлением небольшого количества AI 2 O 3 . Выделение и очистку ДНК исследуемых образцов проводили по методике фирмы Fermentas, набором Genomic DNA Purification Kit, разработанным этой же фирмой. Концентрацию полученного раствора ДНК определяли методом спектрофотометрии на приборе CARY 50 SCAN (Varian, Австралия). Для проведения ПЦР использовали амплификатор Thermo Hybaid Rx2 (Великобритания). Условия амплификации были следующими: 1) 94оС – 5 мин; 94оС – 45 сек, ХоС – 30 сек, 72оС – 1 мин; 2) 94оС – 30 сек, ХоС – 30 сек, 72оС – 1 мин; 3) 72оС – 5 мин.
Температуру отжига праймеров определяли с помощью программы «олигокалькулятор» . проводили согласно методике [6]. Продукты ПЦР разделяли методом электро-
Таблица 1. Шкала оценки образцов фасоли грибными болезнями Table 1. Scale for evaluating bean samples with fungal diseases
|
Поражение |
Оценка по 5-бальной шкале |
Иммунологическая |
|
|
балл |
% |
характеристика |
|
|
Отсутствует |
0 |
0 |
УУ |
|
Очень слабое |
1 |
1-10 |
УУ |
|
Слабое |
2 |
11-25 |
У |
|
Среднее |
3 |
26-50 |
С |
|
Сильное |
4 |
51-75 |
В |
|
Очень сильное |
5 |
75-100 |
ВВ |
УУ – высокоустойчивый, У – устойчивый,
С – средневосприимчивый, В – восприимчивый, ВВ – сильновосприимчивый.
Таблица 2. Результаты оценки образцов фасоли на пораженность антракнозом фасоли (Colletotrichum Lindemuthianum Br. et Cav) Table 2. The results of evaluating beans samples for anthracnose infestation in beans (Colletotrichum Lindemuthianum Br. Et Cav)
|
№ |
Наименование образца |
Степень пораженности, балл |
Иммунологиче ская характеристик а |
№ |
Наименование образца |
Степень пораженности, балл |
Иммунологиче ская характеристик а |
|
Мутантные образцы |
Гибридные образцы |
||||||
|
1 |
Паланочка, контроль |
3 |
С |
18 |
Паланочка (60С О ), контроль |
2 |
У |
|
2 |
М5-31-2-2-1 (60С О ) |
2 |
У |
19 |
h13-13-6-3-10 |
1 |
УУ |
|
3 |
М5-31-3-1-3 (60С О ) |
1 |
УУ |
20 |
Секунда (60С О ), контроль |
2 |
У |
|
4 |
М5-32-7-1-5 (60С О ) |
3 |
С |
21 |
h16-13-14-18-21 |
2 |
У |
|
5 |
М5-32-8-19-7 (60С О ) |
2 |
У |
22 |
h18-13-20-5-25 |
3 |
С |
|
6 |
М5-32-10-5-10 (60С О ) |
3 |
С |
23 |
Секунда (лаз.), контроль |
4 |
В |
|
7 |
М5-32-11-9-11 (60С О ) |
3 |
С |
24 |
h22-13-27-1-30 |
3 |
С |
|
8 |
М5-32-12-5-12 (60СО) |
1 |
УУ |
25 |
h22-13-36-5-38 |
1 |
УУ |
|
9 |
Триумф сахарный, контроль |
4 |
В |
26 |
h22-13-38-3-40 |
2 У |
|
|
10 |
М11-28-17-6-17 (60С О ) |
4 |
В |
27 |
h22-13-38-8-41 |
1 |
УУ |
|
11 |
М11-28-18-7-18 (60С О ) |
2 |
У |
28 |
h22-13-39-3-42 |
3 |
С |
|
12 |
М11-28-19-1-19 (60С О ) |
2 |
У |
29 |
h22-13-40-4-44 |
2 |
У |
|
13 |
М11-28-20-40-20 (60С О ) |
3 |
С |
30 |
h22-13-43-2-48 |
2 |
У |
|
14 |
М11-28-24-1-23 (60С О ) |
2 |
У |
31 |
h22-13-44-5-49 |
1 |
УУ |
|
15 |
М11-28-25-4-25 (60С О ) |
2 |
У |
32 |
h22-13-46-3-50 |
1 У |
|
|
16 |
М11-28-29-6-29 (60С О ) |
3 |
С |
33 |
h15-13-52-9-56 |
3 |
С |
|
17 |
М11-28-29-44-30 (60С О ) |
3 |
С |
34 |
Триумф сахарный (лаз.), контроль |
4 |
В |
фореза в 1,5% агарозном геле с буфером TАE в присутствии бромистого этидия; визуализацию проводили на UV-трансиллюминаторе. На форез наносились одинаковым объемом ПЦР-продукты (10 мкл). В качестве маркера длины фрагментов использовали DNA Ladder, Mix MassRuler TM; в качестве праймера устойчивости к антракнозу – CV542014 [7].
Фитопатологическая оценка поражаемости растений основывалась на визуальных и инструментальных способах учёта реакции растений (качественные шкалы) и интенсивности поражения (количественные шкалы). Оценку на пораженность антракнозом фасоли ( Colletotrichum lindemuthianum Br. et Cav) мутантных и гибридных образцов в условиях естественного инфекционного фона проводили в фазу технической спелости.
Изучение большого числа растений коллекционных образцов фасоли разного происхождения ранее, показало, что степень поражения в комфортных условиях и развитие болезни среди образцов наблюдается с нормальным распределением, т.е. большинство растений поражается в средней степени. Согласно методическим указаниям по изучению коллекции зерновых бобовых культур, шкала оценки поражения фасоли грибными болезнями определяется по таблице 1.
Результаты и их обсуждение
С учетом того, что благоприятным фактором для развития данного заболевания на посевах фасоли является повышенная влажность (за счет дождей и обильных рос), а также значительное количество осадков, выпавших в летние месяцы активной вегетации растений (в июле выпало 150 мл осадков при норме 89 мл (отклонение 169%), в августе – 83 мл при норме 68 мл (отклонение 122%)), развитие антракноза происходило активными темпами, что позволило выделить высокоустойчивые образцы (с баллом поражения 1) – М5-31-3-1-3 (60С О ), М5-32-12-5-12 (60С О ), h13-13-6-3-10, h22-13-36-5-38, h22-13-38-8-41, h22-13-44-5-49, h22-13-46-3-50.
Антракнозом в слабой степени (2 балла) были поражены мутантные образцы фасоли М5-31-2-2-1 (60С О ), М5-32-8-197 (60С О ), М5-32-12-5-12 (60С О ), которые составили 23,5% от общего количества исследуемых образцов. Среди гибридных образцов фасоли очень слабо и слабо данным микологическим заболеванием были поражены 11 образцов (32,3%), средняя степень поражения (3 балла) была зафиксирована у 11 образцов фасоли, сильная (4 балла) – у 4 образцов (11,2%). Также была обнаружена тенденция более сильного
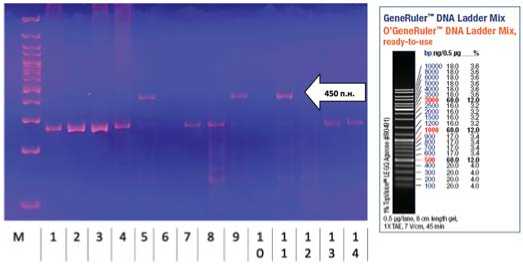
Рис.1. Результаты амплификации фрагментов ДНК образцов мутантного и гибридного происхождения фасоли овощной с праймером CV2014, где: М – маркер молекулярного веса, 1 – М5-32-12-5-12 (60СО), 2 – Триумф сахарный (контроль), 3 – М11-28-17-6-17 (60С О ), 4 – М11-28-7-18 (60С О ), 5 – h13-13-6-3-10, 6 – h15-13-52-9-56, 7 – Секунда (лаз., контроль), 8 – h22-13-46-3-50, 9 – h22-13-44-5-49, 10 – h22-13-43-2-48, 11 – h22-13-40-4-44, 12 – h22-13-39-3-42, 13 – h22-13-38-3-40, 14 – h22-13-36-5-38
Fig. 1. Results of amplification of DNA fragments from samples of mutant and hybrid origin of vegetable beans with primer CV2014.
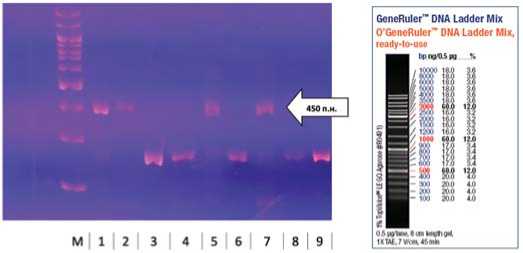
Рис. 2. Результаты типирования мутантных образцов фасоли овощной с праймером CV2014, где: М – маркер молекулярного веса, 1 – М5-31-2-2-2 (60СО), 2 – М5-31-3-1-3 (60СО), 3 – М5-32-7-1-5 (60СО), 4 – М5-32-8-19-7 (60СО), 5 – М5-32-10-5-10 (60СО), 6 – М5-32-11-9-11 (60СО), 7 – М11-2819-1-19 (60СО), 8 – М11-28-20-40-20 (60СО), 9 – Паланочка (контроль)
Fig. 2. Results of typing of mutant samples of vegetable beans with primer CV2014
поражения антракнозом исходных родительских форм, которые выступали в роли контроля (табл.2).
В качестве маркера выступил праймер CV2014, устойчивые генотипы были на уровне бэндов размером около 450 п.н. В результате лабораторного анализа аллели устойчивости к антракнозу обнаружены у мутантных форм М5-31-2-2-1
(60С О ), М5-31-3-1-3 (60С О ), М5-32-10-5-10 (60С О ), М11-28-1-119 (60С О ). Среди гибридных форм устойчивые генотипы обнаружены у h13-13-6-3-10, h18-13-20-5-25, h22-13-40-4-44, h22-13-44-5-49 (рис. 1 и 2).
Следует отметить, что среди четырех мутантных образцов фасоли овощной, имеющих ген устойчивости к антракнозу, исходной формой трех образцов является Паланочка, одного – Триумф сахарный. Что же касается образцов гибридного происхождения, то исходная комбинация скрещивания Триумф сахарный (лаз.) x Секунда (лаз.) показала наибольшую генетическую невосприимчивость к антракнозу фасоли – 2 образца с генами устойчивости (в четвертом поколении); также наличие генов устойчивости были отмечены у двух образцов, родительскими формами которых выступила мутантная Паланочка (60С О ), как по материнской, так и по отцовской линиям (Паланочка (60С О ) x Секунда (60С О ) и Секунда (лаз.) x Паланочка (60С О )). Не было выявлено бэндов, соответствующих устойчивым генотипам, у мутантных образцов М11-28-29-6-29 (60С О ) и М11-28-29-44-30 (60С О ).
Заключение
По результатам оценки мутантных и гибридных образцов фасоли овощной, были выделены образцы, имеющие генетическую устойчивость к антракнозу фасоли и проявившие ее в полевых условиях: мутантный образец М11-28-19-1-19 (60С О ) и гибридные образцы h13-13-6-3-10, h22-13-40-4-44 и h22-13-44-5-49. Также выделены образцы с геном устойчивости к антракнозу фасоли – М5-32-10-5-10 (60С О ), М11-2819-1-19 (60С О ) и h22-13-40-4-44. Все 7 указанных образцов фасоли представляют интерес и включены в последующие исследования.
Об авторах:
Anna M. Pashkevich – postgraduate student, head. the leguminous vegetable sector
Andrey I. Tchaikovsky – Cand. Sci. (Agriculture), Director
Natalya V. Medved – Agronomist
-
• Литература
-
1. Темиров, К.С. и др. Урожайность и биохимические показатели селекционных линий гороха посевного различного морфотипа. Растениеводство и селекция. 2016;(5):21-27.
-
2. Пашкевич, А.М. и др. Оценка коллекционных сортообразцов фасоли овощной по хозяйственным и биолого-морфологическим признакам. Овощеводство: сборник научных статей. Самохваловичи 2015;(23):139-143.
-
3. Jones, A.L. Phaseolus bean: Post-harvest operations. Organisation: Centro Internacional de Agricultura Tropical (CIAT). Edited by AGSI/FAO. [Электронный ресурс]. – Режим доступа: http: // www.fao.org/3/a-av015e.pdf . – Дата доступа: 02.02.2016.
-
4. Djeugap, F.J. et al. Effet variétal et du traitement fongicide sur la sévérité de la maladie des taches angulaires et le rendement du haricot commun ( Phaseolus vulgaris L.) à l'Oue st-Came roun. International Journal of Biological and Chemical Sciences. 2014;8(3):1221-1233.
-
5. Dutartre, M. Santé et adaptation du haricot commun Phaseolus vulgari s L. Mémoire de fin d’études pour l’obtention du diplôm d’Ingénieur Aronome. Paris, 2015. 70 p.
-
6. Yu, K. et al. Integration of Simple Sequense Repeat (SSR) Markers into a Molecular Linkage Map of Common Bean ( Phaseolus vulgaris L.). The Journal of Heredity. 2000;(91):429-434.
-
7. Goncalves-Vidigal, M.C. et al. Linkage mapping of the Phg-1 and Co-14 genes for resistance to angular leaf spot and anthracnose in the common bean cultivar AND277. Theor. Appl. Genet. 2011;(122):893-903.
-
-
• References
-
1. Temirov, K.S. [et al.]. Productivity and biochemical indicators of breeding lines of seeded peas of various morphotypes. Crop Production and selection. Moscow, 2016;(5):21-27. (in Russ.)
-
2. Pashkevich, A.M. et al. Evaluation of collectible varieties of vegetable beans by economic and biological-morphological characte ristics. Vegetable Growing: collection of scientific articles – Samokhvalovichi. 2015;(23):139-143. (In Russ.)
-
3. Jones, A.L. Phaseolus bean: Post-harvest operations. Organisation: C entro Inte rnacional de A gricultura Tropical (C IA T). Edited by A GSI/FAO. [Ele ctronic re source ]. - A cce ss mode: http: // www.fao.org/3/a-av015e.pdf . - Date of access: 02.02.2016.
-
4. Djeugap, F.J. et al. Effet variétal et du traitement fongicide sur la sévérité de la maladie des taches angulaires et le rendement du haricot commun ( Phaseolus vulgaris L.) à l'Ouest-C ameroun. International Journal of Biological and Chemical Sciences. 2014;8(3):1221-1233.
-
5. Dutartre, M. Santé et adaptation du haricot commun Phaseolus vulgari s L. Mémoire de fin d’études pour l’obtention du diplôm d’Ingénieur Aronome. Paris, 2015. 70 p.
-
6. Yu, K. et al. Integration of Simple Sequense Repeat (SSR) Markers into a Molecular Linkage Map of Common Bean ( Phaseolus vulgaris L.). The Journal of Heredity. 2000;(91):429-434.
-
7. Goncalves-Vidigal, M.C. et al. Linkage mapping of the Phg-1 and Co-14 genes for resistance to angular leaf spot and anthracnose in the common bean cultivar AND277. Theor. Appl. Genet. 2011;(122):893-903.
-
Список литературы Определение устойчивости фасоли к возбудителю антракноза - Colleotrichum lindemuthianum Br. et Cav
- Темиров, К.С. и др. Урожайность и биохимические показатели селекционных линий гороха посевного различного морфотипа. Растениеводство и селекция. 2016;(5):21-27.
- Пашкевич, А.М. и др. Оценка коллекционных сортообразцов фасоли овощной по хозяйственным и биолого-морфологическим признакам. Овощеводство: сборник научных статей. Самохваловичи, 2015;(23):139-143.
- Jones, A.L. Phaseolus bean: Post-harvest operations. Organisation: Centro Internacional de Agricultura Tropical (CIAT). Edited by AGSI/FAO. [Электронный ресурс]. - Режим доступа: http: // www.fao.org/3/a-av015e.pdf. - Дата доступа: 02.02.2016.
- Djeugap, F.J. et al. Effet varietal et du traitement fongicide sur la severite de la maladie des taches angulaires et le rendement du haricot commun (Phaseolus vulgaris L.) a l'Ouest-Cameroun. International Journal of Biological and Chemical Sciences. 2014;8(3):1221-1233.
- Dutartre, M. Sante et adaptation du haricot commun Phaseolus vulgaris L. Memoire de fin d'etudes pour l'obtention du diplom d'Ingenieur Aronome. Paris, 2015. 70 p.
- Yu, K. et al. Integration of Simple Sequense Repeat (SSR) Markers into a Molecular Linkage Map of Common Bean (Phaseolus vulgaris L.). The Journal of Heredity. 2000;(91):429-434.
- Goncalves-Vidigal, M.C. et al. Linkage mapping of the Phg-1 and Co-14 genes for resistance to angular leaf spot and anthracnose in the common bean cultivar AND277. Theor. Appl. Genet. 2011;(122):893-903.


