Оптическая активность и спектрофотометрические характеристики растворов хитозана, полученного из камчатского краба и арктической креветки
Автор: Реут Кира Васильевна, Долгопятова Наталия Владимировна, Новиков Виталий Юрьевич, Путинцев Николай Михайлович, Коновалова Ирина Никандровна, Кучина Юлия Анатольевна
Журнал: Вестник Мурманского государственного технического университета @vestnik-mstu
Статья в выпуске: 3 т.16, 2013 года.
Бесплатный доступ
Показано, что величина удельного оптического вращения растворов хитозана зависит от нуклеофильности гидролизующего агента, растет по абсолютной величине с увеличением в растворе хитозана количества концевых гликозидных центров; степень деацетилирования хитозана практически не влияет на величину удельного оптического вращения. Для хитозана из хитина камчатского краба и арктической креветки получены одинаковые закономерности по влиянию молекулярной массы и степени деацетилирования на величину удельного оптического вращения. Установлено влияние фосфорной кислоты на конформационные превращения концевых гликозидных центров молекул хитозана.
Хитин, хитозан, кислотный гидролиз, оптическая активность, молекулярная масса, степень деацетилирования, ультрафиолетовый спектр, конформационные превращения
Короткий адрес: https://sciup.org/14294617
IDR: 14294617
Текст научной статьи Оптическая активность и спектрофотометрические характеристики растворов хитозана, полученного из камчатского краба и арктической креветки
Вестник МГТУ, том 16, №3, 2013 г. стр.580-585
-
2 . Материалы и методы
В качестве объектов исследования использовали хитозан, полученный из хитина панциря камчатского краба, акклиматизированного в Баренцевом море, и арктической креветки. Хитин и хитозан получали в лабораторных условиях по известным методикам ( Новиков , 2003; Новиков и др. , 1990). Гидролиз хитина проводили в хлороводородной кислоте с молярной концентрацией эквивалента С н = 1÷ 5 моль/дм3 и фосфорной кислоте с С н = 1 моль/дм3 в течение 5-60 мин при температуре 50 °С. Хитозан получали из хитина стандартным деацетилированием ( Новиков и др ., 2012).
Средневязкостную молекулярную массу хитозана (ММ) определяли по методике ( Новиков и др. , 2012). Молекулярную массу в Дальтонах (Да) рассчитывали по формуле Марка-Хаувинка-Куна:
MM = 2,4 x104 X [7]0’98, где [η] – характеристическая вязкость, дл/г; 2,4 и 0,98 – пересчетные коэффициенты.
Значения пересчетных коэффициентов в уравнении Марка-Хаувинка-Куна опубликованы в работе ( Павлов, Селюнин , 1986).
Определение степени деацетилирования хитозана проводили обратным потенциометрическим титрованием хлороводорода, связанного с аминогруппами молекул хитозана. Титрование выполняли с использованием рН-метра "Иономер – Эксперт-001".
Угол вращения плоскости поляризации поляризованного света растворов хитозана измеряли на круговом поляриметре СМ-3, построенном по принципу полутеневых приборов. Угол вращения измеряли при длине волны λ = 589 нм и длине кюветы 1 дм.
Растворы хитозана готовили в ацетатном буфере с pH 4,86. Концентрация растворов составляла 0,005 г/см3.
Удельное вращение плоскости поляризации [α]tλ вычисляли по формуле (Государственная…, 1987): [α]tλ = ϕ / l⋅c, где ϕ – угол вращения плоскости поляризации, град.; l – толщина слоя раствора оптически активного вещества, l = 1 дм; с – концентрация раствора, г/см3.
Спектрофотометрический анализ проводили на спектрофотометре Т70 UV/VIS Spectrometer в диапазоне длин волн 190-1100 нм с рабочей длиной кюветы 10 мм. Готовили растворы хитозана с концентрацией 1 %, в качестве растворителя использовали раствор хлороводородной кислоты с концентрацией 0,1 моль/дм3.
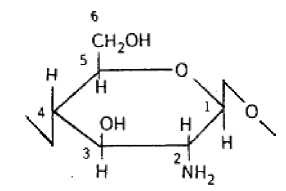
Рис. 1. Структурная формула мономерного звена хитозана
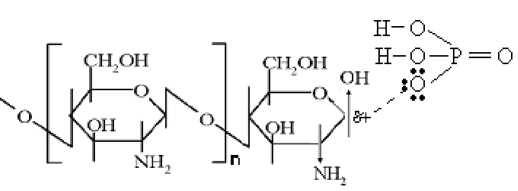
Рис. 2. Образование комплекса хитозана с фосфорной кислотой
Величину удельного вращения [ α ]t λ измеряли через сутки после приготовления растворов хитозана. В течение этого времени в растворе устанавливается таутомерное равновесие между различным формами концевых гликозидных центров – полуацетальных ( α и β) и оксикарбонильных. Каждой форме присущ свой угол вращения плоскости поляризации. В состоянии равновесия раствора он равен алгебраической сумме углов вращения всех таутомерных форм ( Петров и др. , 2002). По всей видимости, при уменьшении молекулярной массы хитозана в растворе накапливаются конформации, для которых величина удельного оптического вращения увеличивается по абсолютной величине.
При гидролизе полисахарида в фосфорной кислоте в условиях эксперимента ММ изменяется незначительно (58,3 ÷ 48,3 кДа), однако величина [ α ]t λ в большей степени, по сравнению с гидролизом в хлороводородной кислоте, сдвигается в сторону положительных значений (до –4). В работе ( Долгопятова и др. , 2011) было показано, что кислотный гидролиз гликозидных связей в хитине является реакцией нуклеофильного замещения второго порядка (S N2 ), скорость которой зависит от нуклеофильности кислоты. В изучаемых кислотах хлорид-ион является слабым нуклеофилом, анион фосфорной кислоты – сильным. По всей видимости, фосфорная кислота, как сильный нуклеофил, может оказывать влияние на положение ОН-групп, связанных с концевым гликозидным центром молекулы хитозана. Вероятно, анион фосфорной кислоты может образовывать с концевым гликозидным центром хитозана устойчивый комплекс. В этом комплексе положение ОН-группы фиксируется в конфигурации, которая вносит наибольший вклад в величину удельного вращения. На рис. 2 показан комплекс аниона Н2РО4¯ с гликозидным центром хитозана. В этом комплексе ОН-группа находится в β -конфигурации.
Таблица 1. Влияние природы кислоты и молекулярной массы хитозана (ММ) на величину удельного оптического вращения раствора хитозана [ α ]t λ
|
Условия гидролиза (концентрация кислоты, С н моль/дм3, время гидролиза, мин) |
ММ, Да |
[ α ]t λ |
|
Хитозан из камчатского краба |
||
|
1н HCl, 5 мин |
53300 |
–22 |
|
1н HCl, 20 мин |
46700 |
–22 |
|
1н HCl, 30 мин |
45100 |
–20 |
|
1н HCl, 40 мин |
45000 |
–20 |
|
1н HCl, 60 мин |
40000 |
–18 |
|
1н H 3 PO 4 , 5 мин |
56000 |
–12 |
|
1н H 3 PO 4 , 10 мин |
55800 |
–10 |
|
1н H 3 PO 4 , 20 мин |
54320 |
–10 |
|
1н H 3 PO 4 , 30 мин |
52081 |
–9 |
|
1н H 3 PO 4 , 40 мин |
50034 |
–6 |
|
1н H 3 PO 4 , 60 мин |
48382 |
–4 |
|
Хитозан из арктической креветки |
||
|
1н HCl, 60 мин |
28130 |
–26 |
|
3н HCl, 60 мин |
15830 |
–24 |
|
5н HCl, 30 мин |
12000 |
–22 |
|
5н HCl, 60 мин |
11600 |
–18 |
Концентрации растворов хитозана – 0,005 г/см3, степень деацетилирования хитозана из камчатского краба – 79-80 %, степень деацетилирования хитозана из арктической креветки – 69-70 %.
Вестник МГТУ, том 16, №3, 2013 г. стр.580-585
Таблица 2. Влияние степени деацетилирования (DD, %) на величину удельного оптического вращения растворов хитозана [ α ]t λ
|
Хитозан из камчатского краба |
Хитозан из арктической креветки |
||||
|
ММ, Да |
DD, % |
[ α ]t λ |
ММ, Да |
DD, % |
[ α ]t λ |
|
58320 |
83,8 |
–28 |
56380 |
84,0 |
–30 |
|
58320 |
70,7 |
–28 |
56380 |
70,5 |
–28 |
В табл. 2 приведены результаты по изучению влияния степени деацетилирования на величину [ α ]t λ растворов хитозана из камчатского краба и арктической креветки. Из данных таблицы следует, что величина удельного оптического вращения [ α ]t λ практически не зависит от степени деацетилирования хитозана. Для хитозана из краба и креветки со степенью деацетилирования 70,7 и 83,8 величина [ α ]t λ соответственно составляет –28 ÷ –30. По всей видимости, это можно объяснить тем, что в условиях стандартного щелочного деацетилирования хитина его макромолекула практически не подвергается деструкции, при этом не изменяется молекулярная масса полисахарида и, следовательно, количество концевых гликозидных центров ( Чеботок и др ., 2006).
Результаты спектрофотометрического анализа растворов хитозана в УФ-области спектра приведены на рис. 3, 4, 6.
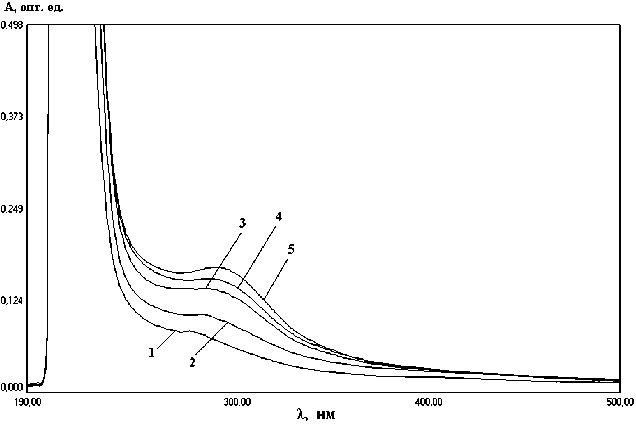
Рис. 3. Спектры поглощения растворов хитозана с различной молекулярной массой:
1 – ММ = 55000 Да; 2 – ММ = 28130 Да; 3 – ММ = 15830 Да; 4 – ММ = 12000 Да; 5 – ММ = 11600 Да
А, опт. ед .
0,2
0,15
0,1
0,05
0 10000 20000 30000 40000 50000
ММ, Да
Рис. 4. Зависимость оптической плотности растворов от молекулярной массы хитозана
На рис. 3 приведена оптическая плотность растворов хитозана с различной молекулярной массой. Хитозан был получен гидролизом крабового хитина в хлороводородной кислоте. После стандартного деацетилирования DD хитозана составляла 79-82 %. В полученных спектрах максимумы светопоглощения наблюдаются в интервале длин волн 250-300 нм.
С уменьшением молекулярной массы хитозана (от 55 кДа до 11,6 кДа) оптическая плотность растворов увеличивается (рис. 4).
Известно, что в интервале длин волн 250-300 нм максимумы поглощения характерны для органических молекул, в которых присутствует хромофорная карбонильная группа С = О ( Карнаухова, Тупицин , 2002).
Присутствие карбонильных групп в спектрах растворов хитозана можно объяснить таутомерными превращениями концевых гликозидных центров молекул хитозана из полуацетальных в окси-карбонильную форму (рис. 5) ( Петров и др. , 2002). С уменьшением молекулярной массы хитозана при одинаковой концентрации полисахарида в растворе общее количество концевых гликозидных центров возрастает, что приводит к увеличению оптической плотности.
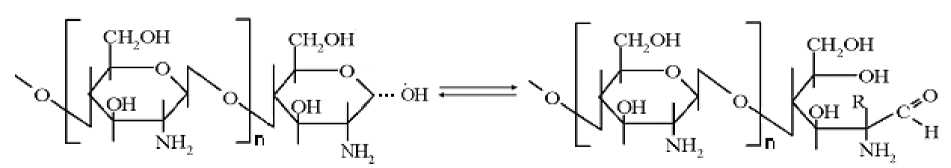
Рис. 5. Таутомерные превращения концевых гликозидных центров макромолекулы хитозана
На рис. 6 приведены спектры поглощения растворов хитозана, полученного из крабового хитина, гидролизованного в хлороводородной и фосфорной кислотах. В спектрах наблюдаются максимумы оптической плотности в интервале длин волн 250-300 нм, причем в случае H 3 РO 4 более интесивные.
По всей видимости, образование устойчивых комплексов хитозана с фосфорной кислотой влияет не только на величину удельного оптического вращения растворов хитозана, но и на их спектральные характеристики.
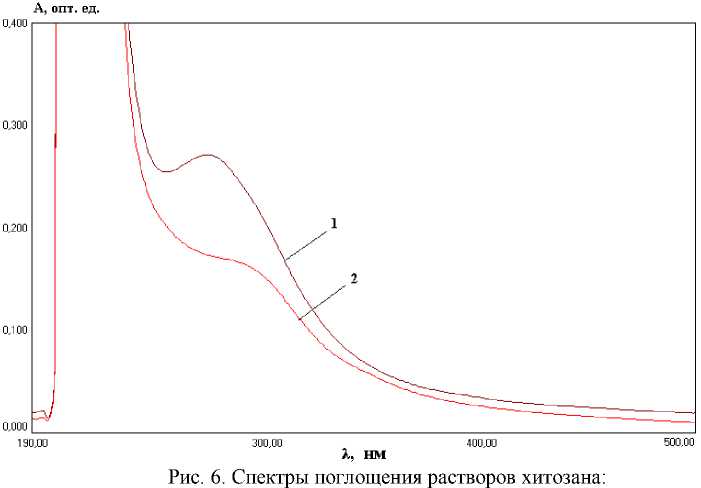
1 – хитозан гидролизован в H 3 РO 4 (С кислоты = 1 моль/дм3, время гидролиза – 60 мин), ММ = 48 кДа; 2 – хитозан гидролизован в HCl (С кислоты = 1 моль/дм3, время гидролиза – 60 мин), ММ = 40 кДа
4. Заключение
Показано, что величина удельного оптического вращения растворов хитозана зависит от нуклеофильности гидролизующего агента, растет с увеличением в растворе хитозана количества концевых гликозидных центров; степень деацетилирования хитозана практически не влияет на величину удельного оптического вращения. Для хитозана из хитина камчатского краба и арктической креветки получены одинаковые закономерности по влиянию молекулярной массы и степени деацетилирования на величину удельного оптического вращения. Установлено влияние фосфорной кислоты на конформационные превращения концевых гликозидных центров молекул хитозана.
Вестник МГТУ, том 16, №3, 2013 г. стр.580-585


