Оптимизация аутологичных дендритно-клеточных вакцин для лечения больных злокачественными новообразованиями
Автор: Нехаева Т.Л.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 3 (57), 2013 года.
Бесплатный доступ
Исследованы иммунобиологические характеристики дендритных клеток (ДК) для оптимизации технологии получения дендритно-клеточных вакцин (ДК-вакцин). Проведен сравнительный анализ иммунологического фенотипа незрелых и зрелых ДК, дифференцированных in vitro в присутствии ростового фактора GM-CSF (CellGenix, Германия) и ГМ-КСФ (Фармсинтез, Россия) в ранее изученной концентрации 72 нг/мл, и IL-4 (CellGenix, Германия) в интервале концентраций от 0 до 45 нг/мл. Для стандартизации технологического процесса получения вакцинных ДК рекомендуется использовать оптимальную панель моноклональных антител: CD14, CD1а, CD83, CD86, CD80, CCR7, HLA DR. Результаты проточной цитометрии и иммуноцитохимического анализа показали отсутствие достоверных различий в экспрессии маркеров зрелых ДК (p>0,05), что свидетельствует о целесообразности использования ростового фактора ГМ-КСФ (Фармсинтез, Россия) для приготовления противоопухолевых вакцин на основе ДК. С помощью однофакторных полиномиальных моделей второго порядка установлен оптимальный интервал концентрации IL-4 для дифференцировки ДК от 5 до 15 нг/мл.
Иммунотерапия, дендритные клетки, вакцина, оптимизация
Короткий адрес: https://sciup.org/14056334
IDR: 14056334 | УДК: 616-006.04-097
Текст научной статьи Оптимизация аутологичных дендритно-клеточных вакцин для лечения больных злокачественными новообразованиями
Создание терапевтических вакцин на основе дендритных клеток (ДК) рассматривается как один из перспективных подходов в комплексной терапии злокачественных новообразований, результаты международных и отечественных клинических исследований свидетельствуют о клинической эффективности данного метода лечения у некоторых категорий больных [1, 2, 5]. Вместе с тем использование ДК-вакцин, обладающих эффективностью, безопасностью и надлежащим уровнем качества в рутинной клинической практике, предполагает оптимизацию и стандартизацию рекомендованных методик [3, 8, 9].
Дифференцировка вакцинных ДК из моноцитов периферической крови in vitro с использованием различных питательных сред, ростовых факторов и факторов дифференцировки различной активности в ряде случаев препятствует получению стандартного клеточного продукта охарактеризованного качества. В частности, появление на фармацевти- ческом рынке гранулоцитарно-макрофагеального колониестимулирующего фактора (ГМ-КСФ) Неостим отечественного производства (Фарм-синтез, Россия) для клинического использования позволяет заменить дорогостоящий импортный аналог GM-CSF (СellGenix, Германия) и значительно удешевить стоимость изготовления ДК-вакцин. Вместе с тем предполагаемый технологический переход не изучен. Более того, не определена оптимальная концентрация интерлейкина-4 (IL-4), в присутствии которого осуществляется дифференцировка ДК из моноцитов периферической крови. Более чем в 200 клинических исследованиях были использованы различные концентрации IL-4 без достаточно аргументированного обоснования, чаще в диапазоне от 6,75 нг/мл до 180 нг/мл [7, 11]. Несомненно, это затрудняет стандартизацию ДК-вакцин, что определило проблему научного поиска и цель настоящего исследования.
Целью исследования является изучение иммунологического фенотипа незрелых и зрелых ДК, дифференцированных из моноцитов периферической крови больных злокачественными новообразованиями в присутствии фиксированной концентрации GM-CSF (CellGenix, Германия) или ГМ-КСФ (Фармсинтез, Россия), и различных концентраций IL-4 (СellGenix, Германия).
Материал и методы
Дифференцировку ДК из адгезионной моноцитарной фракции мононуклеаров периферической крови больных меланомой кожи проводили в сбалансированной бессывороточной среде «Cell-Gro DC», приготовленной в условиях надлежащей производственной практики GMP (Cell Genix, Германия), адгезионных культуральных флаконах с вентилируемыми крышками (Sarstedt, Германия) в условиях СО2 инкубатора «Heracel» (Termo Electron LTD GmbH, Германия) при 37°С, 5 % CO2 и 98 % влажности. В исследовании использовали ростовой фактор GM-CSF (CellGenix, Германия) и ГМ-КСФ (Фармсинтез, Россия) в ранее изученной концентрации 72 нг/мл и IL-4 (CellGenix, Германия) в интервале концентраций от 0 до 45 нг/мл. Ростовые факторы и фактор дифференцировки вносили на 1, 3 и 5-й день культивирования (незрелые ДК). На 7-й день вносили коктейль лизированных охарактеризованных аутологичных и/или аллогенных опухолевых клеток (клеточные линии Mel 226, Mel 515, Mel 519, Mel 520), экспрессирующих иммуногенные раково-тестикулярные антигены (NY-ESO-1+, MAGE+, HAGE+, GAGE+) и фактор некроза опухоли (TNFα) 20 нг/мл (BD, США). Инкубацию с опухолевым лизатом проводили в течение 48 ч.
Таблица 1
Иммунофенотип зрелых ДК, выращенных в присутствии ростового фактора GM-CSFразличных производителей и -4, M±m, δ
|
Дифференцировочные/ линейноспецифические антигены |
GM-CSF Фармсинтез, Россия |
GM-CSF CellGenix, Германия |
Критерий Фишера (F), уровень значимости (p) |
|
CD14+ |
2,02 ± 0,91 %; 3,18 |
6,12 ± 2,34 %; 5,17 |
F=3,91; p=0,07 (>0,05) |
|
CD1a+ |
24,03 ± 9,11 %; 26,22 |
20,08 ± 9,13 %; 23,01 |
F=0,07; p=0,79 (>0,05) |
|
CD83+ |
82,15 ± 6,07 %; 18,34 |
66,14 ± 4,21 %; 10,12 |
F=3,85; p=0,07 (>0,05) |
|
CD1a+ CD83- |
13,11 ± 5,01 %; 15,12 |
13,23 ± 6,16 %; 15,32 |
F=0,001; p=0,97 (>0,05) |
|
CD1a+CD83+ |
10,12 ± 4,06 %; 13,10 |
8,12 ± 4,21 %; 11,15 |
F=0,08; p=0,78 (>0,05) |
|
CD1a-CD83+ |
72,22 ± 9,12 %; 27,15 |
59,41 ± 7,26 %; 17,16 |
F=1,10; p=0,31 (>0,05) |
|
CD83+ CD86+ |
47,05 ± 7,11 %; 21,14 |
51,24 ± 6,12 %; 15,16 |
F=0,11; p=0,74 (>0,05) |
|
CD83+ CD80+ |
78,23 ± 5,07 %; 15,10 |
65,25 ± 4,12 %; 9,06 |
F=3,63; p=0,08 (>0,05) |
|
CCR7+ |
83,23 ± 8,02 %; 24,14 |
82,56 ± 11,31 %; 28,31 |
F=0,01; p=0,94 (>0,05) |
|
CCR7+CD83+ |
76,16 ± 9,13 %; 23,43 |
64,14 ± 7,16 %; 13,05 |
F=0,74; p=0,41 (>0,05) |
|
HLA DR+ |
93,03 ± 2,11 %; 6,23 |
91,31 ± 5,33 %; 12,14 |
F=0,17; p=0,68 (>0,05) |
Примечание: M – среднее значение экспрессии иммунофенотипического маркера, m – ошибка среднего значения, δ – стандартное отклонение, концентрация GM-CSF – 72 нг/мл, IL-4 – 45 нг/мл.
Подсчет количества и оценку жизнеспособности ДК осуществляли с помощью автоматического счетчика клеток «Countess ™ » («Invitrogen», США) и 0,4 % трипанового синего (Sigma, США). Экспрессию линейноспецифических и дифферен-цировочных антигенов на моноцитах, незрелых и зрелых ДК изучали с помощью моноклональных антител (DAKO, Дания) и системы визуализации «In vision» (DAKO, Дания) для иммуноцитохимического метода; напрямую меченных флуорохро-мами моноклональных антител (anti-CD83-PE-Cy5, anti-CD1а-PE, anti-CD80-FITC, anti-CD86-FITC, anti-CD14-FITC, anti-CCR7-FITC, anti-HLA-DR-Per CP-Cy5.5), для метода лазерной проточной цитофлуориметрии («BD Biosciences», США). В последнем случае использовали программное обеспечение CellQuest Pro (tm).
Оценку результатов исследования проводили с помощью описательной статистики, однофакторного дисперсионного и регрессионного анализа [4].
Результаты и обсуждение
Сравнительный анализ экспрессии иммуно-фенотипических маркеров зрелых ДК, дифференцированных в присутствии фиксированной концентрации ростового фактора GM-CSF (CellGenix, Германия) или ГМ-КСФ (Фармсинтез, Россия) 72 нг/мл в сочетании с IL-4 (CellGenix, Германия) 45 нг/мл (табл. 1), не выявил статистически значимых различий (р>0,05), что свидетельствует о сопоставимой активности ростовых факторов импортного и отечественного производства. Вместе с тем интересным является изучение особенностей дифференцировки ДК на разных стадиях созревания в присутствии ГМ-КСФ отечественного производства.
Результаты исследования (табл. 2) демонстрируют дифференцировку моноцитов в незрелые ДК: появление на клеточной мембране молекулы CD1a (71 ± 4,01 %) и утрату CD14 (3,02 ± 1,01 %). Зрелые ДК характеризуются высокой экспрессией маркера дифференцировки CD83 (76,1 ± 4,01 %) и утратой CD1a антигена (22,03 ± 6,02 %), а также статистически достоверным усилением экспрессии костимулирующих молекул CD80 с 31,01 ± 12,02 % до 73,03 ± 4,02 % (р=0,0003) и CD86 с 8,01 ± 2,02 % до 49,11 ± 5,03 % (р=0,00001). Высокий уровень экспрессии молекул хемокинового рецептора (CCR7), обеспечивающего миграцию зрелых ДК в лимфатические узлы, и белков, участвующих в презентации антигена (HLA DR) на 7-й и 9-й день культивирования, свидетельствует о созревании ДК.
Уровень зрелости ДК определяли по коэкспрес-сии антигенов CD1а и CD83. Анализ результатов свидетельствует о снижении содержания незрелых ДК (CD1a+CD83-) с 52,01 ± 11,02 % до 13,01 ± 4,02 % (р=0,0003) и увеличении зрелых ДК (CD1a-CD83+) с 11,01 ± 4,04 % до 67,05 ± 6,02 % (р=0,00001) ДК к 9-му дню культивирования. Низкое содержание ДК промежуточной степени зрелости (CD1a+CD83+) в
Таблица 2
Сравнительный анализ иммунофенотипа ДК на разных стадиях созревания, M±m, δ
|
Дифференцировочные/ линейноспецифические антигены |
ДК незрелые (7-й день) |
ДК зрелые (9-й день) |
Критерий Фишера (F), уровень значимости (p) |
|
CD1a+ |
71,12 ± 4,01 %; 11,21 |
22,03 ± 6,02 %; 24,36 |
F=25,73; p=0,00001 (<0,05) |
|
CD14+ |
3,02 ± 1,01 %; 3,18 |
4,04 ± 1,02 %; 4,13 |
F=0,25; p=0,62 (<0,05) |
|
CD83+ |
32,02 ± 12,1 %; 33,26 |
76,1 ± 4,01 %; 17,41 |
F=17,18; p=0,0005 (<0,05) |
|
CD1a+ CD83- |
52,01 ± 11,02 %; 29,42 |
13,01 ± 4,02 %; 14,21 |
F=18,59; p=0,0003 (<0,05) |
|
CD1a+CD83+ |
21,03 ± 9,04 %; 23,17 |
9,02 ± 3,03 %; 12,25 |
F=2,79; p=0,11 (>0,05) |
|
CD1a-CD83+ |
11,01 ± 4,04 %; 11,31 |
67,05 ± 6,02 %; 24,43 |
F=34,07; p=0,00001 (<0,05) |
|
CD83+ CD86+ |
8,01 ± 2,02 %; 6,24 |
49,11 ± 5,03 %; 19,32 |
F=31,56; p=0,00001 (<0,05) |
|
CD83+ CD80+ |
31,01 ± 12,02 %; 31,11 |
73,03 ± 4,02 %; 14,34 |
F=19,574 p=0,0003 (<0,05) |
|
CCR7+ |
63,03 ± 14,1 %; 38,32 |
82,02 ± 6,01 %; 25,18 |
F=2,044 p=0,17 (>0,05) |
|
HLA-DR+ |
91,01 ± 3,13 %; 8,26 |
92,02 ± 2,02 %; 9,02 |
F=0,16; p=0,68 (>0,05) |
Примечание: M – среднее значение экспрессии иммунофенотипического маркера, m – ошибка среднего значения, δ – стандартное отклонение.
СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2013. № 3 (57)
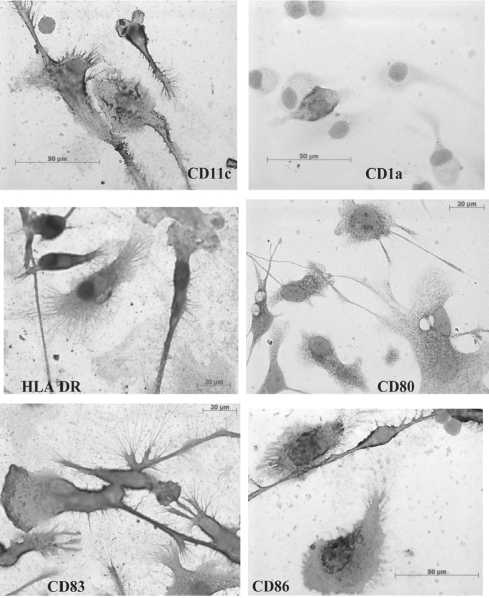
Рис. 1. Микрофото. Иммунофенотип зрелых вакцинных ДК (CD1a-, CD83+, CD11c+, HLA DR+, CD86+), выращенных in vitro в присутствии ростового фактора GM-CSF (72 нг/мл), Фармсинтез (Россия) и IL-4 (45 нг/мл), CellGenix (Германия), нагруженных опухолевым лизатом и активированных TNF-α (20 нг/мл, BD (США), (световой микроскоп, ×100)
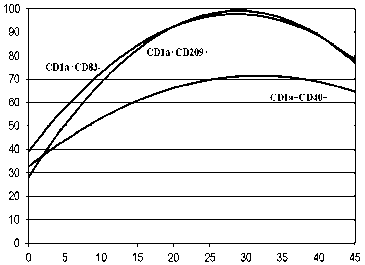
Рис. 2А. Зависимость экспрессии иммунофенотипических маркеров незрелых ДК от концентрации IL-4. Ось абсцисс – концентрации IL-4, нг/мл. Ось ординат – уровень экспрессии иммунофенотипических маркеров, %
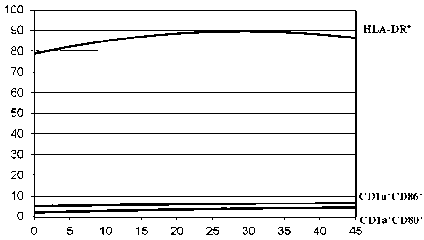
Рис. 2Б. Отсутствие зависимости экспрессии иммунофенотипических маркеров незрелых ДК от концентрации IL-4. Ось абсцисс – концентрации IL-4, нг/мл.
Ось ординат – уровень экспрессии иммунофенотипических маркеров, % указанные сроки свидетельствует об их высокой функциональной активности.
Признаком функциональной активности ДК является повышение уровня экспрессии костиму-лирующих молекул CD80, CD86, молекул адгезии CD209, антигена CD83, характерного для терминальной степени созревания ДК по сравнению с незрелыми ДК.
На рис. 1 представлен иммунофенотип вакцинных ДК, изученный с помощью иммуноцитохимического метода. Маркеры активированных ДК (HLA DRhigh, CD1alow, CD80high, CD86high) экспрессируют 65–80 % клеток, что сопоставимо с результатами, полученными методом проточной цитофлуориметрии.
Для дифференцировки ДК из моноцитов периферической крови чаще используют GM-CSF в сочетании с IL-4 и их синергизм в индукции созревания [6, 10]. При этом используются различные концентрации IL-4 и GM-CSF без достаточно обоснованной аргументации, что свидетельствует о широком диапазоне их активности. На основе однофакторного регрессионного анализа нами проведена оценка влияния различных концентраций IL-4 на экспрессию иммунофеноти-пических маркеров незрелых и зрелых ДК. В результате были получены полиномиальные модели второго порядка: Yi=A0+A1×C+A2×C2 (1), где Yi – уровень экспрессии иммунофено-типического маркера (%), соответственно для Y1(CD1а+CD83-), Y2(CD1а+CD86+), Y3(CD1а+CD80+), Y4(CD1а+CD40+), Y5(CD1а+CD209+), Y6(HLA-DR+); A0, A1, A2 – численные значения коэффициентов моделей; С – концентрация IL-4, нг/мл. Коэффициенты детерминации моделей (R2) составили от 70,0 до 82,0. Это свидетельствует о возможности корректного применения выражения (1) для определения зависимости изменений соответствующей величины (Yi) от параметра (С).
На рис. 2А представлено наличие зависимостей экспрессии маркеров CD1а+CD83-; CD1а+CD40+ и CD1а+CD209+ от концентрации IL-4 от 0 до 45 нг/мл. На рис. 2Б демонстрируется отсутствие существенных изменений уровня экспрессии маркеров CD1а+CD86+; CD1а+CD80+ и HLA-DR+. Расчеты показывают, что оптимальный интервал концентрации IL-4 при дифференцировке ДК находится в пределах от 5 до 15 нг/мл. Дальнейшее увеличение этой концентрации не приводит к значимому повышению уровня экспрессии изучаемых маркеров.
Таким образом, незрелые и зрелые ДК, дифференцированные из моноцитов периферической крови в присутствии изученных концентраций GM-CSF и IL-4, обладают выраженной функциональной активностью, определяемой по экспрессии молекул активации, миграции и костимулирующих сигналов.
Выводы
Применение для созревания ДК ростового фактора ГМ-КСФ отечественного производства (Фармсинтез, Россия) обеспечивает получение результатов, сопоставимых с таковыми при использовании GM-CSF импортного производства (CellGenix, Германия).
Оптимальный интервал концентрации IL-4 для дифференцировки ДК находится в пределах от 5 до 15 нг/мл.
Для стандартизации технологического процесса получения вакцинных ДК рекомендуется исполь- зовать оптимальную панель моноклональных антител: CD14, CD1а, CD83, CD86, CD80, CCR7, HLA DR, метод проточной цитометрии или иммуноцитохимическое окрашивание.


